Плазменная деструкция костной ткани в экспериментальном исследовании
Автор: Федорина Т.А., Терсков А.Ю., Сухачв П.А., Вдовин О.В., Иванов В.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Макро- и микроморфология
Статья в выпуске: 2 т.8, 2012 года.
Бесплатный доступ
Удаление патологической очага в пределах здоровых тканей при хирургическом лечении пациентов с опухолеподобными заболеваниями и доброкачественными опухолями костей является главным условием в достижении благоприятного исхода. Цель: снизить количество рецидивов на границе резекции, воздействуя различными химическими веществами и физическими методами. Материал и методы. Предложен новый способ обработки костной ткани потоком низкотемпературной плазмы, температура воздействия которого достигает 20000°С. При воздействии потоком плазмы на костную ткань происходит потеря всех клеточных элементов, в том числе патологических, с сохранением минеральной структуры кости. Результаты. Выявлена прямая зависимость между мощностью потока плазмы и глубиной деструкции костной ткани. Заключение. Полученные в ходе эксперимента данные выявили прямую зависимость между мощностью потока плазмы и глубиной деструкции костной ткани, что позволяет дифференцированно применять плазменную деструкцию на костях скелета в зависимости от анатомического строения, размеров, типов костной ткани (губчатой или кортикальной), а также индивидуальных особенностей состояния тканей пациента
Зона резекции, опухолеподобные заболевания костей, патологический очаг, плазменная деструкция
Короткий адрес: https://sciup.org/14917498
IDR: 14917498
Текст научной статьи Плазменная деструкция костной ткани в экспериментальном исследовании
1Введение. Доброкачественные опухоли и опухолеподобные заболевания опорно-двигательной системы — один из важных и трудных в диагностическом и лечебном плане разделов ортопедии. Зачастую данная патология поражает детей и лиц молодого возраста, т.е. социально значимый контингент населения. По своему гистогенезу и морфологическому строению костные опухоли являются наиболее сложными и наименее изученными разделами онкологии. Это объясняется тем, что кость имеет сложную многотканевую структуру [1–3].
Несмотря на большое количество научных работ, посвященных этой проблеме, нет единой тактики лечения больных с данными образованиями.
Максимальное удаление патологической ткани при оперативном лечении больных с опухолеподобными заболеваниями и доброкачественными опухолями костей — один из основных принципов онкологии [4–6]. В то же время стремление уменьшить операционную травму, объем резецируемой костной ткани, не нарушая указанного положения, прослеживается на протяжении всей истории развития онкологии. Для деструкции патологической ткани использовались различные химические и физические методы воздействия. Изучение физических факторов воздействия на биологические ткани позволяет повысить качество оказываемой медицинской помощи больным с опухолеподобными заболеваниями и доброкачественными опухолями костей скелета [1].
Общими признаками для всех доброкачественных опухолей и опухолепободных заболеваний являются четкие контуры, медленный рост, четкая дифференцировка от здоровой кости. Клиническая картина обусловлена объемом, темпом, топографоанатомическими особенностями растущей опухоли, болью. Рентгенологическая картина и визуализация с помощью компьютерной томографии настолько характерная, что зачастую этих исследований достаточно для постановки диагноза. Способность добро-
Адрес: 443096, г. Самара, ул. Клиническая, 28, кв. 47.
Тел.: 8-927-725-18-52.
качественных опухолей малигнизироваться следует учитывать при выявлении показаний к операции.
Хирургическое лечение больных с опухолеподобными заболеваниями и доброкачественными опухолями костей скелета сводится к обеспечению радикальности операции и сохранению максимального объема костной ткани, необходимой для восстановления пораженной.
В клиниках Самарского государственного медицинского университета (СамГМУ) на базе кафедры и клиники травматологии, ортопедии и экстремальной хирургии проведено экспериментальное исследование по изучению воздействия плазмы на костную ткань с целью улучшения результатов лечения больных с доброкачественными опухолями скелета и псевдоопухолевыми заболеваниями костей.
Морфологические и морфометрические исследования проводили на кафедре общей и клинической патологии: патологическая анатомия, патологическая физиология СамГМУ. В результате ряда проведенных исследований получен патент РФ № 2416367 от 20.04.2011 г. «Способ обработки костной ткани при хирургическом лечении доброкачественных опухолей скелета».
Цель : изучить патоморфологические изменения в костной ткани при плазменной деструкции и оценить возможность ее применения при оперативном лечении опухолеподобных заболеваний и доброкачественных опухолей костей скелета.
Методы . Деструкция костной ткани достигалась воздействием низкотемпературной плазмы, которую получали путем продувания аргона через электрическую дугу постоянного тока. Применяли режим коагуляции, при котором температура плазменного потока не превышала 20 000ºС.
Оперативное вмешательство выполнялось в соответствии с топографо-анатомическими особенностями расположения патологического очага. Послойно осуществлялся хирургический доступ к объемному образованию, выполнялась резекция кости с удалением опухоли в пределах здоровой ткани. После удаления опухоли область резекции обрабатывалось потоком низкотемпературной плаз-
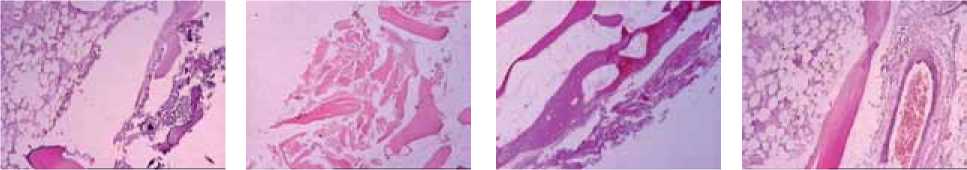
а
б в г
Рис. 1: а – дефект губчатой кости с прилегающей зоной некроза, за которой видна жировая ткань костного мозга; мощность воздействия 60 Вт; окраска гематоксилином и эозином; увеличение ×200; б – гомогенизированные и частично фрагментированные костные балки губчатой кости в зоне, примыкающей к дефекту; мощность воздействия 40 Вт; окраска гематоксилином и эозином; увеличение ×50; в – зона некроза губчатой костной ткани, примыкающая к дефекту; мощность воздействия 100 Вт; окраска гематоксилином и эозином; увеличение ×50; г – полнокровие сосудов и отек в межбалочном пространстве губчатой кости; мощность воздействия 20 Вт; окраска гематоксилином и эозином; увеличение ×200
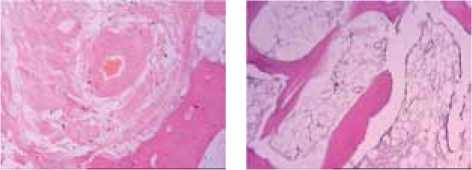
а
б
Рис. 2: а – полнокровие сосудов и отек в межбалочном пространстве губчатой кости; единичные лимфоидные клетки располагаются периваскулярно; мощность воздействия 80 Вт; окраска гематоксилином и эозином; увеличение ×200; б – неизменённая костная ткань губчатой кости за зоной реактивных изменений; мощность воздействия 80 Вт; окраска гематоксилином и эозином; увеличение ×200; в – гомогенизированная ткань кортикальной пластинки в пограничной зоне дефекта; мощность воздействия 120 Вт; окраска гематоксилином и эозином; увеличение ×200; г – зона пограничного воздействия в кортикальной пластинке; мощность воздействия 80 Вт; окраска гематоксилином и эозином; увеличение ×200
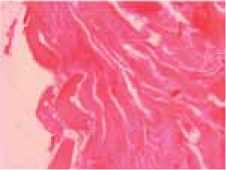
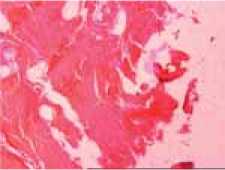
в г
мы. Мощность подбиралась исходя из особенностей анатомии, толщины кортикального и губчатого слоя кости. При необходимости выполнялась костная пластика и остеосинтез. Процедура проводимых экспе-рементов соответствовала стандартам Хельсинкской декларации Всемирной медицинской ассоциации (протокол № 111 комитета по биоэтике при Самарском государственном медицинском университете от 26 октября 2011 г.).
Морфологическое исследование: материалом служили фрагменты костной ткани, обработанные потоком плазмы мощностью от 20 до 120 Вт с интервалом в 20 Вт. После макроскопической оценки объекты декальцинировали в 7%-ном растворе азотной кислоты, после чего проводили в ацетонах и заливали в парафиновые блоки. Срезы толщиной 7 мкм окрашивали гематоксилином и эозином, пикрофукси-ном по Ван-Гизону. Изучали светооптически при помощи микроскопа Nikon Alphaphot YS2-H, оснащенного цифровой видеокамерой. Морфометрическое исследование проводилось с помощью программы «Видео Тест-Морфо».
Зоны некроза в препаратах соответствовали зонам дефекта после декальцинации при макро- и микроскопическом исследованиях.
Результаты. Результаты морфометрического исследования экспериментального материала представлены в таблице.
Препараты были разделены на 6 групп. Первую составили фрагменты костной ткани, подвергшейся воздействию плазмы мощностью 20 Вт; вторую — соответственно 40 Вт, а третью — 60 Вт, четвертую — 80 Вт, пятую — 100 Вт, шестую — 120 Вт.
Во всех группах выявлены аналогичные изменения. Место воздействия представлено дефектом костной ткани, имеющим вид щели различной ширины в зависимости от мощности потока плазмы. Не- посредственно к дефекту примыкает узкая полоска гомогенной некротизированной костной ткани, ширина которой также зависела от мощности воздействия (рис. 1 а, б, в).
В межбалочном пространстве расположены кровеносные сосуды, волокнистые структуры, жировая ткань, а также небольшие скопления кроветворных и фибробластических клеток. Изменения этих структур представлены умеренно выраженным полнокровием сосудов, незначительным отёком, единичными мелкоточечными кровоизлияниями (рис. 1 г ). Пери-васкулярно в небольшом количестве выявляются преимущественно лимфоциты, лейкоциты, что нами расценено как слабо выраженное реактивное воспаление (рис. 2 а ).
Дальше от зоны повреждения никаких значимых морфологических изменений нами отмечено не было. Костные балки и межбалочное пространство выглядели обычно (рис. 2 б ). Изменения в кортикальной пластинке имели вид дефекта щелевидной формы. В некоторых случаях он приобретал воронковидную форму, суживаясь книзу от места воздействия. Ширина дефекта варьировалась в зависимости от применяемой мощности. В зоне, непосредственно примыкающей к дефекту, ткань гомогенизировалась и менялась ее окраска в сторону гиперхромии (рис. 2 в ). Этот участок, примыкающий к дефекту, мы назвали зоной пограничных изменений. При измерении ширины этой зоны также выяснилось, что ее ширина зависит от мощности воздействия (рис. 2 г ).
Обсуждение. Проведенные морфометрические исследования выявили прямую зависимость между мощностью плазменного потока и глубиной зоны деструкции костной ткани. Получение зоны некроза приводило к потере всех клеточных элементов, в том числе элементов опухоли, которые служат источниками рецидивов. Сохраненная минеральная неорга- ническая структура костной ткани служила основой для последующей регенерации.
Представленный способ обработки костной ткани плазмой при хирургическом лечении применили у 124 больных с доброкачественными опухолями и опухолеподобными заболеваниями костей со сроками наблюдения до 8 лет. Динамика консолидации и регенерации костной ткани отслеживалась на контрольных рентгенограммах и компьютерных томографических исследованиях.
Выводы:
-
1. При гистологическом исследовании установлено, что низкотемпературная плазма вызывает полную деструкцию костной ткани в области воздействия. Реактивные изменения в прилегающих участках кости незначительны и представлены узкой зоной гомогенизации костного вещества и слабо выраженной воспалительной реакцией.
-
2. Полученные данные позволяют использовать обработку зоны резекции костной ткани потоком плазмы, что способствует снижению числа рецидивов и повышает эффективность хирургического лечения пациентов с доброкачественными опухолями и опухолеподобными заболеваниями костей.
Список литературы Плазменная деструкция костной ткани в экспериментальном исследовании
- Арустамян Э.Э. Криохирургия и костная пластика при лечении хондром: дис... канд. мед. наук. Самара, 2009.160 с.
- Давыдов М.И., Чиссов В. И. Национальное руководство по онкологии. М.: ГЕОТАР-Медиа, 2008. 1142 с.
- Демичев А. Н., Тарасов. Диагностика и криохирургия костных кист. М.: МЕДПРЕСС-ИНФОРМ, 2005. 144 с.
- Нейштадт Э.Л., Маркочев А. Б. Опухоли и опухолепо-добные заболевания костей. СПб.: Фолиант, 2007. 344 с.


