Plectranthus scutellarioides (L.) R.Br. (Lamaiceae): перспективы медицинского применения (обзор)
Автор: Золотых Д.С., Поздняков Д.И., Дайронас Ж.В.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 3 (71), 2021 года.
Бесплатный доступ
В работе проведен анализ основных вторичных метаболитов Plectranthus scutellarioides и описаны выявленные виды биологической активности для отдельных выделенных соединений и для извлечений из рассматриваемого растения.
Plectranthus scutellarioides, дитерпеноиды, флавоноиды, розмариновая кислота, противовоспалительная активность, антибактериальная активность
Короткий адрес: https://sciup.org/142231345
IDR: 142231345 | УДК: 615.322:615.21/.26
Текст обзорной статьи Plectranthus scutellarioides (L.) R.Br. (Lamaiceae): перспективы медицинского применения (обзор)
Род Coleus Lour (колеус) семейства Lami- aceae (яснотковые) включал около 150 видов растений, но в 2004 г. был пересмотрен. После этого в нем осталось только два подтвержден- ных вида – Coleus decurrens Gürke (колеус низ- бегающий) и Coleus forskohlii (Willd.) Briq. (коле- ус Форсколя) [5]. Большая часть оставшихся видов были отнесены к роду Plectrantus L'Hér.(шпороцветник), объединяющему в настоящее время около 325 видов растений. Среди пере- несенных видов присутствует Colues blumei Benth. (колеус Блюма), который теперь называ- ется Plectranthus scutellarioides (L.) R. Br. (шпо-роцветник шлемниковидный или плектрантусшлемниковидный). [7]. Plectranthus scutellarioides был открыт в 1853 г. на о. Ява датским ботаником Карлом Людвигом
Блюмом. Растение была названо в честь открывателя, а затем название было изменено в 2006 г. на Coleus hybridus для учета всех существующих гибридных вариантовданного растения. С 2012 г. ботаническим назва- нием колеуса Блюма стало Plectranthus scutellarioides. [8]. Именно Карл Людвиг Блюм интродуцировал данный вид в Европе в XIX в. [6]Родиной P. scutellarioides является
Юго- Восточная Азия, Новая Гвинея и северная Ав-стралия. Данный вид был распространен на дру- гие части Азии, включая Филиппины, Маршалловы острова и разные части Азиатско-тихоокеанского региона, а также в Америке в целях культивации в медицинских целях, в качестве декоративного растения и использования в кулинарии.
В настоящее время P. scutellarioides встре- чается в природе континентальной юго-восточной Азии южнее Малайзии. Данный вид в тропических и умеренных регионах по всему миру, включая все части Китая и в некоторых местах является инвазивным. Также встречается как единствен- ный вид рода Plectrantus L'Hér. в Коста-Рике [9].
P. scutellarioides приобрел большую попу- лярность в качестве декоративного растения в связи необычной разноцветной окраской ли- стовой пластинки. Для вида известно огромное количество культиваров, отличающихся окрас- кой листьев [20]. Флавоноиды лютеолин и квер- цетин отвечают за их желтую окраску [16], а ан- тоцианы за ярко-красную или пурпурную [23, 25].
P. scutellarioides используется в народной ме- дицине Индии, Индонезии [12], Мексики и Папуа- Новой Гвинее: в Мексике используют перорально при заболеваниях ЖКТ, например в случае диареи [1]; в Индии используют в качестве противовоспа- лительного средства, например, горячий отвар смешивают с соком цитрусовых и прикладывают к месту укуса скорпиона [21]; на острове Бугенвиль Папуа-Новой Гвинеи используют перорально от- вар при головной боли и кашле, а также для лече- ния малярии [11]. Лекарственные свойства
P. scutellarioides могут быть связаны с большим содержанием фенольных соединений, основным из которых является розмариновая кислота (со- единение 7 , табл. 1), представляющая собой по- лифенол (эфир кофейной кислоты и 3,4-дигид- роксифенил-молочной кислоты [19].
Первоначально розмариновая кислота бы- ла выделена из Rosmarinum officinalis L. (Lami- aceae) в 1958 г., что и послужило основанием для её тривиального названия [13]. Данное ве- щество является общим для видов семейств Lamiaceae и Boraginaceae [10] и оно было иден- тифицировано как одно из основных в ряде ле- карственных растений указанных семейств (например, Salvia officinalis L., Mentha piperita L., Thymus vulgaris L., Melissa officinalis L., Symphytum officinale L.). Однако не все виды семейства La- miaceae содержат розмариновую кислоту [13]. Химический синтез этого соединения впервые был осуществлен в 1991 г., после чего были получены её многочисленные производные [14]. Считается, что один из основных вторич- ных метаболитов P. scutellarioides, розмарино- вая кислота, накапливаясь в вакуолях и затем, высвобождаясь в окружающие ткани, является частью защитной системы растения от грибковых и бактериальных инфекций, а также хищни- ков. В сравнении со всеми остальными вторич- ными метаболитами розмариновая кислота синтезируется в процессе роста тканей. Для данного вещества не описаны токсические эффекты, что очень вероятно, является причиной накопления ее высоких концентраций в растении [19]. Наибольшее содержание розмариновой кислоты установлено в листьях, меньшее в стеблях и минимально в корнях. Накопление данного вещества увеличивается при внесении дополнительных стимуляторов, полученных из грибов (например, экстракт дрожжей). Указан- ное послужило основанием предположения за- щитных свойств розмариновой кислоты в растении [23, 14]. P. scutellarioides не используется для выделения субстанции розмариновой кис- лоты, однако, с 1985 г. были изучены культуры клеток данного вида растения для коммерче- ского производства этого соединения. Её био- синтез из фенилаланина и тирозина подробно описан, а также известны все восемь ключевых ферментов [10, 14]. Было установлено, что фе- нилаланин является предшественником для синтеза части молекулы розмариновой кисло- ты, представляющей собой кофейную кислоту. При этом тирозин используется для синтеза ча- сти молекулы розмариновой кислоты, представ- ляющей собой 3,4-дигидроксифенилмолочную кислоту. Таким образом, только одна из четы- рех ароматических гидроксильных групп непосредственно заимствуется в молекулу розма- риновой кислоты из аминокислотных предше- ственников. Остальные три ароматические гидроксильные группы образуются в процессе биосинтеза [3]. Розмариновая кислота накапли- вается в недифференцированных растительных клетках культуры, в некоторых случаях ее кон- центрация значительно превышает содержание в самом растении. Было установлено, что куль- туры клеток P. scutellarioides могут накапливать до 21% розмариновой кислоты в сухом виде.
Следует отметить, что в молекуле присут- ствует два ароматических кольца, каждое из которых содержит по две соседние гидроксиг- руппы. Фенольные гидроксилы связаны с антиок- сидантной активностью розмариновой кислоты. Соответственно, молекула данной кислоты рабо- тает как ловушка для свободных радикалов [15]. Розмариновая кислота способствует снижению образования активных форм кислорода, умень- шает пероксидное окисление липидов и истоще- ние внутриклеточных запасов глутатиона [19]. Образуются межмолекулярные водородные свя- зи между свободными атомами водорода гид- роксильных групп и феноксирадикалами, что может являться причиной таких видов биологи- ческой активности, как антиоксидантная, проти- вовоспалительная, фотозащитная и противора- ковая. Молекула розмариновой кислоты ингибирует особо активный 1,1-дифенил-2-пикрилгид- разил (DPPH) радикал. В итоге данная кислота может снижать образование опухолей кожи по- средством антиоксидантного и противовоспали- тельного эффектов [15].
Во многих исследованиях показана проти- вораковая активность розмариновой кислоты. Она может быть связана со способностью ингибировать активацию циклооксигеназы-2 (COX-2). Простагландин Е2 (PGE2) играет ключевую роль в развитии и прогрессировании колоректального рака, что связано с путями активации COX-2. Розмариновая кислота ингибирует COX-2, что может предотвращать образование и развитие рака. Кроме того, влияние на колоректальный рак может быть оказано со стороны розмарино- вой кислоты в связи с её противовоспалитель- ной активностью [15].
Следует отметить, что для розмариновой кислоты выявлены антибактериальная и проти- вовирусная активности [14, 24]. В частности, это соединение также играет важную роль в защит- ном механизме от таких патогенных вирусов, как Herpes simplex virus, Human immunodeficiency virus или Japanese encephalitis virus.
Розмариновая кислота способна улучшать когнитивные функции, предотвращать развитие болезни Альцгеймера и оказывать кардиопро-текторное действие. Данная кислота ингибирует амилазу панкреатического сока, что замедляет разрушение углеводов и предотвращает гиперг- ликемию при сахарном диабете 2-го типа [4].
Выявлена способность ингибировать ГАМК- трансаминазу для розмариновой кислоты. Сле- довательно, данная кислота может обладать анксиолитическим эффектом, изменяя уровень ГАМК в нервной системе. Кроме того, розмари- новая кислота является ингибитором индоле- амин-пиррол-2,3-диоксигеназы, которая играет важную роль в иммунном ответе и рассматри- вается как важная мишень в иммунотерапии при раковых заболеваниях [24].
Указанную кислоту вносят в качестве добав- ки во многие косметические средства и лекар- ственные препарата, используемые для лечения разных заболеваний [10, 19]. Так же розмарино- вая кислота может использоваться в качестве консерванта в продуктах питания [15].
Вторичные метаболиты, идентифицированные в P. Scutellarioides
Таблица 1
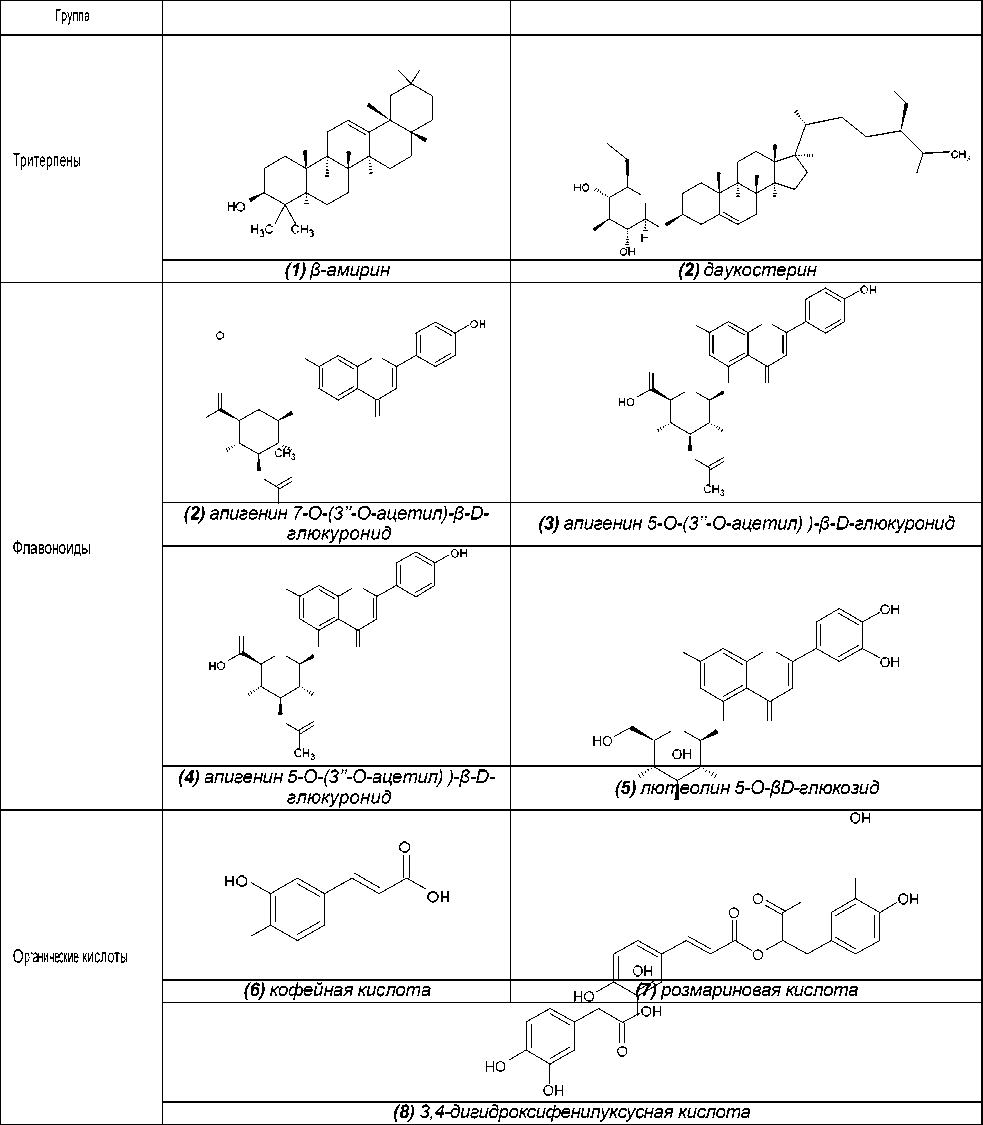
Группа
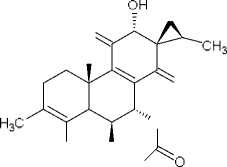
(9) колеон О
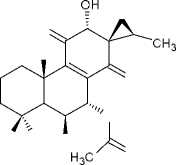
(11) лангунон К
Дитерпеноиды
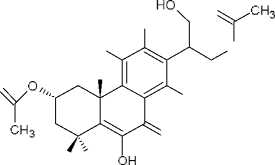
Продолжение табл. 1
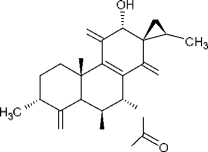
(10) колеон G
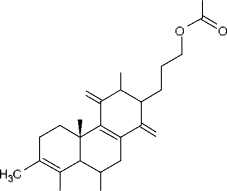
(12) фредерикон В
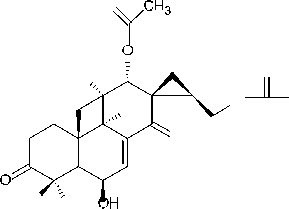
(13) 2,16-диацетилпроизводное
2,6,11,12,14,16,17-гептагидрокси-
5,8,11,13-абиетатетраен-7-она
(14) спироскутелон А
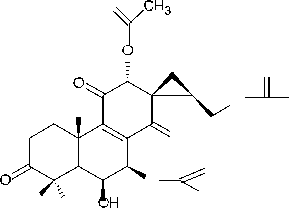
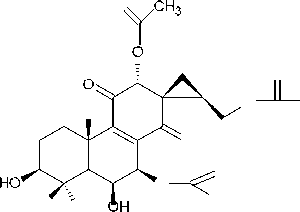
-
(15) спироскутелон В
-
(16) спироскутелон С
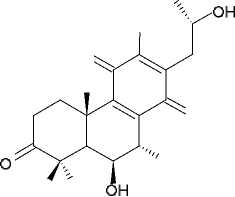
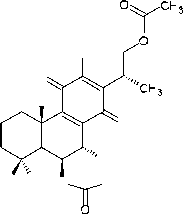
-
(17) скутеллариоидон А
Окончание табл. 1
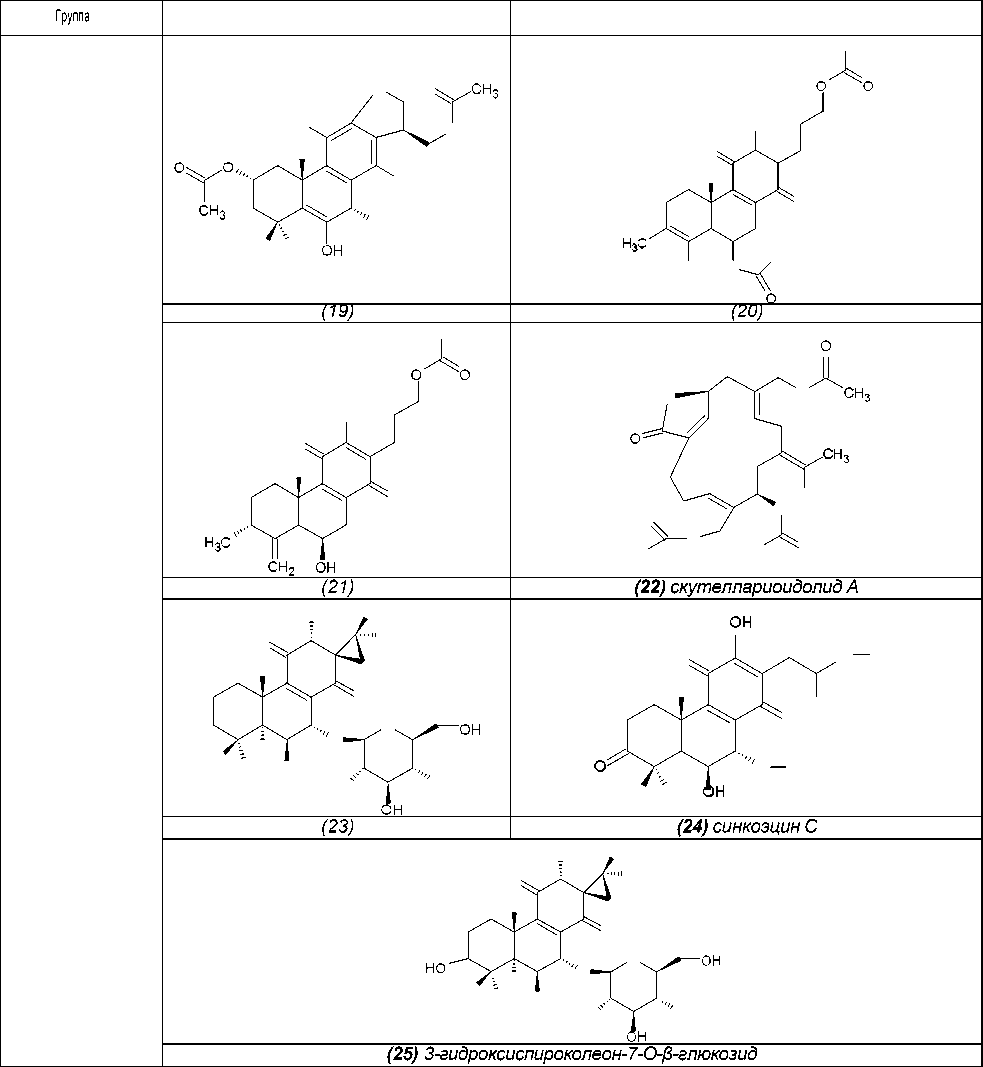
Среди прочих вторичных метаболитов бы- ли идентифицированы тритерпены β-амиин ( 1 ) и даукостерин ( 2 ), флавоноиды апигенин 7-О- (3’’-О-ацетил)-β-D-глюкуронид ( 3 ), апигенин 5- О-(3’’-О-ацетил)-β-D-глюкуронид ( 4 ) и лютеолин 5-О-βD-глюкозид ( 5 ), органические кислоты ко- фейная кислота ( 6 ) и 3,4-дигидроксифенилук- сусная кислота ( 8 ) (таблица 1) [26].
В результате фитохимических исследова- ний рода Plectranthus выявлены дитерпеноиды, в основе которых лежат структуры абиетана и лабдана (см. рис.). К ним относится группа дитер- пеноидов колеоны. Описано, что колеон О (9), обнаруженный в P. scutellarioides, является силь- ным аллергеном, в связи с которым растение мо- жет вызвать раздражение на коже или аллерги- ческий дерматит [28]. Также были обнаружены колеон G (10) (ранее был выделен из Plectranthus lanuginosus (Hochst. ex Benth. [син. Coleus soma- liensis S.Moore) Agnew]), ланугон К (11) (ранее был идентифицирован в P. lanuginosus), фреде- рикон В (12) (ранее был выделен из Plectranthus welwitschii (Briq.) Codd [син. Coleus fredericii G. Taylor]) и 2,16-диацетилпроизводное 2,6,11,12, 14,16,17-гептагидрокси-5,8,11,13-абиетатетраен- 7-она (13). Для последнего соединения былопроведено исследование антимикробной актив- ности и было установлено, что это соединение активно в отношении Bacillus subtilis, Pseudomonas aeruginosa и Candida albicans. Однако в сравне- нии с хлорамфениколом, тетрациклином и кло- тримазолом 2,16-диацетилпроизводное оно характеризовалось низкой антимикробной активно- стью [2].
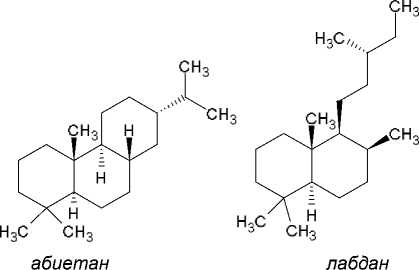
Рис. Структурные формулы абиетана и лабдана
Из листьев P . scutellarioides, собранных вИндонезии, было выделено четыре дитерпенои- да, обладающих цитотоксической активностью (соединения 13-16 , табл. 1). Наибольшая актив- ность была установлена для соединения 15 [29]. Для соединений 9, 10, 11, 12, 13, 17, 18, 19, 20, 21, 22 (табл. 1) исследовано ингибиро- вание транскрипционного фактора NF-κB, а такжеантипролиферативная активность.
Наибольшая способность к ингибированию NF-κB наблюда- лась у соединения 9 (колеон О), 10 (колеон G), 11 (лагунон К) и 20 (6-ацетил фредерикон В). Следует отметить, что соединения 9, 10 и 11 имеют структуру 7α-ацетокси-6β,12-дигидрокси- 8-абиетаен-11,14-диона с метилированным фраг- ментом спироциклопропана в положении С-13. Подобная структура ингибиторов ранее не встре- чалась, что может быть использовано для дальнейших исследований новых ингибиторов NF-κB.Наибольшая антипролиферативная активностьбыла установлена у соединения 9 (колеон О) [27].
Был выделен абиетановый дитерпеноид в гликозилированной форме ( 23 ). Для этого со- единения, а также апигенина 7-О-(3’’-О-ацетил)-β- D-глюкуронида ( 3 ), апигенина 5-О-(3’’-О-ацетил)- β-D-глюкуронида ( 4 ), кофейной кислоты ( 6 ), лю- теолина 5-О-глюкозида ( 5 ) и розмариновой кис- лоты ( 7 ) проводили исследование ингибирова- ния гиалуронидазы.
В качестве контроля использовали кверце- тин. Установлено, что соединение 23 проявило более высокую способность к ингибированию гиалуронидазы в сравнении с флавоноидами 3, 4 и 5. Розмариновая считается ингибиротом ги- алуронидазы и ее эффект ингибирования сопо- ставим с эффектом соединения 23. При оценке антиоксидантной активности вышеуказанного перечня соединений (23, 3, 4, 6, 5 и 7) выделен- ные флаваноиды 3 и 4 проявили более слабую активность в сравнении с розмариновой кислотой или контролем кверцетином. Кроме того, для опи- санного перечня соединений проводилась оценка ингибирования ацетилхолинэстеразы (AChE) и бутирилхолинэстеразы (BuChE). В качестве контроля использовали галантамин. Было уста- новлено, что выделенные из P. scutellarioides флавоноиды в гликозилированной форме 3, 4 и 5 оказали умеренное ингибирование указанных холинэстераз, не превышающее контроль [26].
Проводилось исследование антибактериаль- ной активности абиетановых дитерпеноидов в от- ношении метициллин-резистетного Staphylococcus aureus для соединений 17 (скутеллариоидон А), 23 , 24 (синкоэфцин С) и 25 (3-гидроксиспиро- колеон-7-О-β-глюкозид) . Наибольшая антибакте- риальная активность установлена для соедине- ния 24 . Предполагается, что гликозилирование гидроксильной группы в структуре абиетана по- давляет антибактериальную активность в отно- шении метициллин-резистетного Staphylococcus aureus [28].
Помимо исследований отдельных соеди- нений с установленной структурой, проводили многочисленные исследования суммарных экс- трактов P. scutellarioides .
Для метанольного извлечения P. scutella- rioides выявлена антиоксидантная активность. Сок листьев данного растения используется в Индии для лечения болезней, при которых возникает воспалительная реакция [28].
Метанольные извлечения из листьев P. scu- tellarioides использовали для исследования анти- микробной активности в отношении грамм-положительных ( Bacillus subtilis и Staphylococcus aureus ) и грамм-отрицательных ( Escherichia coli и Pseudomonas aeruginosa ) бактерий. Извлече- ния из листьев оказывали ингибирующее влия- ние на рост всех выше указанных микроорганизмов [17].
Этанольные экстракты из листьев P. scute- llarioides показали антибактериальный эффект в отношении двух видов бактерий, обитающих в ротовой полости, Staphylococcus aureus и Streptococcus mitis . При этом зоны ингибирова- ния для хлоргекседина биглюконата и этаноль- ного извлечения сопоставимы [18].
Установлена противогрибковая активность извлечений Coleus forskohlii и Plectranthus bar- batus Andrews [син. Coleus barbatus (Andrews) Benth. ex G. Don], тогда как для P. scutellarioides подобная активность не выявлена [17].
Интересно отметить исследование острой токсичность острой токсичности этанольного извлечения из листьев P. scutellarioides. Было установлено, что летальность животных отсут- ствует при наибольшей дозе 5 000 мг/кг веса мыши; это может являться основанием для предположения безопасности употребления из- влечения, однако требует дальнейших исследований [18].
При этом были описаны клинические слу- чаи психотропного действия P. scutellarioides на пациентов, пытавшихся употреблять листья данного растения в целях достижения эйфори- ческого состояния. На основании литературных данных не представляется возможным выявить непосредственную связь психотропного дей- ствия с конкретными веществами или группами веществ. Единственным упоминанием является влияние розмариновой кислоты на ГАМК-транс- аминазу [22, 24].
В табл. 2 представлены виды биологиче- ской активности и соответствующие группы со- единений, для которых они установлены. Наибольший интерес представляют активности с сочетанием нескольких групп соединений, та- кие как антибактериальная и противовоспали- тельная.
Таблица 2
|
Группа соединений/соединение |
Вид активности |
|
Органические кислоты (розмариновая кислота) |
Анксиолитическая |
|
Органические кислоты (розмариновая кислота), дитерпеноиды |
Антибактериальная |
|
Органические кислоты (розмариновая кислота) |
Антиоксидантная |
|
Органические кислоты (розмариновая кислота) |
Кардиопротекторная |
|
Органические кислоты (розмариновая кислота), флавоноиды |
Лечение болезни Альцгеймера |
|
Органические кислоты (розмариновая кислота), дитерпеноиды |
Противовоспалительная |
|
Органические кислоты (розмариновая кислота) |
Противовирусная |
|
Органические кислоты (розмариновая кислота), дитерпеноиды |
Противораковая |
Связь видов биологической активности и групп вторичных метаболитов
ЗАКЛЮЧЕНИЕ
Plectranthus scutellarioides является цен- ным источником биологически активных соеди- нений с высоким потенциалом использования при различных заболеваниях. Был проведен анализ вторичных метаболитов и установлена связь с изученными видами биологической ак- тивности. Также следует отметить перспектив- ность дальнейшего проведенного исследования дитерпеноидов как нового потенциального класса ингибиторов NF-κB.
(visual) : unmediated.
Список литературы Plectranthus scutellarioides (L.) R.Br. (Lamaiceae): перспективы медицинского применения (обзор)
- Andrade-Cetto // Journal of Ethnopharmacology. – 2009. – № 122. – Р. 163 – 171. – Text (visual) : unmediated.
- Consolacion Y. Ragasa, [et al.] // Chem. Pharm. Bull. – 2001. – № 49 (7) 927 – 929. – Text (visual) : unmediated.
- David Eberle, [et al.] // Plant Mol Biol. – 2009. – № 69. – Р. 239 – 253. – Text (visual) : unmediated.
- Trócsányi, E. [et al.] // Current Plant Biology. – 2020. – № 23. – Р. 100162. – Text (visual) : unmediated.
- The Families and Genera of Vascular Plants, (La- miales) / R. M. Harley, S. Atkins, A. Budantsev, [et al.]. Labiatae. In: Kadereit J. W. (Ed.) – Electron- ic text // Springer, Berlin. – 2004. – Vol. 6. – Р. 167 – 275. – URL : https://doi.org/10.1007/978-3-642- 18617-2_11
- Electronic text. – URL : http://ucce.ucdavis.edu/uni- versal/printedprogpageshow.cfm?pagenum=7203&p rogkey=2080&county=5576
- Electronic text. – URL : http://www.theplantlist.org/
- Electronic text. – URL : https://thedailygardener.org/ otb20200203/. – Electronic text
- Electronic text. – URL : https://www.cabi.org/isc/ datasheet/118545#C5FCB1DB-38BE-4136-A0A3- 054597FD7529. – Electronic text
- Qian, J., [et al.] // Natural Product Research. – 2009. – Vol. 23, № 2. – Р. 127 – 137. – Text (visual) : unmediated.
- Waruruai, J. [et al.] // Journal of Ethnopharmacolo- gy. – № 2011. – № 138. – Р. 564 – 577. – Text (visual) : unmediated.
- Budiarti, M. [et al.] // Heliyon. – 2020. – 6e05562. – Text (visual) : unmediated.
- Petersen M., [et al.] // Phytochemistry. – 2009. –
- № 70. – Р. 1663 – 1679. – Text (visual) : unmediated.
- Petersen M., Simmonds M. S. J., [et al.] // Phyto- chemistry. – 2003. – № 62. – Р. 121 – 125. – Text (visual) : unmediated.
- Mallappa Kumara Swamy, [et al.] // Appl Microbiol Biotechnol. – 2018 – № 102 (18). – Р. 7775 – 7793. – Text (visual) : unmediated.
- Moelyono M., Jutti L., Syafrudin P., [et al.] // Majalah Farmasi Indonesia. – 2011. – № 22 (3). – Р. 191 – 196. – Text (visual) : unmediated.
- Muhammad Muzaffar Ali Khan Khattak, [et al.] // Nu- trition & Food Science. – 2013. – Vol. 43, № 6. – Р. 582 – 590. – Text (visual) : unmediated.
- Bismelah, N. A., [et al.] // IOP Conf. Series: Earth and Environmental Science. – 2019. – № 269. – Р. 012015. – Text (visual) : unmediated.
- Bauer, N., [et al.] // Rosmarinic Acid Production from C. blumei Tissues, Food Technol. Biotechnol. – 2015. – № 53 (1). – Р. 3 – 10. – Text (visual) : un- mediated.
- Genetic Transformation of Coleus blumei, Food Tech- nol / Bauer, N. [et al.] // Biotechnol. – 2002. – № 40 (3). – Р. 163 – 169. – Text (visual) : unmediated.
- Namsa, N. D. [et al.] // Journal of Ethnopharmacolo- gy. – 2009. – № 125. – Р. 234 – 245. – Text (visual) : unmediated.
- Nitin Chopra, [et al.] // J Addict Med. – 2016. – Vol. 10, № 1. – Text (visual) : unmediated.
- Dörr, O. S., [et al.] // Environmental and Experi- mental Botany. – 2019. – № 167. – Р. 103830. – Text (visual) : unmediated.
- Levsh, O., [et al.] // J. Biol. Chem. – 2019. – № 294 (42). – Р. 15193 – 15205 1. – Text (visual) : unmediated.
- Nguyen P., Cin V. D. // Plant Physiology and Bio- chemistry. – 2009. – № 47. – Р. 934 – 945. – Text (visual) : unmediated.
- Kubínová, R. [et al.] // South African Journal of Botany. – 2019. – № 120. – Р. 286 – 290. – Text (visual) : unmediated.
- Cretton, S. [et al.] // Phytochemistry. – 2018. – № 154. – Р. 39 – 46. – Text (visual) : unmediated.
- Jurkaninova, S. [et al.] // Nat Prod Res. – 2019. – № 6. – Р. 1 – 7. doi: 10.1080/14786419.2019.1686371. – Text (visual) : unmediated.
- Ito, T. [et al.] // Fitoterapia. – 2018. – № 127. – Р. 146 – 150. – Text (visual) : unmediated.


