Плейотропные ферменты апоптоза и синаптическая пластичность гиппокампа белых крыс после окклюзии общих сонных артерий
Автор: Авдеев Д.Б., Акулинин В.А., Степанов А.С., Горбунова А.В., Степанов С.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 3 т.33, 2018 года.
Бесплатный доступ
Цель: исследование было посвящено изучению плейотропных свойств фермента апоптоза каспазы-3, его связи с синаптической пластичностью гиппокампа белых крыс в норме и после 20-минутной окклюзии общих сонных артерий.Материал и методы. С помощью световой (окраска гематоксилином и эозином), электронной (уранилацетат и цитрат свинца) микроскопии, иммуногистохимии (MAP2, синаптофизин, каспаза-3, p53, bcl-2) и морфометрии были изучены общая численная плотность нейронов, ультраструктура синапсов, площадь иммунопозитивных синаптических терминалей stratum radiatum СА1 и stratum lucidum СА3 гиппокампа головного мозга в норме (n=5) и через 1 (n=5), 3 (n=5), 7 (n=5), 14 (n=5) и 30 суток (n=5) после острой ишемии.Результаты и обсуждение. Исследование показало, что в течение 30 суток постишемического периода 33,0% пирамидных нейронов СА1 и 17,4% СА3 подвергалось необратимой деструкции. Среди необратимо поврежденных преобладали нейроны с признаками коагуляционно-ишемического некроза. На этом фоне сначала (1 сутки) уменьшалась, а затем (3, 7 суток) восстанавливалась относительная площадь синаптофизин-позитивного материала. Установлено, что локализация каспазы-3 совпадала с локализацией синаптофизина. Особенно наглядно это было показано на гигантских синапсах stratum lucidum поля СА3. В телах пирамидных нейронов гиппокампа каспаза-3 не выявлялась, она локализовалась только в терминалях аксодендритических, аксошипиковых и аксосоматических синапсов. В динамике постишемического периода наиболее выраженные изменения содержания каспазы-3 отмечались в stratum radiatum поля СА1. Белки регуляции апоптоза (р53, bcl-2) выявлялись в единичных нейронах. В этой связи каспазу-3 необходимо рассматривать в аспекте ее плейотропности, участия в адаптационных и восстановительных процессах за счет постишемической активации нейропластичности на уровне аксонов и синапсов.Заключение. После острой ишемии, вызванной 20-минутной окклюзией общих сонных артерий, активация каспазы-3 способствует защите нервной ткани.
Острая ишемия, гиппокамп, каспаза-3, р53, синаптофизин, мар-2
Короткий адрес: https://sciup.org/149125225
IDR: 149125225 | DOI: 10.29001/2073-8552-2018-33-3-102-110
Текст научной статьи Плейотропные ферменты апоптоза и синаптическая пластичность гиппокампа белых крыс после окклюзии общих сонных артерий
Природа постишемической гибели пирамидных нейронов гиппокампа белых крыс после транзиторной ишемии переднего мозга изучена довольно полно. Установлено, что после ишемии в гиппокампе активировались механизмы некроза и апоптоза [1–3]. При развитии апоптоза показана роль каспазы-3. Так, имеются данные о том, что клетки с апоптоз-подобной морфологией и/или экспрессией каспазы-3 составляют менее 10% ишемически измененных нейронов, в то время как подавляющее большинство — это нейроны, погибающие путем некроза. Смерть СА1 пирамидных клеток после транзиторной ишемии переднего мозга инициируется через активацию c-JunN-terminal kinase (JNK). Затем следует апоптоз или вторичный (отдаленный) некроз [4].
Ключевыми структурами, связанными с активацией механизмов некроза и апоптоза нервной ткани головного мозга млекопитающих, являются межнейронные синапсы. Это обусловлено тем, что возбуждающие нейромедиаторы после повреждения синаптических пузырьков и выхода в межклеточное пространство запускают кальций-зависимые эксайтотоксические механизмы гибели нейронов [5, 6]. Изменения синапсов гиппокампа происходят быстро в ранние сроки после ишемии и отражают соответствующие патофизиологические нарушения в синаптической передаче. В любом случае, чем активнее выделение глутамата, тем выше вероятность активации кальций-зависимых механизмов деструкции постсинаптических нейронов [7, 8].
Кроме того, синапсы гиппокампа обладают высокой пластичностью, что обеспечивает восстановление и перестройку межнейронных отношений этого отдела головного мозга после ишемии [9]. Последнее также отмечено другими авторами [10]. Максимальные проявления диффузно-очагового разрушения синаптических контактов отмечались через 1–3 суток после острой ишемии, а восстановление межнейронных связей происходило на фоне исчезновения признаков отека-набухания нервной ткани через 7–14 суток [9, 11].
В последнее время активно изучаются неапоптотиче-ские свойства протеолитических ферментов, в частности каспаз. Каспаза-3 рассматривается как один из ключевых адаптивных ферментов [12, 13]. Каспаза-3 может быть активирована в результате Ca2+-зависимого процесса, при этом активация проходит по неизвестному механизму, а активированный фермент обладает меньшей, чем при апоптозе, активностью [14–16].
Кроме того, апоптотические протеиназы имеют функции, непосредственно связанные с работой нервной системы в норме, иными словами, с нормальной нейропластичностью. Например, пластичность и подвижность конусов роста сопровождается локальной активацией каспазы-3 в конусе роста. Ингибирование каспазы-3 в зрелом головном мозге приводит к нарушению пластических процессов и снижению адаптивных возможностей мозга. То есть каспазе-3 присуща плейотропность или мультимодальность, что реализуется в вовлеченности этого фермента во множество различных функций, часто прямо противоположных. При развитии церебральных патологий этот фермент опосредует как гибель нервных клеток, так и компенсаторные процессы, необходимые для выживания нейронов и нормального функционирования мозга в целом. Именно поэтому блокирование каспазы-3 в мозге для лечения церебральных патологий не дало положительных результатов и даже опасно для его восстановления. Кроме того, после ишемии нервной ткани происходит адаптивная активация каспазы-3 без каких-либо признаков апоптоза [12, 13].
Таким образом, все вышесказанное свидетельствует от тесной связи механизмов развития апоптоза и нейропластичности. При этом исход постишемического периода зависит от характера и степени тяжести острой ишемии [12, 13].
Обзор литературы показал, что практически нет работ, посвященных сопоставлению иммуногистохимических проявлений активации синаптической пластичности и уровня экспрессии каспазы-3 после 20-минутной окклюзии общих сонных артерий.
Цель настоящего исследования: иммуногистохимическое изучение коры гиппокампа для выявления связи синаптической пластичности и активности каспазы-3 как одного из плейотропных ферментов защиты головного мозга.
Материал и методы
Исследование выполнено на базе ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России, одобрено этическим комитетом университета (протокол № 83 от 14 октября 2016 г.).
В качестве экспериментальных животных использовали белых крыс ( n =30, самцы) линии Wistar массой 180–200 г. Животные содержались в обычном виварии. Исследования проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.77 № 755), рекомендациями Международного комитета по науке о лабораторных животных, поддержанными ВОЗ, директивой Европейского Парламента № 2010/63/EU от 22.09.10 «О защите животных, используемых для научных целей».
Применен комплексный методологический подход, включающий экспериментальный, анатомический, гистологический, морфометрический и информационноматематический методы, а также методы наблюдения, описания и анализа.
Выход из эксперимента осуществляли путем декапитации в соответствии с директивой Европейского Парламента № 2010/63/EU от 22.09.2010 «О защите животных, используемых для научных целей».
Острую 20-минутную ишемию мозга путем пережатия общих сонных артерий (2-сосудистая модель неполной глобальной ишемии без гипотонии) моделировали на фоне премедикации (сульфат атропина 0,1 мг/кг, подкожно) и общей анестезии (Zoletil 100, 10 мг/кг).
Общее состояние животных в послеоперационном периоде оценивалось по 100-бальной системе [17] с учетом принципов исследования физиологии и патофизиологии головного мозга [18, 19].
Взятие материала проводили через 1 ( n =5), 3 ( n =5), 7 ( n =5), 14 ( n =5) и 30 ( n =5) суток после ишемии. Контролем ( n =5) служили ложнооперированные (без окклюзии артерий) животные того же возраста. Головной мозг фиксировали путем перфузии 4%-го раствора параформа на 0,1 М фосфатном буфере (рН — 7,4) через восходящую часть дуги аорты. Серийные фронтальные срезы (2–4 мкм) на уровне гиппокампа [20] окрашивали гематоксилином и эозином, а также с помощью иммуногистохимического метода против каспазы-3, р-53, bcl-2, синаптофизина (р38) и MAP-2 (производитель: Leica Biosystems Newcastle Ltd, Великобритания). Окраска осуществлялась согласно рекомендациям фирмы производителя реагентов. На микроскопе Leica DM 1000 делались цифровые микрофотографии серийных срезов (по 200 полей зрения с каждого отдела на срок).
Для исследования ультраструктуры клеток, отростков и синапсов материал контрастировали 1– 2 ч в 1%-м неза-буференном растворе четырехокиси осмия, заключали в смесь эпона и аралдита. Ультратонкие срезы окрашивали уранилацетатом и цитратом свинца. Использовали ультрамикротом LKB- 8800 (Швеция), микроскоп Hitachi-600H (Япония). Фотографировали на пленки 9 x 12 см при разном увеличении.
Морфометрический анализ проводили с использованием ранее разработанного подхода к оценке систем межнейронной коммуникации с помощью иммуногистохимических методов и программы ImageJ 1.46 [21]. Определяли общую численную плотность нейронов, относительную площадь р38- и каспаза-позитивного материала. Проверку статистических гипотез осуществляли непараметрическими критериями Манна — Уитни, ANOVA (однофакторный дисперсионный анализ Краскела — Уоллиса) и критерия х 2 (StatSoft STATIS-TICA 8.0) [22]. Результаты представлены как медиана (нижний, верхний квартили) и в процентах (95%-й доверительный интервал — 95% ДИ). В ходе проведения статистического анализа нулевая гипотеза отвергалась при p ≤ 0,05.
Результаты
Для молекулярного слоя поля СА3 гиппокампа характерно наличие уникальной зоны — stratum lucidum ), которая локализуется на уровне апикальных участков дендритов пирамидных нейронов и состоит из дендритов, гигантских синапсов, сформированных аксонами мшистых волокон, и небольшого количества отростков астроцитов. Существенно то, что при окраске гематоксилином и эозином stratum lucidum не контрастировалась с другими уровнями молекулярного слоя СА3 и выглядела как в СА1 (рис. 1 а, б). Совершенно иная картина наблюдалась при иммуногистохимическом выявлении цито-скелетного белка MAP2 (microtubule-associated protein 2; dendrite-specific). Stratum lucidum была представлена в виде светлой полосы, содержащей срезы дендритов с MAP2-позитивным материалом, над слоем тел пирамидных нейронов только в поле СА3. Светлые участки соответствовали синаптическим терминалям, цитоскелет которых не содержит MAP2-позитивный материал (рис. 1 в, г; 3 а, б).
Именно эти синаптические терминали (светлые участки при окраске на МАР2) в stratum radiatum СА1 и особенно гигантские терминали в stratum lucidum СА3 интенсивно окрашивались при иммуногистохимическом выявлении синаптофизина (рис. 2 а, б). В stratum radiatum СА1 крупные терминали практически не выявлялись. Локализация меток была вдоль дендритов и в нейропиле (рис. 2а). В stratum lucidum СА3 метки локализовались вдоль апикальных дендритов (рис. 2б).
Существенно то, что при окраске на каспазу-3 локализация меток (рис. 2 в, г) соответствовала таковой при окраске на синаптофизин (рис. 2 а, б). В телах пирамидных нейронов каспаза-3 не выявлялась, она локализова- лась только в терминалях аксодендритических, аксоши-пиковых и аксосоматических синапсов (рис. 2 в, г).
Таким образом, по своей локализации каспаза-3 соответствовала стратегическим зонам реализации механизмов синаптической пластичности. При этом большее ее количество было в терминалях аксошипиковых и аксо-дендритических синапсов. Это позволяет предположить, что данный плейотропный фермент апоптоза может принимать участие в механизмах защиты, компенсации и восстановления межнейронных связей гиппокампа как в норме, так и после ишемического воздействия. При этом острая ишемия головного мозга может стимулировать защитные свойства каспазы-3.
Для проверки этой гипотезы в настоящей работе оценивали изменения количества нейронов, ультраструктуры синапсов, сравнивали площадь меток при иммуногистохимическом выявлении синаптофизина и каспазы-3 в терминалях. Изучение апоптоза сводилось к определению активности про- (р53), антиапоптозных (bcl-2) белков и каспазы-3 в перикарионе нейронов.
Установлено, что в постишемическом периоде происходило уменьшение общей численной плотности пирамидных нейронов. Через 30 суток после окклюзии дефицит нейронов в поле СА1 составил 33,0%, а в СА3 — 17,4% (табл. 1).
В остром периоде (1, 3 суток) после острой ишемии в гиппокампе появлялись нейроны с признаками тин-кториальных (усиление и уменьшение интенсивности окраски цитоплазмы и ядра — гиперхромные и гипохромные), гидропических (вакуолизация, отек-набухание), дегидратационных (темные клетки с обратимым сморщиванием) и некробиотических (клетки-тени, пик-номорфные, гомогенизированные клетки) изменений,
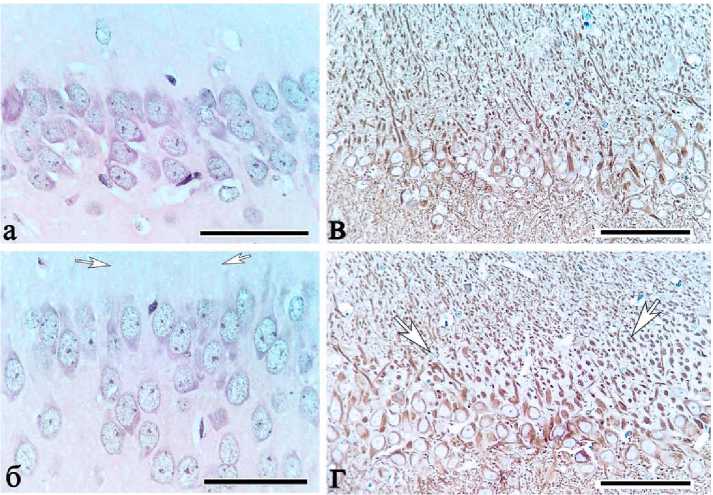
Рис. 1. Поля СА1 (а, в) и СА3 (б, г) гиппокампа контрольных белых крыс: демонстрация выявления и локализации stratum lucidum (стрелки); а, б — окраска гематоксилином и эозином, в, г — иммуногистохимическая окраска против MAP2. Докраска гематоксилином. Объектив х 40, шкала — 100 мкм (в, г); х 100, шкала — 25 мкм (а, б)
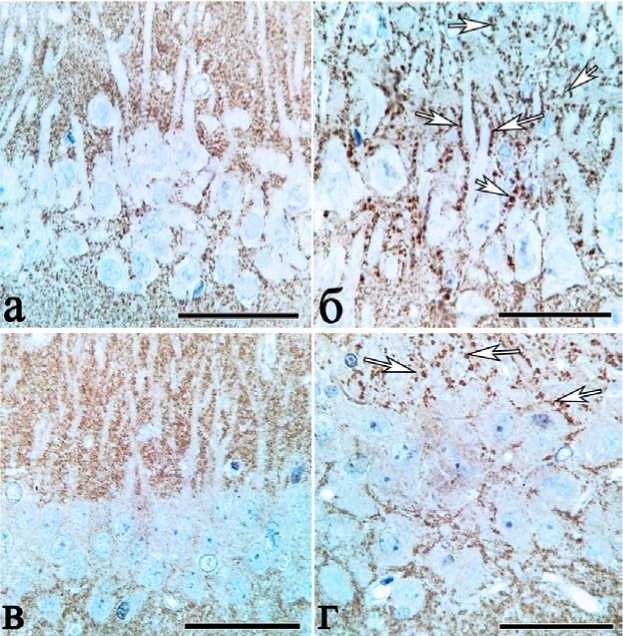
Рис. 2. Поля СА1 (а, в) и СА3 (б, г) гиппокампа контрольных белых крыс: наличие гигантских терминалей в stratum lucidum (стрелки) СА3 и более мелких терминалей в stratum radiatum СА1 при иммуногистохимической окраске против синаптофизина (а, б) и каспазы-3 (в, г). Докраска гематоксилином. Объектив х 100, шкала — 25 мкм
Таблица 1
Общая численная плотность (на 1 мм2площади клеточных слоев) нейронов гиппокампа в постишемическом периоде, Me (QL-QU)
|
Группы животных |
Поля гиппокампа |
|
|
СА1 |
СА3 |
|
|
Ложнооперированные |
2936 (2726-3652) |
1983 (1755-2106) |
|
1 сутки |
2322 (2167–2553)* |
1754 (1541–1902)* |
|
3 суток |
2308 (1960–2456)* |
1699 (1432–1712)*^ |
|
7 суток |
2135 (1865–2301)*^ |
1650 (1415–1720)* |
|
14 суток |
2090 (1767–2115)*^ |
1662 (1398–1734)* |
|
30 суток |
1983 (1764–2213)* |
1638 (1178–1702)* |
|
ANOVA |
df=5; Н=18,5; p =0,02& |
df=5; Н=16,6; p =0,03& |
Примечание: * — сравнение с ложнооперированными животными, ^ — сравнение с предыдущим сроком (критерий Манна — Уитни), & - сравнение между всеми сроками по данному полю гиппокампа (ANOVA); различия статистически значимы при p<0,05. Анализировали по 5 – 10 серийных срезов с каждого животного. Me — медиана, QL- нижний , QU — верхний квартили, ANOVA — однофакторный дисперсионный анализ Краскела — Уоллиса.
фагоцитоза и мелкие поля «выпадения» нейронов. Среди необратимо поврежденных преобладали пикноморфные нейроны с признаками коагуляционно-ишемического некроза (рис. 3 а, б). В молекулярном слое появлялись контуры окрашенных эозином апикальных дендритов (рис. 3 б). Нейроглиальные взаимоотношения характеризовались увеличением количества единичных, групп астроцитов и микроглиоцитов около патологически измененных нейронов.
Через 7 суток в гиппокампе сохранялись проявления кариоцитолизиса, отека-набухания и вакуолизации тел нейронов, пикноморфные нейроны. Выявлялись очаги выпадения нейронов и большое количество микроглиоцитов, которые располагались около ишемически измененных нейронов либо отдельно, либо в составе группы с астроцитами.
Через 14 суток рядом с очагами ишемически поврежденных нейронов часто выявлялись гипертрофи-
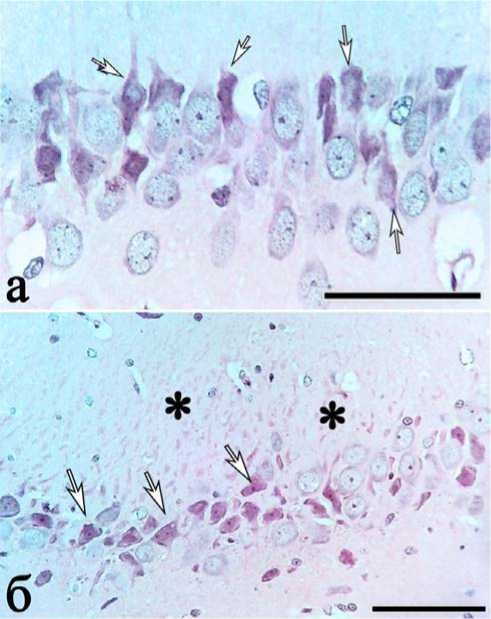
Рис. 3. Поля СА1 (а) и СА3 (б) гиппокампа через 1 сутки после ишемии: преобладают нейроны с признаками коагуляционноишемического некроза (стрелки), в stratum lucidum (*) видны контуры апикальных дендритов. Окраска гематоксилином и эозином. Объектив х 100, шкала — 25 мкм (а); х 40, шкала — 100 мкм (б)
рованные нейроны. Даже через 30 суток после ишемии сохранялись очаги пикноморфных нейронов с большим содержанием глиальных клеток.
Изучение ультраструктуры синапсов гиппокампа показало, что после ишемии появлялось большое количество синаптических терминалей, измененных по светлому типу деструкции. Подобные изменения затрагивали все типы синапсов, включая и гигантские в stratum lucidum (рис. 4б).
Таким образом, после 20-минутной окклюзии общих сонных артерий в гиппокампе происходила необратимая деструкция части пирамидных нейронов и разрушение межнейронных синапсов.
По данным иммуногистохимического исследования, белки регуляции апоптоза (р53, bcl-2) выявлялись в единичных нейронах, основная масса перикарионов была bcl-2-, р53-негативной. Каспаза-3 имела высокую активность только в аксонах и синаптических терминалях, а в перикарионах меток к данному белку, как и в контроле, не выявлялось. Мы полагаем, что это свидетельствовало о том, что при использованной модели острой ишемии не выявлялось функционально значимых объемов элиминации нейронов путем апоптоза. Единичные нейроны с признаками активации белков регуляции апоптоза без наличия активной каспазы-3 в цитоплазме сомы нейронов свидетельствовали только о принципиальной возможности реализации данного процесса. Каспазу-3 в данном случае необходимо рассматривать в аспекте ее плейотропности, участия в адаптационных и восстановительных процессах за счет постишемической активации нейропластичности на уровне аксонов и синапсов.
Для этого в полях СА1 и СА3 проведено сравнение относительной площади меток синаптофизина и каспазы-3 в динамике постишемического периода. Установлено, что в поле СА1 количество меченного синаптофизина снижалось через 1 и 3 суток. Затем этот показатель восстанавливался до контрольного уровня (табл. 2).
В гигантских синапсах поля СА4 содержание синап-тофизина уменьшалось через 1 сутки после ишемии, а уже через 3 суток было на уровне контроля (табл. 3).
Все это свидетельствовало о том, что выявленное нами разрушение терминалей по светлому типу сопровождалось, вероятно, и разрушением синаптофизина, связанного с синаптическими пузырьками во всех синапсах.
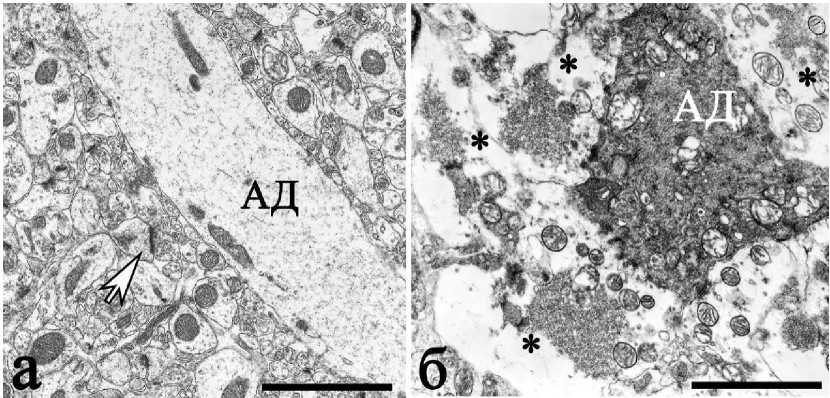
Рис. 4. Ультраструктура зоны апикальных дендритов (АД) поля СА1 (а — норма) и СА3 (б — через 1 сутки после ишемии): вокруг дендритов в СА1 преобладают мелкие и средние синапсы (стрелка), для поля СА3 после ишемии характерно наличие гигантских терминалей с признаками светлого типа деструкции (*). Окраска уранилацетатом и цитратом свинца, шкала — 2 мкм
Таблица 2
Относительная площадь (%) меток синаптофизина и каспазы-3 в stratum radiatum поля СА1 гиппокампа белых крыс в норме и после восстановления кровотока (по 200 полей зрения при каждом сравнении на срок)
|
Группы |
Белки |
|
|
Синаптофизин |
Каспаза-3 |
|
|
Ложнооперированные |
20,2 (14,9–26,4) |
25,4 (19,5–32,0) |
|
1 сутки |
9,1 (5,5–14,0) |
13,6 (9,2–19,1) |
|
χ 2=8,9; p = 0,003 * |
χ 2=8,1; p=0,004 * |
|
|
3 суток |
11,4 (7,4–16,6) χ 2=5,2; p = 0,02 * |
22,1 (16,5–28,5) χ 2=4,4; p=0,037 ^ χ 2=7,5; p = 0,01# |
|
34,3 (27,8–41,3) |
||
|
7 суток |
16,7 (11,8–22,6) |
χ 2=6,8; p =0 ,01^ χ 215,4; p = 0,0001*# |
|
38,5,2 (31,7–45,6) |
||
|
14 суток |
12,8 (8,1–17,7) |
χ 2=7,3; p = 0,007* χ 2=33,2; p = 0,0001# |
|
30 суток |
17,5 (12,5–23,5) |
20,1(14,8–26,3) χ 2=15,5; p = 0,0001 ^ |
Примечание: различия статистически значимы в cравнении с контролем (*), с предыдущим сроком (^) и между белками (#) при p≤0,05 (критерий χ 2, n=200). Данные представлены как среднее и 95% ДИ.
Таблица 3
Относительная площадь (%) меток синаптофизина и каспазы-3 в stratum lucidum поля СА3 гиппокампа белых крыс в норме и после восстановления кровотока (по 200 полей зрения на каждый срок)
|
Группы |
Белки |
|
|
Синаптофизин |
Каспаза-3 |
|
|
Ложнооперированные |
24,6 (18,8–31,2) |
21,1 (15,7–27,4) |
|
1 сутки |
15,8 (11,0–21,6) χ 2=4,3; p=0,038 * |
19,5 (14,3–25,7) |
|
3 суток |
22,0 (16,5–28,4) |
27,8 (21,7–34,6) |
|
7 суток |
29,2 (23,0–36,0) |
23,3 (17,6–29,8) |
|
14 суток |
22,3 (16,7–28,7) |
19,7 (14,4–25,9) |
|
30 суток |
28,2 (22,1–35,0) |
17,6 (12,6–23,6) |
Примечание: * — в cравнении с контролем различия статистически значимы при p≤0,05 (критерий χ 2). Данные представлены как среднее и 95% ДИ.
В норме относительная площадь меток каспазы-3 в поле СА1 статистически значимо не отличалась от таковой синаптофизина (табл. 1 и 2). В постишемическом периоде наиболее выраженные изменения содержания каспазы-3 отмечались в stratum radiatum поля СА1. Здесь содержание каспазы-3 в остром периоде по сравнению с контролем сначала (1 сутки) уменьшалось, а через 3 суток восстанавливалось. Затем (7 и 14 суток) сохранялось высокое содержание этого белка. При этом через 3, 7 и 14 суток относительная площадь меток каспазвы-3 была больше, чем меток синаптофизина (табл. 1). В stratum lu- cidum поля СА3, содержащем большое количество гигантских терминалей, статистически значимых изменений содержания каспазы-3 выявить не удалось (табл. 2).
Обсуждение
Ранее при использовании 2-сосудистой модели неполной глобальной ишемии без гипотонии (ООСА) нами была показана смешанная (парапоптоз) природа гибели нейронов неокортекса — гидропическая дистрофия, сочетание процессов некроза (колликвационного и коагуляционного) и апоптоза. Однако основную роль в гибели нейронов все же играли процессы быстрого (аутолитического колликвационного) и отдаленного постишемического некроза (коагуляционного на фоне истощения лизосомальных ферментов) [9, 11]. По данным литературы, каспаза-3 рассматривается не только как ключевой фермент конечной стадии апоптоза, но и как важный химический компонент ишемического прекондиционирования и синаптической пластичности [12, 13]. В результате возникла необходимость выявления связи синаптической пластичности и активности каспазы-3 как одного из ключевых ферментов защиты нейронов.
Наиболее подходящей моделью острой ишемии для решения поставленных задач была 20-минутная окклюзия общих сонных артерий, после которой, как правило, возникают диффузно-очаговые изменения нервной ткани головного мозга экспериментальных животных [9, 11]. Выбор отдела головного мозга был обусловлен тем, что в stratum lucidum поля СА3 содержится большое количество гигантских синапсов, которые можно изучать с помощью методов световой иммуногистохимии.
При сравнении серийных фронтальных срезов гиппокампа мы показали, что места локализации синапто-физина в stratum lucidum совпадали с локализацией каспазы-3 — гигантские синаптические терминали. Метки обоих белков четко выявлялись в виде округлых гранул, локализацию и размеры которых можно было оценить с помощью программы ImageJ. Установлено, что максимальное содержание каспазы-3 было в поле СА1 через 3–14 суток после острой ишемии.
Таким образом, мы показали, что каспаза-3 в норме и после ишемии локализовалась в синаптических терминалях, а в перикарионах этот белок отсутствовал. Кроме того, с помощью иммуногистохимии нам не удалось показать активации белков р53 и bcl-2. То есть подтверждались неапоптотические свойства каспазы-3, которая, вероятно, участвовала в постишемической активации нейропластичности. По нашим данным, в постишемическом периоде на фоне активации синапсов и компенсаторного неосинаптогенеза происходила активация каспазы-3 в терминалях и аксонах без каких-либо признаков ее активации в перикарионе, свойственной для апоптоза.
Заключение
-
1. Плейотропный фермент апоптоза каспаза-3 в норме и после острой ишемии локализуется в аксонах и си-
- наптических терминалях, имеет связь с механизмами синаптической пластичности гиппокампа белых крыс.
-
2. Максимальная активация каспазы-3 происходит в stratum radiatum поля СА1 гиппокампа через 3–14 суток после восстановления кровотока.
Список литературы Плейотропные ферменты апоптоза и синаптическая пластичность гиппокампа белых крыс после окклюзии общих сонных артерий
- Zeng Y. S., Xu Z. C. Co-existence of necrosis and apoptosis in rat hippocampus following transient forebrain ischemia. Neurosci. Res. 2000; 37: 113-125. DOI: 10.1016/s0168-0102(00)00107-3
- Winkelmann E. R., Charcansky A., Faccioni-Heuser M. C., Netto C. A., Achaval M. An ultrastructural analysis of cellular death in the CA1 field in the rat hippocampus after transient forebrain ischemia followed by 2, 4 and 10 days of reperfusion. Anat. Embryol. 2006; 211: 423-434. DOI: 10.1007/s00429-006-0095-z
- Wirth C., Brandt U., Hunte C., Zickermann V. Structure and function of mitochondrial complex I. Biochim Biophys Acta. 2016; 1857(7): 902-914. DOI: 10.1016/j.bbabio.2016.02.013
- Muller G. J., Stadelmann C., Bastholm L., Elling F., Lassmann H., Johansen F. F. Ischemia leads to apoptosis-and necrosis-like neuron death in the ischemic rat hippocampus. Brain Pathol. 2004; 14(4): 415-424. DOI: 10.1111/j.1750-3639.2004.tb00085.x
- Baron J.-C., Yamauchi H., Fujioka M., Endres M. Selective neuronal loss in ischemic stroke and cerebrovascular disease. J. Cereb. Blood Flow Metab. 2014; 34: 2-18. DOI: 10.1038/jcbfm.2013.188
- Maurer L. L., Philbert M. A. The mechanisms of neurotoxicity and the selective vulnerability of nervous system sites. Handb. Clin. Neurol. 2015; 131: 61-70.
- DOI: 10.1016/B978-0-444-62627-1.00005-6
- Nikonenko A. G., Radenovic L., Andjus P. R., Skibo G. G. Structural features of ischemic damage in the hippocampus. The anatomical record. 2009; 292: 1914-1921.
- DOI: 10.1002/ar.20969
- Shetty A. K. Hippocampal injury-induced cognitive and mood dysfunction, altered neurogenesis, and epilepsy: can early neural stem cell grafting intervention provide protection? Epilepsy Behav. 2014; 38: 117-124.
- DOI: 10.1016/j.yebeh.2013.12.001
- Степанов А. С., Акулинин В. А., Степанов С. С., Авдеев Д. Б. Клеточные системы восстановления и утилизации поврежденных нейронов головного мозга белых крыс после 20-минутной окклюзии общих сонных артерий. Российский физиологический журнал им. И. М. Сеченова. 2017; 103(10): 1135-1147.
- Семченко В. В., Степанов С. С., Боголепов Н. Н. Синаптическая пластичность головного мозга (фундаментальные и прикладные аспекты). 2-е изд. М.: 2014: 408.
- Степанов А. С., Авдеев Д. Б., Акулинин В. А., Степанов С. С. Структурно-функциональные изменения нейронов неокортекса белых крыс после 20-минутной окклюзии общих сонных артерий. Патологическая физиология и экспериментальная терапия. 2018; 62(2): 30-38.
- Яковлев А. А., Гуляева Н. В. Плейотропные функции протеиназ мозга: методические подходы к исследованию и поиск субстратов каспазы. Биохимия. 2011; 76(10): 1325-1334.
- DOI: 10.1134/s0006297911100014
- Яковлев А. А., Гуляева Н. В. Прекондиционирование клеток мозга к патологическим воздействиям: вовлеченность протеаз (обзор). Биохимия. 2015; 80(2): 204-213.
- McLaughlin B., Hartnett K. A., Erhardt J. A., Legos J. J., White R. F., Barone F. C., Aizenman E. Caspase 3 activation is essential for neuroprotection in preconditioning. Proc. Natl. Acad. Sci. USA. 2003; 100: 715-720.
- DOI: 10.1073/pnas.0232966100
- Launay S., Hermine O., Fontenay M., Kroemer G., Solary E., Garrido C. Vital functions for lethal caspases. Oncogene. 2005; 24: 5137-5148.
- DOI: 10.1038/sj.onc.1208524
- Khalil H., Peltzer N., Walicki J., Yang J.-Y., Dubuis G., Gardiol N., Held W., Bigliardi P., Marsland B., Liaudet L., Widmann Ch. Caspase 3 protects stressed organs against cell death. Mol. Cell Biol. 2012; 32: 4523-4533.
- DOI: 10.1128/mcb.00774-12
- Корпачев В. Г., Лысенков С. П., Тель Л. З. Моделирование клинической смерти и постреанимационной болезни у крыс. Патологическая физиология и экспериментальная терапия. 1982; 3:78-80.
- Буреш Я., Бурешова О., Хьюстон Д. П. Методики и основные эксперименты по изучению мозга и поведения. М.: Высшая школа; 1991: 399.
- Васильев Ю. Г., Вольхин И. А., Данилова Т. Г., Берестов Д. С. Оценка неврологического статуса домашних и лабораторных животных. Международный вестник ветеринарии. 2013; 3: 52-55.
- Paxinos G., Watson C. The Rat Brain in Stereotaxic Coordinates. 5th ed. San Diego: Elsevier Academic Press; 2005: 367. 21. Акулинин В. А., Степанов С. С., Авдеев Д. Б., Степанов А. С., Разумовский В. С., Артюхов А. В., Горбунова А. В. Особенности изменений неокортекса, архикортекса и миндалевидного тела белых крыс после острой ишемии. Журнал анатомия и гистопатология. 2018; 7(2): 9-17.
- DOI: 10.18499/2225-7357-2018-7-2-9-17
- Боровиков В. Statistica. Искусство анализа данных на компьютере. 2-е изд. СПб: Питер; 2003: 688.


