Почечно-клеточный рак у пациентов, находящихся на диализе
Автор: Isao Ishikawa
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Лекции
Статья в выпуске: 1 т.1, 2011 года.
Бесплатный доступ
Заболеваемость почечно-клеточным раком (ПКР) у пациентов, находящихся на диализе, выше, чем в общей популяции. Чем дольше больной получает гемодиализ, тем выше заболеваемость ПКР. Риск развития ПКР связан с формированием поликистоза почек. Некоторые виды ПКР у пациентов, находящихся на гемодиализе, или пациентов с заболеваниями почек поздних стадий не соответствуют гистологической классификации ПКР, представленной Всемирной Организацией Здравоохранения. Такие опухоли отличаются от спорадических; их называют ПКР, ассоциированным с приобретенным поликистозом почек (ППКП), или светлоклеточным-папиллярным ПКР у пациентов с заболеваниями почек поздних стадий. Рак почки на фоне ППКП развивается у пациентов, которые получают диализ длительно (более 10 лет). В связи с высокой заболеваемостью и отсутствием симптомов, пациентов находящихся на диализе из группы высокого риска, необходимо обследовать на предмет ПКР. Такой скрининг особенно важен для пациентов на диализе продолжительностью более 10 лет, пациентам с тяжелым ППКП и кандидатам на трансплантацию почки. Опухоль в почке, прилежащая к множественным приобретенным кистам, как правило, мало или совсем не накапливает контрастное вещество при КТ, а также не выступает за контур почки. Таким образом, дооперационная оценка ПКР у пациентов на длительном диализе затруднительна.
Приобретенные кисты почек, гемодиализ, почечно-клеточный рак, пкр на фоне ппкп, ультразвуковое исследование с контрастированием с использованием перфторбутановых микропузырь- ков, пэт-кт, кт
Короткий адрес: https://sciup.org/14045401
IDR: 14045401
Текст научной статьи Почечно-клеточный рак у пациентов, находящихся на диализе
Диагноз ППКП устанавливается при выявлении в пораженной почке от 3 до 5 кист, если используются методы лучевой диагностики, а также в случае поражения 25% поверхности почки кистами на гистологическом срезе [1].
ППКП выявляется у 12% пациентов с хроническими заболеваниями почек еще до начала диализа, у 44% пациентов на диализе продолжительностью менее 3 лет, у 79% пациентов, находящихся на диализе продолжительностью от 3 до 10 лет [2], и у 90% пациентов на диализе более 10 лет [1]. Таким образом, чем дольше пациент находится на диализе, тем выше заболеваемость и частота сложных случаев ППКП [2]. Известно, что сморщенные почки увеличивают- ся в размерах за счет приобретенного полики-стоза. Заболеваемость ППКП у мужчин и женщин отличается [3]. У мужчин заболеваемость выше и течение болезни менее благоприятное, чем у женщин [4]. Так, у мужчин медиана (интерквартильный размах) билатерального объема почек составила 71 (55~85) мл/1,73м2 n=24, 320 (186~723) мл/1,73м2 n=19, 280 (157~696) мл/1,73м2 n=19 и 347 (164~740) мл/1,73м2 n=18, после 3, 18, 19 и 20 лет гемодиализа, соответственно. У женщин медиана (интерквартильный размах) билатерального объема почек была 62 (49~71) мл/1,73м2 n=20, 66 (54~107) мл/1,73м2 n=15, 65 (62~102) мл/1,73м2 n=14 и 76 (68~112) мл/1,73м2 n=13, после 3, 18, 19 и 20 лет гемодиализа, соответственно. Логарифмически преобразованные объемы почек в период от 5 до 25 лет после начала гемодиализа были значительно больше у мужчин, чем у женщин [4]. Также от- мечено, что частота ППКП выше у молодых пациентов [5].
ПКР развивается у 1,5% всех пациентов на диализе [6], а ежегодная заболеваемость ПКР у пациентов на диализе составляет 0,04% [1]. В Японии на протяжении 22 лет проводилось общенациональное исследование посредством анкетирования больных ПКР, развившимся на фоне диализа. Анкетирование проводилось 12 раз с интервалом 1 год с 1982 по 2004 годы [7]. В итоге были накоплены данные по 2873 пациентам с ПКР, изучены характеристики ПКР у больных на диализе (Таблица 1) [7].
Ежегодная заболеваемость ПКР у больных на диализе составляет 191 случай на 100 000 пациентов,т находящихся на диализе, 112 случаев на 100 000 пациентов на диализе продолжительностью менее 10 лет и 438 случаев ПКР на 100 000 пациентов на диализе более 10 лет (Диаграмма 1).
Таблица 1. Сводная таблица данных по 2873 пациентам с ПКР на фоне диализе (результаты общенационального анкетирования в Японии)
Стандартизированный показатель заболеваемости ПКР у пациентов на диализе оказался в 1417 раз выше, чем в общей популяции [7]. Таким образом, можно констатировать, что заболеваемость ПКР у больных на диализе выше, чем в общей популяции. ПКР особенно распространен у пациентов на длительном диализе, также заболеваемость ПКР выше у молодых пациентов мужского пола и не зависит от предшествующего заболевания почек [1].
Рисунок 1. Сравнение ежегодной заболеваемости ПКР на 100 000 пациентов, находящихся на диализе в зависимости от продолжительности диализа
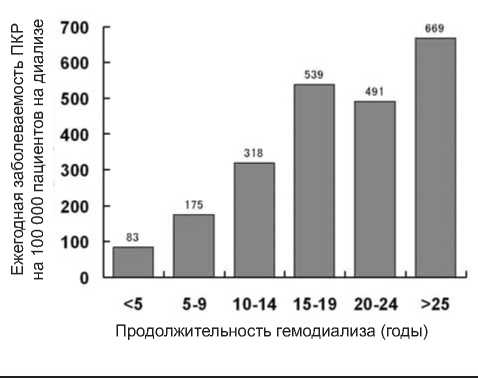
ПКР чаще развивается у пациентов с хроническим гломерулонефритом, который требует более продолжительного гемодиализа, чем такие заболевания, как диабетическая нефропатия или нефросклероз [2, 8]. ПКР у больных на диализе связан с приобретенным поликистозом почек в 81% случаев [7]. К группе риска возникновения ПКР относятся молодые пациенты мужского пола, пациенты после продолжительного диализа, а также пациенты с увеличенными в размерах почками за счет приобретенного полики-стоза [9].
По данным Dunnill и соавт. [9] и Hughson и со-авт. [10] гистологически рак почки может развиваться из трубочек, кист, атипичных кист, аденомы. Как показано ранее, факторы риска развития приобретенного поликистоза почек и ПКР во многом схожи.
При изучении гистологических подтипов ПКР отмечено, что заболеваемость папиллярным ПКР (по классификации ПКР Всемирной Организации Здравоохранения (ВОЗ) 2004) у пациентов, находящихся на длительном диализе [11], была выше по сравнению с общей популяцией [12].
Однако заболеваемость ПКР у пациентов на кратковременном диализе такая же, как и в общей популяции пациентов без приобретенного поли-кистоза, т.е. отмечается высокая частота светлоклеточного ПКР [7, 13].
При сравнении характеристик ПКР у больных на диализе [1] и больных общей популяции отмечено следующее: 1) ПКР чаще возникает у молодых пациентов мужского пола на диализе; 2) ПКР связан с приобретенным поликистозом почек; 3) светлоклеточный подтип ПКР встречается реже; 4) гистологические подтипы ПКР включают такие формы, как ПКР, ассоциированный с ППКП, и светлоклеточный-папиллярный ПКР; 5) ПКР чаще развивается билатерально; 6) ПКР возникает мультифокально; 7) ПКР чаще происходит из трубочек, кист, атипичных кист и аденом; 8) метастазы возникают в 15% случаев. Таким образом, метастатический процесс развивается не так редко [7].
По данным исследования, проведенного при помощи анкетирования [14], прогноз ПКР у пациентов на диализе относительно благоприятный. У пациентов после хирургического лечения актуальная пятилетняя выживаемость составила 79,7%, а опухолеспецифичная выживаемость -91,7% [14]. Однако выживаемость пациентов на диализе, у которых развился ПКР, на 14% ниже, чем у пациентов на диализе без ПКР, поскольку ко времени установления диагноза у некоторых пациентов уже выявляются метастазы или отмечается стремительный рост опухоли [14].
При сравнении характеристик групп пациентов, находящихся на диализе >20 лет (N=84) и <10 лет (N=215), пациентам, длительно получающих диализ, были свойственны: молодой возраст, мужской пол, большие размеры опухоли, папиллярное строение ПКР (диагностированного до 2006), метастазирование и неблагоприятное течение [15]. Поскольку после успешной трансплантации почки отмечается регрессия приобретенных почечных кист [16], ожидается снижение заболеваемости ПКР. На самом деле заболеваемость ПКР может увеличиться из-за иммуносупрессивной терапии после трансплантации почки [16]. По нашим данным у 268 реципиентов аллогенных трансплантантов отмечено 4 случая ПКР, при этом в 3 из 4 случаев ПКР развился перед трансплантацией почки.
Патологическая анатомия ПКР у больных на диализе
Начиная с 2006 года, гистологическая классификация ПКР, развившегося у пациентов на диа- лизе или с хроническими заболеваниями почек, отличается от стандартной предложенной ВОЗ [11, 17, 18].
Tickoo и соавт. [18] описали следующие опухоли, возникающие на фоне заболеваний почек поздних стадий:
-
A) Типичные формы опухолей, соответствующие спорадическим, а именно светлоклеточный ПКР, папиллярный ПКР 1 и 2 типов, а также хромофобный ПКР;
-
B) Опухоли, отличающиеся от спорадических, ассоциированные с ППКП и представляющие светлоклеточный-папиллярный ПКР;
-
C) Кисты, микрокистозные образования, папиллярные аденомы и т.п.
По данным Tickoo и соавт. [18] ПКР, наблюдаемый в общей популяции, составил только 41% случаев ПКР у больных на диализе. При этом неклассифицированный ПКР, ассоциированный с ППКП у больных на диализе, составил 36%, а светлоклеточный-папиллярный ПКР, возникший на фоне заболеваний почек поздних стадий, которые отмечается у больных без ППКП и без диализа, составил 23%.
Частота встречаемости новых подтипов ПКР у больных на диализе по данным Tickoo и соавт. [18], Nouh и соавт. [19] и нашим данным представлена в Таблице 2.
ся «+» и «+», «+» и «-», «-» и «+», соответственно [18]. ПКР, ассоциированный с ППКП [18], описан исследователем Nouh и соавт. как «неклассифицированный ПКР ассоциированный с ППКП» [19] и как «ПКР с отложением оксалатов кальция» исследователем Zamin-Khamesh и соавт. (20). Для ПКР, ассоциированного с ППКП, группы ученых под руководством Cossa-Rocca [21] и Pan [22] описали хромосомные вставки на Х хромосомах 1, 2, 3, 6, 7, 16, 17 и Y хромосоме.
Изучается взаимосвязь гистологического строения ПКР и продолжительности гемодиализа. По сообщению Tickoo и соавт. [18], в США развитие ПКР, ассоциированного с ППКП, не связано с длительностью гемодиализа, в то время как, по данным Nouh и соавт. [19] и нашим данным (не опубликованы) в Японии, отмечена высокая заболеваемость ПКР, ассоциированного с ППКП, у пациентов, находящихся на гемодиализе длительностью более 10 лет. Данные представлены в Таблице 3.
На Рисунке 2-а представлены гистологические подтипы ПКР, ассоциированного с ППКП: крупные опухолевые клетки, содержащие гранулярную эозинофильную цитоплазму, большие ядра и ядрышки; степень злокачественности по Фурману 2 или 3. Строение опухоли тубулярное или папиллярное, ацинарное или солидное (Рисунок
Таблица 2. Гистологические подтипы ПКР у больных на диализе
|
Tickoo и соавт. 2006 |
Nouh и соавт. 2009 |
Ishikawa и соавт. 2009 |
Всего |
|
|
N |
66 |
27 |
34 |
127 |
|
Опухоли, подобные спорадическому ПКР, N (%) |
||||
|
Светлоклеточный (обычный) ПКР |
10 (15) |
10 (37) |
12 (35) |
32 (25) |
|
Папиллярный ПКР |
12 (18) |
2 (7) |
8 (24) |
22 (17) |
|
Хромофобный ПКР |
5 (8) |
1 (4) |
0 (0) |
6 (5) |
|
Опухоли, отличающиеся от спорадических форм ПКР, N (%) |
||||
|
Неклассифицированный (ПКР, ассоциированный с ППКП) |
24 (36) |
8 (30) |
9 (27) |
41 (32) |
|
Светлоклеточный - папиллярный ПКР |
15 (23) |
2 (7) |
2 (6) |
19 (15) |
|
Другие типы, N (%) |
4 (15) |
3 (9) |
7 (6) |
|
|
Саркоматоидный, N (%) |
2 (3) |
3 (11) |
1 (3) |
6 (5) |
По данным иммуногистохимического исследования, клетки папиллярного ПКР 2 типа, ПКР, ассоциированного с ППКП, и светлоклеточного-папиллярного ПКР по альфа-метилацил-КоА рацемазе (AMAКР) и цитокератину 7 (ЦК7) являют-
2-а, b и d). В 79% случаях ПКР, ассоциированного с ППКП, в опухоли внутриклеточно, внутри канальцев и в интерстициальном пространстве отмечается отложение оксалатов кальция. Микро-кистозные структуры часто обнаруживаются во
Таблица 3. Гистологические подтипы ПКР у больных на диализе
|
Tickoo и соавт. 2006 |
Nouh и соавт. 2009 |
Ishikawa и соавт. 2009 |
||||
|
Продолжительность диализа |
<10 лет |
≥ 10 лет |
<10 лет |
≥ 10 лет |
<10 лет |
≥ 10 лет |
|
N |
14 |
11 |
15 |
12 |
20 |
14 |
|
Опухоли, подобные спорадическому ПКР, N (%) |
||||||
|
Светлоклеточный (обычный) ПКР |
1 |
1 |
9 |
1 |
11 |
1 |
|
Папиллярный ПКР |
1 |
1 |
2 |
0 |
5 |
3 |
|
Опухоли, отличающиеся от спорадических форм ПКР, N (%) |
||||||
|
Неклассифицированный (ПКР, ассоциированный с ППКП) |
7 |
7 |
1 |
7 |
1 |
8 |
|
Светлоклеточный - папиллярный ПКР |
4 |
2 |
2 |
0 |
2 |
0 |
|
Другие типы, N (%) |
1 |
0 |
1 |
4 |
1 |
2 |
внутриклеточном и межклеточном пространстве, а ПКР, ассоциированный с ППКП, имеет ячеистое строение (Рисунок 2-d). Помимо иммуногистохимических характеристик важными признаками для дифференцировки между ПКР ассоциированным с ППКП и папиллярным ПКР 2 типа являются кристаллы оксалатов кальция (Рисунок 2-а, b и c) и ячеистые структуры.
Гистологические подтипы ПКР у больных на диализе, данные о которых были собраны Японской Урологической Ассоциацией в 1999 году [7], должны быть реклассифицированы согласно новым представлениям [18]. Так, папиллярный и гранулярный ПКР, классифицированные Японской Урологической Ассоциацией [23], будут переименованы в ПКР, ассоциированный с ППКП, согласно
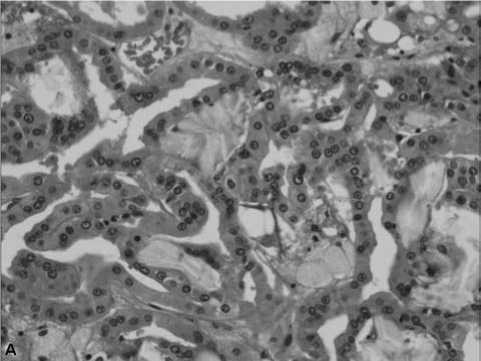
Рисунок 2. Новые гистологические подтипы ПКР у больных на диализе: 2-a : ПКР, ассоциированный с ППКП (главный гистологический подтип ПКР у больных на гемодиализе). ППКП с крупными опухолевыми клетками, содержащими гранулярную эозинофильную цитоплазму, большие ядра и ядрышки. Степень злокачественности по Фурману 2 или 3. ПКР, ассоциированный с ППКП, также может быть назван неклассифицируемым или ПКР с отложением оксалатов кальция. 2-b : ПКР, ассоциированный с ППКП, с отложением оксалатов кальция, 2-c : Депозиты оксалатов кальция можно увидеть при помощи поляризующей микроскопии, 2-d : Некоторые варианты ПКР, ассоциированного с ППКП, представлены микрокистозными или ячеистыми структурами, 2-e : Другой новый подтип ПКР - это светлоклеточный-папиллярный ПКР на фоне заболеваний почек поздних стадий
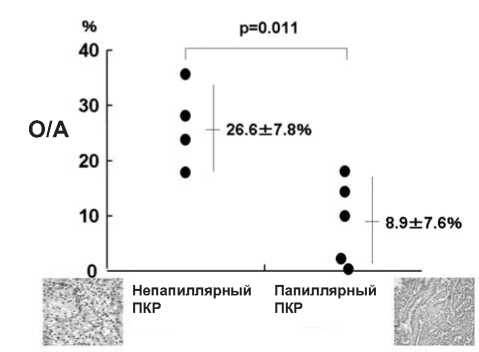
Рисунок 3. Отношение контрастно-усиленной опухоли к аорте (О/A) при светлоклеточном ПКР (непапиллярном ПКР) и папиллярном ПКР по определению до 2006 года (процитировано из 1)
новой классификации Tickoo с соавт. [18].
Другим типом ПКР, развивающегося на фоне заболеваний почек поздних стадий и гемодиализа, является светлоклеточный-папиллярный ПКР (Рисунок 2-е) [18].
Гистологические подтипы и данные лучевых методов исследования у больных ПКР на фоне гемодиализа
По данным компьютерной томографии (КТ) с внутривенным контрастированием отношение контрастно-усиленной опухоли к аорте составляет 26,6±7,8% для гиперваскулированных опухолей, главным образом, для светлоклеточного ПКР (непапиллярный ПКР). Однако для гипова-скуляризированных опухолей отношение контрастно-усиленной опухоли к аорте составляет 8,9±7,6% (Рисунок 3), например, для папиллярного ПКР (классификация ВОЗ) и ПКР ассоциированного с ППКП подобной морфологии. Мы представили данные по пациентам с ПКР ассоциированным с ППКП, у которых получены результаты лучевых методов исследования (слабое контрастирование при КТ, контрастное усиление при помощи ультрасонографии с использованием перфторбутановых микропузырьков (Son-azoid ® ), контрастирование на позитронно-эмиссионной компьютерной томографии (ПЭТ-КТ) и магнитно-резонансной томографии (МРТ) [8, 24].
Скрининг ПКР в общей популяции
Скрининг типичного ПКР в общей популяции не проводится, так как это считается нецелесоо- бразным. Данный вид обследований (массовый скрининг по типу диспансеризации) не включен в Клинические Рекомендации Японской Урологической Ассоциацией по ПКР, изданные в 2007 году [25]. Однако, в этих рекомендациях ультразвуковое исследование (УЗИ) описано как метод общего обследования населения во время диспансеризации. УЗИ органов брюшной полости может быть целесообразным в некоторых случаях при подозрении на ПКР. КТ выполняется для постановки окончательного диагноза ПКР (степень доказательности B).
По данным Terasawa и соавт. [26], хирургическое лечение ПКР было выполнено 60 (0,1%) из 57411 человек, у которых заболевание было выявлено в ходе комплексного обследования. По данным Marumo и соавт. [27], в Японии ежегодная стандартизированная по возрасту заболеваемость ПКР в общей популяции была невысокой и составила 4,9 случая на 100 000 у мужчин и 1,8 случая на 100 000 у женщин. В связи с этим во время диспансеризации скрининг для выявления ПКР в общей популяции активно не проводится.
Скрининг ПКР у больных на диализе
Согласно Клиническим Рекомендациям Японской Урологической Ассоциации [25], требуется проводить скрининг в группе больных на диализе для выявления ПКР, поскольку заболеваемость ПКР у этой категории высока, а раннее выявление и лечение опухоли способствует улучшению прогноза [15, 28, 29]. Регулярное выполнение УЗИ или КТ особенно целесообразно пациентам молодого возраста и длительно находящимся на диализе (рекомендации категории В) [15,28,29].
Как уже было отмечено, в группе пациентов на диализе отмечается не только высокая заболеваемость ПКР, но и бессимптомное течение рака почки (>90% пациентов с ПКР). Следовательно, 90% случаев ПКР у пациентов, находящихся на диализе, выявляются во время скрининга [7]. Прогноз заболевания для больных на диализе более благоприятный, если ПКР выявлен во время скрининга, а не после появления гематурии и других симптомов [29].
В 1979 году, когда было начало изучение рака почки у больных на диализе, в Японии численность всех больных, находящихся на диализе, составляла 27 000 человек. Основным заболеванием, приводящим к диализу, был хронических гломерулонефрит [8]. Средний возраст пациентов составлял 40,3 года, а средняя продолжительность диализа была только 3,3 года. Однако в 2007 году количество пациентов, которым проводился диализ, увеличилось до 275 119 (25,5% из них находились на диализе более 10 лет) [8]. Также увеличилось число пациентов, находящихся на длительном диализе вследствие хронического гломерулонефрита. Такая тенденция была связана с недостаточным количеством трансплантаций. Средний возраст пациентов увеличился до 60,8 лет, а средняя продолжительность диализа в 2007 увеличилась до 11,8 лет. Частота хронического гломерулонефрита снизилась, а диабетической нефропатии и нефросклероза увеличилась в связи с увеличением продолжительности жизни в Японии.
Важным является наблюдение в группе больных на диализе, которым планируется хирургическое лечение ПКР [1]. Следует подчеркнуть, что особенно важен скрининг у пациентов мужского пола, находящихся на диализе более 10 лет, и в группе с ППКП тяжелой степени [1]. Также скрининг ПКР с применением КТ необходим у потенциальных кандидатов на трансплантацию почки [30].
Поскольку в Европе и США количество пациентов, находящихся на диализе более 10 лет невелико [1], скрининг в этих регионах представляется нецелесообразным. Однако, по мнению Brown [31], решение о скрининге должно завесить от прогностических факторов. По данным нашего исследования, проведенного при помощи опросников, показания для скрининга должны определяться на индивидуальной основе [7]. Sarasin и соавт. [32] предположили, что скрининг целесообразен у молодых пациентов с большой ожидаемой продолжительностью жизни. Более того, в США и Европе, где в последнее рость введения 3 мл в секунду), оценивается усиливающий эффект контрастирующего вещества на опухоль в артериальной фазе. Папиллярный ПКР (по классификации до 2006 года), окруженный кистами, у пациентов на длительном диализе, слабо накапливает контраст из-за плохого кровоснабжения опухоли (Рисунок 4) [1]. Доопе-рационная оценка папиллярного ПКР представляется сложной, поскольку опухоль окружена многочисленными кистами, не выступает за контуры почки и слабо или вовсе не накапливет контрастный препарат при КТ [1].
Поскольку светлоклеточный ПКР у пациентов на краткосрочном диализе возникает в сморщенной почке в отсутствии или при небольшом количестве кист, выступает за контур почки и является гиперваскуляризированной опухолью, его диагностика при помощи КТ с контрастированием не представляет сложности (Рисунок 5) [1, 13]. ПКР в окружении кист у пациентов на долгосрочном диализе является гиповаскуля-ризированной опухолью папиллярного строения или схожего гистологического подтипа, следовательно, его диагностика при помощи КТ с контрастированием затруднена. Помимо КТ с контрастированием в дооперационном периоде также может применяться УЗИ с контрастированием с использованием микропузырьков галактозы или пальмитиновой кислоты (Levovist’) или перфторбутановых микропузырьков (Sonazoid’) и ПЭТ-КТ [8]. Даже если опухоль гиповаскуляризирована и слабо либо вообще не накапливает контраст при КТ, кровоток в опухоли может быть визуализирован при помощи УЗИ с контрастированием с использованием перфтор- время отмечено увеличение времени ожидания трансплантации, подчеркивается необходимость обследования на ПКР перед трансплантацией почки [30, 33].
Особенно важен скрининг ПКР с использованием КТ или УЗИ в группе пациентов мужского пола, находившихся на диализе более 10 лет, пациентов с ППКП и потенциальных кандидатов для трансплантации почки.
Какой метод обследования выбрать? Для скрининга можно использовать УЗИ или КТ: оба метода информативны и могут применяться в зависимости от доступности или предпочтений лечебного учреждения [1]. Окончательный диагноз рака почки устанавливается только при помощи КТ с контрастированием, которая выполняется пациентам с подозрением на ПКР [34,35]. КТ выполняется после быстрого внутривенного введения 40 мл йодсодержащего контраста (ско-
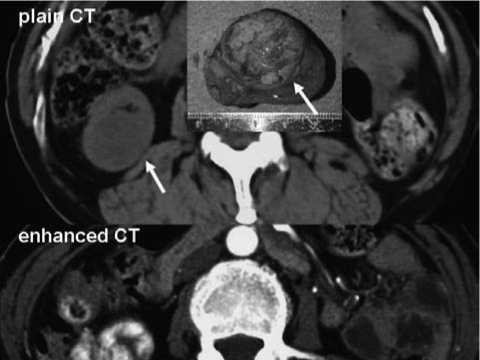
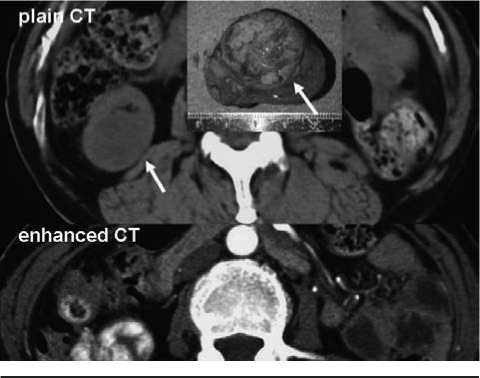
Рисунок 4. КТ с контрастированием у больного ПКР при ППКП: опухоль является гиповаскуляризирован-ной и слабо накапливает контраст (процитировано из 8)
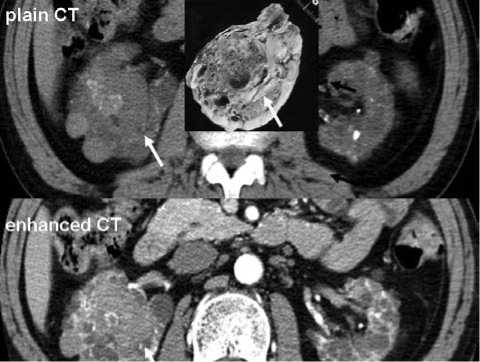
Рисунок 5. КТ: светлоклеточный ПКР - гиперваскуляризированная опухоль, хорошо накапливающая контраст (цитируется из 1)
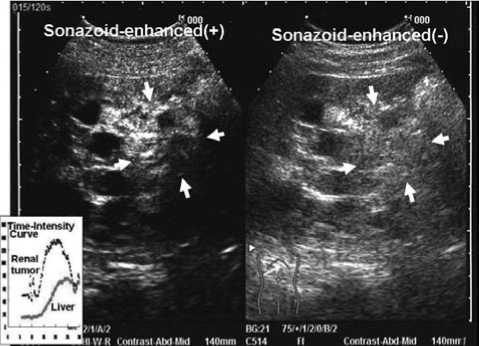
бутановых микропузырьков (Sonazoid ® ) (Рисунок 6) [8, 36]. Контрастирование с использованием микропузырьков галактозы или пальмитиновой кислоты (Levovist ® ) достигается вследствие разрушения этих микропузурьков, из-за чего контрастирующее вещество перестает визуализироваться. Однако контрастирование при помощи перфторбутановых микропузырьков (Sonazoid ® ) осуществляется вследствие вибрации перфторбутановых микропузырьков, таким образом, кровоток в опухоли может быть визуализирован в режиме реального времени [36].
ПЭТ-КТ может быть информативным методом, поскольку папиллярный ПКР и рак почки схоже-
Рисунок 6. УЗИ с контрастированием с использованием перфторбутановых микропузырьков (Sonazoid ® ) у пациента с ПКР и ППКП визуализирует кровоток в опухоли в режиме реального времени (процитировано из 8)
го гистологического подтипа у пациентов после длительного диализа часто накапливают 18-ФДГ (18 фтордеоксиглюкозу) [8, 37, 38] (Рисунок 7), хотя светлоклеточный ПКР накапливает этот радиофармпрепарат сравнительно редко.
Рисунок 7. ПЭТ-КТ у пациента с ПКР и ППКП демонстрирует накопление 18-ФДГ в опухоли ( процитировано из 8)
Как часто необходимо проводить обследование в рамках скрининга? Некоторые авторы рекомендуют начинать скриниг через 3 года после начала диализа [20], однако, такой подход может быть целесообразен только для ПКР при ППКП. В связи с тем, что у большинства пациентов ПКР был выявлен в течение года или через год после начала диализа, скрининг ПКР необходимо начинать сразу же [7]. Контрольные обследования требуется проводить ежегодно или каждые 2 года в зависимости от риска возникновения ПКР [1]. Обследование дважды в год может быть рекомендовано больным, находящимся на диализе более 10 лет, а также больным с быстрорастущей опухолью, поскольку при ежегодном скрининге метастазы могут быть своевременно не выявлены. Алгоритм обследований указан на Рисунке 8 [34].
Показатели выживаемости для ПКР снижаются у пациентов старшего возраста, при выявлении опухоли более крупных размеров и более поздних стадиях заболевания [14].
Диагностика ПКР у пациентов на диализе
Обычно рак почки у больных на диализе обнаруживается при очередном контрольном обследовании [1]. В некоторых случаях ПКР предшествуют симптомы болезни: макрогематурия, боли в пояснице, лихорадка неясного генеза, высокий уровень гемоглобина или симптомы метастатического поражения [1]. Методы доопера-ционной оценки включают: КТ без контрастирования или УЗИ. Если есть подозрение на опухоль, выполняется КТ с контрастированием. В случае, если опухоль является гиповаскуляризированной или не накапливает контраст при КТ, необходимо исключить геморрагическую кисту. Для дифференциального диагноза на дооперационном этапе используется МРТ (без контрастирования), УЗИ с использованием перфторбутановых микропузырьков (Sonazoid®) или ПЭТ-КТ [8].
Лечение и прогноз почечно-клеточного рака у больных на диализе
Своевременная диагностика и лечение ПКР у больных на диализе представляются чрезвычайно важными. Хирургическое лечение включает стандартные методы (нефрэктомию при помощи открытого или лапароскопического доступа) [1]. Адъювантное лечение в рамках исследований выполняется в зависимости от стадии и степени злокачественности опухоли. Для лечения распространенного заболевания применяются интерферон, интерлейкин-2 или ингибиторы тиро- зинкиназ (сорафениб, сунитиниб и др.) [24, 39]. Неблагоприятный прогноз зависит от таких показателей, как пожилой возраст, высокая стадия заболевания и степень злокачественности опухоли, а также гистологический вариант с саркоматоидным компонентом [14, 40].
Будущие направления: какая информация необходима в настоящий момент?
До сих пор нет убедительных данных, определяющих оптимальную частоту обследований в рамках скрининга. Не до конца изученным является патогенез ПКР при ППКП у больных на диализе. Необходимо изучить взаимосвязь ПКР с отложением солей кальция. Помимо методов визуализации необходимо поиск биомаркеров для ранней диагностики ПКР у больных на диализе.
Самым важным является совершенствование диагностики и своевременного лечения ПКР. Пациенты, находящиеся на диализе, не должны умирать от рака почки.
Заключая, хочется подчеркнуть, что:
-
1) За последние годы количество пациентов,
Рисунок 8. Алгоритм обследования и лечения осложнений заболеваний почек на диализе (процитировано из 8)
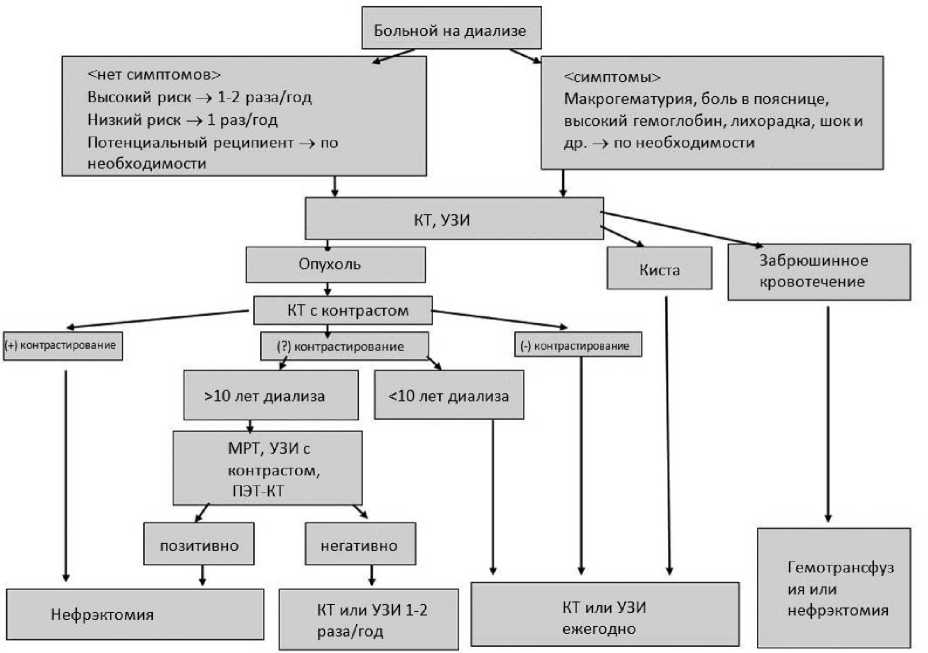
находящихся на длительном диализе в Японии, увеличилось; возросла клиническая значимость ППКП, как отдаленного осложнения гемодиализа.
-
2) У больных на длительном диализе ПКР развивается в окружении множества приобретенных кист и, как правило, не выступает за пределы почки; опухоль слабо накапливает контраст при КТ. Таким образом, диагностика ПКР у пациентов на длительном диализе затруднена. УЗИ с использованием перфторбутановых микропузырьков (Sonazoid ® ) в качестве контраста или 18-ФДГ ПЭТ/КТ являются значимыми методами оценки ПКР на дооперационном этапе.
-
3) Основным гистологическим подтипом ПКР у больных на длительном диализе является ПКР, ассоциированный с ППКП (неклассифицированный тип или ПКР с депозитами оксалатов кальция). 4) Пациентам на диализе из группы высокого риска рекомендовано проводить скрининг ПКР, поскольку заболеваемость раком почки высока, а симптомы болезни развиваются редко. Прогноз после хирургического лечения по сравнению с общей популяцией в большинстве случаев благоприятен. Частота обследований определяется на индивидуальной основе в зависимости от таких факторов как пол и общее состояние.
Список литературы Почечно-клеточный рак у пациентов, находящихся на диализе
- Ishikawa I: Acquired Cystic Disease of the Kidney and Renal Cell Carcinoma-Complication of Long-Term Hemodialysis, Springer,Tokyo. 1-111, 2007
- Ishikawa I, Saito Y, Onouchi Z, Kitada H, Suzuki S, Kurihara S, Yuri T, Shinoda A: Development of acquired cysti disease and adenocarcinoma of the kidney in glomerulonephriti chronic hemodialysis pati nts. Clin Nephrol 14: 1-6, 1980
- Ishikawa I, Onouchi Z, Saito Y, Tateishi K, Shinoda A, Suzuki S, Kitada H, Sugishita N, Fukuda Y: Sex differences in acquired cystic disease of the kidney on long-term dialysis. Nephron 39: 336-340, 1985
- Ishikawa I, Hayama S, Morita K, Nakazawa T, Yokoyama H, Honda R, Satoh K, Kakuma T: Long-term natural history of acquired cystic disease of the kidney. Ther Apher Dial: 14:409-416, 2010
- Ishikawa I, Saito Y, Asaka M, Tomosugi N, Yuri T, Watanabe M, Honda R: Twenty-year follow-up of acquired renal cystic disease. Clin Nephrol 59: 153-159, 2003
- Ishikawa I: Uremic acquired cystic disease of kidney. Urology 26: 101-108, 1985
- Ishikawa I: Present status of renal cell carcinoma in dialysis patients:A questionnaire study in 2004 and review of past questionnaires since 1982 (in Japanese with English abstract). J Jpn Soc Dial Ther 38: 1689-1700, 2005
- Ishikawa I: Present status of acquired cystic disease of the kidney (in Japanese). J Jpn Ass Dial Physicians 23: 179-187, 2008
- Dunnill MS, Millard PR, Oliver D: Acquired cysti disease of the kidneys: a hazard of long-term intermittent maintenance haemodialysis. J. Clin. Pathol. 30: 868-877, 1977
- Hughson MD, Hennigar GR, McManus JFA: Atypical cysts, acquired renal cysti disease, and renal cell tumors in end stage dialysis kidneys. Lab. Invest. 42: 475-480, 1980
- Eble IN, Sauter G, Epstein JI, al. e: WHO classification of tumours. In: Pathology and Genetics:Tumours of the Urinary System and Male Genital Organs. Lyon, France: IARC Press. 2004
- Ishikawa I, Kovacs G: High incidence of papillary renal cell tumours in patients on chronic haemodialysis. Histo-pathology 22: 135-139, 1993
- Ishikawa I, Shinoda A: Renal adenocarcinoma with or without acquired cysts in chronic hemodialysis patients. Clin Nephrol 20: 321-322, 1983
- Ishikawa I: Prognosis in dialysis patients complicated with renal cell carcinoma (in Japanese with English abstract). J Jpn Ass Soc Dial Ther 35: 287-293, 2002
- Ishikawa I: Present status of renal cell carcinoma in dialysis patients in Japan: questionnaire study in 2002. Nephron Clin Pract 97: c11-16, 2004
- Ishikawa I, Yuri T, Kitada H, Shinoda A: Regression of acquired cystic disease of the kidney after successful renal transplantation. Am J Nephrol 3: 310-314, 1983
- Sule N, Yakupoglu U, Shen SS, Krishnan B, Yang G, Lerner S, Sheikh-Hamad D, Truong LD: Calcium oxalate deposition in renal cell carcinoma associated with acquired cystic kidney disease: a comprehensive study. Am J Surg Pathol 29: 443-451, 2005
- ickoo SK, dePeralta-Venturina MN, Harik LR, Worcester HD, Salama ME, Young AN, Moch H, Amin MB: Spectrum of epithelial neoplasms in end-stage renal disease: an experience from 66 tumor-bearing kidneys with emphasis on histologic patterns distinct from those in sporadic adult renal neoplasia. Am J Surg Pathol 30: 141-153, 2006
- Nouh MA, Kuroda N, Yamashita M, Hayashida Y, Yano T, Minakuchi J, Taniguchi S, Nomura I, Inui M, Sugimoto M, Kakehi Y: Renal cell carcinoma in patients with end-stage renal disease: relationship between histological type and duration of dialysis. BJU Int, 2009
- Zamin-Khamesh N, Zhai Q, Truong LD: Renal cell carcinoma with calcium oxalate deposition A distinct type of renal cell carcinoma within the spectrum of renal neoplasms associated with acquired cystic kidney disease. Pathology Case Reviews 15: 14-19, 2010
- Cossu-Rocca P, Eble JN, Zhang S, Martignoni G, Brunelli M, Cheng L: Acquired cystic disease-associated renal tumors: an immunohistochemical and fluorescence in situ hybridization study. Mod Pathol 19: 780-787, 2006
- Pan CC, Chen YJ, Chang LC, Chang YH, Ho DM: Immunohistochemical and molecular genetic profiling of acquired cystic disease-associated renal cell carcinoma. Histopathology 55: 145-153, 2009
- Japanese Urological Association, Japanese Society of Pathology, Japan-Radiological-Society: General Rule for Clinical and Pathological Studies on Renal Cell Carcinoma (in Japanese). ed 3. Tokyo, Kanehara Syuppan. 1999
- Ishikawa I: Acquired cysts and cancer of failing kidneys, Cancer and the Kidney, 2nd Ed, Cohen EP, Ed, Oxford University Press, in press. 2010
- Japanese-Urological-Association: Clinical Practice Guideline for Renal Cell Carcinoma, 2007 ed (in Japanese), Tokyo, Kanehara Syuppan. 1-66, 2007
- Terasawa Y, Hirota M, Sudo S: Detection of renal cell carcinoma detection by ultrasonography at health check-up (in Japanese). Japanese Association for Cancer Detection and Diagnosis 15: 166-171, 2008
- Marumo K, Satomi Y, Miyao N, Hasegawa M, Tomita Y, Igarashi T, Onishi T, Nakazawa H, Fukuda M, Ozono S, Terachi T, Tsushima T, Nakamoto T, Kawamura J: The prevalence of renal cell carcinoma: a nation-wide survey in Japan in 1997. Int J Urol 8: 359-365, 2001
- Ishikawa I, Saito Y, Nakamura M, Takada K, Ishii H, Nakazawa T, Fukuda Y, Asaka M, Tomosugi N, Yuri T: Fifteen-year follow-up of acquired renal cystic disease -a gender difference. Nephron 75: 315-320, 1997
- Ishikawa I, Honda R, Yamada Y, Kakuma T: Renal cell carcinoma detected by screening shows better patient survival than that detected following symptoms in dialysis patients. Ther Apher Dial 8: 468-473, 2004
- Schwarz A, Vatandaslar S, Merkel S, Haller H: Renal cell carcinoma in transplant recipients with acquired cystic kidney disease. Clin J Am Soc Nephrol 2: 750-756, 2007
- Brown EA: Renal tumours in dialysis patients: who should we screen? Nephron Clin Pract 97: c3-4, 2004
- Sarasin FP, Wong JB, Levey AS, Meyer KB: Screening for acquired cystic kidney disease: a decision analytic perspective. Kidney Int 48: 207-219, 1995
- Scandling JD: Acquired cystic kidney disease and renal cell cancer after transplantation: time to rethink screening? Clin J Am Soc Nephrol 2: 621-622, 2007
- Ishikawa I: Uremic acquired renal cystic disease. Natural history and complications . Nephron 58: 257-267, 1991
- Takebayashi S, Hidai H, Chiba T, Takagi H, Koike S, Matsubara S: Using helical CT to evaluate renal cell carcinoma in patients undergoing hemodialysis: value of early enhanced images. Am. J. Roentgenol. 172: 429-433, 1999
- Akiyama T, Onoue A: Sonazoid-enhanced ultrasonography: adiagnosis of kidney and prostate disease (in Japanese). Innervision 22: 41-45, 2007
- Ak I, Can C: F-18 FDG PET in detecting renal cell carcinoma. Acta Radiol 46: 895-899, 2005
- Ozawa N, Okamura T, Koyama K, Hamazawa Y, Senzaki H, Tanabe S, Ikemoto S, Inoue Y: Usefulness of F-18 FDG-PET in a long-term hemodialysis patient with renal cell carcinoma and pheochromocytoma. Ann Nucl Med 21: 239-243, 2007
- Shinsako K, Mizuno T, Terada T, Watanabe J, Kamba T, Nakamura E, Ogawa O, Inui KI: Tolerable sorafenib therapy for a renal cell carcinoma patient with hemodialysis: a case study. Int J Clin Oncol, 2010
- Ishikawa I: Cancer in dialysis patients. Cancer and the Kidney, Cohen EP, ed, Oxford University Press, Oxford: 227-247, 2005


