Почечноклеточный рак
Автор: Волкова М.И., Носов Д.А., Алексеев Б.Я., Гладков О.А., Матвеев В.Б.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-2 т.14, 2024 года.
Бесплатный доступ
В данном разделе указаны критерии оценки клинической значимости применения дорогостоящей противоопухолевой лекарственной терапии в соответствии со шкалой, разработанной экспертной группой (стр. 6). В тексте они обозначены, как магнитуда клинической значимости (МКЗ).
Почечноклеточный рак, иммунотерапия, ингибиторы m-tor, тирозинкиназные ингибиторы, циторедуктивная нефрэктомия
Короткий адрес: https://sciup.org/140307411
IDR: 140307411 | DOI: 10.18027/2224-5057-2024-14-3s2-1.2-08
Текст научной статьи Почечноклеточный рак
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Стадирование почечноклеточного рака (ПКР) должно проводиться по системе TNM (2017 г.) (табл. 1).
Таблица 1. Стадирование рака почки по системе TNM (2017 г.)
|
Клиническая стадия |
Характеристика |
|
Первичная опухоль (категория T) |
|
|
cTx |
Первичная опухоль не может быть оценена |
|
cT0 |
Нет признаков наличия первичной опухоли |
|
cT1 |
Опухоль ≤ 7 см в наибольшем измерении, не выходит за пределы почки |
|
cT1a |
Опухоль ≤ 4 см в наибольшем измерении, не выходит за пределы почки |
|
cT1b |
Опухоль > 4 см, но < 7 см в наибольшем измерении |
|
cT2 |
Опухоль ≥ 7 см в наибольшем измерении, не выходит за пределы почки |
|
cT2a |
Опухоль > 7 см, но ≤ 10 см, не выходит за пределы почки |
|
cT2b |
Опухоль > 10 см, но не выходит за пределы почки |
|
cT3 |
Опухоль распространяется в крупные вены или периферические ткани, но не распространяется за пределы фасции Герота и не прорастает ипсилатеральный надпочечник |
|
cT3a |
Опухоль макроскопически распространяется на почечную вену или её сегментарные вены (с мышечной стенкой) либо опухоль прорастает в периренальные ткани и/или почечный синус (в клетчатку, окружающую почечную лоханку), но не выходит за пределы фасции Герота |
|
Клиническая стадия |
Характеристика |
|
cT3b |
Опухоль макроскопически распространяется в нижнюю полую вену ниже уровня диафрагмы |
|
cT3c |
Опухоль макроскопически распространяется в нижнюю полую вену выше уровня диафрагмы или прорастает стенку нижней полой вены |
|
cT4 |
Опухоль распространяется за пределы фасции Герота (и может прорастать в ипсилатеральный надпочечник) |
|
Лимфатические узлы (категория N) |
|
|
cNx |
Регионарные лимфатические узлы не могут быть оценены |
|
cN0 |
Отсутствие метастазов в регионарных лимфатических узлах |
|
cN1 |
Метастазы в регионарных лимфатических узлах |
|
Отдаленные метастазы (категория М) |
|
|
Mx |
Оценить наличие отдаленных метастазов невозможно |
|
M0 |
Отдаленные метастазы отсутствуют |
|
M1 |
Определяются отдаленные метастазы |
Таблица 2. Соответствие стадий опухолевого процесса категориям TNM
|
Стадия |
Категория T |
Категория N |
Категория M |
|
I |
T1 |
N0 |
M0 |
|
II |
T2 |
N0 |
M0 |
|
III |
T3 |
N0 |
M0 |
|
T1, T2, T3 |
N1 |
M0 |
|
|
IV |
T4 |
N любое |
M0 |
|
T любое |
N любое |
M1 |
Гистологическая классификация выделяет следующие варианты рака почки (Moch, H., et al. 2016):
• светлоклеточный почечноклеточный рак;
• мультилокулярная кистозная опухоль с низким злокачественным потенциалом;
• папиллярный почечноклеточный рак;
• почечный рак, ассоциированный с наследственным лейомиоматозом и почечноклеточным раком;
• хромофобноклеточный почечноклеточный рак;
• почечноклеточный рак из собирательных трубочек;
• медуллярный почечноклеточный рак;
• почечноклеточный рак, связанный с транслокацией MiT;
• почечно-клеточный рак, связанный с дефицитом сукцинатдегидрогеназы;
• муцинозный тубулярный и веретеновидноклеточный рак;
• тубулокистозный почечноклеточный рак;
• почечноклеточный рак, ассоциированный с наследственным поликистозом почек;
• папиллярный светлоклеточный почечноклеточный рак;
• неклассифицируемый почечноклеточный рак.
2. ДИАГНОСТИКА
3. ЛЕЧЕНИЕ3.1. Клинически локализованные и местнораспространенные стадии заболевания (T1–4N0–1M0)
Градация ПКР по системе Фурман, основанная на оценке характеристик клеточных ядер и ядрышек, выделяет четыре степени (G1-G4). В настоящее время предпочтительно применять классификацию WHO/ISUP, которая также выделяет четыре степени злокачественности.
Саркоматоидная дифференцировка не является самостоятельным гистологическим вариантом ПКР, может встречаться при любых морфологических формах рака почки, всегда соответствует G4 по Фурману и ассоциирована с неблагоприятным прогнозом.
Целью обследования при ПКР является оценка локализации и распространенности опухолевого процесса. Стандартом диагностики и стадирования ПКР является мульти-спиральная четырехфазная КТ забрюшинного пространства, брюшной и грудной полостей с в/в болюсным контрастированием. Больным с симптомами, подозрительными в отношении поражения костей, выполняется радиоизотопное исследование костей скелета. При необходимости может быть выполнено дополнительное исследование зон повышенного накопления РФП с помощью рентгенографии, однофотонно-эмиссионной томографии (ОФЭТ), КТ или МРТ. Пациентам с общемозговыми и/или очаговыми неврологическими симптомами показана МРТ головного мозга с контрастным усилением. Диагностическая эффективность ПЭТ-КТ с любыми трейсерами при ПКР неизвестна, метод не рекомендован к применению в рутинной практике ввиду его невысокой чувствительности при данном заболевании.
Морфологическую верификацию первичного образования или отдаленных метастазов выполняют с целью установления гистологического варианта опухоли перед назначением системной противоопухолевой терапии, а также перед применением аблативных методов лечения или динамического наблюдения за больными с небольшими размерами первичного образования. У пациентов с множественными злокачественными новообразованиями с целью дифференциальной диагностики источников диссеминации также необходима верификация.
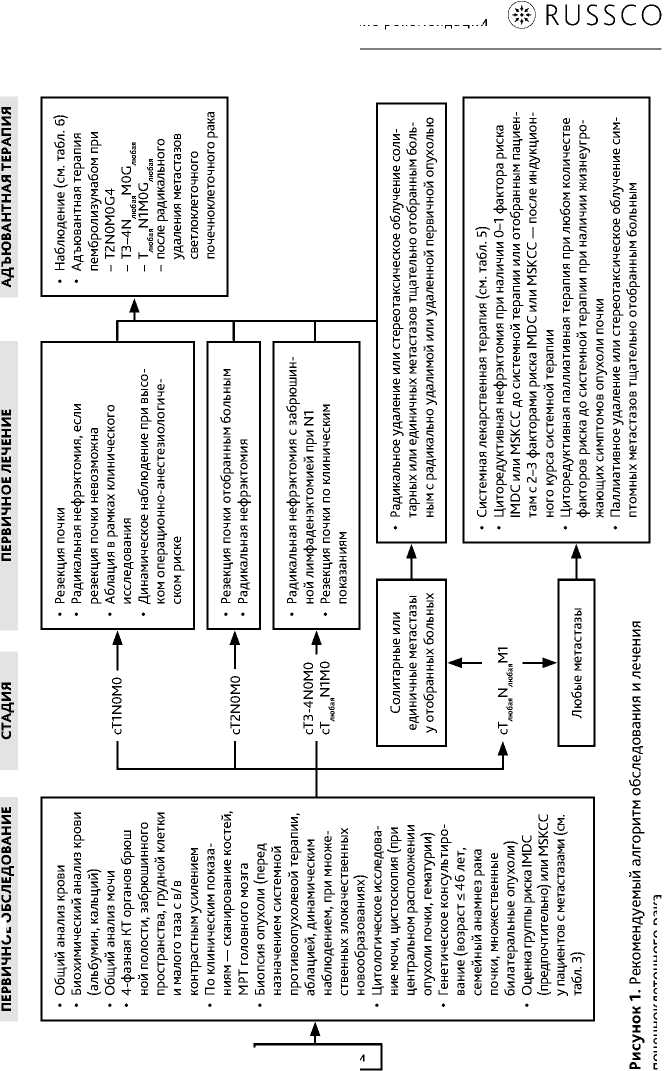
Рекомендуемый алгоритм обследования при ПКР представлен на рис. 1.
Рекомендуемый алгоритм лечения при ПКР представлен на рис. 1.
Основным методом лечения при клинически локализованном и местно-распространенном ПКР (сТ1–4N0–1М0) является хирургический. Стандартным подходом при ПКР сТ1 является резекция почки. Отобранным пациентам с категорией сT2 допустимо выполнение органосохраняющего лечения. При абсолютных показаниях к резекции почки возможно выполнение органосохраняющих вмешательств при любой клинической стадии ПКР. Нефрэктомия выполняется пациентам с опухолями сТ1, локализация и размеры которых делают выполнение органосохраняющего лечения технически невозможным, а также больным ПКР сТ2–4. Лимфодиссекция при клинически негативных лимфоузлах (сN0) не является обязательной. При наличии увеличенных забрюшинных лимфоузлов (cN1) лимфодиссекция выполняется со стадирующей целью. Положительное влияние лимфодиссекции на отдаленные результаты лечения не доказано. Аблативные методы в стандарты лечения ПКР не входят и могут рассматриваться как альтернатива хирургическому лечению наряду с динамическим наблюдением у больных с крайне высоким операционным риском, имеющих малые периферически расположенные опухоли почки.
После хирургического лечения 10-летняя выживаемость больных в зависимости от стадии варьирует от 30% до 85%.
После радикального хирургического лечения адъювантная ЛТ не проводится, поскольку не способствуют улучшению общей выживаемости.
После радикального хирургического лечения больных светлоклеточным ПКР промежуточного и высокого риска рецидива (T2N0M0G4, T3–4N любая M0G любая , T любая N1M0G любая ) и пациентов с отдаленными метастазами светлоклеточного ПКР рекомендовано проведение адъювантной иммунотерапии пембролизумабом 200 мг каждые 3 недели в течение 12 мес. (МКЗ A-B) 1 . Данный подход улучшает показатели безрецидивной и общей выживаемости, при этом наибольшая клиническая польза отмечена при G4 (саркоматоидная дедифференцировка опухоли).
-
3.2. Диссеминированная стадия (М1)
-
3.2.1. Факторы прогноза
Популяция больных диссеминированным ПКР прогностически неоднородна. До 2010 г. для оценки прогноза пациентов, которым проводится терапия ИНФ и/или ИЛ-2, использовалась прогностическая модель Memorial Sloan Kettering Cancer Center (MSKCC). В настоящее время для оценки прогноза при проведении системной терапии в клинической практике используется прогностическая модель IMDC, которая представляет собой модифицированную модель MSKCC. В основе модели IMDC лежат факторы, ассоциированные с неблагоприятным прогнозом пациентов, получавших антиангиогенную терапию (табл. 3).
-
-
3.2.2. Лечение
-
3.2.2.1. Локальное лечение
-
Таблица 3. Модели прогноза больных диссеминированным раком почки, получавших системную терапию, IMDC (D. Heng, 2010 г.) и MSKCC (R. Motzer, 2002 г.)
|
Прогностическая модель |
IMDC |
MSKCC |
|
Факторы риска |
|
|
|
Группа прогноза |
Медиана общей продолжительности жизни, мес.1 |
|
|
Благоприятный (0 факторов) |
43,3 |
29,6 |
|
Промежуточный (1–2 фактора) |
22,5 |
13,8 |
|
Неблагоприятный (≥ 3 факторов) |
7,8 |
4,9 |
1 На фоне антиангиогенной таргетной терапии в группах риска IMDC, на фоне цитокиновой терапии в группах риска MSKCC.
Выполнение циторедуктивной нефрэктомии до начала системной терапии целесообразно у пациентов, способных перенести хирургическое вмешательство, с 0–1 факторами риска IMDC или MSKCC, потенциально резектабельной первичной опухолью. У больных с 2–3 факторами риска вопрос о целесообразности циторедуктивной нефрэктомии может быть решен индивидуально, после оценки эффекта индукционной системной терапии. Пациентам с наличием > 3 факторов риска циторедуктивное хирургическое лечение не показано, так как не приводит к увеличению общей выживаемости. Больным с клинически значимыми и/или жизнеугрожающими симптомами первичной опухоли допустимо выполнение паллиативной циторедуктивной нефрэктомии независимо от количества факторов риска.
Радикальное удаление солитарных или единичных метастазов может рассматриваться в качестве возможного лечебного подхода у тщательно отобранных больных группы благоприятного прогноза IMDC/MSKCC с метахронными (> 24 месяцев после удаления первичной опухоли) метастазами. Вопрос об удалении синхронных солитарных метастазов с целью потенциального излечения и/или дифференциальной диагностики с другим злокачественным новообразованием должен обсуждаться индивидуально на междисциплинарном консилиуме.
Пациентам, подвергнутым радикальному удалению первичной опухоли и метастазов, может быть рекомендована адъювантная иммунотерапия пембролизумабом в течение 1 года.
Паллиативное удаление метастазов ПКР допустимо у отдельных пациентов, прежде всего, — с поражением костей или ЦНС, для уменьшения интенсивности клинических проявлений заболевания и профилактики осложнений, угрожающих жизни и/или снижающих ее качество.
Альтернативой хирургическому лечению метастазов является стереотаксическая ЛТ. ЛТ может быть использована с паллиативной целью при наличии болевого синдрома у больных с метастатическим поражением костей, а также при симптомных метастазах в ЦНС.
-
3.2.2.2. Системная противоопухолевая терапия
В настоящее время для клинического использования рекомендованы следующие препараты (табл. 4):
Таблица 4. Препараты и комбинации, рекомендованные для лечения диссеминированного ПКР
|
Препарат |
Группа |
Режим лечения |
|
Сунитиниб 1 |
Тирозинкиназный ингибитор VEGFR-1–3, PDGFR, c-KIT, FLT-3 |
50 мг/сут. внутрь 1–4 недели, 2 недели перерыв или 50 мг/сут. внутрь 1–2 недели, 1 неделя перерыв |
|
Пазопаниб |
Тирозинкиназный ингибитор VEGFR-1–3, c-KIT, PDGFR |
800 мг/сут. внутрь ежедневно |
|
Акситиниб 2 |
Высокоаффинный и селективный тирозинкиназный ингибитор VEGFR-1–3 |
5 мг × 2 раза в день внутрь ежедневно |
|
Кабозантиниб |
Тирозинкиназный ингибитор MET, VEGFR 1–3, c-KIT, AXL |
60 мг × 1 раз в день внутрь ежедневно |
|
Эверолимус |
Ингибитор m-TOR |
10 мг/сут. внутрь |
|
Ленватиниб + эверолимус |
Комбинация тирозинкиназного ингибитора FGFR 1–4, RET, VEGFR 1–3 и ингибитора m-TOR |
Ленватиниб 18 мг/сут. внутрь + эверолимус 5 мг/сут. внутрь |
|
Ниволумаб |
Анти-PD-1 МКА |
3 мг/кг или 240 мг в/в кап. каждые 2 недели или 480 мг в/в кап. каждые 4 недели |
|
Пембролизумаб |
Анти-PD-1 МКА |
200 мг в/в кап. каждые 3 недели |
|
Ниволумаб + ипилимумаб |
Комбинация анти-PD-1 и анти-CTLA МКА |
Ниволумаб 3 мг/кг + ипилимумаб 1 мг/кг в/в каждые 3 недели, 4 введения; далее через 3 недели начинается монотерапия ниволумабом 3 мг/кг или 240 мг в/в каждые 2 недели или 480 мг каждые 4 недели |
|
Ниволумаб + кабозантиниб |
Комбинация анти-PD-1 МКА и тирозинкиназного ингибитора MET, VEGFR 1–3, c-KIT, AXL |
Ниволумаб 240 мг в/в кап. каждые 2 недели или 480 мг в/в кап. каждые 4 недели + кабозантиниб 40 мг × 1 раз в день внутрь ежедневно |
|
Пембролизумаб + акситиниб 2 |
Комбинация анти-PD-1 МКА с тирозинкиназным ингибитором VEGFR 1–3 |
Пембролизумаб 200 мг в/в кап. каждые 3 нед. или 400 мг в/в кап. каждые 6 нед. + акситиниб 5 мг × 2 раза в день |
|
Препарат |
Группа |
Режим лечения |
|
Пембролизумаб + ленватиниб |
Комбинация анти-PD-1 МКА с тирозинкиназным ингибитором FGFR 1–4, RET, VEGFR 1–3 |
Пембролизумаб 200 мг в/в кап. каждые 3 нед. или 400 мг в/в кап. каждые 6 нед. + ленватиниб 20 мг/сут. внутрь |
|
Авелумаб + акситиниб 2 |
Комбинация анти-PD-L1 МКА с тирозинкиназным ингибитором |
Авелумаб 800 мг в/в кап. каждые 2 нед. + акситиниб 5 мг × 2 раза в день |
1 Сунитиниб в данном режиме (2 / 1 нед.) используется только в случае непереносимости стандартного режима (4 / 2 нед.).
2 Начальная доза акситиниба — 5 мг × 2 раза в день, при отсутствии нежелательных явлений 3–4 степеней тяжести в течение первых двух недель приема производится эскалация дозы препарата до 7 мг × 2 раза в день (в течение последующих двух недель) и далее — до 10 мг × 2 раза в день.
На выбор оптимального режима лекарственной терапии оказывают влияние гистологический вариант ПКР, наличие саркоматоидного компонента в опухоли, группа риска IMDC, предшествующее лечение и наличие противопоказаний к назначению препаратов различных фармакологических групп.
Лекарственная терапия светлоклеточного ПКР
В I линии терапии светлоклеточного ПКР (сПКР) группы благоприятного прогноза при необходимости достижения объективного ответа предпочтительно использование режимов пембролизумаб + ленватиниб (МКЗ II-A) , ниволумаб + кабозантиниб (МКЗ III-B) или пембролизумаб + акситиниб (МКЗ III-C) . Альтернативным режимом является комбинация авелумаб + акситиниб (МКЗ III-B) . Использование данных комбинаций у пациентов с благоприятным прогнозом не приводит к статистически значимому увеличению общей выживаемости, но обеспечивает достоверное преимущество частоты объективных ответов. Для отдельных режимов (пембролизумаб + ленватиниб) отмечено значимое увеличение медианы продолжительности жизни без прогрессирования по сравнению с сунитинибом. У пациентов с малой опухолевой нагрузкой, минимальными симптомами болезни и/или противопоказаниями к назначению комбинированных режимов допустимо использование монотерапии пазопанибом или сунитинибом.
В I линии терапии сПКР групп промежуточного и неблагоприятного прогноза предпочтительно назначение следующих комбинированных режимов: ниволумаб + ипилимумаб (МКЗ I-A) , пембролизумаб + акситиниб (МКЗ I-A) , пембролизумаб + ленватиниб (МКЗ I-A) или ниволумаб + кабозантиниб (МКЗ I-A1) . В качестве альтернативного режима с меньшим уровнем доказательности может рассматриваться комбинация авелумаб + акситиниб (МКЗ II-C1) . Допустимой опцией при наличии противопоказаний к проведению иммунотерапии является назначение кабозантиниба в монорежиме (МКЗ II-B) .
Использование комбинированных режимов ассоциировано с более высокой частотой нежелательных явлений 3–4 ст. (до 60–70%) и требует более тщательного мониторинга состояния пациентов по сравнению с монотерапией тирозинкиназными ингибиторами.
При использовании комбинации ниволумаб + ипилимумаб частота иммуноопосредован-ных нежелательных явлений 3–4 ст. увеличивается до 46%.
У ранее не получавших лечения пациентов с саркоматоидной дифференцировкой в опухоли режимами предпочтения являются ниволумаб + кабозантиниб (МКЗ I-A1), пем-бролизумаб + акситиниб (независимо от группы прогноза) (МКЗ I-A) и ниволумаб + ипи-лимумаб (при промежуточном и неблагоприятном прогнозе) (МКЗ I-A). Данные режимы обеспечивают значимое преимущество в общей, беспрогрессивной выживаемости и частоте объективного ответа по сравнению с сунитинибом. В качестве альтернативы рассматриваются комбинации пембролизумаб + ленватиниб (МКЗ II-A) или авелумаб + акситиниб (МКЗ II-B), которые приводят к увеличению беспрогрессивной выживаемости и частоты объективного ответа по сравнению с сунитинибом.
Больным сПКР, у которых развилась резистентность к антиангиогенной терапии тирозинкиназными ингибиторами в монорежиме или к комбинации бевацизумаб + ИФН, предпочтительно назначение ниволумаба (МКЗ I-A1) или кабозантиниба (МКЗ I-A1). В качестве альтернативы возможно проведение терапии комбинацией ленватиниб + эве-ролимус (МКЗ I-A). У отдельных пациентов, имеющих противопоказания к использованию режимов предпочтения или альтернативного режима, во II линии допустимо назначение акситиниба. Частота нежелательных явлений 3–4 ст. при использовании кабозантиниба или комбинации ленватиниб + эверолимус может достигать 70% и требует тщательного мониторинга переносимости терапии.
У больных сПКР с резистентностью на фоне или после использования комбинированных режимов в первой линии оптимальный лекарственный подход продолжает оставаться предметом клинических исследований. При прогрессировании болезни после назначения иммунотерапевтической комбинации ипилимумаб + ниволумаб возможно использование тирозинкиназных ингибиторов в монорежиме: сунитиниба или пазопа-ниба —у пациентов без факторов риска IMDC/MSKCC, кабозантиниба или ленватиниба с эверолимусом — при наличии факторов риска.
В случае прогрессирования болезни на фоне комбинации тирозинкиназного ингибитора с анти-PD1/PD-L1 МКА оптимальный выбор терапии для последующей линии остается не изученным. В этих случаях возможной опцией является назначение кабозантиниба или комбинации ленватиниб + эверолимус, если данные препараты не использовались ранее. В качестве допустимых режимов возможно использование других тирозинкиназных ингибиторов, которые ранее не использовались. Если в качестве первой линии терапии использовались комбинированные режимы с включением анти-PD1 МКА, дальнейшее их использование при прогрессировании процесса нецелесообразно.
В настоящее время роль комбинации бевацизумаба с ИФН, сорафениба и эверолимуса в последовательной терапии распространенного ПКР представляется крайне сомнительной.
У пациентов, ранее получивших две и более линий терапии, последующий режим выбирается индивидуально, с учетом ранее использованных препаратов, их эффективности и переносимости.
Лекарственная терапия несветлоклеточного ПКР
Лекарственная терапия несветлоклеточного ПКР (нПКР) не изучалась в рандомизированных исследованиях III фазы. В программах расширенного доступа было показано, что прогноз больных нПКР хуже, чем у пациентов со светлоклеточными опухолями. Желательно включение больных нПКР в клинические исследования.
В настоящее время при папиллярном ПКР предпочтительными опциями являются монотерапия кабозантинибом (МКЗ II-B) и комбинация пембролизумаб + ленватиниб. Кабозантиниб продемонстрировал увеличение беспрогрессивной выживаемости и частоты объективных ответов по сравнению с сунитинибом в исследовании II фазы SWOG 1500. Пембролизумаб + ленватиниб обеспечивали удовлетворительные результаты в однорукавном исследовании II фазы KEYNOTE-В61.
При нПКР любого другого гистологического типа за исключением рака собирательных трубочек предпочтительной опцией является комбинация пембролизумаба с ленватини-бом, обеспечившая высокую частоту объективных ответов, а также удовлетворительные показатели ВБП и ОВ в КИ II фазы KEYNOTE-B61.
На основании результатов небольших исследований 2 фазы (ESPN, RECORD-3, ASPEN, KEYNOTE-427, CheckMate 920), а также результатов, полученных в отдельных сериях наблюдений, альтернативными опциями для лечения нПКР являются пембролизумаб , пембролизумаб с ленватинибом, ниволумаб , ниволумаб с ипилимумабом или кабозанти-нибом, сунитиниб; допустимым режимом в последующих линиях может являться монотерапия эверолимусом.
При раке из собирательных трубочек возможно назначение ХТ комбинацией цисплатин + гемцитабин или карбоплатин + гемцитабин (при противопоказаниях к назначению цисплатина).
Алгоритм выбора режима лекарственной терапии у больных ПКР представлен в табл. 5.
Таблица 5. Алгоритм выбора режима лекарственной терапии первой линии у больных ПКР
|
Предшествующее лечение |
Группа прогноза IMDC |
Режимы предпочтения |
Альтернативные режимы |
Допустимые режимы |
|
I линия терапии светлоклеточного ПКР |
||||
|
Не было |
Благоприятный |
+ кабозантиниб
|
• Авелумаб + акситиниб |
• Пазопаниб • Сунитиниб |
|
Предшествующее лечение |
Группа прогноза IMDC |
Режимы предпочтения |
Альтернативные режимы |
Допустимые режимы |
|
Промежуточный и неблагоприятный |
+ ипилимумаб
+ кабозантиниб |
• Авелумаб + акситиниб |
• Кабозантиниб |
|
|
I линия терапии ПКР с саркоматоидной дифференцировкой |
||||
|
Не было |
Благоприятный |
+ кабозантиниб
|
+ акситиниб
|
– |
|
Промежуточный и неблагоприятный |
+ ипилимумаб
+ кабозантиниб
|
|||
|
I линия терапии несветлоклеточного ПКР |
||||
|
Не было |
Все группы прогноза IMDC, папиллярный вариант ПКР |
• Кабозантиниб • Пембролизумаб + ленватиниб |
+ ипилимумаб
+ кабозантиниб
|
|
|
Не было |
Все группы прогноза IMDC, все варианты несветлоклеточного ПКР, кроме рака собиратель ных трубочек |
• Пембролизумаб + ленватиниб |
||
|
Не было |
Все группы прогноза IMDC, рак собирательных трубочек |
• Клинические исследования |
+ гемцитабин
+ гемцитабин2 |
– |
|
II линия терапии |
||||
|
Анти-VEGF |
Все группы |
• Ниволумаб • Кабозантиниб |
• Ленватиниб + эверолимус |
• Акситиниб |
|
Анти- PD(L)1 + анти-VEGF |
Все группы |
• Клинические исследования |
• Кабозантиниб 1 • Ленватиниб 1 + эверолимус |
– |
|
Предшествующее лечение |
Группа прогноза IMDC |
Режимы предпочтения |
Альтернативные режимы |
Допустимые режимы |
|
Анти-PD(L)-1 + анти-CTLA-4 |
Благоприятный |
• Клинические исследования |
• Клинические исследования |
• Сунитиниб • Пазопаниб |
|
Промежуточный и неблагоприятный |
• Кабозантиниб • Ленватиниб + эверолимус |
|||
|
Последующая терапия3 |
||||
|
Не было анти-PD(L)-1 и/или анти-CTLA-4 |
Все группы |
• Ниволумаб • Кабозантиниб |
• Ленватиниб + эверолимус |
+ ипилимумаб
+ кабозантиниб
|
|
Были анти-PD (L)-1 и/или анти-CTLA-4 |
Все группы |
• Клинические исследования |
• Кабозантиниб • Ленватиниб + эверолимус |
+ ипилимумаб
+ кабозантиниб
|
1 Если препарат не использовался в первой линии терапии.
2 При противопоказаниях к цисплатину.
3 Допустимо применение препаратов, не применявшихся в предыдущей линии терапии.
4. НАБЛЮДЕНИЕ ПОСЛЕ ПЕРВИЧНОГО ЛЕЧЕНИЯ
5. ПОБОЧНЫЕ ЭФФЕКТЫ, СВЯЗАННЫЕС ПРОВЕДЕНИЕМ ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ
За всеми пациентами, подвергнутыми радикальному хирургическому лечению ПКР, должно осуществляться тщательное наблюдение. Кратность обследования определяется группой риска (табл. 6). Первое обследование (КТ органов грудной клетки и живота с контрастным усилением) у больных с низким риском выполняется через 6 месяцев после операции, далее — через 18 и 30 месяцев, пациентам с промежуточным риском — через 6, 12, 24 и 36 месяцев, больным с высоким риском — через 3, 6, 12, 18, 24 и 36 месяцев. В дальнейшем контрольное обследование проводится ежегодно. При появлении клинических симптомов производится внеплановое обследование, объем которого может быть расширен в зависимости от проявлений заболевания.
Таблица 6. Шкала оценки риска метастазирования рака почки Лейбовича
|
Фактор |
Баллы |
|
Категория рТ |
|
|
• pT1a |
0 |
|
• pT1b |
2 |
|
• pT2 |
3 |
|
• pT3a-pT4 |
4 |
|
Категория pN |
|
|
• pNx или pN0 |
0 |
|
• pN1 |
2 |
|
Размер опухоли почки |
|
|
• < 10 см |
0 |
|
• ≥ 10 см |
1 |
|
Степень злокачественности |
|
|
• 1–2 |
0 |
|
• 3 |
1 |
|
• 4 |
3 |
|
Некроз в опухоли |
|
|
• нет |
0 |
|
• да |
1 |
|
Группа риска |
|
|
• низкий |
0–2 |
|
• промежуточный |
3–5 |
|
• высокий |
≥ 6 |
|
Расчетная выживаемость без метастазов (%) |
|
|
Группа риска |
1 год 5 лет 10 лет |
|
Низкий |
99,5 97,1 92,5 |
|
Промежуточный |
90,4 73,8 64,3 |
|
Высокий |
57,7 31,2 23,6 |
Наиболее частыми побочными эффектами, характерными для ингибиторов VEGFR, являются астения, АГ, диарея, ЛПС, гипотиреоз, кожная токсичность, нейтропения. Частота и степень выраженности данных побочных явлений может варьировать в зависимости от использования того или иного препарата. До начала и на фоне терапии тирозинкиназными ингибиторами необходимо осуществлять мониторинг гематологических показателей, АД и функции щитовидной железы (ТТГ, Т3, Т4).
Перед назначением препарата следует добиться адекватного контроля АД (ингибиторы АПФ или блокаторы рецептора ангиотензина II, антагонисты кальциевых каналов, бета-адреноблокаторы) и, при необходимости, продолжить гипотензивную терапию. Уровень ТТГ > 10 мМЕ/л является показанием к назначению гормонозаместительной терапии независимо от наличия симптомов гипотиреоза. Развитие АГ и гипотиреоза в течение первых 4–6 недель лечения ассоциировано с более высокими показателями беспрогрессивной и общей выживаемости. Медикаментозная коррекция АД и гипотиреоза, развившихся на фоне таргетной терапии, не влияет на результаты лечения и должна проводиться в соответствии с общепринятыми рекомендациями.
Характерными нежелательными явлениями, ассоциированными с терапией ингибиторами mTOR (эверолимус), являются мукозиты, пульмониты, иммуносупрессия и риск инфекции, а также метаболический синдром (гипергликемия, гиперхолестеринемия, гиперлипидемия). До старта терапии ингибиторами mTOR следует оценить и, при необходимости, скорректировать исходные показатели липидов и глюкозы сыворотки крови, излечить персистирующие инфекции, а также исключить клинически значимое снижение дыхательной функции. В процессе лечения необходимо мониторировать указанные показатели.
При проведении иммунотерапии ингибиторами контрольных точек (ниволумаб, аве-лумаб, пембролизумаб, ипилимумаб) в различные сроки могут развиваться аутоиммунные поражения различных органов различной степени выраженности. Чаще всего регистрируются проявления кожной и гастроинтестинальной токсичности, реже — аутоиммунные эндокринопатии (аутоиммунный гипофизит, тиреоидит, поражение надпочечников), нефропатии, гепатиты, нейропатии.
о о почечноклеточного рака
Опухоль почки
| том /vol. 14(3s2) 2024
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


