Почвенные актинобактерии рода Rhodococcus, обладающие высокой амидазной активностью
Автор: Демаков В.А., Павлова Ю.А., Максимов А.Ю., Кузнецова М.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 10, 2009 года.
Бесплатный доступ
Исследованы почвенные культуры актинобактерий рода Rhodococcus, обладающие термостабильной амидазной активностью. Проведен ПЦР-анализ и секвенирование генов амидаз. Выявлены последовательности, гомологичные известным генам амидаз из R. erythropolis (GenBank, M88614), R. erythropolis (GenBank, E12517) и R. rhodochrous N774.
Короткий адрес: https://sciup.org/147204471
IDR: 147204471 | УДК: 579.26:579.222.4
Текст научной статьи Почвенные актинобактерии рода Rhodococcus, обладающие высокой амидазной активностью
-
a Пермский государственный университет, 614990, Пермь, ул. Букирева, 15
-
b Институт экологии и генетики микроорганизмов УрО РАН, 614081, Пермь, ул. Голева, 13
Исследованы почвенные культуры актинобактерий рода Rhodococcus , обладающие термостабильной амидазной активностью. Проведен ПЦР-анализ и секвенирование генов амидаз. Выявлены последовательности, гомологичные известным генам амидаз из R. erythropolis (GenBank, M88614), R. erythropolis (GenBank, E12517) и R. rhodochrous N774.
Амидазы (КФ 3.5.1.4) – ферменты, катализирующие реакции гидролиза амидосоединений, участвуют в метаболизме азота и широко распространены в природе: они обнаружены у прокариот и эукариот (Fournand, 2001). У бактерий присутствие амидазной активности нередко ассоциировано с метаболизмом нитрилов. Микроорганизмы, активно использующие амиды и нитрилы в качестве ростового субстрата, обнаружены среди бактерий различных таксономических групп: Agrobacterium, Alcaligenes, Bacillus, Brevibacterium, Pseudomonas , Rhodococcus и др (Забазная, 1998, Кузнецова, 1997; Максимов, 2003; Моисеева, 1991, Banerjee, 2002; Cowan, 2000; Kotlova, 1999, Yanenko, 1995).
Амидазы, выделенные из различных источников, характеризуются различной субстратной специфичностью (Banerjee, 2002). Некоторые из них преимущественно гидролизуют амиды алифатических кислот, другие расщепляют ароматические соединения, в то время как остальные трансформируют амиды α- или ω-аминокислот. Некоторые амидазы обладают стереоселективностью (Four-nand, 2001). Однако распространение ферментных систем разных типов, способных трансформировать различные виды субстратов, не является видоспецифическим признаком (Перцович, 2005).
Данная работа посвящена исследованию почвенных микроорганизмов, обладающих высокой амидазной активностью, и анализу генов амидаз.
Материалы и методы исследования
Объектами исследования являлись полученные в результате селекции на ацетонитриле штаммы Rhodococcus erythropolis, активно трансформирующие амиды и нитрилы карбоновых кислот. Культуры выращивали на минеральной безазотной солевой среде N, содержащей ацетонитрил в концентрации 10 мМ .
Трансформацию амидов и нитрилов с использованием активной биомассы проводили в 1 мл 10 мМ калий-натрий фосфатного буфера, pH 7.2, при начальной концентрации субстрата 2% параллельно при 25 и 50°С в течение 10 мин. Реакцию останавливали добавлением концентрированной HCl до концентрации 2%. Пробы центрифугировали при 12 тыс. об/мин в течение 5 мин. Продукты реакции анализировали методами газовой хроматографии и ВЭЖХ.
Газовую хроматографию продуктов трансформации нитрилов проводили на хроматографе Chrom 5d ( " LP " , Чехословакия), оснащенном плазменно-ионизационным детектором. Хроматографическая колонка длиной 2 м и внутренним диаметром 3 мм была заполнена носителем полисорб-1, фракция 0,25-0,5 мм ( " Реахим " , Россия). В газ-носитель азот подавался с объемным расходом 35 см3/мин. Температура термостата 190 ± 3 ° С, температура испарителя 220 ± 10 ° С. В качестве стандартов использовали растворы чистых нитрилов, амидов и карбоновых кислот.
Удельную активность ферментов – амидазы и нитрилгидратазы – выражали в мкмоль продукта реакции (кислоты или амида), образуемого за 1 мин, в пересчете на 1 мг веса сухих клеток (мкмоль/мг/мин).
Хромосомную ДНК получали фенольным методом, модифицированным для выделения ДНК из актиномицетов (Клонирование ДНК, 1988).
Праймеры для амплификации генов нитрилгидратазы (А) и нитрилазы (Б )
|
Выявляемый тип гена |
Праймер |
Последовательность |
|
Амидаза, гомологичная ферментам из R. erythropolis (E12517) и R. rhodochrous N-774 (X54074) |
AmiRhd-1 AmiRhd-2 |
5’-ATGGCGACAATCCGACCTGACGACA 5’-CTAGGCGGGGCTGAGTTGTGGTGCAGA |
|
Амидаза, гомологичная ферменту из R. erythropolis (M88714) |
AmiReR-1 AmiReR-2 |
5’-ATGCGACACGGTGACATCTCCTCGA 5’-TTACGCTTCGACGGTCTTCTCGAC |
|
Амидаза, гомологичная ферменту из R. erythropolis (AY026386) |
AmiReX-1 AmiReX-2 |
5’-GTGCGACCCAATCGCCCATTCGGCC 5’-CTACCGCAGCACCGGTGCGCTCGG |
|
Амидаза, гомологичная ферментам из R. rhodochrous J1 (S38270) |
AmiJ1-1 AmiJ1-2 |
5’-ATGTCTTCGTTGACTCCCCCCAATT 5’-TTATGTCAGGGTGCCGGCTGCAGC |
|
Rhodococcus sp. (BD061400) |
AmiBD-2 |
5’-TCAGGACGGCACCGAGGGTCGCGG |
|
Амидаза, гомологичная ферменту Rhodococcus sp. (A19131) |
AmiRsp-1 AmiRsp-2 |
5’-ATGGGCTTGCATGAACTGACGCTCG 5’-TCAAAGCGGCGCCAGTCGCGGCCA |
|
α-субъединица Со-нитрилгидратазы ( R. rhodochrous J1) |
F AM3 R АМ9 |
5’-GTGATACATATGAGCGAGCACGTCAAT 5’-ATGCATCATACGATCACTTCCTG |
|
β- субъединица Со-нитрилгидратазы ( R. rhodochrous J1) |
F АМ2 R АМ7 |
5’-GTGATACATATGGATGGTATCCACGAC 5’-ATGCATCACGCAGAGATCAGGTA |
|
α- субъединица Fe-нитрилгидратазы ( R. rhodochrous N-774, X54074) |
F АМ5 R АМ8 |
5’-СATATGTCAGTAACGATCGAC 5’-ATGCATCAGACGGTGGGAACCTG |
|
β- субъединица Fe-нитрилгидратазы ( R. rhodochrous N-774, X54074) |
F АМ4 R АМ6 |
5’-СATATGGATGGAGTACACGAT 5’-ATGCATCAGGCCGCAGGCTCGAG |
Амплификацию ДНК проводили с применением термостабильной Taq -SE ДНК-полимеразы (ООО «СибЭнзим», Новосибирск) на термоциклере Т3 (Biometra, Германия). Олигонуклеотидные праймеры разработаны с использованием базы данных GenBank (таблица).
Режим амплификации включал начальный цикл денатурации – 1 мин при 94°С; денатурацию, 94°С - 40 с; отжиг, 55-63° - 30 с; элонгацию, 72°С -60 с; (35 циклов) и завершающий этап – 60 с при 72°С.
Электрофоретическое разделение продуктов реакции проводили в 1,5 % агарозном геле в трис-боратном буфере при напряженности электрического поля 6 В/см.
Результаты и их обсуждение
Выделено более 400 клонов бактерий, способных к быстрому росту при использовании ацетонитрила или изобутиронитрила в качестве единственного источника углерода и азота. Для дальнейшего исследования отобраны 25 клонов, активно утилизирующих амиды и нитрилы и различающихся по морфологическим характеристикам.
Проведена идентификация бактерий по совокупности культурально-морфологических, биохимических, хемотаксономических свойств. Видовая принадлежность представителей рода Rhodococ-cus была подтверждена методом ПЦР-анализа генов 16S РНК с видоспецифическими праймерами.
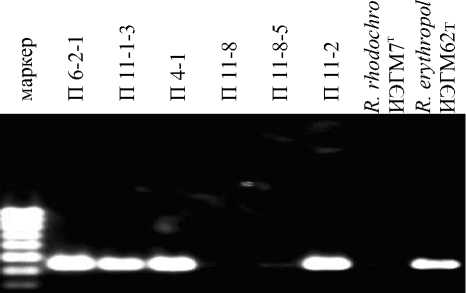
Рис. 1. Идентификация штаммов R. erythropolis по генам 16S РНК
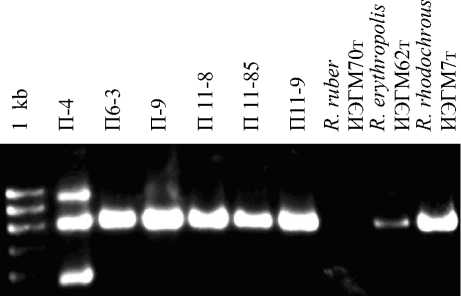
Рис. 2. Идентификация штаммов R. rhodochrous по генам 16S РНК
Основная часть активных изолятов была представлена нокардиоподобными микроорганизмами, в основном относящимися к роду Rhodococcus (рис. 1, 2).
В ходе селекционного процесса при постепенным повышении концентрации субстрата (нитрила) получены культуры R. erythropolis П4-1, П6-21, П11-2, П11-1-3 и R. rhodochrous П-11-8, П-1185, проявляющих амидазную активность более 6 Ед. при 25°С и более 30 Ед. при 50°С, а также активность нитрилгидратазы более 10°С. Установлено, что наилучшими субстратами для ферментов большинства штаммов являются ацетамид и пропионамид. Никотинамид и бензамид гидролизовались с меньшей скоростью.
Молекулярный анализ генов амидаз и нитрил-гидратаз
Для идентификации генов, кодирующих ферменты гидролиза амидов и нитрилов, проведен ПЦР-анализ с применением набора праймеров, специфичных для известных в настоящее время видов амидаз и нитрилгидратаз.
Показано, что геномы изолятов Rhodococcus содержат преимущественно последовательности, родственные ранее известным генам амидаз R. erythropolis , GenBank , E12517, R. rhodochrous N-771, X54074 и R. erythropolis , GenBank, M88614 (рис.3). Гены других видов амидаз встречались со значительно меньшей частотой.
Большинство штаммов также содержали последовательности, родственные генам α- и β- субъединиц Fe-содержащей нитрилгидратазы штаммов R. rhodochrous N-774, Rhodococcus sp. R312.
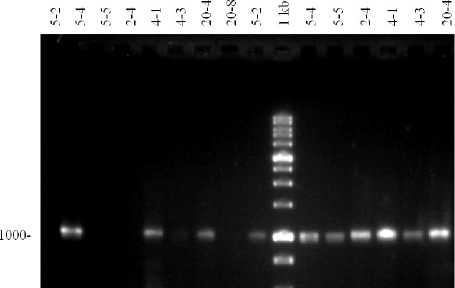
Рис. 3. Амплификация последовательностей, гомологичных генам амидазы R. erythropolis , GenBank, M886142.
Проведено секвенирование полученных ПЦР-фрагментов с помощью ДНК-секвенатирующей системы MegaBase1000.
Установлено, что гомология известной последовательности E12517 составляет от 94 до 99% (рис. 4, 5,А). У некоторых штаммов обнаружен ряд нуклеотидных замен, что, очевидно, обуславливает различия субстратной специфичности ферментов.
Последовательности, полученные в ПЦР-реакции с праймерами AmiReR, на 82-99% гомологичны гену амидазы R. erythropolis , приведенному в базе данных GenBANK под номером M88614 (рис.5,Б), относящемуся к структурному семейству нитрилаз-цианидгидратаз (Перцович, 2005).
----------------------------------------------------------------------------------------------------------------------------Section 1
(1) 1 ,10 go go 40 gO 66
П6-2-1 (1) TCC6AAACC3TCGAACTA6T6GCCCTGACCGSCCACCAC66CATCACCGCCCTCGGCG6CGCGA6C
AmiRhd fr (1) TCCGAAACC6TC*AACTGGTGGCCCTG*CC6GCCACCACGGC*TCACCACCCTCGGCGGCGCGAGC
П11-2 (1) TCCGAAACCGTCAAACTGGTGGCTCTGACCGGCCACCACGGCATCACCACCCTCGGCGGCGCGAGC
E12517 fr (1) TCCGAAACCGTCAAACTGGTGGCTCTGACCGGCCACCACGGCATCACCACCCTCGGCGGCGCGAGC
П4-1 (1) TCCGAAACCGTCAAACTGGTGGCTCTGACCGGCCACCACGGCATCACCACCCTCGGCGGCGCGAGC
П11-8-5 (1) TCCGAAACCGTCAAACTGGTGGCTCTGACCGGCCACCACGGCATCACCACCCTCGGCGGCGCGAG-
K17p (1) TCCGAAACCGTCAAACTGGTGGCTCTGACCGGCCACCACGGCATCACCACCCTCGGCGGCGCGAGC
Consensus (1) TCCGAAACCGTCAAACTGGTGGCTCTGACCGGCCACCACGGCATCACCACCCTCGGCGGCGCGAGC -------------------------------------------------------------------------------------------------------------------Section 2
(67) 67 80 90 J 00 1g 0 120 132
П6-2-1 (67) TACGGCAAAGCCCGGAACCTCGTACCGCTCGCCCGCGCCGCCTACGACAATGCCTTGAGACAATTC
AmiRhd fr (67) tacggcaaagcccggaacctcgtaccgcttgcccgcgccgcctacgacactgccttgagacaattc
П11-2 (67) tacggcaaagcccggaacctcgtaccgctcgcccgcgcagcctacgacactgccttgagacaatt.c
E12517 fr (67) TACGGCAAAGCCCGGAACCTCGTACCGCTCGCCCGCGCCGCCTACGACACTGCCTTGAGACAATTC
П4-1 (67) TACGGCAAAGCCCGGAACCTCGTACCGCTCGCCCGCGCCGCCTACGACACTGCCTTGAGACAATTC
П11-8-5 (66) TACGGCAAAGCCCGGAACCTCGTACCGCTCGCCCGCGCAACCTACGACACTGCCGTGAGACAATTN
K17p (67) TACGGCAAAGCCCGGAACCTCGTACCGCTCGCCCGCGCAGCCTACGACACTGCCTTGAGACAATTC
Consensus (67) TACGGCAAAGCCCGGAACCTCGTACCGCTCGCCCGCGCCGCCTACGACACTGCCTTGAGACAATTC -------------------------------------------------------------------------------------------------------------------Section 3 133) 133 140 150 160 ,170 180 198
П6-2-1 133) GACGTCCTGGTGATGCCCACACTGCCCTACGTCGCATCCGAAGTTCCGGCGAAGGACGTGGATCGT
AmiRhd fr 133) GACGTCCTGGTGATGCCAACGCTGCCCTACGTCGCATCCGAATTGCCGGCGAAGGACGTAGATCGT
П11-2 133) GACGTCCTGGTGATGCCCACACTGCCCTACGTCGCATCCGAACTACCGGCGAAGGACGTGGATCGT
E12517 fr 133) GACGTCCTGGTGATGCCCACACTGCCCTACGTCGCATCCGAACTACCGGCGAAGGACGTGGATCGT
П4-1 133) GACGTCCTGGTGATGCCCACACTGCCCTACGTCGCATCCGAATTGCCGGCGAACGACGTGGATCGT
П11-8-5 132) GACGTCCTGGTGATGCCCACACTGCCCTACGTCGCATCCGAATTGCCGGCGAACGACGTGGATCGT
K17p 133) GACGTCCTGGTGATGCCCACACTGCCCTACGTCGCATCCGAATTGCCGGCGAACGACGTGGATCGT
Consensus 133) gacgtcctggtgatgcccacactgccctacgtcgcatccgaattgccggcgaaggacgtggatcgt -------------------------------------------------------------------------------------------------------------------Section 4
Рис. 4. Нуклеотидные последовательности генов амидаз штаммов почвенных изолятов Rhodococcus , гомологичные генам R. erythropolis (E12517) и R. rhodochrous N744 (X54074).
А ---------------------------П 6-2-1 (0.0198)
---------------------------------------AmiRhd fr (0.0281)
------П11-2 (0.0045)
- E12517fr(0.0015)
П4-1 (0.0007)
--------------П11-8-5 (0.0120)
K17p (0.0000)
Б
111-8-5Г-А (-0.0004)
2-4ff-AR (0.0002)
11-2^(0.0002)
------------4-1 For-A (0.0082)
----------------------------------------------------------------5-2F-A [0.0404]
-------------------4-3F-A (0.0124)
-------------------------------------------------------------------------------------5-4for A (0.0534)
Рис. 5. Филогенетические древа нуклеотидных последовательностей, гомологичных генам амидазы R. rhodochrous N744 (А), R. rhodochrous M88614 (Б)
Заключение
Бактерии, активно трансформирующие амиды карбоновых кислот, широко представлены в почве естественной среды. Среди культур, обладающих высоким уровнем нитрилгидратазной и амидазной активности, преобладают представители рода Rhodococcus .
Среди почвенных изолятов Rhodococcus , обладающих высокой амидазной активностью, наиболее распространены гены амидаз двух типов, гомологичные последовательностям из R. erythropolis , GenBank , E12517 и R. erythropolis , GenBank, M88614.
Филогенетический анализ секвенированных последовательностей позволяет предположить, что структура вновь выявленных генов ближе к гипотетической предковой форме алифатической амидазы, чем последовательности, депонированные в GenBank E12517, M88614 (рис. 5).
Работа поддержана программой Президиума РАН «Молекулярная и клеточная биология», ВЦП «Развитие научного потенциала высшей школы (2009–2010 гг.)» и грантом поддержки молодых ученых УрО РАН.
Список литературы Почвенные актинобактерии рода Rhodococcus, обладающие высокой амидазной активностью
- Забазная Е.В. Отбор штаммов, трансформирующих акрилонитрил и акриламид в акриловую кислоту/Е.В. Забазная, С.В. Козулин, С.П. Воронин//Прикладная биохимия и микробиология. 1998. Т. 34, № 4. С. 377-384.
- Клонирование ДНК. Методы/пер. с англ.; под ред. Д. Гловера. М.: Мир, 1988. 538 с.
- Кузнецова М.В. Распространение нитрилконвертирующих бактерий в почвах Пермского края/М.В. Кузнецова, А.Ю. Максимов, Г.В. Овечкина, В.А. Демаков//Вестник Перм. ун-та. 2007. Т.5(10). С.96-99.
- Максимов, А.Ю. Влияние нитрилов и амидов на рост и нитрилгидратазную активность штамма Rhodococcus sp. gt1/А.Ю. Максимов, М.В. Кузнецова, Г.В. Овечкина и др.//Прикладная биохимия и микробиология. 2003. Т. 39, № 1. С. 63-68.
- Моисеева Т.Н. Скрининг штаммов-деструкторов акриловой кислоты и ее производных/Т.Н. Моисеева, С.В. Козулин, Л.К. Куликова, С.П. Воронин//Биотехнология. 1991. № 6. С. 79-83.
- Перцович С.И. Алифатическая амидаза из Rhodococcus rhodochrous-представитель семейства нитрилаз/цианидгидратаз/С.И. Перцович, Д.Т. Гуранда, Д.А. Подчерняев, А.С. Яненко, В.К. Швядас//Биохимия. 2005. Т.70. С.1556-1565
- Asano Y. Overview of screening for new microbial catalysts and their uses in organic synthesis -selection and optimization of biocatalysts//J. Biotechnol. 2002. Vol. 94. P. 65-72.
- Banerjee A. The nitrile-degrading enzymes: current status and future prospects/A. Banerjee, R. Sharma, U.C. Banerjee//Appl. Microbiol. Biotechnol. 2002. Vol. 60. P. 33-44.
- Cowan D. Biochemistry and biotechnology of mesophilic and thermophilic nitrile metabolizing enzymes/D. Cowan, R. Cramp, R. Pereira et al.//Extremophiles. 1998. Vol. 2, № 3. P. 207-216.
- Fournand D. Aliphatic and enantioselective amidases: from hydrolysis to acyl transfer activity/D. Fournand and A. Arnaud//J.Appl.Microbiol. 2001. Vol.91. P. 381-393.
- Kotlova E. K. Isolation and primary characterization of an amidase from Rhodococcus rhodochrous E.K. Kotlova, G.G. Chestukhina, O.B. Astaurova., T.E Leonova, A.S. Yanenko, V.G. Debabov//Biochemistry. 1999. Vol. 64, N. 4. P. 384-389.
- Yanenko A.S. Regulation of nitrile utilization in Rhodococcus/A.S. Yanenko, O.B. Astaurova, T.V. Gerasimova et al.//Biotechnologia. 1995. №.7-8. P. 139-144.


