Почвенные микробные сообщества как источник штаммов для биологической защиты сои от фузариоза в Приенисейской Сибири
Автор: Родовиков С. А., Чураков А. А., Попова Н. М., Хижняк С. В.
Журнал: Вестник Нижневартовского государственного университета @vestnik-nvsu
Рубрика: Экология растений
Статья в выпуске: 2, 2020 года.
Бесплатный доступ
Из почвенных микробных сообществ Приенисейской Сибири выделены 18 штаммов бактерий-антагонистов, подавляющих рост возбудителей фузариоза сои. Два наиболее активных антагониста (штамм RSA-1, предварительно идентифицированный как представитель р. Bacillus, и штамм RSA-13, предварительно идентифицированный как представитель р. Streptomyces) были протестированы в качестве биологических агентов для защиты сои от фузариоза в лабораторных условиях. В отсутствие искусственного заражения штамм RSA-1 снизил распространенность фузариоза на 25 процентных пунктов (с 61,5% до 36,5%, статистическая значимость эффекта p
Соя, фузариоз, приенисейская сибирь, биологическая защита
Короткий адрес: https://sciup.org/14117221
IDR: 14117221 | УДК: 579.64 | DOI: 10.36906/2311-4444/20-2/01
Текст научной статьи Почвенные микробные сообщества как источник штаммов для биологической защиты сои от фузариоза в Приенисейской Сибири
В мировом сельском хозяйстве соя культурная (Glycine max (L.) Merr.) является самой распространенной белково-масличной культурой. Россия по производству соевых бобов занимает 9-е место в мире, а валовый сбор по стране с 1990 по 2018 гг. увеличился на 461% [13; 17; 20]. В последние годы рост посевных площадей под этой культурой наблюдается и в Сибири. Так, только за период 2016–2017 гг. в Новосибирской области рост посевных площадей под соей увеличился более чем в 7 раз, в Красноярском крае – в 2,7 раза [9]. В 2018 и 2019 г. тенденция к росту площади посева сои сохранилась. Значительный ущерб посевам сои наносят фитопатогенные микроорганизмы, в первую очередь – возбудители грибных болезней [16; 20; 22]. По разным оценкам, потери урожая сои от болезней могут достигать 20–50% [1; 15; 20]. В условиях Дальневосточного региона и лесостепи Западной Сибири наиболее вредоносными фитопатогенами являются представители р. Fusarium, вызывающие корневые гнили и фузариозный вилт [2; 4]. По результатам наших исследований, среди возбудителей болезней сои в Красноярском крае также преобладают виды р. Fusarium, распространенность которых в ряде случаев достигает 100%. Разнообразие видового состава рода Fusarium затрудняет поиск источников устойчивости к этому фитопатогену [4; 5]. В этой связи наиболее эффективным способом защиты посевов сои от фузариоза и других грибных болезней является предпосевная обработка семян фунгицидами [15; 18]. Неуклонный рост химической нагрузки на агроценозы и способность вредных организмов вырабатывать резистентность к массово применяемым пестицидам актуализировали вопрос биологизации защиты растений сои от болезней путем замены химических препаратов на биопрепараты, создаваемые на основе микроорганизмов, проявляющих антагонизм в отношении возбудителей болезней [1; 3; 5; 8; 10; 21]. Мировая практика показывает, что высокая эффективность биопрепаратов может быть достигнута только при использовании в их составе штаммов, адаптированных к местным почвенно-климатическим условиям [12; 14; 19; 23; 24]. В этой связи нами была проведена оценка перспектив защиты сои от грибных болезней в Приенисейской Сибири на основе бактерий, выделенных из автохтонных микробных сообществ.
Материалы и методы исследования
Для выделения бактерий использовали образцы почвы из-под сои и пшеницы, отобранные в ООО «Учебно-опытное хозяйство “Миндерлинское”» (Красноярский край, Сухобузимский район). Выделение проводили методом рассева на агаризованную питательную среду №1 ГРМ производства ФБУН ГНЦ ПМБ (панкреатический гидролизат рыбной муки – 15,0 г/л, панкреатический гидролизат казеина – 10,0 г/л, дрожжевой экстракт – 2,0 г/л, натрия хлорид – 3,5 г/л, глюкоза – 1,0 г/л, агар – 10,0 г/л), дополненной агаром до 20 г/л. Проверку антибиотической активности выделенных бактериальных изолятов в отношении грибов р. Fusarium проводили чашечным методом на питательной среде № 2 ГРМ (Сабуро) производства ФБУН ГНЦ ПМБ (панкреатический гидролизат рыбной муки – 10,0 г/л, панкреатический гидролизат казеина – 10,0 г/л, дрожжевой экстракт – 2,0 г/л, натрия фосфат однозамещенный – 2,0 г/л, глюкоза – 40,0 г/л, агар – 10,0 г/л), разведенной в 2 раза и дополненной агаром до 20 г/л. Предварительные исследования показали, что такая среда хорошо поддерживает как рост грибов р. Fusarium , так и рост выделенных изолятов почвенных бактерий. Выявление штаммов-антагонистов проводили по наличию зоны подавления роста тест-культуры вблизи бактериальных колоний. Дополнительную количественную проверку антагонизма проводили по подавлению прорастания конидий тест-культур в растворе 1%-ной глюкозы в присутствии бактерий-антагонистов [11] (рис. 1).
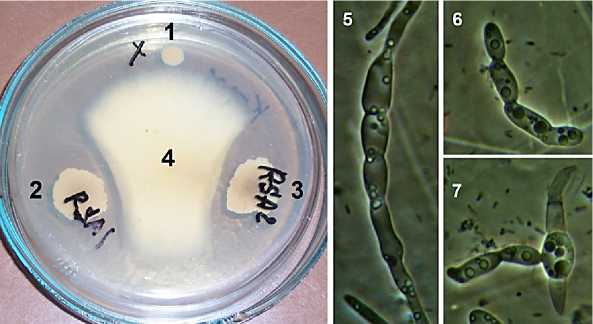
Рис. 1. Проверка антагонизма выделенных бактериальных изолятов в отношении Fusarium spp.:
1, 2, 3 – бактериальные изоляты, 4 – тест-культура Fusarium , 5 – нормальное прорастание конидии в отсутствии бактерий-антагонистов после 24 часов инкубирования в 1%-ном растворе глюкозы,
6, 7 – ингибирование прорастания конидий в присутствии бактерий-антагонистов после 24 часов инкубирования в 1%-ном растворе глюкозы (на примере штамма RSA-1)
Тест-культурами для проверки антибиотической активности бактериальных штаммов служили 4 морфологически различающихся изолята Fusarium sp., выделенные из пораженных фуза-риозом растений сои.
Микроскопические исследования и микрофотосъемку проводили с помощью микроскопа МИКМЕД-6 вариант 7, оснащенного фазово-контрастным устройством и цифровой камерой DCM-130E. Измерения бактериальных клеток проводили по микрофотографиям с помощью программы ImageJ, для пересчета пикселей в микрометры использовали объект-микрометр проходящего света ОМП ГОСТ 7513-55 производства ОАО «ЛОМО».
Лабораторную эффективность наиболее активных штаммов-антагонистов (RSA-1 и RSA-13) в подавлении развития фузариоза в сравнении с химическим протравителем проверяли методом рулонных культур на сое сорта Заряница (оригинаторы – ФГБНУ «Омский аграрный научный центр», ФГБОУ ВО «Красноярский ГАУ»; регион допуска – Восточно-Сибирский). В эксперименте использовали семена, полученные в ООО «Учебно-опытное хозяйство “Миндерлинское”» и характеризующиеся высоким (свыше 60%) уровнем естественной зараженности фузариозом. Схема эксперимента включала следующие варианты: контроль (семена без обработки); бактеризация штаммом RSA-1; бактеризация штаммом RSA-13; обработка химическим протравителем; искусственное заражение возбудителями фузариоза; искусственное заражение возбудителями фузариоза + бактеризация штаммом RSA-1; искусственное заражение возбудителями фузариоза + бактеризация штаммом RSA-13; искусственное заражение возбудителями фузариоза + обработка химическим протравителем. В каждом варианте было 4 повторности, по 50 семян в повторности. В качестве химического протравителя использовали препарат «Оплот» (действующие вещества: дифеноконазол – 90 г/л, тебуконазол – 45 г/л) производства АО Фирма «Август», обработку семян проводили в соответствии с инструкцией производителя.
Бактеризацию проводили водными суспензиями штаммов-антагонистов с титром 108 клеток на мл из расчёта 1 мл суспензии на 100 г семян, что соответствует стандартному расходу 10 л на тонну при обработке семян в полевых условиях. Искусственное заражение проводили суспензией конидий, полученной смывом с 10-суточных колоний 4 изолятов Fusarium sp., использованных для выявления штаммов-антагонистов, титр 106 конидий на мл. Учет распространенности фузари-оза проводили в соответствии с Межгосударственным стандартом ГОСТ 12044-93 «Семена сельскохозяйственных культур. Методы определения зараженности болезнями» [7]. Распространенность фузариоза вычисляли как выраженное в процентах отношение растений с признаками заболевания к общему числу растений. Кроме распространенности фузариоза учитывали длину надземной части проростков сои.
Математическую обработку результатов проводили с помощью Пакета анализа MS Excel 2007 и StatSoft STATISTICA 6.0. В качестве тестов при анализе распространенности заболевания использовали хи-квадрат (в случае множественного сравнения вариантов) и точный F-тест для таблиц 2×2 (в случае парного сравнения вариантов). В качестве тестов при сравнении длины проростков использовали двухфакторный дисперсионный анализ, где в качестве факторов выступали «наличие искусственного заражения» и «бактеризация», а при парном сравнении вариантов – двухвыборочный t-тест.
Результаты и их обсуждение
В ходе исследований было выделено 18 штаммов бактерий-антагонистов, проявляющих антибиотическую активность в отношении всех четырех изолятов р. Fusarium , выделенных из пораженных фузариозом проростков сои. Наибольшая антибиотическая активность отмечена у штаммов RSA-1 и RSA-13.
Штамм RSA-1 представлен грамположительными аэробными подвижными спорообразующими палочками. Спора – овальная, 1,5–2,4×0,7–1,3 мкм, расположение в клетке – центральное или субтерминальное. Прорастание споры – латеральное. Молодые клетки – до 24 мкм длиной, клетки в зрелой культуре – 4,2–9,6×1,1–1,3 мкм (рис. 2). Штамм предварительно идентифицирован как представитель р. Bacillus .
Штамм RSA-13 представлен грамположительными аэробными актинобактериями. Подвижные стадии не выявлены. Споры – овальные, 1,4–1,8×0,9–1,2 мкм, формируются в закрученных спорангиях. Мицелий хорошо развитый, ветвящийся, толщина гиф варьирует от 0,8 до 1,7 мкм (рис. 3). Штамм предварительно идентифицирован как представитель р. Streptomyces .
В эксперименте с рулонными культурами в вариантах без искусственного заражения грибами р. Fusarium оба штамма статистически значимо (p < 0,001) снизили распространенность фуза-риоза с 61,5% в контроле до 36,5% (штамм RSA-1) и до 29,5% (штамм RSA-13).
Искусственное заражение статистически значимо (p < 0,001) повысило распространенность фузариоза во всех вариантах эксперимента (в среднем на 27,9 процентных пунктов). В варианте с бактеризацией штаммом RSA-1 распространенность фузариоза по-прежнему была статистически значимо (p < 0,001) ниже, чем в варианте без обработки (54,5% против 83,5%). В варианте с бактеризацией штаммом RSA-13 распространенность фузариоза (82,5%) не отличалась от варианта без обработки.
Наибольший эффект в снижении распространенности фузариоза как без искусственного заражения, так и при искусственном заражении семян оказал протравитель «Оплот» (распространенность фузариоза 22,0% и 40,5% соответственно) (рис. 4).
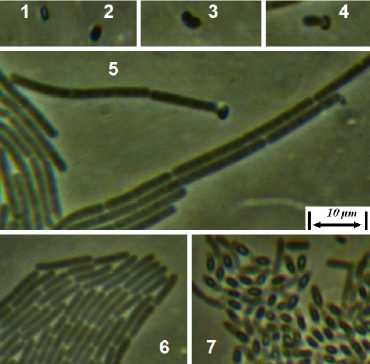
Рис. 2. Морфология штамма RSA-1:
1 – спора, 2 – набухшая спора,
3, 4 – прорастание споры, 5 – удлиненные клетки в молодой (17-часовой) культуре непосредственно после прорастания спор,
6 – клетки в зрелой (48-часовой) культуре,
7 – спорулирующие клетки
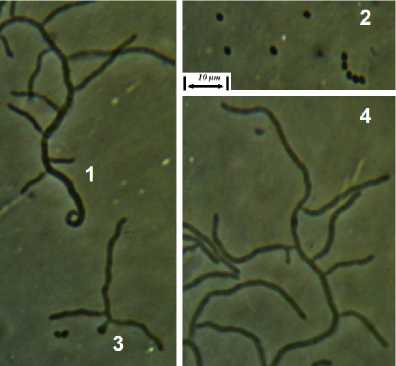
Рис. 3. Морфология штамма RSA-13:
1 – формирующийся спорангий, 2 – споры, 3 – прорастание споры, 4 – мицелий
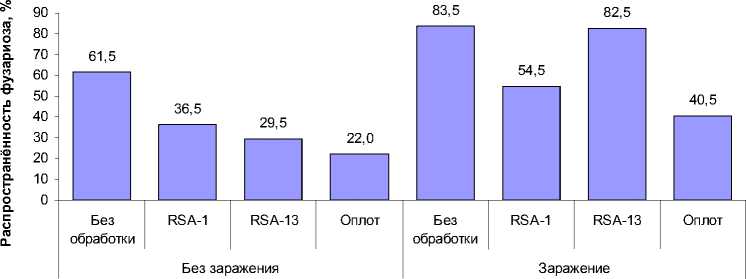
Рис. 4. Распространенность фузариоза проростков сои в разных вариантах эксперимента
Однако «Оплот» оказал ярко выраженное и в высшей степени значимое (p < 0,001) угнетающее действие на рост проростков сои, как в отсутствие заражения (средняя длина проростков 3,60±0,17 см против 17,40±0,88 см в контроле), так на фоне искусственного заражения (средняя длина проростков 3,38±0,16 см против 9,32±0,97 см в варианте без обработки) (рис. 5, 6).
В то же время бактеризация обоими штаммами оказала стимулирующее влияние на рост проростков, особенно ярко проявившееся на фоне искусственного заражения. Так, в варианте с заражением средняя длина надземной части проростков при бактеризации штаммом RSA-1 соста- вила 13,03±1,13 см, при бактеризации штаммом RSA-13 – 13,43±1,11 см, что в 1,4 раза превышает среднюю длину проростков в варианте без обработки.
При отсутствии искусственного заражения стимулирующий эффект бактеризации был не столь выражен – при бактеризации штаммом RSA-1 средняя длина проростков составила 17,74±0,88 см, при бактеризации штаммом RSA-13 – 19,15±0,91 см, что превышает среднюю длину проростков в варианте без обработки, соответственно, в 1,02 и 1,10 раза.
Дисперсионный анализ подтвердил угнетающее действие искусственного заражения грибами р. Fusarium на рост проростков (статистическая значимость p < 0,001), стимулирующее действие бактеризации на рост проростков (статистическая значимость p < 0,001), а также эффект взаимодействия факторов «заражение» и «бактеризация» (статистическая значимость p < 0,01). Значимость различий между вариантами по тесту Дункана представлена в таблице 1.
Можно предположить, что стимулирующий эффект бактеризации в значительной степени обусловлен подавлением развития фузариоза. Действительно, между распространенностью фуза-риоза и длиной проростков отмечена статистически значимая (p < 0,05) отрицательная корреляция (r = –0,823). Регрессионный анализ с использованием данных по отдельным повторностям показал, что снижение распространенности фузариоза на 1 процентный пункт увеличивает среднюю длину проростка на 0,2 см.
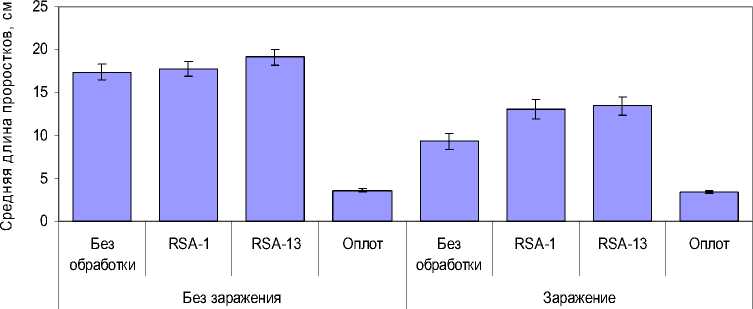
Примечание: Бары на диаграммах означают 95%-е доверительные интервалы для среднего
Рис. 6. Средняя длина надземной части проростков сои в разных вариантах

Рис. 5. Угнетающее действие протравителя «Оплот» на проростки сои на примере варианта без заражения: 1 – контроль, 2 – обработка «Оплотом»
Таблица 1
Статистическая значимость (p) различий по длине проростков между вариантами эксперимента в рулонной культуре согласно тесту Дункана
|
Искусственное заражение |
Бактеризация |
Искусственное заражение |
|||||
|
есть |
нет |
||||||
|
RSA-1 |
RSA-13 |
нет |
RSA-1 |
RSA-13 |
нет |
||
|
есть |
RSA-1 |
нет |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
|
|
RSA-13 |
нет |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
||
|
нет |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
||
|
нет |
RSA-1 |
<0,001 |
<0,001 |
<0,001 |
<0,05 |
нет |
|
|
RSA-13 |
<0,001 |
<0,001 |
<0,001 |
<0,05 |
<0,05 |
||
|
нет |
<0,001 |
<0,001 |
<0,001 |
нет |
<0,05 |
||
В целом можно констатировать, что выделенные штаммы-антагонисты в лабораторных испытаниях продемонстрировали сопоставимую с химическим протравителем эффективность в защите сои от фузариоза, и, в отличие от протравителя, не оказали негативного влияния на рост растений. Таким образом, нами продемонстрирована перспективность использования почвенных микробных сообществ Приенисейской Сибири для защиты сои от фузариоза.
Работа выполнена при финансовой поддержке научно-исследовательских работ, выполняемых высшими учебными заведениями, подведомственными Министерству сельского хозяйства России, финансовая поддержка – за счет средств федерального бюджета в 2020 г.
Список литературы Почвенные микробные сообщества как источник штаммов для биологической защиты сои от фузариоза в Приенисейской Сибири
- Баранов В. Ф., Махонин В. Л. О биологической защите агрофитоценозов сои от вредных организмов // Масличные культуры. 2014. Вып. 1 (157-158). С. 152-164.
- Горобей И. М., Ашмарина Л. Ф., Коняева Н. М. Фузариозы зернобобовых культур в лесостепной зоне Западной Сибири // Защита и карантин растений. 2011. № 2. С. 14-16.
- Жаркова С. В., Манылова О. В. Эффективность биофунгицида Метабактерин, СП на посевах сои Glycine max (L.) Merrill // Вестник Алтайского государственного аграрного университета. 2018. № 12 (170). С. 5-10.
- Заостровных В. И., Кадуров А. А., Дубовицкая Л. К., Рязанова О. А. Мониторинг видового состава болезней сои в различных зонах соесеяния // Дальневосточный аграрный вестник. 2018. № 4 (48). С. 51-67. DOI: 10.24411/1999-6837-2018-14081
- Курилова Д. А. Вредоносность фузариоза сои в зависимости от степени поражения растений // Масличные культуры. 2010. № 2(144-145). С. 84-89.
- Маслиенко Л. В., Курилова Д. А., Шипиевская Е. Ю., Асатурова А. М. Первичный скрининг штаммов грибов и бактерий антагонистов к возбудителю фузариоза сои // Масличные культуры. 2009. № 1(140). С. 114-119.
- Межгосударственный стандарт ГОСТ 12044-93 "Семена сельскохозяйственных культур. Методы определения зараженности болезнями". Принят 21 октября 1993 г.
- Семыкин В. А., Пигорев И. Я., Тарасов А. А., Глинушкин А. П., Плыгун С. А., Сычева И. И. Микробные препараты и регулятор роста как средства биологизации земледелия // Russian Journal of Agricultural and Socio-Economic Sciences. 2016. Т. 11. № 59. С. 3-9.
- DOI: 10.18551/rjoas.2016-11.01
- Чураков А. А. Направления селекции сои в Красноярском крае // Зернобобовые культуры, развивающееся направление в России: Второй Международный форум (Омск, 17-20 июля 2018 г.). Омск: Полиграфический центр КАН, 2018. С. 175-180.
- Штерншис М. В., Беляев А. А., Цветкова В. П., Шпатова Т. В., Леляк А. А., Бахвалов С. А. Биопрепараты на основе бактерий рода Bacillus для управления здоровьем растений. Новосибирск: изд-во СО РАН. 2016. 284 с.
- Хижняк С. В., Пучкова Е. П., Петрушкина С. А. Экспресс-метод выявления штаммов-антагонистов для биологической защиты растений от фитопатогенных грибов // Приоритетные направления научно-технологического развития агропромышленного комплекса России: Материалы Национальной научно-практической конференции. 2019. Ч. 2. С. 590-594.
- Amaria W., Soesanthy F., Ferry Y. The Effectiveness of Biofungicide Trichoderma sp. with Three Kinds of Carrier on White Root Disease Rigidoporus microporus // Jurnal Tanaman Industri dan Penyegar. 2016. V. 3. № 1. P. 37-44.
- DOI: 10.21082/jtidp.v3n1.2016.p37-44
- Anderson E. J., Ali M. L., Beavis W. D., Chen P., Clemente T. E., Diers B. W., Nelson R. L. et al. Soybean [Glycine max (L.) Merr.] Breeding: History, Improvement, Production and Future Opportunities // Advances in Plant Breeding Strategies: Legumes. Springer, Cham, 2019. P. 431-516.
- DOI: 10.1007/978-3-030-23400-3_12
- Butu M., Stef R., Grozea I., Corneanu M., Butnariu M. Biopesticides: Clean and Viable Technology for Healthy Environment // Bioremediation and Biotechnology. 2020. P. 107-151.
- DOI: 10.1007/978-3-030-35691-0_6
- Delaney M., ArchMiller A. A., Delaney D. P., Wilson A. E., Sikora E. J. Effectiveness of fungicide on soybean rust in the southeastern united states: a meta-analysis // Sustainability. 2018. V. 10. № 6. P. 1784.
- DOI: 10.3390/su10061784
- Dean R., Van Kan J. A., Pretorius Z. A., Hammond-Kosack K. E., Di Pietro A., Spanu P. D.,.. Foster G. D. The Top 10 fungal pathogens in Molecular plant pathology // Molecular plant pathology. 2012. V. 13. № 4. P. 414-430.
- DOI: 10.1111/j.1364-3703.2011.00783.x
- Food and Agricultural organization. Food and agricultural data. URL http://www.fao.org/faostat/en/#data/QC
- Grichar, W. J. Soybean (Glycine max L.) Response to Fungicides in the Absence of Disease Pressure // International Journal of Agronomy. 2013.
- DOI: 10.1155/2013/561370
- Haddad P. E., Leite L. G., Lucon C. M. M., Harakava R. Selection of Trichoderma spp. strains for the control of Sclerotinia sclerotiorum in soybean // Pesquisa Agropecuária Brasileira. 2017. V. 52. № 12. P. 1140-1148.
- DOI: 10.1590/s0100-204x2017001200002
- Hartman G. L., West E. D., Herman T. K. Crops that feed the World 2. Soybean-worldwide production, use, and constraints caused by pathogens and pests // Food Security. 2011. V. 3. № 1. P. 5-17.
- DOI: 10.1007/s12571-010-0108-x
- O'Brien P. A. Biological control of plant diseases // Australasian Plant Pathology. 2017. V. 46. № 4. P. 293-304.
- DOI: 10.1007/s13313-017-0481-4
- Savary S., Willocquet L., Pethybridge S. J., Esker P., McRoberts N., Nelson A. The global burden of pathogens and pests on major food crops // Nature ecology & evolution. 2019. V. 3. № 3. P. 430-439.
- DOI: 10.1038/s41559-018-0793-y
- Thakkar A., Saraf M. Development of microbial consortia as a biocontrol agent for effective management of fungal diseases in Glycine max L // Archives of Phytopathology and Plant Protection. 2015. V. 48. № 6. P. 459-474.
- DOI: 10.1080/03235408.2014.893638
- Vasebi Y., Safaie N., Alizadeh A. Biological control of soybean charcoal root rot disease using bacterial and fungal antagonists In Vitro and greenhouse condition // Journal of Crop Protection. 2013. V. 2. № 2. P. 139-150. http://journals.modares.ac.ir/article-3-9001-en.html


