Подбор оптимальных условий биосинтеза молочной кислоты
Автор: Бондарева О.В., Толкачева А.А., Некрасова Н.А., Шуваева Г.П., Черенков Д.А., Корнеева О.С.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 1 (91), 2022 года.
Бесплатный доступ
Молочная кислота находит применение во множестве отраслей промышленности, при этом 40% потребности отечественного рынка удовлетворяется за счёт импорта, при этом основными способами получения молочной кислоты является микробиологический или синтетический. Наиболее рационален микробиологический синтез, однако, при его реализации используются ценные сахаросодержащие субстраты. В связи с этим поиск новых технологий получения молочной кислоты является актуальной задачей. Один из перспективных и экономически выгодныхспособов - переработка молочной сывороткив молочную кислоту путем бактериального ферментирования лактозы, поскольку сыворотка является отходом производства творога. Постоянным финансовым обязательством для молочной отрасли является экологический сбор, большая часть предприятий молокопереработки фактически не имеет возможности следовать существующим требованиям в области биологических загрязнений, а потому компенсирует водоканалам дополнительные расходы на доочистку сточных вод. Цель исследования - провести скрининг культур микроорганизмов, способных ферментировать лактозу, содержащуюся в молочной сыворотке, и подобрать состав среды, обеспечивающий максимальный выход молочной кислоты. В эксперименте использовали штаммы молочнокислых бактерий, полученные из Всероссийской коллекции промышленных микроорганизмов (НИЦ «Курчатовский институт» - ГосНИИгенетика). С целью обеспечения максимального выхода молочной кислоты был определен оптимальный состав среды путем подбора концентраций дрожжевого автолизата и раствора солей. Также была подобрана оптимальная продолжительность биосинтеза молочной кислоты. Исследование кислотообразующей способности штаммов молочнокислых бактерий показало, что из исследованных штаммов наибольшую способность ферментировать лактозу, синтезируя молочную кислоту, проявил Lactobacillus casei C1 (B5726), что коррелирует с данными по ассимиляции культурой лактозы. Подобраны оптимальная продолжительность культивирования (132 ч) и концентрация дрожжевого лизата (5%) в питательной среде на основе творожной сыворотки. При оптимальных параметрах максимальная концентрация молочной кислоты в культуральной жидкости Lactobacillus casei C1 (B5726) составила 54.77 г./л, что сопоставимо с используемыми в настоящее время продуцентами при промышленном производстве молочной кислоты.
Творожная сыворотка, молочная кислота, молочнокислые бактерии, кислотообразующая способность
Короткий адрес: https://sciup.org/140293746
IDR: 140293746 | УДК: 360
Текст научной статьи Подбор оптимальных условий биосинтеза молочной кислоты
В настоящее время молочная кислота (МК) – промышленно важный продукт, спрос на который растет во всем мире, в том числе в России. Потребность рынка в МК составляет порядка 130–150 тыс. т/год.
Молочную кислоту используют во многих промышленных отраслях,в химической добавляют для синтеза различных соединений (пропионовая и акриловая кислоты, уксусный альдегид и другие) и при изготовлении нейтрализаторов, растворителей, средств от нагара; в пищевой промышленности используют в качестве добавки в изделиях кондитерского и мучного производств, используют при консервации плодоовощных культур, а также в процессе изготовления слабоалкогольных и безалкогольных напитков; в косметической используют в кремах, в средствах против акне, в качестве питающего и отбеливающего компонента; в фармацевтической ее используют при изготовлении диализных растворов и минеральных препаратов, протезов и хирургических нитей, а также в системах контролируемой доставки лекарств. В сельском хозяйстве также отмечают использование молочной кислоты, так ее применяют в качестве добавки, которая способствует снижению уровня заболеваемости и повышению уровня репродуктивности сельскохозяйственных животных и птиц. Особое значение и интерес в современном мире представляют полимеры молочной кислоты, которые используют для получения биоразлагаемого пластика. Такие полимеры оказываются изомерами молочной кислоты и обладают схожими физическими и химическими свойствами с применяемыми в настоящее время полимерами из нефтехимических соединений [1, 5, 7, 11–20].
К сожалению, значительная часть потребности отечественного рынка в МК (40%) удовлетворяется за счёт импорта, так как отсутствуют инновационные технологии для её производства и предприятия, которые обладают возможностью выпускать качественную и высококонцентрированную МК [16].
В настоящее время промышленно молочную кислоту получают двумя способами: микробиологический и синтетический. Целесообразным является микробный синтез, однако, в его технологии основными компонентами выступают ценные сахаросодержащие субстраты (сахароза, меласса, патока), которые оказывают значительное влияние на стоимость конечного продукта. В связи с этим существует очевидная необходимость разработки новых технологий получения молочной кислоты [5, 12, 17, 20].
Получить молочную кислоту можно из отходов молочной промышленности, а именно, молочной сыворотки, в состав которой входит достаточное количество молочного сахара – лактозы, ферментируемой молочнокислыми бактериями в МК [9, 11, 15, 18, 19].
Развитие молочной отрасли способствует увеличению объемов молочной сыворотки, налажено производство её концентрата с увеличенным содержанием лактозы. Это открывает широкую перспективу экономически выгодного и рационального использования сыворотки. Переработка молочной сыворотки в молочную кислоту позволит обеспечить российский рынок ценным продуктом и снизить нагрузку на окружающую среду, так как только 20% сыворотки подвергается переработке, а остальной объём сливается в окружающую среду.
Цель исследования – провести скрининг культур микроорганизмов, способных ферментировать лактозу, содержащуюся в молочной сыворотке, и подобрать состав среды, обеспечивающий максимальный выход молочной кислоты.
Методы и материалы
В эксперименте исследовались штаммы молочнокислых бактерий (МКБ): Leuconostoc-mesenteroides subsp. mesenteroides 122 (B-1699), Lactobacillus brevis B-78 (B-5728), Lactobacillus plantarum K-9 (B-5466), Lactobacillus casei C-1 (B-5726), Lactobacillus acidophilus (B-9012), Lactobacillus paracasei БТ 24/88 (B-6253), Lactobacillus paracasei 139 (B-2430), полученные из Всероссийской коллекции промышленных микроорганизмов (НИЦ «Курчатовский институт» – ГосНИИгенетика).
Для восстановления лиофилизированных культур молочнокислых бактерий применяли питательную среду Man-RogosaSharpe (MRS, стандартная) следующего состава (г/л): гидролизат казеина – 10, пептон – 10, глюкоза – 20, дрожжевой экстракт – 5, калий фосфорнокислый двузамещенный – 2, ацетат натрия – 5, цитрат триаммония – 2, сульфат магния – 0,2, МnSО 4 – 0,05.
Для изучения накопления молочной кислоты исследуемыми штаммами использовали предварительно освобождённую от белка творожную молочную сыворотку, следующего состава (г/л): молочный жир – 1, белок – 0,70, лактоза – 52, минеральные соли – 9, молочная кислота – 6. Для обогащения сыворотки применяли дрожжевой автолизат и раствор микроэлементов по Федорову (г/л): Н 3 ВО 3 – 5,0; Nа 2 МоО 4 ×2Н 2 O – 5,0; МnSО 4 ×4Н 2 O; KI – 0,5; NaBr – 0,5; ZnSО 4 ×7Н 2 O – 0,2 [4]. Дрожжевой автолизат готовили из прессованных дрожжей, добавляя 2 см3 хлороформа и выдерживая 72 часа при температуре 50 °С [7].
В качестве инокулята использовали культуры молочнокислых бактерий, которые выдерживали на жидкой среде MRS в шейкер-культиваторе Multitron (INFORSHT, Швейцария) при температуре 37 °С в течение 12 часов. Инокулят вносили в количестве 2% от объема среды.
Биосинтез молочной кислоты проводили в лабораторных условиях в шейкере-культиваторе при температуре 37 °С в течение 168 часов. Каждые 12 часов проводится отбор проб для контроля рН, измерение проводили при помощи рН-метра рН-150МИ (ООО «Измерительная техника», Россия). Оптимальное значение рН среды (около 6,7) поддерживали добавлением 20% раствора Ca(OH) 2 [6].
Для определения окончания процесса брожения и максимального накопления молочной кислоты ведут контроль за остатком массовой доли лактозы в среде с помощью рефрактометра. Суть данной методики заключается в том, что молочная кислота обладает способность преломления проходящего луча света под определенным углом, с учетом исходной концентрации молочного сахара [3,4].
Содержание молочной кислоты определяли с помощью спектрофотометрического метода, предложенного Л.Н. Борщевской с соавторами [10].
Результаты и обсуждение
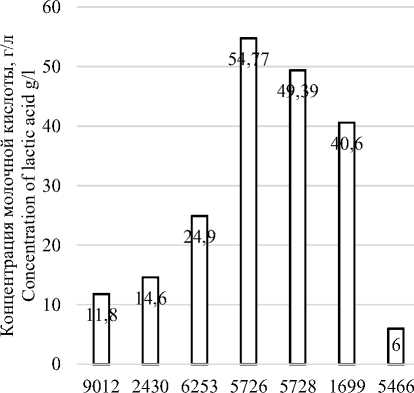
В результате анализа кислотообразующей способности молочнокислых бактерий (рисунок 1) было установлено, что максимальной кислотообразующей способностью обладает штамм Lactobacillus casei C-1 (B-5726). Содержание МК в культуральной жидкости составило 54.77 г./л, что на 54% выше по сравнению с известными в настоящее время продуцентами МК [6, 17]. По способности синтезировать МК из лактозы творожной сыворотки исследуемые штаммы можно расположить в следующей убывающей последовательности: Lactobacillus casei C-1 (B-5726) – 54.77 г./л, Lactobacillus brevis B-78 (B-5728) – 49.39 г./л, Leuconostocmesenteroides-subsp. mesenteroides 122 (B-1699) – 40.60 г./л, Lactobacillus paracasei БТ 24/88 (B-6253) – 24.59 г./л, Lactobacillus paracasei 139 (B-2430) – 14.60 г./л, Lactobacillus acidophilus (B-9012) – 11.80 г./л, Lactobacillus plantarum K-9 (B-5466) – 6.00 г./л.
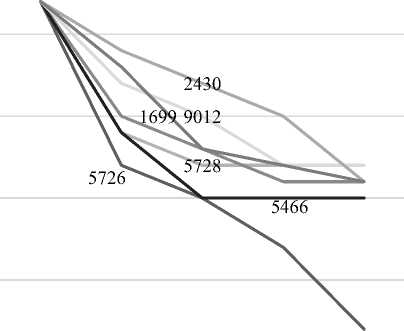
Аналогичные результаты были получены при анализе способности штаммов ферментировать лактозу (рисунок 2). Установлено, что штамм Lactobacillus casei C-1 (B-5726) утилизировал 78% лактозы, содержащейся в молочной сыворотке, что на 20% выше относительно других исследуемых штаммов.
Исследуемые штаммы МКБ LAB strains
Рисунок 1. Концентрация молочной кислоты в культуральной жидкости исследуемых штаммов через 120 часов культивирования
Figure1. The concentration of lactic acid in the culture fluid after 120 hours of cultivation
7,3
6,8
5,3
12345 Продолжительность биосинтеза, сут.
Duration of biosynthesis, days
4,8
Рисунок 2. Кинетика ассимиляции лактозы (%)
культурами исследуемых штаммов
Figure2. Kinetics of lactose assimilation by the culture of the studied strains
Для определения оптимального состава среды для биосинтеза молочной кислоты штаммом Lactobacillus casei C-1 (B-5726) проводили культивирование в течение 72 ч в питательной среде на основе творожной сыворотки с различным содержанием дрожжевого лизата (таблица 1).
Таблица 1.
Определение оптимальной концентрации дрожжевого автолизата в питательной среде для биосинтеза молочной кислоты штаммом
Lactobacillus casei C-1 (B-5726)
Table 1.
Selection of the optimal concentration of yeast autolysate in the nutrient medium for the biosynthesis of lactic acid by the Lactobacillus casei C-1 (B 5726) strain
|
Концентрация дрожжевого автолизата в питательной среде, % The concentration of yeast autolysate in the nutrient medium, % |
Концентрация молочной кислоты через 72 ч культивирования, г/л Lactic acid concentration after 72 hours of cultivation, g/l |
|
1 |
22,2 |
|
2,5 |
24,36 |
|
5 |
27,96 |
|
7,5 |
26,33 |
|
10 |
25,35 |
|
15 |
25,20 |
В ходе эксперимента выявлено, что достичь конечную максимальнуюконцентрацию молочной кислоты можно путем добавления к питательной среде автолизата дрожжей в количестве 5 % от объема среды.
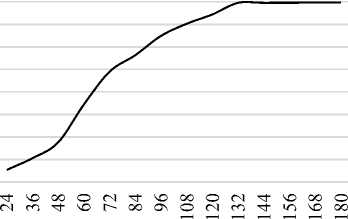
Для определения оптимальной продолжительности биосинтеза МК штаммом Lactobacillus casei C-1 (B-5726) культуру выращивали на стандартной среде (MRS) при температуре 37 °С в течение 7 суток. Количество МК в культуральной жидкости определяли каждые 12 ч (рисунок 3). Установлено, что максимальное количество молочной кислоты продуцент накапливает к 132 ч роста (54.77 г./л). Дальнейшее культивирование не приводило к значительному увеличению концентрации МК, из чего следует вывод о целесообразности ограничения продолжительности культивирования Lactobacillus casei C-1 (B-5726) периодом в 132 ч.

Продолжительность культивирования, ч Duration of biosynthesis, h
Рисунок 3. Кинетика накопления молочной кислоты штаммом Lactobacillus casei C-1 (B-5726)
Figure3. Kinetics of lactic acid accumulation by
Lactobacillus casei C 1 (B 5726) strain
Заключение
Исследование кислотообразующей способности штаммов молочнокислых бактерий показало, что из исследованных штаммов наибольшую способность ферментировать лактозу, синтезируя молочную кислоту, проявил Lactobacillus casei C-1 (B-5726), что коррелирует с данными по ассимиляции культурой лактозы. Подобраны оптимальная продолжительность культивирования (132 ч) и концентрация дрожжевого лизата (5%) в питательной среде на основе творожной сыворотки. При оптимальных параметрах максимальная концентрация молочной кислоты в культуральной жидкости Lactobacillus casei C-1 (B-5726) составила 54.77 г./л, что сопоставимо с используемыми в настоящее время продуцентами при промышленном производстве МК.
Список литературы Подбор оптимальных условий биосинтеза молочной кислоты
- Болотенков М.В. Производство молочной кислоты в мембранном биореакторе. М.: ЦНИИТЭИмясомолпром, 2017. 78 с.
- Государственная фармокопея Российской Федерации, XIV издание; под. редакцией С.Е. Емшанова. Москва: «Медицина», 2018. 2787 с.
- Горбатова К.К., Гунькова П.И. Химия и физика молока. СПБ: ГИОРД, 2012. 336 с.
- ГОСТ 34304-2017 Молоко и молочные продукты. Метод определения лактозы и галактозы (с Поправкой). Москва, Стандартинформ, 2018. 7 с.
- Дуринец А.С. Биологические основы совершенствования культивирования молочнокислых бактерий для разработки высокоэффективной технологии получения молочной кислоты: дис. на соиск. учен. степ. канд. биол. наук: 03.01.06. Москва, 2020. 153 с.
- Залашко М.Н. Биотехнология переработки молочной сыворотки. М.: Агропромиздат, 1990. 192 с.
- Квасников Г.И., Нестеренко О.А. Молочнокислые бактерии и пути их использования. М: Агвопоомиздат, 2015.208 с.
- Пат. № 2000109701, RU, С12Р 7/56. Способ получения молочной кислоты /Исакова Д.М. № 2000109701/13; Заявл. 20.04.2000; Опубл. 20.10.2001.
- Самуйленко А.Я., Еремец В.Е., Гринь С.А., Шинкарев С.М. и др. Промышленные способы биотехнологического получения и выделения молочной кислоты // Вестник технологического университета. 2017. С. 123-126.
- Борщевская Л.Н., Гордеева Т.Л., Калинина А.Н., Синеокий С.П. Спектрофотометрической определение молочной кислоты // Журнал аналитической химии. 2016. С. 787-780.
- Hujanen M., Linko Y.-Y. Effect of temperature and various nitrogen sources on L (+)-lactic acid production by Lactobacillus casei // Appl Microbiol Biotechnol. 1995. P. 307-313.
- Fitzpatrick J.J., Ahrens M., Smith S. Effect of manganese on Lactobacillus casei fermentation to produce lactic acid from whey permeate // Process Biochemistry. 2001. V. 36. №7. P. 671 - 675.
- Rocha-Mendoza D., Kosmerl E., Krentz A., Zhang L. et al. Invited review: Acid whey trends and health benefits // Journal of Dairy Science. 2021. V. 104. №. 2. P. 1262-1275. doi: 10.3168/jds.2020-19038
- Litchfield J.H. Lactic Acid, Microbially Produced//Encyclopedia of Microbiology. 2009. P. 362-372.
- Ago K.-I., Hasegawa S., Azuma M., Takahashi K. Lactic acid fermentation from rice by adopting food wastes as nutrients // Journal of Chemical Engineering of Japan. 2007. V. 40. №2. P. 164 - 167.
- Amrane A., Prigent Y. Lactic acid production from lactose in batch culture: analysis of the data with the help of a mathematical model; relevance for nitrogen source and preculture assessment // Applied Microbiology and Biotechnology. 1994. V. 40. №5. P. 644-649.
- Coelho L.F., Bernardo M.P., de Oliveira P.M. et al. Lactic acid production from renewable resources // Lactic Acid: Production, Properties and Health Effects. 2012. P 47-64.
- Kwon S., Lee P.C., Lee E.G., Keun Chang Y. et al. Production of lactic acid by Lactobacillus rhamnosus with vitamin-supplemented soybean hydrolysate // Enzyme and Microbial Technology. 2000. V. 26. №2. P. 209-215.
- Smithers G.W. Whey-ing up the options - Yesterday, today and tomorrow // Int. Dairy J. 2015. V. 48. P. 2-14. doi: 10.1016/i.idairyj .2015.01.011 "
- Gharwalová L., Paulová L., Patakova P., Branská B. et al. Use of wheat straw and chicken feather hydrolysates as a complete medium for lactic acid production // Czech Journal of Food Sciences. 2018. V. 36. №. 2. P. 146-153. doi: 10.17221/461/2017-CJFS


