Подход к терапии болезни Альцгеймера с помощью индукции антител, направленных к 7-субъединице ацетилхолинового рецептора
Автор: Камынина А.В., Шал Гунов В.С., Вол Кова Т.Д., Короев Д.О., Обозная М.Б., Медвинская Н.И., Самохин А.Н., Бобкова Н.В., Вольпина О.М.
Журнал: Труды Московского физико-технического института @trudy-mipt
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.1, 2009 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/142185569
IDR: 142185569
Текст статьи Подход к терапии болезни Альцгеймера с помощью индукции антител, направленных к 7-субъединице ацетилхолинового рецептора
Болезнь Альцгеймера (БА) является одной из самых распространенных причин деменции в пожилом и старческом возрасте [1]. Это заболевание сопровождается массовой гибелью нейронов в основном в коре и гиппокампе больных [2]. Существующие на сегодняшний день основные методы лечения БА обладают симптоматическим эффектом [3]. Поэтому актуальна разработка новых подходов к радикальной терапии БА. Показано, что главную роль в механизме гибели нейронов при БА играют пептиды β-амилоидного ряда, в частности, β-амилоид (1–42) [4–7]. При БА отмечается поражение холинэргической системы, а именно: наблюдается уменьшение количества α7-субъединицы ацетилхолинового рецептора (АХР) на поверхности нейрональных клеток в разных отделах головного мозга [8]. Один из предполагаемых механизмов развития заболевания за- ключается в том, что β-амилоид (1–42) с высокой аффинностью связывается с α7-субъединицей АХР и проникает внутрь нейрона, приводя к лизису клетки и к формированию на её месте амилоидной бляшки [9–11]. Ранее мы предположили, что антитела к α7-субъединице АХР могут препятствовать связыванию β-амилоида с рецептором и, таким образом, предохранять нейроны от гибели [12]. В соответствии с этим предположением была проведена иммунизация животных, при которой в качестве иммуногенов были использованы белковые конъюгаты синтетических фрагментов α7-субъединицы АХР, вызывающие выработку специфичных к данному рецептору антител. Моделью спорадической формы БА были выбраны бульбэкто-мированные (БЭ) мыши линии NMRI, развивающие в отдаленные сроки после удаления обонятельных луковиц поведенческие, морфологические и биохимические признаки нейродегенеративного процесса альцгеймеровского типа, включая потерю пространственной памяти, снижение обучаемости и повышенный уровень мозгового в-амилоида [13-15]. Исследования, проведённые на БЭ мышах, подтвердили гипотезу о протективном действии иммунизации мышей пептидами, конъюгированными с гемоцианином улитки (KLH), на состояние пространственной памяти животных в модели БА. Результаты проведённых исследований показали, что среди БЭ мышей, иммунизированных KLH-конъюгатом фрагмента 1-23 (I) а 7-субъединицы, обучились 20% животных, а среди БЭ мышей, иммунизированных KLH-конъюгатом пептида (159–168)-(179–188) (II), — 50% животных. При этом у контрольных ложнооперированных мышей (ЛО), проходивших все те же манипуляции, что и БЭ, но без удаления обонятельных луковиц, наблюдалось снижение обучаемости живот- ных при иммунизации обоими пептидами. В случае иммунизации конъюгатом пептида II негативный эффект на ЛО мышах был ниже, чем в случае иммунизации пептидом I.
Полученные результаты оставляли открытым ответ на вопрос о роли антител к фрагментам а 7 -субъединицы АХР в индукции протективного иммунитета, поэтому актуальным представлялось более детальное изучение механизмов воздействия иммунизации фрагментами а 7 -субъединицы на состояние пространственной памяти БЭ мышей. Принципиальным был также поиск новых пептидов, способных в свободном виде, без конъюгации с KLH, индуцировать иммунный ответ и оказывать более интенсивное терапевтическое действие на мышей в модели БА без снижения памяти у контрольных ЛО животных.
Таблица 1
Результаты тестирования пространственной памяти и титры антител в сыворотках крови и спинномозговой жидкости иммунизированных БЭ мышей
|
Иммуноген |
Соотношение числа обученных мышей к числу необученых (%) |
Титр противопеп-тидных антител ( - lg ) в сыворотке крови |
Титр противопептид-ных антител ( - lg ) в спинномозговой жидкости |
|
(I)-KLH |
3/15(20) |
5,1–5,7 |
1,6–3,4 |
|
(II)-KLH |
8/16(50) |
5,1–5,7 |
2,2–3,4 |
|
Контроль (KLH) |
0/5(0) |
< 1 , 0 |
< 1 , 0 |
Приведён диапазон титров антител, определённых индивидуально для каждого из животных в группе
-
II. Результаты и обсуждение
Поскольку иммунизация KLH-конъюгатами пептидов I и II оказывала про-тективное действие на память БЭ мышей, представляет интерес более подробное изучение роли антител в этом процессе. Согласно нашему предположению, мишенью для выработанных противопептидных антител является АХР а7-типа, интегрированный в мембраны нейронов мозга. В связи с этим для доказательства участия антител в оказании протективного эффекта на память БЭ мышей нам было важно показать, что противопептидные антитела проходят гематоэнцефалический барьер. Для этих целей на первом этапе исследований выделяли спинномозговую жидкость у БЭ мышей, иммунизированных KLH-конъюгатами пептидов I и II. Далее проводили анализ спинномозговой жидкости животных на содержание проти-вопептидных антител. В результате таких исследований было выявлено наличие антител в спинномозговых жидкостях в обеих группах БЭ мышей (табл. 1). В первой группе животных, иммунизированных конъюгатом пептида I, титр антител находился в пределах от 1,6 до 3,4. Во второй группе, иммунизированной KLH-конъюгатом пептида II, значения титров колебались от 2,2 до 3,4. При этом иммунизация конъюгатами обоих пептидов индуцировала высокий иммунный ответ (титры в сыворотках крови 5,1-5,7) и оказывала протективное действие на состояние пространственной памяти у БЭ мышей. В контрольной группе, иммунизированной KLH, противопептидные антитела в спинномозговой жидкости отсутствовали.
Таким образом, показано, что проти-вопептидные антитела проходят гематоэнцефалический барьер. Это даёт основание предполагать, что именно иммунизация пептидными фрагментами приводит к улучшению пространственной памяти у части БЭ мышей. Но при этом обучаемость в двух группах БЭ мышей различается, что даёт основание полагать, что терапевтическое действие антител зависит от того, к какому участку а 7 -субъединицы АХР направлены антитела. Возможно, иммунизация конъюгатом пептида II оказывала наибольший протек-тивный эффект из-за близкого расположения этого участка к сайту связывания с ацетилхолином [16].
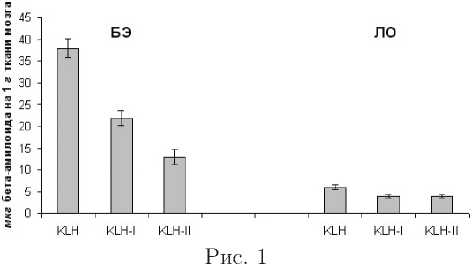
Одним из признаков развития БА является повышение содержания в-амилоида в мозгу больных [3]. Поэтому на следующем этапе мы исследовали влияние иммунизации конъюгатами пептидов на уровень в -амилоида в индивидуальных образцах мозга животных. В контрольной группе БЭ мышей, иммунизированных KLH, уровень в-амилоида в среднем составляет (38 ± 2,1) мкг на 1 г ткани мозга и не отличается от результатов, полученных на неиммунизированных БЭ мышах (рис. 1). Было показано, что в группе БЭ мышей, иммунизированных KLH-конъюгатом фрагмента I, уровень в -амилоида снизился до (22 ± 1,75) мкг на 1 г ткани, в то же время во второй группе, иммунизированной конъюгатом пептида II, — до 13 ± 1,76 мкг на 1 г ткани мозга. Исследование тканей мозга контрольных ЛО животных показало, что иммунизация KLH-конъюгатами обоих пептидов не приводит к изменениям в содержании в-амилоида в мозговых тканях — уровень в -амилоида находится в пределах нормы (4-6 мкг/г ткани) (рис. 1). В результате таких исследований была выявлена корреляция между обучаемостью БЭ животных, иммунизированных KLH-конъюгатами пептидов I и II, и содержанием в -амилоида в мозговой ткани. В группе мышей, иммунизированных конъюгатом пептида II, был наибольший процент обучившихся (50%) животных и наименьший уровень в -амилоида в мозгу. Таким образом, показано, что в результате иммунизации конъюгатом пептида II, оказывающей большее терапевтическое действие, наблюдается наиболее значительное снижение уровня в -амилоида в мозгу животных.
Мы предположили, что негативное влияние иммунизации конъюгатами пептидов на состояние памяти контрольных ЛО мышей происходит из-за стимуляции очень высокого уровня противопептидных антител, направленных к эндогенному белку ( а 7 -субъединица) [12]. Поэтому была предпринята попытка понизить титры противо-пептидных антител, отказавшись от конъюгации с гемоцианином улитки, но сохранив при этом иммуногенные и протек-тивные свойства пептидов. Более выраженное терапевтическое действие иммунизации конъюгатом пептида II по сравнению с иммунизацией конъюгатом пептида I означало, что возможна оптимизация структуры пептидов и целесообразен их выбор в районе связывания ацетилхолина с рецептором (171–193). Поэтому помимо двух уже рассмотренных пептидов 1–23 (I) и (159–168) –(179–188) (II) были выбраны ещё два пептида, являющихся фрагментами 173–188 (III) и 173–193 (IV) а 7 -субъединицы АХР и содержащих теоретически рассчитанные Т-хелперные эпитопы [17] (табл. 2). Пептид IV содержит два цистеина С190 и С191 и включает ацетилхолин, связывающий сайт. Были проведены исследования по изучению способности пептидов в свободном виде индуцировать иммунный ответ у мышей линии NMRI (табл. 3). Было показано, что пептиды I и IV в свободном виде индуцировали иммунный ответ у мышей, в то время как пептиды II и III — нет. В связи с этим дальнейшие работы по изучению влияния иммунизации на память БЭ мышей были проведены с пептидами I и IV.
В результате таких исследований было показано, что в группе БЭ мышей, иммунизированных пептидом I в свободном виде, ни одно животное не обучилось, в то время как во второй группе, иммунизированной пептидом IV, 82% мышей (9 из 11) демонстрировали наличие пространственной памяти. В случае иммунизации ЛО мышей пептидом IV негативное влияние на память контрольных животных отсутствовало: все мыши в группе демонстрировали наличие пространственной памяти (табл. 2). В настоящее время ведутся работы, направленные на исследование способности антител к пептиду IV проходить гематоэнцефалический барьер и на изучение влияния иммунизации этим фрагментом на уровень в -амилоида в тканях мозга БЭ мышей.
Проведённые исследования показывают принципиальную возможность ис- пользования иммунизации фрагментами а 7-субъединицы для коррекции памяти при БА. При этом показано, что иммунизация фрагментами а 7-субъединицы АХР, конъюгированными с гемоцианином улитки, приводит к выработке антител, которые проходят гематоэнцефалический барьер, и снижению уровня в-амилоида в мозгу мышей в экспериментальной модели БА. Наибольшую терапевтическую активность проявил пептид 173–193 (IV), иммунизация которым оказывала выраженное протективное действие на память животных в экспериментальной модели БА при отсутствии негативного влияния на память контрольных ЛО мышей. На основе пептида IV представляется перспективным создание иммунотерапевтического препарата для профилактики и лечения болезни Альцгеймера.
Таблица 2
Аминокислотные последовательности пептидов
|
I, II, III и IV |
|
|
Название пептида |
Аминокислотная последовательность |
|
I (1–23) |
GEFQ RKLYKELVKNY NPLERPVA |
|
II (159–168)-(179-188) |
QMQEADISG Y-IPGKRSER FY |
|
III (173–188) |
E WDLVGIPGK RSERFY |
|
IV (173–193) |
E WDLVGIPGK RSERFYECCKE |
Выделены участки, являющиеся расчётными Т-хелперными эпитопами
Таблица 3
Результаты тестирования пространственной памяти и титры антител в сыворотках крови и спинномозговой жидкости БЭ и ЛО животных после иммунизации свободными пептидами
|
Иммуноген |
% обученных БЭ мышей |
% обученных ЛО мышей |
Титр противопептидных антител ( - lg ) в сыворотке крови |
|
I |
0 |
100 |
2,2–3,7 |
|
II |
н. о. |
н. о. |
< 1 , 6 |
|
III |
н. о. |
н. о. |
< 1 , 6 |
|
IV |
82 |
100 |
2,2–4,8 |
|
Контроль (PBS) |
100 |
100 |
< 1 , 0 |
Н. о. — не определяли. Приведён диапазон титров антител, определённых индивидуально для каждого из животных в группе.
-
III. Экспериментальная часть
В работе использовали реактивы и производные аминокислот (Merck, ФРГ; Fluka, Швейцария). В иммунологических исследованиях использовали раствор KLH в PBS в концентрации 5 , 3 мг / мл (Sigma,
CША), 25% водный раствор глутарового альдегида (Sigma, CША), полный адъювант Фрейнда (ПАФ), неполный адъювант Фрейнда (НАФ), козьи антитела против иммуноглобулинов мышей, конъюгированные с пероксидазой хрена
(Sigma, США), 96-луночные планшеты Maxisorp (Nunc, Дания) для иммунофер-ментного анализа. Для иммунизации использовали 2-месячных мышей самцов линии NMRI.
-
IV. Твердофазный синтез пептидов
Пептиды I, II, III и IV синтезировали твердофазным методом на пара-алкоксибензильном полимере как описано в [18].
Схема опыта:
-
1-й день — первая иммунизация;
28-й день — операция бульэктомирова-ния;
35-й день — вторая иммунизация;
45-й день — забор крови;
45–50-е дни — обучение;
50-й день — тестирование.
-
V. Иммунизация животных
Мыши были иммунизированы дважды. Первую иммунизацию проводили в ПАФ, вторую — в НАФ. Растворы пептидов в концентрации 1 мг / мл в PBS ( 0 , 15 М раствор NaCl в 0 , 01 М растворе Na 2 HPO 4 (pH7,4)) смешивали с равным объёмом адъюванта до получения эмульсии. Эмульсию вводили подкожно в основании хвоста в объёме 0 , 2 мл из расчёта 100 мкг пептида на одну мышь.
-
VI. Получение сывороток и спинномозговой жидкости и определение титра противопептидных антител
Кровь и спинно-мозговую жидкость отбирали после тотального забоя мышей. Для этих целей мышь сначала усыпляли хлороформом, затем вскрывали грудную клетку и шприцем отбирали кровь из правого желудочка. Далее проводили перфузию сердца 10 мл физ. раствора. Из спинно-мозгового канала в шейном отделе позвоночника мыши отобрали спинно-мозговую жидкость. Сыворотку крови готовили из индивидуально отобранной крови мышей. Титры противопептидных антител определяли с помощью твердофазного иммуноферментного анализа, как описано в работе [12].
Операция бульбэктомирования и тест на пространственную память животных проводили, как описано в работе [12].
-
VII. Определение уровня β -амилоида в мозгу животных
Выделение и очистку в -амилоида из ткани мозга БЭ и ЛО мышей проводили, как описано в работе [13]. Уровень бета-амилоида определялся в экстрактах мозга всех групп экспериментальных животных с помощью DOT-анализа и использованием специфических моноклональных антител к бета-амилоиду 4G8 [13].
Работа выполнена при финансовой поддержке гранта РФФИ (№ 06-04-48710-а) и программ РАН «Молекулярная и клеточная биология» и «Фундаментальные науки в медицине».


