Подходы к оценке определения опасности диоксинов
Автор: Гумерова Гузель Ильдаровна, Гоголь Эллина Владимировна, Егорова Ольга Сергеевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 5-3 т.18, 2016 года.
Бесплатный доступ
Рассмотрен метод биотестирования для оценки безопасности диоксиноподобных соединений. Описан процесс трансформации диоксинов в живых системах до более токсичных метаболитов. Выявлены ферменты, участвующие в детоксикации диоксинов. Получены модельные растворы диоксинов, имитирующие образование их в объектах окружающей среды. Экспериментально доказана неинформативность биотестирования для определения опасности диоксинов.
Диоксины, биотестирование, цитохром р450, опасность для окружающей природной среды, диоксиновый эквивалент, коэффициент токсичности
Короткий адрес: https://sciup.org/148204938
IDR: 148204938 | УДК: 57.084.1
Текст научной статьи Подходы к оценке определения опасности диоксинов
Диоксины – это собирательный термин для галогенированных шестичленных ароматических углеводородов, содержащие в своем составе два атома кислорода.
Диоксины являются побочными продуктами производственных процессов (пиролиза, отбеливания целлюлозы и пр.) химической, нефтехимической и металлургической промышленностей, образуются при горении полимеров (бытовых и медицинских отходов, древесины). Диоксины присутствуют в природной среде в виде сложных смесей, каждый из компонентов которых имеет разную токсичность, в связи с чем в пробах реальных объектов природной среды сложно определить их общую токсичность и оценить экологическую опасность смеси [1]. Рассеивание в атмосфере способствует трансграничному переносу диоксинов, поэтому их распространение в природной среде носит глобальный характер: диоксины обнаруживаются во всем мире в пробах почв, донных отложений, продуктах питания, воды и воздуха [2].
Ившин с соавт. [1] предположили, что образование ПХДД/ПХДФ возможно из ароматических соединений – прекурсоров – в присутствии хлора и катализаторов – переходных металлов. В качестве прекурсоров могут выступать такие ароматические соединения, как фенолы, хлорфенолы и хлорбензолы. Хлорид меди (II) может ускорять превращение ароматических прекурсоров в их хлорированные формы, а затем в диоксины и дибензофураны [3].
Находящиеся в воде гуминовые и фульво-кислоты являются естественными источниками фенольных веществ, которые по вышеуказанному механизму могут преобразовываться в соединения диоксинового ряда (рис. 2).
Все соединения диоксинового ряда характеризуются высокой температурой плавления (> 800 °С), низкой растворимостью в воде (0,2 мкг/л) и хорошей растворимостью в неполярных растворителях, устойчивостью к агрессивным средам и окислителям в отсутствии катализаторов, высокой способностью к адгезии к любым поверхностям. Их накопление или адсорбция происходит в донных отложениях, взвешенных твердых частицах, золе, саже и жировых тканях организма. Эти свойства важны для прогнозирования образования диоксинов в ряде производственных процессов и выбора метода аналитической диагностики [4]. Для выбора методов контроля содержания диоксинов важными являются не только физико-химические свойства этих соединений, но и понимание механизма их влияния на живые системы.
В Российской практике в рамках экологического нормирования широко используются санитарно-гигиенические показатели для оценки токсичности объектов природной среды, которые основываются на определении концентраций нормируемых компонентов и сопоставления их с предельно допустимыми значениями. Но данный подход не позволяет оценить степень биологической опасности для живых организмов. В связи с этим проводится биотестирование на тест – организмах для характеристики и оценки токсического эффекта.
С помощью биотестирования возможно определить токсическое действие некоторых веществ для которых не установлены предельно допустимые концентрации, а следовательно и опасность. Метод позволяет определить интегральную токсичность, обусловленную совокупностью всех присутствующих в пробе опасных токсических веществ и их метаболитов.
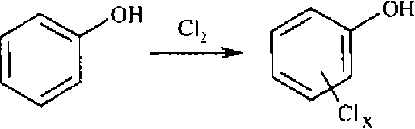
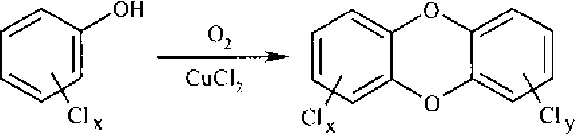
Рис. 2. Образование диоксиноподобных ксенобиотиков из фенола в качестве прекурсора
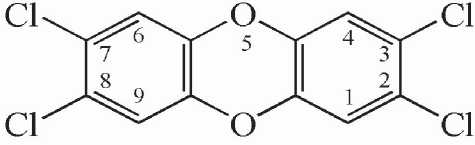
2,3,7,8-тетрахлордибензо-п-диоксин
Cl
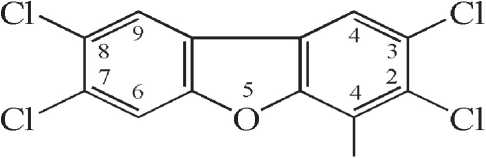
2,3,4,7,8-пентахлордибензофуран
3,3',4,4',5-пентахлорбифенил
Рис. 1. Наиболее опасные представители класса диоксинов
Конечной целью биотестов является оценка безопасности исследуемого объекта и на основании полученных результатов прогнозирование реакции организма человека или животных. Сложность при таком подходе к оценке безопасности заключается в получении прогноза с достаточным уровнем достоверности, так как любые биологические модели имеют разную степень приближения к организму, который моделируют. А следовательно, и разную реакцию на продукты метаболизма этих веществ внутри клетки.
В отношении диоксинов применение биотестирования вызвано тем, что физико-химические методы анализа могут оказаться неэффективными из-за недостаточной чувствительности, отсутствия методик на определение некоторых конгенеров и ультранизких концентраций. Тогда как живые организмы способны воспринимать более низкие концентрации веществ, чем любой аналитический датчик. Т.е. они могут быть подвержены токсическим воздействиям, не регистрируемым техническими средствами [5].
Считается, что опасность представляют только 17 хлор- и бромпроизводных конгенеров ПХДД и ПХДФ, обладающих диоксиноподобной активностью, т.е. особо токсичных для окружающей среды. Согласно стандартам ВОЗ токсичность каждого соединения ряда диоксинов определяется фактором токсической эквивалентности (ФТЭ)
по отношению к наиболее токсичной форме (2,3,7,8-ТХДД) и называется диоксиновым эквивалентом (ДЭ) размерностью нг/кг [6].
ДЭ=У(ТХДДi* ФТЭi)+ У(ТХДФi* ФТЭi)+ У(ПХБi* ФТЭi)
Факторы токсической эквивалентности основаны на величинах острой токсичности, полученных в исследованиях in vivo и in vitro. Однако метод с применением ФТЭ имеет свои ограничения. Молекулярная организация живого чрезвычайно сложна. Теоретически любая молекула организма может стать мишенью для воздействия диоксинов. Однако, поскольку значение ФТЭ для разных когенеров неодинаково, то и последствия этого воздействия различны.
Отсутствие острой токсичности некоторых соединений диоксинового ряда не говорит об отсутствии опасности их воздействия на живые организмы. Воздействие когенеров с низким фактором токсической эквивалентности или микродоз когенеров, проявляющих, либо не проявляющих острою токсичность, может быть опасным. Опасность может заключаться в их накоплении и образовании онкологических заболеваний и генных изменений.
К тому же, попадая в живые системы, диоксины вступают в метаболизм и подвергаются биохимической трансформации под действием ферментов ряда цитохромов Р450 [7]. Ферментная система цитохромов Р450 обнаруживается во всех организмах, начиная от бактерий, и характеризуется высокой каталитической активностью и способностью к окислению почти всех классов сложных органических ксенобиотиков [9]. Митохондриальные цитохромы Р450 играют важнейшую роль в определении интенсивности и времени действия чужеродных соединений и ключевую - в детоксикации ксенобиотиков, а также в активации их до токсичных и/или канцерогенных метаболитов [9].
С физиологической точки зрения это процесс направлен на защиту живых систем от накопления в них подобных соединений и является важней- шей составляющей адаптивного ответа на чужеродные соединения, попадающие в клетку, усиления детоксификационной функции организма и выведения ксенобиотика [10]. Однако, в случае диоксинов, побочными продуктами метаболизма являются фенольные соединения, которые могут привести к гораздо большим токсическим эффектам, чем нативные когенеры. Причем острый токсический эффект от продуктов метаболизма диоксинов у всех организмов будет разным. Это зависит от активности фермента фенолоксидазы, способной разлагать фенольные соединения и выводить их из организма. Поэтому об опасности диоксиноподобных соединений в отношении живых систем можно судить по активации именно изоформы фермента цитохром Р4501А1.
-
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
-
2.1. Материалы и реагенты
-
В качестве объектов исследования были выбраны модельные пробы, имитирующие фоновое содержание фенола в Куйбышевском водохранилище, которые готовились из дистиллированной воды, нитрата меди и фенола.
При определении концентрации фенола использовали стандартные образцы состава водного и спиртового растворов фенола (с погрешностью не более 1 %), фенол кристаллический, натрий гидроокись, спирт этиловый ректифицированный технический, калий хлористый или, двузамещенного, содержащем для постоянства ионной силы 0,1 М Na2SO4.
Измерения проводили с помощью комплекса аналитического вольтамперометрического СТА-1 сопряженного с IBМ-совместимым компьютером.
При имитации образовании диоксинов были использованы растворы NaCl, NaОCl (свежеприготовленный), хлориды Fe3+, Cu2+.
Биотестирование проводили на инфузориях-туфельках Paramecium caudatum и дафниях Ceriodaphnia affi nis .
Качественная реакция на содержание диоксиновых соединений в модельном растворе производилась индикаторами на основе азотистых соединений.
Растворы диоксинов заданной концентрации, использованные для сравнительного анализа при определении концентрации модельных проб, изготавливались из аттестованных стандартных образцов растворов ПХДД в толуоле.
В исследованиях биохимического разложения диоксинов использовали изоформы ферментов цитохром Р4501А1.
-
2.2. Моделирование образования диоксинов в процессе хлорирования воды, содержащей фенольные соединения
-
2.3. Определение острой токсичности модельных проб воды, содержащих фенол и диоксины, методом биотестирования
-
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Исходя из того, что фенол является прекурсором образования диоксинов, на первом этапе эксперимента были подготовлены 3 модельные пробы (см. таблицу проб):
Буферный раствор готовили на основе дистиллированной воды из натрия фосфорнокислого
Желтое окрашивание при добавлении индикатора на основе азотистых соединений в пробы № 2 и № 3 подтвердило образование диоксиноподобных соединений из прекурсора – фенола. В пробе № 1 цветовой реакции не наблюдалось.
Острое токсическое действие исследуемой воды определяли по смертности (летальности) тест-объектов за определенный период экспозиции. Критерием острой токсичности являлось гибель 50% и более цериодафний и инфузорий за 48 часов в исследуемой воде при условии, что в контрольной пробе, не содержащей фенольных соединений, гибель не превышает 10%. Биотестирование и определение критерия токсичности проводили в соответствии с [11-14].
Разведение модельных проб № 1, № 2 и № 3 проводилось согласно табл.1. Для каждой серии растворов дополнительно готовились контрольные пробы с культивационной водой.
Несмотря на наличие множества производств, побочным продуктом которых являются диоксины, они так же могут неконтролируемо образовываться в объектах окружающей среды при определенных условиях. Прежде всего, это касается водоемов, подверженных загрязнению сточных промышленных вод. Процесс реализуется при температуре от 20 °С, воздействие УФ излучения ускоряет образование диоксинов, так как оно усиливает реакционную способность хлора. Это явление хорошо известно в России, где хлорирование является стандартной процедурой водоподготовки и обеззараживания питьевой воды, а контроль содержания хлорфенолов является необязательной процедурой. Косвенно это явление нашло отражение в российских стандартах качества питьевой воды. В них допустимая концентрация фенола в нехлорируемой воде составляет 0,1 мг/л, а в хлорируемой – 0,001 мг/л [15].
При поступлении в организм в дозах, не превышающих допустимых суточных, принятых во многих странах, диоксины не обладают острой токсичностью. Накапливаясь в жировых тканях, они могут приводить к отдаленным последствиям – концерогенезу и мутагенезу. Доказательством этому служат результаты биотестирования подготовленных модельных проб, которое проводилось для подтверждения отсутствия острой токсичности диоксиноподобных соединений и невозможность их определения скрининг – анализом на живых системах (таблица 2).
Для проявления токсического эффекта на живой организм диоксинам требуется активация с образованием электрофильной формы, которая в результате выдает молекулу, способную необратимо реагировать с нуклеофилами живой ткани. Такая биохимическая активация катализируется изоформой фермента цитохром Р4501А1.
Все цитохромы Р450 - гемсодержащие белки. Обычно гемовое железо находится в окисленном состоянии (Fe3+). Механизм монооксигеназных
Таблица 1 . Кратность разведения водной вытяжки в зависимости от класса опасности
|
Класс опасности отхода |
Кратность разведения водной вытяжки, при которой вредное воздействие на гидробионтов отсутствует |
|
I |
>10000 |
|
II |
От 10000 до 1001 |
|
III |
От 1000 до 101 |
|
IV |
<100 |
|
V |
1 |
Таблица 2. Результаты биотестирования модельных проб №№ 2 и 3
Монооксигеназная реакция, которую катализируют цитохромы Р450 является основной, в которой один атом кислорода взаимодействует с субстратом (ArH), а другой восстанавливается до НО-. В качестве восстановителя в реакции (1) участвует НАДФН:
ArH (диоксин)+О 2 + НАДФН + H+ ^ ^ ArOH (фенол) + Н 2 О + НАДФ + (1)
Механизм, благодаря которому цитохром получает электрон от НАДФH, зависит от внутриклеточной локализации цитохрома Р450 [17].
Согласно [18], диоксин прочно связывается со специальным белком, названным арилуглеводородным рецептором (Ah-R), который имеют многие клетки организма. Далее этот комплекс проникает в ядро клетки, активирует специальные гены. В результате в клетках в избыточном количестве нарастает содержание изоформы фермента цитохром Р4501А1. Чрезмерное увеличение содержания этого белка ускоряет окисление важных для жизнедеятельности клетки молекул, что и приводит к нарушению многих биологических процессов и, кроме того, способствует увеличению токсичности других химических соединений, поступающих в организм. Суть работы цитохрома Р450 состоит в том, что он связывает О2 и восстанавливает его в некий эквивалент активных форм кислорода. Именно в таком активированном состоянии фермент окисляет связанный субстрат [19]. Основным путем метаболизма диоксиноподобных ксенобиотиков у млекопитающих изоформой цитохрома Р4501А1, является их дегалогени- рование, расщепление цикла и образование гидроксипроизводных - фенольных метаболитов [20, 21], токсическое действие которых так же подтверждалось методом биотестирования (табл. 3).
Результаты биотестирования показали, что для ксенобиотиков типа диоксина острая токсичность не является критерием опасности, поэтому данный метод контроля для ксенобиотиков, которые не обладают острой токсичностью, а являются канцерогенами и мутагенами, может быть не информативен. Главная опасность, исходящая от соединений такого типа, заключается в их отдаленных последствиях, и их пагубное воздействие происходит только при попадании в организм и вступлении в метаболизм под действием ферментов.
ВЫВОДЫ
При оценке токсичности на основе биотестирования проб воды, содержащих диоксины, их опасность при расчете диоксинового эквивалента занижается, поскольку не учитываются особенности метаболизма диоксинов в живых организмах. Система определения коэффициента токсичности не включает в себя возможности дальнейших превращений диоксинов, происходящих посредством действия ферментов непосредственно в клетках, когда менее токсичные соединения могут превращаться в более токсичные с точки зрения канцерогенности и мутагенности. Не учитывается также тот факт, что диоксины, наряду с прямым действием, обладают также синергическим, усиливая токсическое действие других веществ. К тому же нельзя исключить вероятность того, что при практических исследованиях могут встретиться задачи, которые потребуют учета токсического вклада других, не учтенных пока факторов.
Т.о. при определении опасности ксенобиотиков для живых организмов следует отходить от определения острой токсичности и ориентироваться на процессы, запускаемые ферментными системами при попадании внутрь клетки живых организмов.
Таблица 3. Результаты биотестирования модельной пробы № 1
|
Вид контролируемого объекта |
Наименование тест -объекта, методика |
Вид опыта (острый, хронический) |
Показатель токсичности |
Класс опасности |
|
Проба № 1 |
Paramecium caudatum ПНД ФТ 14.1:2:3.13-06 Ceriodaphnia affinis ФР.1.39.2007.03221 |
Острый Острый |
Токсично, Кр (Ю) =6000 Кр (50) =5000 Токсично, Кр (Ю) =5000 Кр., . 2000 |
2 (высокоопасный) |
Список литературы Подходы к оценке определения опасности диоксинов
- Ившин В.П. Диоксины и диоксиноподобные соединения: пути образования, свойства, способы деструкции. Марий Эл: Изд-во Марийского государственного университета, 2005.-320 с.
- Neubert D. Reflections on the assessment of the toxicity of dioxins for humans, using data from experimental and epidemiological studies//Teratogenesis, Carcinogenesis, and Mutagenesis. 1997. Vol.17. №4-5. Р. 157 -215
- Экспресс-анализ в экохимии/Ю.А. Тунакова, Г.И. Гумерова, М.Н. Исхакова, Д.А Богданова//Научный журнал «Вестник Казанского технологического университета». 2013. Т.16. № 1. С. 163-167
- Alcock R.E., Jones K.C. Dioxins in the Environment: A review of Trend Data//Environmental Sciense and Technology. 1996. Vol. 30. №11. -Р.3133 -3143
- Розанцев, Э.Г., Черемных Е.Г. Биотестирование или биологическая оценка безопасности//Экология и промышленность России. -2003. -№ 10. -С. 44-46
- Safe S. Polychlorinated biphenyls (PCBs), dibenzo-p-dioxins (PCDDs), dibenzofurans (PCDFs), and related compounds: Environmental and mechanistic considerations which support the development of toxic equivalency factors (TEFs)//CRC Crit. Rev. Toxicol.1990. № 21.-Р. 51-88
- Гумерова Г.И., Галиева А.Т., Гоголь Э.В. Методика определения диоксиноподобных токсикантов///Вестник КГТУ им. А.Н. Туполева. 2013. № 1. С. 125-130
- Guengerich, F. P. Human cytochrome P450 enzymes. in Cytochrome P450: Structure, Mechanism, and Biochemistry/P. R. Ortiz de Montellano//Kluwer Academic/Plenum Press, New York. 2005.-Р. 377-530
- Nelson D.R. P450 superfamily: update on new sequences, gene mapping, accession numbers, and nomenclature/L. Koymans, T. Kamataki, J. J. Stegeman, R. Feyereisen, D. J. Waxman, M. R. Waterman, O. Gotoh, M. J. Coon, R.W. Estabrook, I. C. Gunsalus, D.W. Nebert//Pharmacogenetics. 1996. V.6. Р. 1-42
- Микросомная монооксигеназная система живых организмов в биомониторинге окружающей среды. Аналитический обзор./Л.Ф. Гуляева, А.Ю. Гришанова и др.//Экология. Серия аналитических обзоров мировой литературы. 1994. № 32. С. 1-85.
- Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости цериодафний. ФР. 1.39.2007.03221.-М.: Акварос, 2007.-56 с.
- Методика определения острой токсичности питьевых, пресных природных и сточных вод, водных вытяжек из почв, осадков сточных вод и отходов по смертности дафний (Daphnia magna straus). ПНД Ф Т 14.1:2:4.12-06; Т 16.1:2.3:3.9-06.-М. 2006.-45 с.
- Временная инструкция по подготовке проб при определении экспериментальным методом класса опасности отходов для окружающей природной среды № 247 от 25.03.2002
- Критерии отнесения опасных отходов к классам опасности для окружающей природной среды. Приказ № 511 от 15.06.2001
- Милош В.В. Диоксины и их потенциальная опасность в экосистеме «человек -окружающая среда» . URL: http://crowngold.narod.ru/articles/dioxini.htm (дата обращения 10.11.2015).
- Guengerich F.P., Munro A.W. Unusual cytochrome P450 enzymes and reactions//J. Biol. Chem. 2013. № 288.-Р. 17065-17073.
- Reactive intermediates in cytochrome P450 catalysis/Krest, C. M. E. L. Onderko, T. H. Yosca, J. C. Calixto, R. F. Karp, J. Livada, J. Rittle, M. T. Green//J. Biol. Chem. 2013. № 288. Р. 17074-17081
- Сибиряк, С.В. Влияние диоксинов на здоровье человека. Челябинск. 2005. 28 с.
- Шкроб, А.М. Журнальная версия «Молекулы лечат»//«ХиЖ -XXI». 1998. № 1-3
- Голиков, С.Н. Саноцкий И.В., Тиунов Л.А. Общие механизмы токсического действия. Л.: Медицина, 1986. 286 с.
- Claassen, C.D. Toxicology. The basic Science of poisons//New York, Chicago, Toronto, London. Sixth Edition. 2001.-Р. 1236


