Подращивание молоди рака Cherax quadricarinatus (Von Martens, 1868) с применением кормов для осетровых видов рыб
Автор: Шумейко Д.В., Арыстангалиева В.А., Еврумова А.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Аквакультура
Статья в выпуске: 4 т.57, 2022 года.
Бесплатный доступ
Культивирование австралийского красноклешневого рака Cherax quadricarinatus (Von Martens, 1868) еще недостаточно отработано и распространяется в странах с умеренным и субтропическим климатом, где выращивание начинается в контролируемых условиях. В России технологии выращивания C. quadricarinatus находятся на стадии разработки и показатели биопродукции намного скромнее. Молодь рака более требовательна к кормам, для ее быстрого роста необходимо содержание в них белка не менее 30-50 %. Стартовые корма для осетровых видов рыб имеют соответствующие показатели, что открывает перспективы их применения в раководстве. В настоящей работе впервые установлены нормы кормления, скорость роста, выживаемость и гематологические показатели молоди рака при использовании специализированных кормов для осетровых видов рыб с содержанием белка 46 %. Цель исследования - изучить эффективность применения комбикормов для осетровых видов рыб и их влияние на показатели гемолимфы при выращивании молоди австралийского красноклешневого рака. Эксперимент проводили на базе бизнес-инкубатора Кубанского государственного университета с 21 июля по 22 августа 2019 года. Использовали многоярусную установку замкнутого водоснабжения. Для экспериментов отобрали одновозрастную молодь австралийского красноклешневого рака со средней массой 150 мг (480 экз.) от трех самок. В выростные емкости рассаживали по 160 особей. Формировали три группы, различающиеся суточной нормой кормления (в процентах от биомассы): I группа - 9 %, II группа - 6 %, III группа - 3 %. Молодь кормили два раз в сутки (в 900 и 1800) гранулированным кормом для осетровых видов рыб Сoppens vital («Alltech Coppens B.V.», Нидерланды) (0,8-1,2 мм) с содержанием белка 46,0 %. Каждые 8 сут (21 июля, 29 июля, 6 августа, 14 августа, 22 августа) оценивали выживаемость, индивидуальную массу, прирост биомассы и корректировали фактическую суточную норму кормления с учетом изменения численности и биомассы экспериментальных групп. В конце эксперимента (на 32-е сут) отбирали по 13 особей массой от 0,67 до 1,39 г, подвергали их варке, после чего индивидуально взвешивали и отделяли мясо от карапакса и других несъедобных частей тела, мясо взвешивали. В конце эксперимента определяли общее числу гемоцитов (ОЧГ) и долю гранулоцитов в гемолимфе рака. Прокалывали кутикулу в основании первой пары плеопод с вентральной стороны первого сегмента абдомена и микропипеткой изымали небольшое количество гемолимфы. Медианы как усредненные показатели в конце эксперимента были следующими: длина раков в I и II группах - 3,50 см, в III - 3,40 см; масса в I группе - 0,94 г, во II - 0,98 г, в III - 0,89 г. Статистически значимых различий между группами не выявили. В начале работы в емкости рассаживали по 160 особей, итоговый отход составил в I группе 57 экз. (35,6 %), во II - 62 экз. (38,7 %), в III - 58 экз. (36,2 %). Не наблюдалось статистически значимых различий по ОЧГ и доле гранулоцитов между группами. Средние значения ОЧГ находились в диапазоне от 1005 до 1073 шт/мкл, доли гранулоцитов - от 20,1 до 21,1 %. Медианы по ОЧГ были следующими: I группа - 965 шт/мкл, II - 840 шт/мкл, III - 1101 шт/мкл; по доле гранулоцитов в I группе - 21,1 %, во II - 20,1 %, в III - 20,6 %. Общее число гемоцитов у раков при разных суточных нормах кормления не зависело от доли гранулоцитов с коэффициентами корреляции от -0,02 до -0,08. Относительный прирост биомассы снижался от 99,8 до 17,6 % в I группе, от 102,6 до 19,1 % - во II группе, от 105,4 до 16,9 % - в III группе. Удельная скорость роста биомассы составила от 8,6 до 2,0 % - в I группе, от 8,8 до 2,2 % - во II группе, от 9,0 до 2,0 % - в III группе. Выход мяса в опытных группах у молоди рака достоверно не различался. Средние показатели находились в пределах от 31,1 до 32,5 %. У I опытной группы были зафиксированы наибольшие затраты корма, равные 2,00 ед., тогда как во II - 1,47 ед., в III - 0,72 ед. Низкие затраты корма в III опытной группе с суточной нормой кормления 3 % при близких показателях прироста, выживаемости, средних масс, длин и их медиан свидетельствуют об эффективном усвоении корма молодью C. quadricarinatus и избыточной норме кормления в остальных группах.
Cherax quadricarinatus, австралийский красноклешневый рак, молодь, кормление, гемолимфа, гемоциты, гранулоциты, установка замкнутого водоснабжения
Короткий адрес: https://sciup.org/142236354
IDR: 142236354 | УДК: 639.51:639.3.043.2 | DOI: 10.15389/agrobiology.2022.4.803rus
Текст научной статьи Подращивание молоди рака Cherax quadricarinatus (Von Martens, 1868) с применением кормов для осетровых видов рыб
Австралийский красноклешневый рак (Cherax quadricarinatus) отно- сится к теплолюбивым объектам аквакультуры и обладает ценными потребительскими и хозяйственными качествами (1, 2). Технология индустриального выращивания австралийских раков еще недостаточно отработана. Культивирование этого вида все более распространяется в странах с умеренным и субтропическим климатом, где выращивание начинается в контролируемых условиях и затем продолжается в открытых водоемах. В России технологии выращивания C. quadricarinatus находятся на стадии разработки и показатели биопродукции намного скромнее (1, 3).
Холодные климатические условия требуют обязательного применения замкнутых систем для содержания производителей в зимнее время, проведения нереста, содержания самок с икрой и молодью, подращивания молоди (2, 4-6). Важнейший элемент такой технологии — отработка кормления. На рынке представлены линейки специализированных аквариумных кормов, которые несоизмеримо дороги и неприменимы при промышленном разведении. Проводится изучение и разработка новых способов и рецептур кормления с учетом физиологических особенностей ракообразных (7): поиск альтернатив традиционным компонентам кормов (8, 9), включение разнообразных добавок (10-13) и использование различных режимов кормления (14-17), но, как показывает практика, это длительное и дорогостоящее мероприятие. При этом слабо изучена возможность применения в раководстве уже зарекомендованных высококачественных кормов для рыб.
Молодь рака более требовательна к кормам, и для ее эффективного быстрого роста они должны содержать не менее 30-50 % белка (1, 18-20). Таким же требованиям отвечают стартовые корма для осетровых видов рыб, что открывает перспективы их применения в раководстве. Были попытки изучить возможность внедрения таких видов кормов в сравнении с аналогами (21), но различные режимы кормления недостаточно рассмотрены.
Неполноценное питание может вести к неадекватному соотношению потребления энергии и веществ с дефицитом макро- и микронутриентов, что становится наиболее частой причиной иммунодефицитов и служит фактором риска у продуктивных животных. В животноводческой практике наиболее часто происходят нарушения энергопротеинового питания, что сопровождается увеличением чувствительности особей к инфекциям вследствие угнетения врожденного и адаптивного иммунитета (22, 23). В связи с этим при разработке рациона требуется анализировать показатели, которые характеризуют состояние иммунной системы. Для ракообразных такими могут быть показатели гемолимфы — общее число гемоцитов (ОЧГ) и доля гранулоцитов (24-28). Работ, в которых учитываются эти индикаторы при разработке рациона для австралийского красноклешневого рака, немного (15, 29).
В настоящей работе впервые установлены нормы кормления, скорость роста, выживаемость и гематологические показатели молоди австралийского красноклешневого рака при использовании специализированных кормов для осетровых видов рыб с содержанием белка 46 %.
Цель исследования — изучить эффективность применения комбикормов для осетровых видов рыб и их влияние на показатели гемолимфы при выращивании молоди австралийского красноклешневого рака.
Методика. Эксперимент проводили на базе бизнес-инкубатора Кубанского государственного университета с 21 июля по 22 августа 2019 года. Использовали многоярусную установку замкнутого водоснабжения, которая имела следующие габариты: длина — 0,97 м, ширина — 0,70 м, высота — 1,92 м. В ее состав входили: четыре выростные пластиковые емкости с раз-804
мерами 78½56½18 см (дно 65,5½51 см, площадь 0,334 м2); блок водоподготовки, разделенный на пять отсеков: первый — грубая механическая очистка из слоев губки различной пористости, второй-четвертый — плавающая полипропиленовая загрузка BioElements («RK Plast», Дания) с плотностью 0,93 г/см3 и удельной поверхностью 750 м2/м3, пятый — накопитель с насосом и терморегулятором объемом 0,11 м3; насос 14HF HyperFlow («RIO», Тайвань) 3,4 м3/ч; поршневой компрессор Hailea Electrical Magnetic AC ACO-208 («Hailea», Китай) с распылителями для подачи воздуха в отсек биологической очистки; соединительные полипропиленовые трубы и краны. Емкости устанавливали на металлическую сборную раму. Три выростные емкости использовали для эксперимента. Каждую накрывали крышкой из пенополистирола, которая уменьшала расход воды, минимизируя испарение и снижая вероятность выхода рака из емкостей.
Для экспериментов отобрали одновозрастную молодь австралийского красноклешневого рака со средней массой 150 мг (480 экз.) от трех самок, которую смешивали и распределяли по выростным емкостям. В выростные емкости рассаживали по 160 особей.
Для снижения ущерба от каннибализма использовали сконструированные нами многоэтажные укрытия из поликарбоната и пластиковой сетки. По мере роста молоди укрытия меняли в соответствии с размерными характеристиками. Укрытия были рассчитаны на обеспечение молоди рака как индивидуальными ячейками (с запасом), так и на создание площади на этажах, необходимой для безопасных линек, а также служили дополнительным субстратом для фиксации нитрифицирующих бактерий.
Для эксперимента формировали три опытные группы, различающиеся суточной нормой кормления (в процентах от биомассы): I группа — 9 %, II группа — 6 %, III группа — 3 %. Молодь кормили 2 раз в сутки (утром в 900 и вечером в 1800) гранулированным кормом для осетровых видов рыб Сoppens vital (0,8-1,2 мм) («Alltech Coppens B.V.», Нидерланды) с содержанием белка — 46,0 %, жира — 10,0 %, фосфора — 1,5 %, витамина A — 14000 МЕ/кг, витамина D — 2140 МЕ/кг, витамина E — 280 мг/кг, стабильного витамина C — 500 мг/кг, общей энергией — 19,4 МДж/кг.
Во время опыта основные гидрохимические показатели воды (NO 3 , NO 2 , NH 4 /NH 3 , pH) находились в пределах рыбоводных норм, их проверяли колориметрическими тестами марки «Sera» (Германия) и «Api» (США). Чистку дна сифоном и частичную подмену порядка 30 % воды проводили 1 раз в 4 сут. Температура воды за период опыта изменялась от 27,1 до 29,5 °С, средний показатель составлял 28,3 °С.
Каждые 8 сут (21 июля, 29 июля, 6 августа, 14 августа, 22 августа) оценивали выживаемость, индивидуальную массу, прирост биомассы и корректировали фактическую суточную норму кормления с учетом изменения численности и биомассы экспериментальных групп. Измерение проводили линейкой с точностью до 1 мм. Для взвешивания использовали электронные весы MEM-EBS («Mercury», Южная Корея) c точностью до 0,01 г. Объем выборок составлял 50 экз. По окончании эксперимента были измерены все особи.
Для определения выхода мяса в конце эксперимента (на 32-е сут) по 13 особей массой от 0,67 до 1,39 г отбирали и отваривали, после чего индивидуально взвешивали, мясо отделяли от карапакса и других несъедобных частей тела и взвешивали.
Относительный прирост (AM, %) и удельную скорость роста (Cw, %) биомассы вычисляли по формулам (30): AM = (Mt - Mo)/Mo • 100 %; Cw = (lnMt - lnMo)/t* 100 %, где Mo, Mt — биомасса в начале и конце периода, г. Расчет затрат корма (ЗК, г) на единицу прироста биомассы проводили по формуле: ЗК = Мк/П, где Мк— количество затраченного корма, г, П — прирост массы, г.
Определяли ОЧГ и долю гранулоцитов в гемолимфе рака в конце эксперимента (на 32-е сут). Гемолимфу отбирали следующим образом: про- калывали кутикулу в основании первой пары плеопод с вентральной стороны первого сегмента абдомена (31) и микропипеткой изымали небольшое количество гемолимфы.
Работа с гемолимфой велась в камере Горяева под световым микро- скопом Микромед-1 («Микромед», Россия). Для подсчета ОЧГ в 1 мкл применяли следующую формулу: ОЧГ = N ½ 10, где N — число гемоцитов в 25 больших квадратах на сетке камеры (32).
Математическую обработку данных осуществляли стандартными методами вариационной статистики. Вычисляли средние значения (M), среднеквадратичные отклонения (±σ), коэффициенты вариации (CV), медианы (Me), 25-й и 75-й процентиль (Q1 и Q3). Статистически значимые различия между группами выявляли с помощью U-критерия Манна-Уитни и критерия Краскела-Уоллиса для непараметрических и независимых групп. Расчеты и графическое оформление полученных данных проводили с использованием программ Microsoft Excel и Statistica 12 («StatSoft, Inc., США).
Результаты. Внешний вид многоярусной установки замкнутого водоснабжения, которую использовали в работе, представлен на рисунке 1.

Рис. 1. Многоярусная установка замкнутого водоснабжения, которую использовали для выращивания молоди австралийского красноклешне-вого рака ( Cherax quadricarinatus ).
В результате проведенных исследований были получены показатели динамики средних масс и биомассы молоди австралийского красноклешневого рака в течение 32 сут (табл. 1). В начале опыта средняя масса молоди составляла 0,15 г. Средняя масса молоди в конце опыта оказалась следующей: I группа — 1,06 г, II группа — 1,01 г, III группа — 1,02 г. Различия между группами не были статистически значимы.
Показатели средней массы в нашем эксперименте были сопоставимы с результатами, полученными С.В. Севастеевым с соавт. (33). В опыте авторов при кормлении раков из расчета 10 % от биомассы декапсулированной артемией, гранулами из артемии и артемией «янтарь» за 30 сут получена молодь массой 1,11-1,54 г (при начальной посадке — 0,080,12 г).
Коэффициент вариации массы тела у молоди в нашем опыте изменялся во времени от 11,5-11,8 до 45,7-51,9 %, причем различия по группам были невелики. Такая динамика варьирования размерно-массовых характеристик может считаться достаточно большой для австралийского красноклешневого рака, если сравнивать с немногочисленными данными других работ (2, 4, 5). В наших исследованиях это, вероятнее всего, было связано с большей вариабильно- стью исходных показателей и большими плотностями посадки, что приво- дило к угнетению роста изначально отстающих особей. В работе А.В. Жи-гина с соавт. (6) коэффициент вариации по массе тела изменялся от 8,51 до 14,17 % при посадке молоди массой 0,44-0,57 г и исходной плотности посадки 44,4 экз/м2. У нас же молодь имела такую массу через 16 сут после начала эксперимента и плотность посадки находилась в пределах 385,1388,1 экз/м2.
1. Показатели массы молоди австралийского красноклешневого рака ( Cherax quadricarinatus ) при скармливании гранулированного корма для осетровых видов рыб Сoppens vital («Alltech Coppens B.V.», Нидерланды) (лабораторный опыт, 2019 год)
|
Дата |
Масса ( n = 50) |
I группа |
II группа |
III группа |
|
21 июля (начало опыта) |
M ± σ , г |
0,15±0,017 |
0,15±0,017 |
0,15±0,018 |
|
Cv , % |
11,5 |
11,5 |
11,8 |
|
|
29 июля |
M ± σ , г |
0,34±0,059 |
0,34±0,062 |
0,34±0,060 |
|
Cv , % |
17,3 |
18,2 |
17,7 |
|
|
6 августа |
M ± σ , г |
0,56±0,161 |
0,57±0,173 |
0,60±0,169 |
|
Cv , % |
28,7 |
30,3 |
28,2 |
|
|
14 августа |
M ± σ , г |
0,81±0,432 |
0,72±0,310 |
0,76±0,361 |
|
Cv , % |
37,4 |
38,5 |
36,6 |
|
|
22 августа (конец опыта) |
M ± σ , г |
1,06±0,551 |
1,01±0,461 |
1,02±0,506 |
|
Cv , % |
51,9 |
45,7 |
49,7 |
Примечание. Описание опытов см. в разделе «Методика».
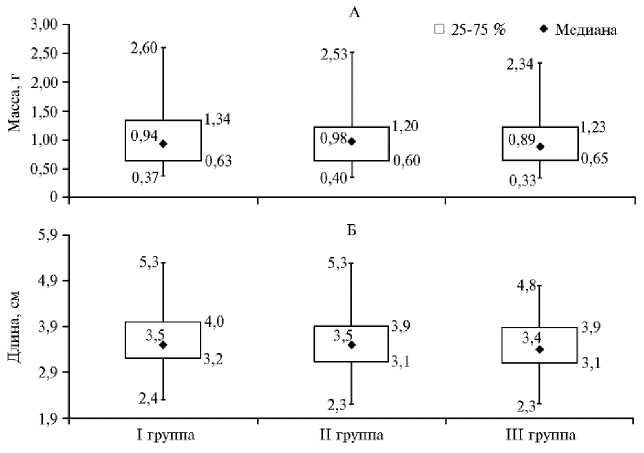
Рис. 2. Итоговые показатели массы (А) и длины (Б) молоди австралийского красноклешневого рака ( Cherax quadricarinatus ) при скармливании гранулированного корма для осетровых видов рыб Сoppens vital («Alltech Coppens B.V.», Нидерланды) на 32-е сут эксперимента (лабораторный опыт, 2019 год) . Описание опытов см. в разделе «Методика».
Медианы (рис. 2) как усредненные показатели выборок считаются более объективными для анализа результатов. Медианы были следующими: по длине в I и II группах — 3,50 см, в III группе — 3,40 см; по массе в I группе — 0,94 г, во II группе — 0,98 г, в III группе — 0,89 г. Различия в медианах по критерию Краскела-Уоллиса не были статистически значимыми. Минимальная масса и длина молоди австралийского красноклешне-вого рака в конце опыта во всех группах оказались примерно одинаковыми и составили соответственно 0,33-0,40 г и 2,3-2,4 см (см. рис. 2). Максимальные показатели различались: в I и II опытных группах они были больше — при длине 5,3 см масса составляла соответственно 2,60 и 2,53 г, в III опытной группе — 2,34 г при 4,8 см.
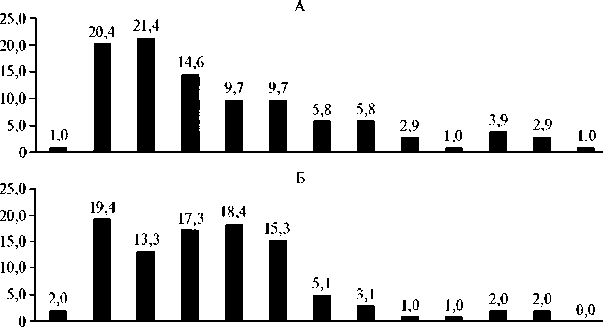
Для оценки размерной структуры молоди, полученной в конце эксперимента, были составлены вариационные ряды (рис. 3, 4). Массу оценивали по 13 размерным классам с интервалом 0,2 г, длину — по 10 классам с интервалом 0,3 см. Наибольшей представительностью по массе во всех группах характеризовались особи в размерном классе 0,40-1,39 г, по длине — 3,10-3,99 см (см. рис. 3, 4). По мере увеличения массы можно заметить планомерное уменьшение числа особей в размерных группах.
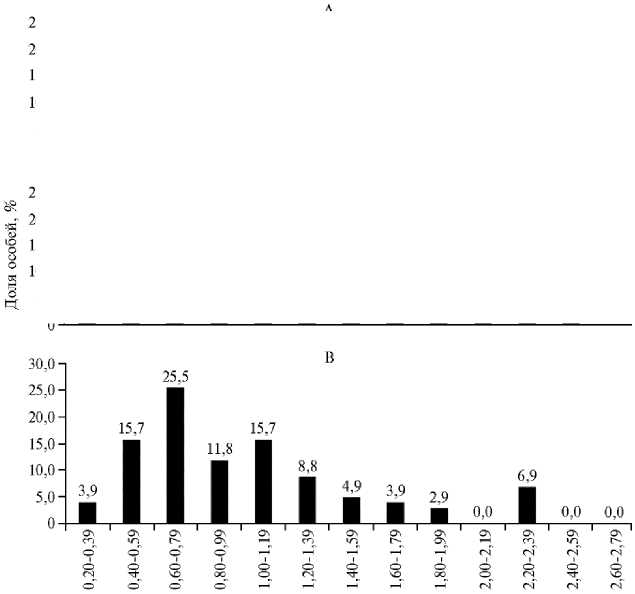
Рис. 3. Вариационные ряды массы quadricarinatus) при скармливании гранулированного корма для осетровых видов рыб Сoppens vital («Alltech Coppens B.V.», Нидерланды) на 32-е сут эксперимента: А — I группа, Б — II группа, В — III группа (лабораторный опыт, 2019 год). Описание опытов см. в разделе «Методика».
Классовые интервалы, г молоди австралийского красноклешневого рака (Cherax
Австралийскому красноклешневому раку свойственен высокий каннибализм, поэтому выживаемость в течение эксперимента (табл. 2) находилась в диапазоне 61,3-64,4 %. Смертность в I группе в итоге составила 57 экз. (35,6 %), во II группе — 62 экз. (38,7 %), в III группе — 58 экз. (36,2 %).
Показательно изменение биомассы в течение эксперимента (см. табл. 2). Изначально она составляла по 24 г на каждую группу. К окончанию опыта наибольшим фактическим приростом биомассы в 85,5 г характеризовалась I группа против 75,0 г во II группе и 79,9 г в III группе. Эту разницу нельзя считать значимой, поскольку с учетом близких средних масс она обусловлена большей выживаемостью в группе.
Поскольку суточная норма кормления, выраженная в процентах, увеличивалась соизмеримо растущей биомассе на каждом этапе, ориентироваться только на вышеперечисленные фактические показатели некорректно. Решающим здесь можно считать описание относительного прироста и удельной скорости роста, которые по мере взросления снижались во всех группах. Относительный прирос за 32 сут снижался от 99,8 до 17,6 % в I группе, от 102,6 до 19,1 % — во II группе и от 105,4 до 16,9 — в III группе. Это связано с естественным снижением метаболизма по мере взросления особей и увеличением межлиночных промежутков у ракообразных, что наблюдается у многих декапод. Удельная скорость роста составляла от 8,6 до 2,0 % в I группе, от 8,8 до 2,2 % — во II группе и от 9,0 до 2,0 % — в III группе.
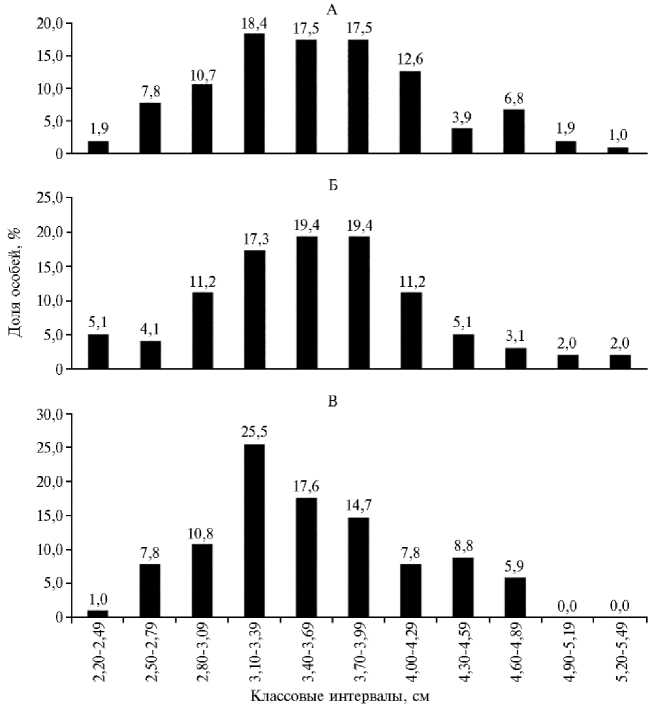
Рис. 4. Вариационные ряды длины молоди австралийского красноклешневого рака ( Cherax quadricarinatus ) при скармливании гранулированного корма для осетровых видов рыб Сoppens vital («Alltech Coppens B.V.», Нидерланды) на 32-е сут эксперимента: А — I группа, Б — II группа, В — III группа (лабораторный опыт, 2019 год). Описание опытов см. в разделе «Методика».
Неполноценное питание может вести к неадекватному соотношению потребления энергии и веществ с дефицитом ряда макро- и микронутриентов. Это становится наиболее частой причиной иммунодефицитов и служит фактором риска у продуктивных животных. На красном болотном раке ( Procambarus clarkii ) проведены исследования в рамках поиска альтернативы рыбьего жира для кормов (34). Полная его замена на говяжий показала потенциальный вред для здоровья раков, в то время как частичная замена не подавляла рост и не ухудшала антиоксидантную способность и врожденный иммунитет. Наблюдалось увеличение содержания триглицеридов в гемолимфе и свободных жирных кислот по сравнению с раками, получавшими полноценный традиционный рацион (p < 0,05) (34).
Некоторые рационы подразумевают периодическое или регулярное включение дополнительных компонентов — иммунопотенциаторов, таких как глицирризиновая кислота в качестве противовирусного средства. F. Liu с соавт. (35) показали, что раки в группах, получавших оптимальную дозу 50-150 мг/кг корма, имели повышенную конечную массу тела, прирост, удельную скорость роста и пониженный коэффициент конверсии корма по сравнению с контролем (p < 0,05). При этом были увеличены общее количество гемоцитов и содержание фенолоксидазы в гемолимфе, улучшены иммунные ответы и экспрессия связанных с иммунитетом генов. Включение в питание полисахаридов Codonopsis pilosula (36) давало аналогичные результаты. Изучалось влияние пробиотика Pediococcus acidilactici (37) и Lactobacillus acidophilus, L. plantarum (38) на иммунологические показатели гемолимфы и ферментативную систему молоди Astacus leptodactylus и Cherax cainii, а также хитозана на Procambarus clarkii (39). Указанные подходы в разной степени влияли на гемограмму ракообразных и общее физиологическое состояние.
-
2. Прирост биомассы и выживаемость молоди австралийского красноклешневого рака ( Cherax quadricarinatus ) при скармливании гранулированного корма для осетровых видов рыб Сoppens vital («Alltech Coppens B.V.», Нидерланды) (лабораторный опыт, 2019 год)
-
3. Гематологические показатели молоди австралийского красноклешневого рака ( Cherax quadricarinatus ) при скармливании гранулированного корма для осетровых видов рыб Сoppens vital («Alltech Coppens B.V.», Нидерланды) на 32-е сут эксперимента (лабораторный опыт, 2019 год)
|
Дата |
I группа |
II группа |
III группа |
|
Биомасс а, г |
|||
|
21 июля (начало опыта) |
24,0 |
24,0 |
24,0 |
|
22 августа (конец опыта) |
109,5 |
99,0 |
103,9 |
|
Прирост биомассы, % |
|||
|
29 июля |
|||
|
Δ M, % |
99,8 |
102,6 |
105,4 |
|
C w , % |
8,6 |
8,8 |
9,0 |
|
6 августа |
|||
|
Δ M, % |
50,7 |
52,4 |
57,0 |
|
C w , % |
5,1 |
5,3 |
5,6 |
|
14 августа |
|||
|
Δ M, % |
28,9 |
12,1 |
14,8 |
|
C w , % |
3,2 |
1,4 |
1,7 |
|
22 августа |
|||
|
Δ M, % |
17,6 |
19,1 |
16,9 |
|
C w , % |
2,0 |
2,2 |
2,0 |
|
Выживаемо сть, % |
|||
|
21 июля |
100,0 |
100,0 |
100,0 |
|
29 июля |
88,1 |
89,4 |
90,6 |
|
6 августа |
80,6 |
81,3 |
80,6 |
|
14 августа |
71,9 |
72,5 |
73,1 |
|
22 августа |
64,4 |
61,3 |
63,8 |
|
Примечани е. Описание опытов см. в разделе «Методика». Δ M |
— относительный прирост биомассы, |
||
C w — удельная скорость роста биомассы.
В наших опытах статистически значимых различий по ОЧГ и доле гранулоцитов между группами раков выявлено не было (p > 0,05). Средние значения ОЧГ в группах находились в диапазоне от 1005 до 1073 шт/мкл, доли гранулоцитов — от 20,1 до 21,1 % (табл. 3).
Показатель I группа I II группа I III группа
ОЧГ, шт/мкл
|
M ± σ |
1030±499 |
1005±493 |
1073±507 |
|
Cv , % |
48,5 |
49,1 |
47,2 |
|
Доля гранулоцитов, % M ± σ |
21,1±5,97 |
20,2±5,50 |
20,1±5,48 |
|
Cv , % |
28,3 |
27,3 |
27,2 |
|
Примечани е. Описание опытов |
см. в разделе «Методика». |
ОЧГ — общее число гемоцитов. |
|
Медианы (рис. 5) как усредненные показатели выборок в группах были следующими: по ОЧГ в I группе — 965, во II группе — 840, в
III группе — 1101 шт/мкл; по доле гранулоцитов в I группе — 21,1 %, во II группе — 20,1 %, в III группе — 20,6 %.
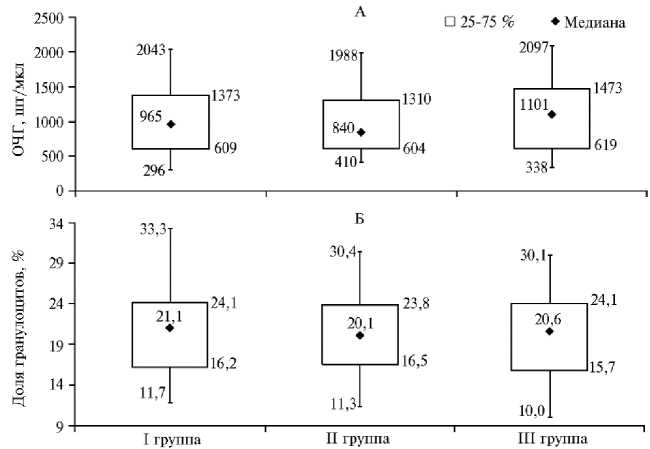
Рис. 5. Общее число гемоцитов (ОЧГ) и доля гранулоцитов у молоди австралийского красноклеш-невого рака ( Cherax quadricarinatus ) при скармливании гранулированного корма для осетровых видов рыб Сoppens vital («Alltech Coppens B.V.», Нидерланды) на 32-е сут эксперимента (лабораторный опыт, 2019 год) . Описание опытов см. в разделе «Методика».
Общее число гемоцитов у раков при разных суточных нормах кормления не зависело от доли гранулоцитов (p > 0,05): коэффициенты корреляции составляли от -0,02 до -0,08 (рис. 6).
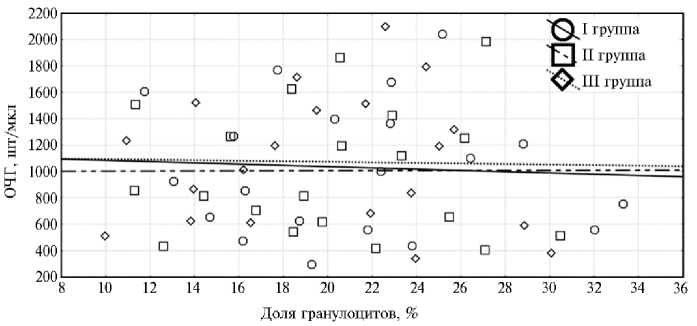
Рис. 6. Соотношение общего числа гемоцитов (ОЧГ) и доли гранулоцитов у молоди австралийского красноклешневого рака ( Cherax quadricarinatus ) при скармливании гранулированного корма для осетровых видов рыб Сoppens vital («Alltech Coppens B.V.», Нидерланды) на 32-е сут эксперимента (лабораторный опыт, 2019 год) . Линии на графике — прямые нулевых корреляций экспериментальных групп. Описание опытов см. в разделе «Методика».
Важный показатель усвоения и распределения питательных веществ в организме выращиваемых в аквакультуре объектов — выход съедобных частей (в нашем случае мышечного волокна, мяса) от общей живой массы. Поскольку масса молоди раков мала и осуществить изъятие всего мяса тела не представляется возможным, оценивали количество, содержащееся только в хвостовой части. Оставшиеся части тела учитывали как несъедобные (табл. 4).
Выход мяса в опытных группах у молоди рака статистически значимо не различался. Средние показатели находились в пределах от 31,11 % (II группа) до 32,54 % (I группа). Близкие данные — 30-32 % от массы тела, соответствующие более взрослым особям массой от 22 до 86 г, отмечены у C. quadricarinatus при выращивании в установке замкнутого водоснабжения (2, 40), у других видов раков они составляли 15-20 % (40). Стоит отметить, что в нашей работе представлены показатели по молоди, которые другие авторы не исследовали.
Один из показателей эффективности выращивания в целом — затраты корма (см. табл. 4). За все время нашего эксперимента больше всего корма было съедено в I группе — 170,9 г. В ней же отмечали наибольшие кормовые затраты — 2,00 ед.
4. Технологические показатели молоди австралийского красноклешневого рака ( Cherax quadricarinatus ) при скармливании гранулированного корма для осетровых видов рыб Сoppens vital («Alltech Coppens B.V.», Нидерланды) (лабораторный опыт, 2019 год)
|
Показатель |
I группа |
II группа |
III группа |
|
Исходная плотность посадки, экз/м2 |
479 |
479 |
479 |
|
Расход корма за период, г: |
|||
|
21 июля-28 июля |
17,3 |
11,5 |
5,8 |
|
29 июля-5 августа |
34,5 |
23,3 |
11,8 |
|
6 августа-13 августа |
52,0 |
35,6 |
18,6 |
|
14 августа-22 августа |
67,1 |
39,9 |
21,3 |
|
Всего, г |
170,9 |
110,3 |
57,5 |
|
Суммарный прирост биомассы, г |
85,5 |
75,0 |
79,9 |
|
Затраты корма, ед. |
2,00 |
1,47 |
0,72 |
|
Продуктивность, экз/м2 |
308 |
293 |
305 |
|
Продуктивность, г/м2 |
326,9 |
295,4 |
310,1 |
|
Себестоимость (затраты на корма), |
|||
|
руб/кг молоди |
421,4 Выход мяса с молоди |
309,7 |
151,7 |
|
Масса тела до обработки, г |
|||
|
M ± σ |
1,06±0,167 |
1,10±0,156 |
1,08±0,172 |
|
min-max |
0,76-1,34 |
0,67-1,30 |
0,79-1,39 |
|
Масса тела после обработки, г |
|||
|
M ± σ |
0,95±0,146 |
0,92±0,136 |
0,97±0,149 |
|
min-max |
0,68-1,16 |
0,66-1,15 |
0,72-1,21 |
|
Мышцы абдомена, г |
|||
|
M ± σ |
0,31±0,065 |
0,30±0,067 |
0,32±0,073 |
|
min-max |
0,15-0,40 |
0,14-0,32 |
0,17-0,46 |
|
Выход мяса из абдомена, % |
|||
|
M ± σ |
32,5±3,85 |
31,1±2,99 |
32,0±3,90 |
|
min-max Примечани е. Описание опытов |
22,1-37,6 см. в разделе «Методика». |
21,9-37,0 |
22,9-36,9 |
Низкие показатели кормового коэффициента показаны в работе С.В. Севастеева с соавт. (33). В ней при кормлении продуктами из артемии в схожие сроки получена молодь близких итоговых размеров при затрате корма от 0,5 до 1,6 ед. Если рассчитать затраты в соответствии с заявленной ООО «Пионер Трейд» (Россия) стоимостью декапсулированной артемии, которая предлагается как один из вариантов кормления в опыте С.В. Сева-стеева с соавторами, в 1500 руб/кг (2018 год), получится себестоимость по кормам от 750 до 2400 руб/кг, что в разы дороже применения кормов для осетровых видов рыб.
Согласно прайс-листу от 21.02.2019, в ООО «АльфеусФидс» (Россия) (официальный российский дистрибьютор «Coppens International B.V.— Alltech Coppens», Нидерланды) стоимость Сoppens vital (0,8-1,2 мм) равняется 2,82 евро/кг, или 210,7 руб/кг (при курсе 74,7 руб/евро в феврале 2019 года). С учетом такой стоимости корма себестоимость молоди в III группе получается минимальной и составляет 151,7 руб/кг против 309,7 и 421,4 руб/кг соответственно в I и II группах.
Таким образом, низкие затраты корма на прирост единицы биомассы молоди австралийского красноклешневого рака при скармливании гранулированного корма для осетровых видов рыб Сoppens vital с суточной нормой кормления 3 % при близких показателях прироста, выживаемости, средних масс, длин и их медиан, а также гематологического статуса свидетельствуют об эффективном усвоении корма и избыточной норме кормления в остальных группах. Увеличение суточной нормы кормления более 3 % не привело к повышению эффективности выращивания. Затраты корма при выращивании молоди в течение 32 сут от средней массы 0,15 г до 0,89 г составили 0,72 ед. При исходной плотности посадки 479 экз/м2 выживаемость составила 61-64 % с продуктивностью 293-308 экз/м2, или 295-327 г/м2. Впервые были получены данные о выходе мяса абдомена у молоди рака, который находился в пределах 31-33 %. Увеличение нормы кормления не сказывалось на общем числе гемоцитов (1005-1073 шт/мкл) и доле гранулоцитов (20-21 %). Несмотря на подтверждение эффективности применения исследуемых схем кормления, необходимы дополнительные эксперименты для выяснения минимального порога суточной нормы кормления как для указанной возрастной группы молоди австралийского красноклешневого рака, так и для более старших возрастов, поскольку метаболизм, а с ним и потребность в корме меняются по мере взросления особи.
Список литературы Подращивание молоди рака Cherax quadricarinatus (Von Martens, 1868) с применением кормов для осетровых видов рыб
- Лагуткина Л.Ю., Кузьмина Е.Г., Таранина А.А., Ахмеджанова А.Б., Ясинский В.С., Пономарев Р.А. Фактологическое обеспечение практик повышения эффективности выращивания тропических пресноводных видов. Вестник Астраханского государственного технического университета. Серия: Рыбное хозяйство, 2020, 2: 94-105 (doi: 10.24143/2073-55292020-2-94-105).
- Арыстангалиева В.А. Разработка технологии выращивания посадочного материала австралийского красноклешневого рака (Cherax quadricarinatus) в установке с замкнутым водоис-пользованием. Канд. дис. М., 2017.
- Лагуткина Л.Ю., Кузьмина Е.Г., Бирюкова М.Г., Першина Е.В. Биопродуктивность прудов VI рыбоводной зоны. Вестник Астраханского государственного технического университета. Серия: Рыбное хозяйство, 2019, 4: 87-94 (doi: 10.24143/2073-5529-2019-4-87-94).
- Shumeyko D., Tsimbal N., Abramchuk A., Moskul G., Taranik A. Biotechnology of Australian red-claw crayfish ( Cherax quadricarinatus) juvenile ongrowing in recirculating aquaculture system. E3S Web of Conferences, 2020, 175: 02005 (doi: 10.1051/e3sconf/202017502005).
- Шокашева Д.И. Рост молоди австралийского рака Cherax quadricarinatus в индустриальных условиях в зависимости от температуры среды. Вестник Астраханского государственного технического университета. Серия: Рыбное хозяйство, 2018, 2: 98-103 (doi: 10.24143/20735529-2018-2-98-103).
- Жигин А.В., Борисов Р.Р., Ковачева Н.П., Загорская Д.С., Арыстангалиева В.А. Выращивание австралийского красноклешневого рака в циркулярной установке. Рыбное хозяйство, 2017, 1: 61-65.
- Cheng S., Wei Y.-c., Jia Y.-y., Li F., Chi M.-l., Liu S.-l., Zheng J.-b., Wang D.-l., Gu Z.-m. A study on primary diets for juveniles of red claw crayfish Cherax quadricarinatus. Aquaculture Research, 2021, 52(5): 2138-2145 (doi: 10.1111/are.15066).
- Muzinic L., Thompson K., Morris A., Webster C., Rouse D., Manomaitis L. Partial and total replacement of fish meal with soybean meal and brewer's grains with yeast in practical diets for Australian red claw crayfish Cherax quadricarinatus. Aquaculture, 2004, 230(1-4): 359-376 (doi: 10.1016/S0044-8486(03)00420-4).
- Qian D., Yang X., Xu C., Chen C., Jia Y., Gu Z., Li E. Growth and health status of the red claw crayfish, Cherax quadricarinatus, fed diets with four typical plant protein sources as a replacement for fish meal. Aquaculture Nutrition, 2021, 27(3): 795-806 (doi: 10.1111/anu.13224).
- Foysal M.J., Chua E.G., Gupta S.K., Lamichhane B., Tay C.Y., Fotedar R. Bacillus mycoides supplemented diet modulates the health status, gut microbiota and innate immune response of freshwater crayfish marron (Cherax cainii). Animal Feed Science and Technology, 2020, 262: 114408 (doi: 10.1016/j.anifeedsci.2020.114408).
- Lai Y., Luo M., Zhu F. Dietary Bacillus amyloliquefaciens enhance survival of white spot syndrome virus infected crayfish. Fish & Shellfish Immunology, 2020, 102: 161-168 (doi: 10.1016/j.fsi.2020.04.033).
- Kong F., Zhu Y., Yu H., Wang X., Abouel Azm F.R., Yuan J., Tan Q. Effect of dietary vitamin C on the growth performance, nonspecific immunity and antioxidant ability of red swamp crayfish (Procambarus clarkii). Aquaculture, 2021, 541: 736785 (doi: 10.1016/j.aquaculture.2021.736785).
- Xiao C., Zhang Y., Zhu F. Effect of dietary sodium butyrate on the innate immune response of Procambarus clarkii and disease resistance against white spot syndrome virus. Aquaculture, 2021, 541: 736784 (doi: 10.1016/j.aquaculture.2021.736784).
- Stumpf L., Cárdenas P.N.S., Timpanaro S., Greco L.L. Feasibility of compensatory growth in early juveniles of «red claw» crayfish Cherax quadricarinatus under high density conditions. Aquaculture, 2019, 510: 302-310 (doi: 10.1016/j.aquaculture.2019.05.053).
- Castillo Díaz F., Tropea C., Stumpf L., López Greco L.S. Effect of food restriction on female reproductive performance in the redclaw crayfish Cherax quadricarinatus (Parastacidae, Decap-oda). Aquaculture Research, 48(8): 4228-4237 (doi: 10.1111/are.13244).
- Luo S., Li X., Onchari M.M., Li W., Bu Y., Lek S., Zhang T., Wan Z., Jin S. High feeding level alters physiological status but does not improve feed conversion efficiency and growth performance of juvenile red swamp crayfish Procambarus clarkii (Girard, 1852). Aquaculture, 2021, 537: 736507 (doi: 10.1016/j.aquaculture.2021.736507).
- Hou J., Wang X., Xu Q., Cao Y., Zhang D., Zhu J. Rice-crayfish systems are not a panacea for sustaining cleaner food production. Environmental Science and Pollution Research, 2021, 28(18): 22913-22926 (doi: 10.1007/s11356-021-12345-7).
- Cortés-jacinto E., Villarreal-colmenares H., Civera-cerecedo R., Naranjo-páramo J. Effect of dietary protein level on the growth and survival of pre-adult freshwater crayfish Cherax quadricarinatus (von Martens) in monosex culture. Aquaculture Research, 2004, 35(1): 71-79 (doi: 10.1111/j.1365-2109.2004.00988.x).
- Cortés-Jacinto E., Villarreal-Colmenares H., Cruz-Suárez L. E., Civera-Cerecedo R., Nolasco-Soria H., Hernández-Llamas A. Effect of different dietary protein and lipid levels on growth and survival of juvenile Australian redclaw crayfish, Cherax quadricarinatus (von Martens). Aquaculture Nutrition, 2005, 11(4): 283-291 (doi: 10.1111/j.1365-2095.2005.00353.x).
- Cortés-Jacinto E., Villarreal-Colmenares H., Civera-Cerecedo R., Cruz-Suárez L.E. Studies on the nutrition of the freshwater crayfish Cherax quadricarinatus (von Martens): effect of the dietary protein level on growth of juveniles and pre-adults. Freshwater Crayfish, 2004, 14: 70-80.
- Анкешева Б.М., Бедрицкая И.Н., Пятикопова О.В. Апробация экспериментального корма для молоди австралийского красноклешневого рака. Рыбоводство и рыбное хозяйство, 2021, 1: 70-79 (doi: 10.33920/sel-09-2101-06).
- Галочкин В.А., Остренко К.С., Галочкина В.П., Федорова Л.М. Взаимосвязь нервной, иммунной, эндокринной систем и факторов питания в регуляции резистентности и продуктивности животных. Сельскохозяйственная биология, 2018, 53(4): 673-686 (doi: 10.15389/agrobiology.2018.4.673rus).
- Jolly C.A., Fernandes G. Protein-energy malnutrition and infectious disease. Nutrition and immunology /M.E. Gershwin, J.B. German, C.L. Keen (eds.). Humana Press, Totowa, NJ, 2000: 195202 (doi: 10.1007/978-1-59259-709-3_16).
- Sepici-Dinjel A., Alparslan Z.N., Benli A.Q.K., Selvi M., Sankaya R., Ozkul I.A., Erkoj F. Hemolymph biochemical parameters reference intervals and total hemocyte counts of narrow clawed crayfish Astacus leptodactylus (Eschscholtz, 1823). Ecological Indicators, 2013, 24: 305-309 (doi: 10.1016/j.ecolind.2012.07.002).
- Safari O., Paolucci M., Motlagh H.A. Effects of synbiotics on immunity and disease resistance of narrow-clawed crayfish, Astacus leptodactylus leptodactylus (Eschscholtz, 1823). Fish & Shellfish Immunology, 2017, 64: 392-400 (doi: 10.1016/j.fsi.2017.03.049).
- Lu X., Peng D., Chen X., Wu F., Jiang M., Tian J., Wei K. Effects of dietary protein levels on growth, muscle composition, digestive enzymes activities, hemolymph biochemical indices and ovary development of pre-adult red swamp crayfish (Procambarus clarkii). Aquaculture Reports, 2020, 18: 100542 (doi: 10.1016/j.aqrep.2020.100542).
- Safari O., Paolucci M. Effects of dietary onion (Allium cepa) powder on growth performance, hemolymph indices and fillet organoleptic properties of juvenile narrow-clawed crayfish, Astacus leptodactylus leptodactylus Eschscholtz, 1823. Aquaculture Nutrition, 2017, 23(6): 1418-1428 (doi: 10.1111/anu.12517).
- Huang Y., Ren Q. Research progress in innate immunity of freshwater crustaceans. Developmental & Comparative Immunology, 2019, 104: 103569 (doi: 10.1016/j.dci.2019.103569).
- Лагуткина Л.Ю., Евграфова Е.М., Кузьмина Е.Г., Мазлов А.М. Гематологические и биохимические показатели гемолимфы австралийского красноклешневого рака. Вестник Астраханского государственного технического университета. Серия: Рыбное хозяйство, 2021, 2: 134-143 (doi: 10.24143/2073-5529-2021-2-134-143).
- Щербина М.А., Гамыгин Е.А. Кормление рыб в пресноводной аквакультуре. М., 2006.
- Ковачева Н.П., Александрова Е.Н. Гематологические показатели как индикаторы физиологического состояния декапод — камчатского краба Paralithodes camtschaticus и речных раков родов Astacus и Pontastacus. М., 2010.
- Иванов А.А., Пронина Г.И., Корягина Н.Ю. Физиология гидробионтов. СПб, 2021.
- Севастеев С.В., Асанова А.В., Литош Т.А. Динамика основных морфобиологических параметров у австралийского красноклешневого рака (Cherax quadricarinatus) при выращивании в УЗВ. В сб.: Сборник III национальной (всероссийской) научной конференции «Теория и практика современной аграрной науки». Новосибирск, 2020, 2: 705-709.
- Gao F., Liu M., Tang J., Wang A., Tian H., Wen C., Chi C., Jiang G., Li X., Liu W., Zhang D. Partial replacement of dietary fish oil by beef tallow does not impair antioxidant capacity and innate immunity of red swamp crayfish, Procambarus clarkii. Aquaculture Research, 2021, 52(7): 3310-3321 (doi: 10.1111/are.15176).
- Liu F., Shao G.-Y., Tian Q.-Q., Cheng B.-X., Shen C., Wang A.-M., Zhang J.-H., Tian H.-Y., Yang W.-P., Yu Y.-B. Enhanced growth performance, immune responses, immune-related gene expression and disease resistance of red swamp crayfish (Procambarus clarkii) fed dietary glycyr-rhizic acid. Aquaculture, 2021, 533: 736202 (doi: 10.1016/j.aquaculture.2020.736202).
- Liu F., Geng C., Qu Y.-K., Cheng B.-X., Zhang Y., Wang A.-M., Zhang J.-H., Liu B., Tian H. Y., Yang W.-P., Yu Y.-B., Chen Z.-B. The feeding of dietary Codonopsis pilosula poly-saccharide enhances the immune responses, the expression of immune-related genes and the growth performance of red swamp crayfish (Procambarus clarkii). Fish & Shellfish Immunology, 2020, 103: 321-331 (doi: 10.1016/j.fsi.2020.05.034).
- Vaezi M., Esmaeili Feridooni A., Manaffar R., Amini K. Effects of probiotic (Pediococcus acidi-lactici) on heamatological parameters, immunological responses and digestive enzymes of Astacus leptodactylus juveniles. Aquatics Physiology and Biotechnology, 2018, 6(3): 35-60 (doi: 10.22124/japb.2018.8702.1197).
- Foysal M.J., Fotedar R., Siddik M.A.B., Tay A. Lactobacillus acidophilus and L. plantarum improve health status, modulate gut microbiota and innate immune response of marron (Cherax cainii). Scientific Reports, 2020, 10(1): 5916 (doi: 10.1038/s41598-020-62655-y).
- Sun B., Quan H., Zhu F. Dietary chitosan nanoparticles protect crayfish Procambarus clarkii against white spot syndrome virus (WSSV) infection. Fish & Shellfish Immunology, 2016, 54: 241246 (doi: 10.1016/j.fsi.2016.04.009).
- Лагуткина Л.Ю., Пономарев С.В. Способ выращивания австралийских раков (Cherax quadricarinatus). Естественные науки, 2010, 4 (33): 64-68.


