Поглощение и рассеяние лазерного излучения в суставном хряще при обработке очага хондропатии
Автор: Лычагин А.В., Юсупов В.И., Сурин В.В., Иванников С.В., Петров П.И., Байцаева О.И., Маликова Т.К., Коваленко Н.В., Шевелкина Е.Д., Заров А.Ю.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 1 (51), 2023 года.
Бесплатный доступ
Обоснование: Остеоартроз - одно из наиболее распространённых заболеваний, приводящих к потере трудоспособности. Артроскопическая лазерная обработка суставного хряща является эффективным и перспективным методом лечения остеоартроза, однако её методика может быть улучшена за счёт результатов данного исследования.Цель исследования: экспериментальная оценка коэффициентов поглощения и рассеяния лазерных излучений с длинами волн λ=1.55 мкм и λ=0.97 мкм в тканях суставного хряща и установления роли этих излучений в механизме лазерного воздействия при лечении хондропатии.Материалы и методы: Из образцов хрящевой ткани свиньи были изготовлены тонкие срезы толщиной 100 мкм и 200 мкм. Срезы подвергались воздействию лазерных излучений с длинами волн λ=1.55 мкм и λ=0.97 мкм. Для измерения оптических свойств образов был использован «метод подвижных интегрирующих сфер».Результаты: При прохождении через хрящевую ткань, коэффициент поглощения для излучения λ=0,97 мкм составил 0,14±0,02 мм-1 для излучения λ=1,55 мкм - 0,8±0,1 мм-1. Коэффициент рассеяния для излучений с λ=0.97 и с λ=1.55 составил 19±2 мм-1 и 3,7±0,4 мм-1 соответственно.Заключение: 1) При прохождении через толщу суставного хряща коэффициент поглощения (μа) у лазерного излучения с λ=0,97 мкм значительно ниже чем у лазерного излучения с λ=1,55 мкм. 2) При прохождении через толщу суставного хряща коэффициент рассеяния (μs) у лазерного излучения с λ=0,97 мкм значительно выше чем у лазерного излучения с λ=1,55 мкм. При лазерной обработке очага хондропатии сочетанным излучением λ=0,97 мкм + λ=1,55 мкм, излучение λ=1,55 мкм «сглаживает» поверхность суставного хряща в очаге хондромаляции позволяя достигать восстановления структурности суставной поверхности, а параметры излучения λ=0,97 мкм в толще суставного хряща позволяют запустить механизмы фотобиомодуляции в суставном хряще и подлежащей субхондральной кости.
Лазер, хрящ, регенерация, хондропатия, остеоперфорация, абляция
Короткий адрес: https://sciup.org/142238937
IDR: 142238937 | УДК: 617-7 | DOI: 10.17238/2226-2016-2023-1-47-55
Текст научной статьи Поглощение и рассеяние лазерного излучения в суставном хряще при обработке очага хондропатии
Остеоартроз - болезнь, проявляющееся повреждением суставного хряща, является одним из наиболее распространённых заболеваний, поражающая до 50 % взрослого трудоспособного населения старше 50 лет. Он выражается в появлении на поверхности хряща очагов хондропатии - зон локальной деструкции суставного хряща [ 1, 2, 3]. Во время артроскопических операций у пациентов с артрозом может выполняться лазерная обработка очагов хондропатии . Лазерная обработка имеет ряд преимуществ по сравнению с другими типами воздействия, такими как хоолодноплазменная абляция и механическое воздействие [ 4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21]. В первую очередь такими преимуществами являются:
-
- дозированность и высокая точность воздействия, позволяющие свести вероятность повреждений хряща вне обрабатываемой области к минимуму;
-
- стимуляция регенерации хрящевой ткани в очаге хондро-маляции по механизмам механобиологии .
Авторами был проведен ряд экспериментов по изучению воздействия сочетанного двухволнового излучения 2=0,97 мкм + 2=1,55 мкм на хрящ [22]. Оказалось, что при таком сочетанном двухволновом воздействии необходимый эффект («сглаживание» поверхности хряща) достигается при меньшей суммарной мощности. Было установлено, что в среде 0,9% рас- твора NaCl эффективное «сглаживание» поверхности хряща при минимальном термическом воздействии на окружающие ткани происходит при использовании двухволнового излучения 1,55 мкм / 5 Вт и 0,97 мкм /3 Вт в импульсно-периодическом режиме (импульс/пауза=100 мс/50 мс) с расстояния 2 мм в течении 2 с [22]. Также было показано, что наибольший вклад в нагрев хрящевой ткани вносит излучение 2=1.55 мкм, поглощающееся в поверхностных областях, тогда как излучение 2=0.97 мкм поглощается слабее и проникает в более глубокие слои [22].
Для отработки этой и подобных лазерных технологий, для уточнения механизма действия лазерного излучения на биоткани , а также для проведения моделирования необходимы данные об оптических характеристиках суставного хряща в используемых спектральных диапазонах. Целью данной работы являются экспериментальная оценка коэффициентов поглощения и рассеяния лазерных излучений с длинами волн 2 =1.55 мкм и 2 =0.97 мкм в тканях суставного хряща и установления роли этих излучений в механизме лазерного воздействия при лечении хондропатии .
Материалы и методы:
В качестве объектов воздействия использовались образцы суставного хряща свиньи. Для изготовления тонких срезов об- разцов хряща использовался криомикротом Cryostat Microtome CM3550.
При помощи криомикротома из образцов хрящевой ткани свиньи были изготовлены тонкие срезы толщиной 100 мкм и 200 мкм. Срезы были помещены между 2 предметными стёклами, смоченными изотоническим 0,9 % раствором NaСl.
Для измерения оптических свойств образов был использован «метод подвижных интегрирующих сфер» [25]. По сравнению с классическим методом при котором сферы фиксируются вплотную к образцу [27, 28], данный метод позволяет значительно повысить точность определения оптических свойств, что обусловлено увеличением количества экспериментальных данных при различных положениях образца [29].
Фотография и блок-схема установки представлены на Рисунке 1.
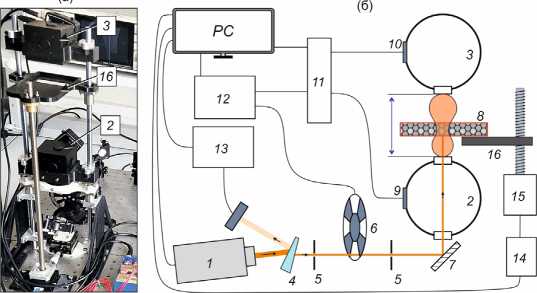
Рисунок 1. Схема установки для оценки оптических характеристик ткани. а – фрагмент общего вида установки для определения оптических характеристик образцов биоткани; б - – схема установки. 1 – лазерный источник; 2, 3 – интегрирующие сферы; 4 – клин; 5 – диафрагмы; 6 – чоппер; 7 – зеркало; 8 – образец биоткани; 9, 10 - фотодетекторы; 11 – мультиплексор; 12 – синхронный детектор; 13 – измеритель мощности;
14 – плата управления; 15 - шаговый двигатель; 16 – платформа.
Основу установки составляют лазерный источник 1 FiberLase CR (НТО «ИРЭ-Полюс», Россия) и две интегрирующие сферы (2 и 3) Thorlabs IS200-4 диаметром 8 см с входными портами 12.5 мм. Излучение от источника 1 попадало на клин 4, который отводил часть излучения на измеритель мощности 13, необходимый для контроля мощности лазера. Проходящее через клин излучение диафрагмируется до диаметра 1-2 мм на диафрагмах 5, а также модулировалось чоппером (Thorlabs MC2000B-EC) 6 на частоте 130 Гц. После чоппера излучение с помощью зеркало 7 перенаправлялось во входной порт нижней интегрирующей сферы 2. Пройдя через образец 8, часть излучения, попадало в верхнюю сферу 3. Каждая сфера была оснащена фотодетектором Thorlabs PDA10CS2 (9 и 10), сигнал с которых регистрировался с помощью синхронного детектора, выделяющего сигнал на частоте модуляции излучения (12). Применения метода синхронного детектирования при измерении сигналов с фотодетекторов способствует значительному увеличению точности ввиду исключения влияния электрических и оптических шумов, возникающих вне частоты модуляции. Поочередное считывания показаний детекторов осуществлялось с помощью мультиплексора 11.
В процессе измерения образец располагался на подвижной платформе 16 и с помощью шагового двигателя 15 обеспечивалось его передвижение в пространстве между сферами. Управление ходом эксперимента осуществлялось с помощью компьютера ( PC ).
В х од е э ксперимента измерялись зависимости PT(LT) и PR(LR) , где - PT и P – мощности регистрируемые детекторами верхней и нижней интегрирующих сфер соответственно, LT и LR – расстояния от образца до ближнего порта верхней и нижней сфер соответственно [25].
Полученные значения мощностей нормировались на значения мощности, регистрируемой в отсутствие образца каждой сферой в отдельности. Измеренные нормированные зависимости PT(LT) и PR(LR) являются монотонно убывающими функциями. На больших расстояниях функция PT(LT) стремится к некоторому ненулевому значению, которое соответствует значению коллимированного пропускания.
Оптические свойства биологических тканей определялись при совмещении этих результатов с результатами математического моделирования с использованием численного метода Монте-Карло, подробно описанного в работе [26].
Метод подвижных интегрирующих сфер, представленный в работе, позволяет значительно повысить точность определения оптических свойств. По сравнению с классическим методом, при котором сферы фиксируются вплотную к образцу [27, 28], в данном методе повышение точности обусловлено увеличением количества экспериментальных данных при различных положениях образца [29].
Теоретическая часть:
Описание процессов взаимодействия биологических тканей с лазерным излучением требует знания их оптических свойств. К основным оптическим параметрам биологических материалов следует отнести показатель преломления n(s→,λ) коэффициенты поглощения μa(s→,λ) и рассеяния μs(s→,λ) , фазовую функцию рассеяния p(s→, s→', λ, λ') , а также параметр анизотропии рассеяния g(s→,λ) (средний косинус угла между направлением распространения до и после рассеяния cosθ ) которые зависят от длины волны λ и направления распространения s→ .
Распространение света в изотропной среде в отсутствие неупругого рассеяния может быть описано уравнением переноса [23]:
1 dl(r, s, t) с dt
-(sW, s, t)) - (ца + psW, s , t) + ц$
jp( 5,Г)1 У-,.^'+ =У,3,0
где I(r→, s→, t) – лучевая интенсивность [Вт м-2 ср-1] в точке, соответствующей радиус-вектору r→ , μa – коэффициент поглощения, µs – коэффициент рассеяния, p(s→, s→') – фазовая функция рассеяния, ԑ(r→, s→, t) – функция описывающая распределение источников света, ԁω' - телесный угол в направлении s→ . Фазовая функция p(s→, s→') описывает рассеивающие свойства среды и представляет собой функцию плотности вероятности для рассеяния в направлении s→' фотона, изначально движущегося в направлении s→ , т.е. характеризует элементарный акт рассеяния. Если рассеяние симметрично относительно направления распространения падающей волны, тогда фазовая функция зависит только от угла θ между
направлениями s→ и s→' , т.е. p(s→, s→')= p(θ) .
Предположение о случайном распределение рассеивателей в среде означает отсутствие в структуре биоткани пространственной корреляции, что приводит к нормировке:
[ p(e)2nsinede = 1 (2)
Во многих случаях фазовая функция хорошо аппроксимируется функцией Хеньи-Гринштейна [27]:
p(S)
21-s2 4л (1+g2-2gcos6)3/2, ной отражательной способности поверхности), и µt=µa+µs – полный (интегральный) коэффициет ослабления. Индекс c (вычисленный, прогнозируемый, аналитический) указывает на то, что значения вычисляются в соответствии с моделью распространения света в среде. Эта система нелинейна относительно оптических свойств τ, c и g. Обозначим левую часть системы (4) за F→=(F1, F2, F3). Если вклада рассеянного света в измеряемое коллимированное пропускание нет, оптическая толщина τ может быть оценена в соответствии с законом Бера и система уравнений (4) уменьшится до двух уравнений для c и g. Если, однако, этот вклад значителен, все 3 уравнения
=< cos6 >=
Л
I p(6) • 2nsin9d9 0
решаются совместно.
С целью исключения случайных и инструментальных погрешностей и повышения точности моделирования использовался комбинированный подход, включавший в себя
g изменяется от 0 до 1: соответствует случаю изотропного (рэлеевского) рассеяния, g=1 – полному рассеянию вперед (рассеянию Ми на крупных частицах).
Стандартный набор измеренных значений состоит из полного пропускания Tmt , диффузного отражения и коэффициента коллимированного пропускания Tmc . Верхний индекс m (измеренный) указывает на эмпирическое происхождение используемых значений. Первые два измерения проводятся при помощи установки содержащей одну или две интегрирующие сферы. Конфигурация установки схематично показана на рис. 1а. Измеренные значения Tmt и Rmd преобразуются в действительные значения полного пропускания Tt и диффузного отражения Rd с учетом полученных для интегрирующей сферы коррекций [24].
После получения экспериментальных данных и их коррекции решается система уравнений [24]:
T C (c, 9, t) - T cm = 0
T№, 9,t - T , = 0 (4)
« 5 (c,9-T) - R a = 0
где τ=µtds это оптическая толщина образца, ds - геометрическая толщина образца, c=µs/µt – альбедо (характеристика диффуз- как стандартные измерения при помощи интегрирующих сфер, так и гониометрические измерения [25].
Измерения для излучения с Л =0,97 мкм проводились на 3 образцах толщиной 100 мкм и одного образца толщиной 200 мкм.
Измерения для излучения с Л =1,55 мкм проводились на 2 образцах толщиной 100 мкм и 200 мкм соответственно.
Результаты:
Измерения оптических параметров с источником 0,97 мкм
Графики зависимостей нормированных мощностей, регистрируемых верхней (пропускание) и нижней (отражение) сферами от положения образцов представлены на рис. 2 и 3.
На графике коэффициента пропускания для образцов 100 мкм наблюдается разброс ~10% , который, как мы полагаем, связан с неоднородностью свойств образцов, и наличием в препарате пузырей.
Из рис. 2 видно, что для образцов ткани толщиной 100 мкм зависимости коэффициента полного пропускания от положения образца между сферами близки к линейным.
100 мкм
200 мкм
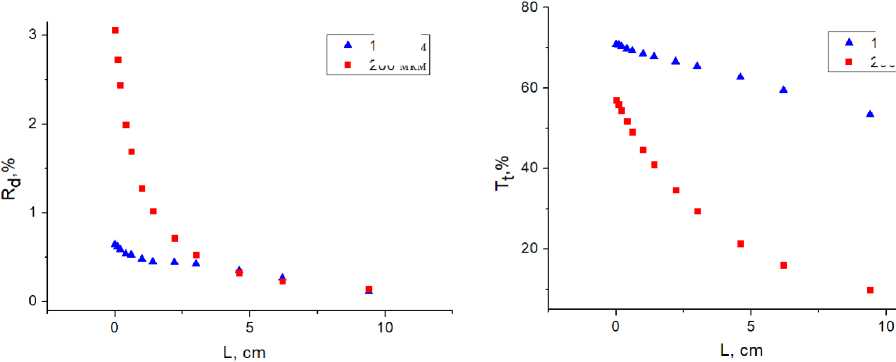
100 мкм
200 мкм
Рисунок 2. Зависимости нормированных мощностей для пропускания и диффузного отражения для срезов хрящевой ткани толщиной 100 и 200 мкм в зависимости от положения образца между сферами.
На графике коэффициента пропускания для образцов 100 мкм наблюдается разброс ~10% , который, как мы полагаем, связан с неоднородностью свойств образцов, и наличием в препарате пузырей.
Из рис. 2 видно, что для образцов ткани толщиной 100 мкм зависимости коэффициента полного пропускания от положения образца между сферами близки к линейным.
Измерения оптических параметров с источником 1,55 мкм
Данные зависимостей нормированных мощностей, регистрируемых верхней (пропускание) и нижней (отражение) сферами от положения образца представлены на рис. 3.
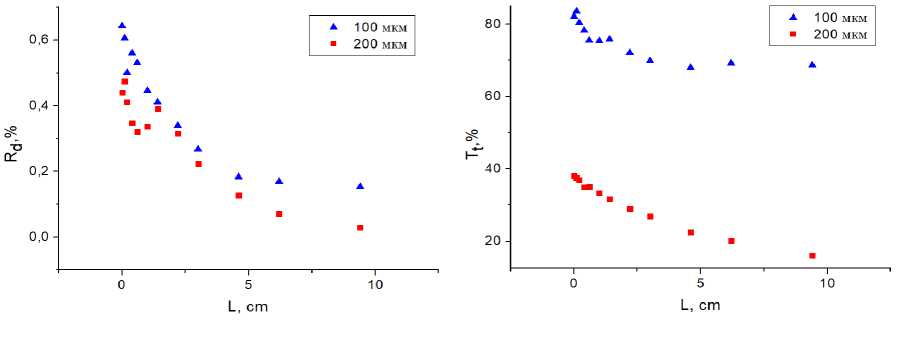
Рисунок 3. Зависимости нормированных мощностей для пропускания () и диффузного отражения () для срезов хрящевой ткани толщиной 100 и 200 мкм в зависимости от положения образца между сферами
Следует отметить, что при измерении на длине волны 1550 нм ввиду меньшей чувствительности используемых фотодетекторов значительно возрастает погрешность.
Для зависимостей коэффициента полного пропускания наблюдается хорошая повторяемость, что свидетельствует о корректности получаемых данных. Для зависимостей коэффициента диффузного отражения (обратного рассеяния) ошибки измерения становятся довольно значительными, т.к. уровень обратного рассеяния довольно низкий. Следует отметить, что в регистрируемый сигнал вклад вносит также засветка и шум фотодетектора.
Обсуждение:
Ниже, на рисунке 4, приведены графики зависимостей для излучения с Л=0,97 мкм, рассчитанных методом Монте-Карло, с использованием оптических параметров, приведенных в табл. 1 для образца толщиной 200 мкм. Расчет параметров проводился обратным методом Монте-Карло, в качестве функции, описывающей акт рассеяния, использовалась функция Хеньи-Гринштейна.
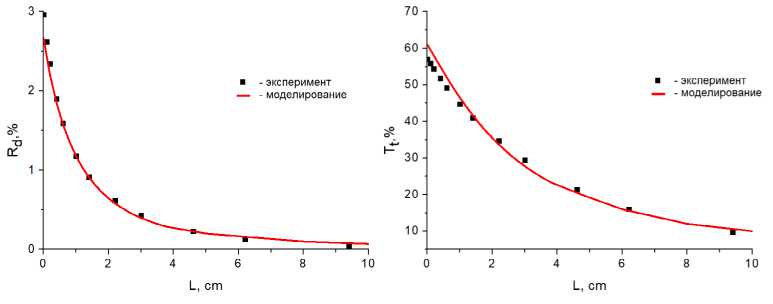
Рисунок 4. Зависимость нормированного сигнала регистрируемой мощности излучения с ^=0,97 мкм от положения образца (d = 200 мкм) слева - отражение, справа – пропускание.
На рисунке 5 приведены графики зависимостей для излучения с 2 =1,55 мкм, рассчитанных методом Монте-Карло, с использованием оптических параметров, приведенных в таблице 2. Расчет параметров проводился обратным методом Монте-Карло, в качестве функции, описывающей акт рассеяния, использовалась функция Хеньи-Гринштейна

Рисунок 5. Зависимость нормированного сигнала регистрируемой мощности излучения с 2 =1,55 мкм от положения образца (d = 100 мкм) слева - отражение, справа – пропускание.
Таблица 1
Оптические характеристики хрящевой ткани для длины волны 0,97 мкм и 1,55 мкм.
|
Длина волны Параметр |
2 =0,97 мкм |
2 =1,55 мкм |
|
Коэффициент поглощения (μа, мм-1) |
0,14±0,02 |
0,8±0,1 |
|
Коэффициент рассеяния (μs, мм-1) |
19±2 |
3,7±0,4 |
|
Фактор анизотропии рассеяния (g) |
0,95±0,01 |
0,9±0,01 |
Используя данные, представленные в таблице 1, легко оценить, как изменяется интенсивность падающего излучения с глуби- ной при проникновении в хрящевую ткань. Хорошо известно, что интенсивность света в ткани уменьшается с увеличением расстояния x от источника по экспоненциальному закону:
-
- * 1
-
1 = 1 0 е 8 , где 5 = •. и ^ = g s (1 - д) (5)
J3Ha(Ha+Ms)
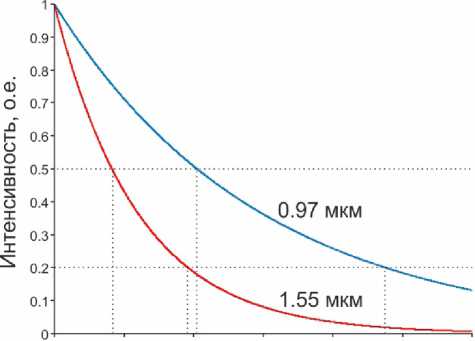
На рисунке 6 показаны зависимости интенсивности лазерных излучений с 2 =0,97 мкм и 2 =1,55 мкм с глубиной, полученные из соотношения (5). Видно, что интенсивность более длинноволнового излучения спадает значительно быстрее. Для 2 =1,55 мкм интенсивность уменьшается в два раза по сравнению с начальной уже на глубине ~0.4 мм, а для 2 =0,97 мкм - на глубине ~1мм. При этом на глубине 1
мм интенсивность излучения с Л =1,55 мкм составляет менее 20% от исходной.
О 0.5 1 1.5 2 2.5 3
Глубина, мм
Рисунок 6. Рассчитанные по (5) зависимости интенсивности лазерных излучений с >1=0,97 мкм и >1=1,55 мкм с глубиной проникновения в хрящевую ткань.
Таким образом при прохождении через толщу хрящевой ткани излучение с длиной волны 0,97 мкм преимущественно не поглощается, и, рассеиваясь, проникает вглубь хряща. При этом мощность постепенно понижается до параметров низкоинтенсивного лазерного излучения, которое, мы полагаем, способно индуцировать регенераторные процессы в хряще и субхондральной кости (куда также проникает) по механизму фотобиомодуляции [30, 31]. В свою очередь, излучение с длиной волны 1,55 мкм при прохождении через толщу хрящевой ткани преимущественно поглощается в поверхностных отделах, лишь незначительно рассеиваясь и незначительно проникая вглубь хряща.
Подобная закономерность наблюдается также и в работах других авторов [32, 33, 34, 35], хотя числовые значения μа и μs расходятся в отдельных работах, что можно объяснить различиями в условиях экспериментов, качестве образцов, а также методах измерения.
Выводы:
Данный эксперимент позволил нам ответить на возникшие ранее в рамках более крупного исследования [22] вопросы. Были определены коэффициенты поглощения и рассеяния лазерных излучений с длинами волн Л =1.55 мкм и Л =0.97 мкм и на основании полученных данных сделаны следующие выводы:
-
1) При прохождении через толщу суставного хряща коэффициент поглощения (μа) у лазерного излучения с Л =0,97 мкм значительно ниже чем у лазерного излучения с Л =1,55 мкм.
-
2) При прохождении через толщу суставного хряща коэффициент рассеяния (^ s ) у лазерного излучения с Л =0,97 мкм значительно выше чем у лазерного излучения с Л =1,55 мкм.
-
3) При лазерной обработке очага хондропатии сочетанным излучением Л =0,97 мкм + Л =1,55 мкм, излучение Л =1,55 мкм «сглаживает» поверхность суставного хряща в очаге хондро-маляции позволяя достигать восстановления структурности суставной поверхности, а параметры излучения Л =0,97 мкм в толще суставного хряща позволяют запустить механизмы фотобиомодуляции в суставном хряще и подлежащей субхондральной кости.
Список литературы Поглощение и рассеяние лазерного излучения в суставном хряще при обработке очага хондропатии
- Glyn-Jones S., Palmer A. J. R. Agricola, AJ Price, TL Vincent, H. Weinans . AJ Carr, Osteoarthritis. Lance., 2015; 386(9991): 376-87 Doi: 10.1016/S0140-6736(14)60802-3
- Madry H., Kon E., Condello V., Peretti G.M., Steinwachs M., Seil R., Berruto M., Engebretsen L., Filardo G., Angele P. (2016) Early osteoarthritis of the knee. Knee Surg Sports Traumatol Arthrosc, 2016;24:1753-1762 Doi: 10.1007/s00167-016-4068-3
- Корнилов Н. Н., Денисов А. А. Парадигма раннего гонартроза: обзор современных возможностей диагностики и лечения (часть 1) //Терапевтический архив // 2017; 12-2(89):238-243. [Kornilov N. N., Denisov A. A. Paradigma rannego gonartroza: obzor sovremennyh vozmozhnostej diagnostiki i lecheniya (chast’ 1) Terapevticheskij arhiv 2017; 12-2(89):238-243]
- Иванников С. В Лазерная артроскопическая хирургия (Дегенеративно-дистрофические поражения коленного сустава). Москва, 2001; 19 с. [Ivannikov S. V. Lazernaya artroskopicheskaya hirurgiya (Degenerativno-distroficheskie porazheniya kolennogo sustava) Moscow, 2001; pp. 19]
- Перспективы лечения дискогенных компрессионных форм пояснично-крестцовых радикулитов с помощью пункционных неэндоскопических лазерных операций // Сандлер Б. И. [и др.]. Владивосток. 2004. 181 с.[ Sandler B. I. et al. Perspektivy lecheniya diskogennyh kompressionnyh form poyasnichno-krestcovyh radikulitov s pomoshch’yu punkcionnyh neendoskopicheskih lazernyh operacij Vladivostok 2004; 181p.]
- Лазерная инженерия хрящей / Баграташвили В. Н. [и др.]. Москва. 2006. 448 с. [Bagratashvili V. N. et al. Lazernaya inzheneriya hryashchej Moscow, 2006. 448 p. ]
- Sobol E. etal. Laser regeneration of spine discs cartilage: mechanism, in-vivo study and clinical applications. Proceedings of Light-Activated Tissue Regeneration and Therapy Conference. Springer, Boston, MA, 2008. Pp. 259-266. Doi: 10.1007/978-0-387-71809-5_24
- Holden P. K. et al. The effects of laser irradiation of cartilage on chondrocyte gene expression and the collagen matrix. Lasers in Surgery and Medicine: The Official Journal of the American Society for Laser Medicine and Surgery, 2009; 7(41):487-491 Doi: https://doi.org/10.1002/lsm.20795
- Wong B. J. F. et al. Identification of chondrocyte proliferation following laser irradiation, thermal injury, and mechanical trauma. Lasers in Surgery and Medicine: The Official Journal of the American Society for Laser Medicine and Surgery, 2005; 1(37):89-96 Doi: https://doi.org/10.1002/lsm.20180
- Yusupov V. I., Chudnovskii V. M., Bagratashvili V. N. Laserinduced hydrodynamics in water-saturated biotissues. 1. Generation of bubbles in liquid. Laser physics 2010; 7(20):1641-1646 Doi:10.1134/S1054660X1014001X
- Yusupov V. I., Chudnovskii V. M., Bagratashvili V. N. Laser-induced hydrodynamics in water-saturated biotissues: 2. Effect on delivery fiber. Laser Physics, 2011; 7(21): 1230-1234 Doi:10.1134/S1054660X11140015
- Yusupov V. I. et al. Laser-induced hydrodynamics in water-saturated tissue: III. Optoacoustic effects. Laser Physics, 2013; 1(24): 015601 Doi:10.1088/1054-660X/24/1/015601
- Yusupov V. I. et al. Generation of acoustic waves by cw laser radiation at the tip of an optical fiber in water. Acoustical Physics, 2016; 5(62): 537-544. Doi:10.1134/S1063771016050183
- O’Conor C. J., Case N., Guilak F. Mechanical regulation of chondrogenesis. Stem cell research & therapy, 2013; 4(4): 1-13 Doi:10.1186/scrt211
- Fahy N., Alini M., Stoddart M. J. Mechanical stimulation of mesenchymal stem cells: Implications for cartilage tissue engineering. Journal of Orthopaedic Research, 2018; 1(36): 52-63 Doi :10.1002/jor.23670
- Juang Y. M. et al. Proteomic analysis of chondrocytes exposed to pressure. Biomedical Chromatography, 2010:12(24): 1273-1282 Doi:10.1002/bmc.1436
- Mizuno S., Ogawa R. Using changes in hydrostatic and osmotic pressure to manipulate metabolic function in chondrocytes. American Journal of Physiology-Cell Physiology, 2011;6(300): 1234-1245 Doi:10.1152/ajpcell.00309.2010
- Karamesinis K. et al. Continuous hydrostatic pressure induces differentiation phenomena in chondrocytes mediated by changes in polycystins, SOX9, and RUNX2. Journal of Orofacial Orthopedics/Fortschritte der Kieferorthopädie, 2017;1(78):21-31 Doi:10.1007/s00056-016-0061-1
- Sobol E. N. et al. Laser-induced regeneration of cartilage. Journal of Biomedical Optics, 2011; 8(6): 080902. Doi:10.1117/1.3614565
- Alexandrovskaya Y. M. et al. Mechanisms of laser activation of chondrocytes in osteoarthritis healing. Laser Physics Letters, 2018;8(15): 085601 Doi:10.1088/1612-202X/aac746
- Баум О. И. Механизмы модификации хрящевой ткани и тканей глаза под действием лазерного излучения. Москва. 2016. 22 с. [Baum O. I. Mekhanizmy modifikacii hryashchevoj tkani i tkanej glaza pod dejstviem lazernogo izlucheniya Moscow 2016; 22 p.]
- Лазерная обработка хондромаляции суставного хряща / А. В Лычагин. и [др.]. //Лазерная медицина. 2022;4(25): 9-15 Doi; https://doi.org/10.37895/2071-8004-2021-25-4-9-15 [A. V Lychagin et al. Lazernaya obrabotka hondromalyacii sustavnogo hryashcha Lazernaya 2022;4(25): 9-15. Doi; https://doi.org/10.37895/2071-8004-2021-25-4-9-15]
- Welch A. J., Van Gemert M. J. Optical-thermal response of laserirradiated tissue New York: Springer, 2011; 2:47 doi: 10.1007/978-90-481-8831-4
- Yaroslavsky I. V. et al. Inverse hybrid technique for determining the optical properties of turbid media from integrating-sphere measurements. Applied Optics, 1996;34(35): 6797-6809 doi: 10.1364/AO.35.006797
- Kovalenko N. V. et al. Optical properties of biological tissues evaluation with a hybrid goniometer and integrating-sphere technique and Monte Carlo mathematical modelling. Journal of Physics: Conference Series, 2019;1(1391):012025 Doi: 10.1088/1742-6596/1391/1/012025
- Jacques S. L., Wang L. Monte Carlo modeling of light transport in tissues. Optical-thermal response of laser-irradiated tissue, Springer, Boston, MA, 1995; pp. 73-100 Doi: 10.1007/978-1-4757-6092-7_4
- Юсупов В.И., Минаев Н.В., Свиридов А.П. Установка для определения оптических характеристик тонких образцов // Приборы и техника эксперимента //2019;6:130-131 doi: 10.1134/S0032816219050276
- Sviridov, A. P., Zhigarkov, V. S., Shubnyi, A. G. E., Yusupov, V. I. Optical fields in porous polylactide matrices. Quantum Electronics, 2020;1(50):81 doi: 10.1070/QEL17236
- Karpova TK, Kovalenko NV, Aloian GA, Ryabushkin OA. Mathematical modelling of optical radiation transport in biological tissues under the conditions of moveable integrating spheres registration. In Journal of Physics: Conference Series, 2021;1(209):012026 doi: 10.1088/1742-6596/2090/1/012026
- Amaroli A. et al. An 808-nm diode laser with a flat-top handpiece positively photobiomodulates mitochondria activities. Photomedicine and Laser Surgery, 2016;11(34): 564-571 https://doi.org/10.1089/pho.2015.4035
- Fekrazad R. et al. Effect of photobiomodulation on mesenchymal stem cells. Photomedicine and laser surgery, 2016;11(34);533-542 https://doi.org/10.1089/pho.2015.4029
- Bagratashvili, V. N., Bagratashvili, N. V., Gapontsev, V. P., Makhmutova, G. S., Minaev, V. P., Omel’chenko, A. I., ... & Tsypina, S. I. Change in the optical properties of hyaline cartilage heated by the near-IR laser radiation. Quantum Electronics, 2001;6(31):534 Doi: 10.1070/QE2001v-031n06ABEH001996
- Ebert, D. W., Roberts, C. J., Farrar, S. K., Johnston, W. M., Litsky, A. S., & Bertone, A. L. (1998). Articular cartilage optical properties in the spectral range 300--850 nm. Journal of Biomedical Optics, 1998;3(3):326-333 Doi: 10.1117/1.429893
- Sviridov, A. P., & Kondyurin, A. V. Optical characteristics of cartilage at a wavelength of 1560 nm and their dynamic behavior under laser heating conditions. Journal of Biomedical Optics, 2010;5(15):055003 Doi: 10.1117/1.3484749
- Khan, B., Kafian-Attari, I., Nippolainen, E., Shaikh, R., Semenov, D., Hauta-Kasari, M., ... & Afara, I. O. Articular cartilage optical properties in the near-infrared (NIR) spectral range vary with depth and tissue integrity. Biomedical optics express, 2021;10(12):6066-6080 Doi: 10.1364/BOE.430053


