Поиск ассоциаций молекулярных маркеров с признаком времени перехода к цветению в естественных и искусственных популяциях Brassica rapa L
Автор: Артемьева А.М., Руднева Е.Н., Цао Ж., Боннема Г., Будан Х., Чесноков Ю.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: ДНК-технологии, трансгенез, молекулярное маркирование
Статья в выпуске: 1 т.47, 2012 года.
Бесплатный доступ
Исследовали хромосомные локусы, ассоциированные со временем перехода к цветению в двуродительской расщепляющейся популяции линий двойных гаплоидов и в стержневой коллекции местных и селекционных сортов-популяций B. rapa, используя различные типы молекулярных маркеров. Применяя методику QTL-анализа и ассоциативного картирования, нашли и картировали хромосомные локусы, расположенные во 2-й, 3-й, 5-й, 6-й, 7-й и 10-й группах сцепления, и установили AFLP-, SSR- и S-SAP-маркеры, сцепленные со временем цветения.
S-sap-маркеры, днк-маркеры, qtl-анализ, ассоциативное картирование
Короткий адрес: https://sciup.org/142133267
IDR: 142133267 | УДК: 633:581.145:575:577.21:57.08
Текст научной статьи Поиск ассоциаций молекулярных маркеров с признаком времени перехода к цветению в естественных и искусственных популяциях Brassica rapa L
Несколько паралогов FLC (BrFLCl, BrFLC2, BrFLC3, BrFLC5), действующих у B. rapa подобно генам FLC у Arabidopsis, картированы в син-теничных для Arabidopsis участках хромосом (9-11). У B. rapa в предшествующих исследованиях QTL, контролирующих время цветения, установлена роль FLC-генов как генов-кандидатов (12-14). Главный QTL с BrFLC2 в качестве гена-кандидата, определяющего сроки цветения и ответ на яровизацию, был идентифицирован во 2-й группе сцепления в не- скольких популяциях B. rapa, выращенных в различных географических и климатических условиях, QTL с BrFLCl — в 10-й (14-16).
Генетическое картирование осуществляется через поиск взаимосвязей молекулярных маркеров с признаками, а его результат отражает параллельную генотипическую и фенотипическую изменчивость в искусственных и естественных популяциях, в том числе в коллекциях растительных ресурсов. Методически оно выполняется с помощью QTL-анализа специально созданных двуродительских расщепляющихся популяций и посредством ассоциативного картирования. Ассоциативное картирование у растений основано на выявлении неравновесного сцепления (linkage disequilibrium, LD), которое существует в естественных и селекционных популяциях, в том числе в коллекциях неродственных генотипов, и учете структуры популяций на уровне как отдельных генов, так и целого генома (17). Ассоциации маркер—признак могут быть найдены, если неравновесное сцепление между маркером и геном, контролирующим признак, еще не полностью разрушено рекомбинацией (18). При таком подходе генетическое разнообразие, выраженное через аллельный полиморфизм, сравнивается с наблюдаемым фенотипическим варьированием. Преимущества метода ассоциативного картирования перед QTL-анализом следующие: как правило, наблюдаемая изменчивость изучаемых признаков больше, нет необходимости создавать расщепляющиеся популяции, а разрешение картирования выше, чем при анализе популяций, полученных от контролируемых скрещиваний (19, 20).
В первой работе по ассоциативному картированию B . rapa с использованием коллекции из Нидерландов были найдены AFLP-маркеры (AFLP — amplified fragment length polymorphism), ассоциированные с тремя морфологическими признаками листа, содержанием фитатов и временем цветения после яровизации и без нее (21). Еще одна научная публикация посвящена дизайну стержневой коллекции B . rapa для ассоциативного картирования на примере времени цветения как фенологического признака (22).
В нашем исследовании мы впервые в России предприняли попытку выявить генетические локусы, определяющие время перехода к цветению у генотипов в двуродительской расщепляющейся популяции и у образцов в стержневой коллекции местных и селекционных сортов-популяций Brassica rapa , используя для этого различные типы молекулярных маркеров, а также сравнили результаты, полученные при QTL- и ассоциативном картировании.
Методика . При QTL-анализе материалом для 3-летних исследований служила двуродительская расщепляющаяся популяция линий двойных гаплоидов, полученная в Университете Вагенингена (Нидерланды) от скрещивания листовой/черешковой китайской капусты и масличного желтого сарсона (DH38, 68 линий). Для ассоциативного картирования использовали стержневую коллекцию ВИР, состоящую из 96 сортов-популяций, в эксперименте по дизайну европейской стержневой коллекции — 102 сорта-популяции из коллекции ВИР и 137 образцов из стержневой коллекции Университета Вагенингена (WUR), включающие все ботанические подвиды, разновидности и морфологические типы B . rapa различного экологогеографического происхождения.
Полевое фенотипическое описание линий DH38 проводили в Пушкинском филиале ВИР (Ленинградская обл.) и на Дагестанской опытной станции ВИР (г. Дербент), стержневой коллекции ВИР — в Пушкинском филиале ВИР, коллекции из Нидерландов — в Вагенингене. Дату появления цветоносного стебля у 10 % растений отмечали как начало видимого 22
перехода в репродуктивную стадию развития; также регистрировали даты появления цветоноса у 75 % растений образца, начала цветения ли-нии/образца (цветение у 10 % растений) и полного цветения (цветение у 75 % растений) (23).
Линии DH38 были генотипированы 326 молекулярными AFLP- и SSR-маркерами (SSR — simple sequence repeats) (24). Для исследования генотипического варьирования двух стержневых коллекций по стандартной методике ПЦР применили 13 пар микросателлитных праймеров (22) и один BrFLCl -специфичный CAPS-маркер (CAPS — cleaved amplified polymorphic sequence), которые представляли генетические локусы для всех 10 групп сцепления у вида, то есть обеспечили хорошее покрытие генома. Для ассоциативного картирования признака времени цветения в двух коллекциях с выявлением генов-кандидатов использовали биаллельный CAPS-маркер BrFLCl (15), локализованный в 10-й группе сцепления, и мульти-аллельный SSR-маркер BRH04D11- BrFLC2 (16 аллелей), картированный во 2-й группе сцепления. Для отдельного генотипирования стержневой коллекции ВИР (96 образцов) и поиска в ней ассоциаций с анализируемым признаком применяли стандартные методы SSR и AFLP и набор праймеров, включающий 21 пару SSR-праймеров, 1 CAPS-маркер и 12 пар S-SAP-праймеров, созданных на основе последовательностей мобильных генетических элементов II класса САСТА. САСТА-специфичными служили праймеры, созданные на основе TIR длиной 17 и 19 п.н., которые описаны K. Alix с соавт. (25): BoB029L16 (CACTACAAGAAAACAGC) и часть BoB048N13 (CACTACAAGAAAACAGCGA). Для селективной амплификации использовали Mse-CAC, Mse-CAT+CAG, Mse-CCG, Mse-CCT, Mse-CGT и Eco-ACA, которые были выбраны в предварительных тестовых испытаниях.
Для QTL-анализа применяли компьютерную программу MAPQTL 6.0 (26), с помощью которой установили присутствие и расположение QTL (кандидатов) в группе сцепления (интервал картирования 5 сМ), значения LOD (logarithm of odds — десятичный логарифм шансов) (P = 0,05) и степень варьирования признаков, которые объясняются соответствующим QTL для каждого признака и популяции. Значимость каждого LOD устанавливали в тесте пермутации (1000 повторений). Анализ структуры популяции проводили с помощью компьютерной программы Structure 2.2 . Для визуализации изменчивости морфологических признаков в коллекциях и объединения образцов по фенотипу выполняли анализ главных компонент. Дисперсионный анализ (ANOVA) использовали для расчета ассоциации SSR-аллелей BRH04D11-BrFLC2 со временем цветения.
При анализе ассоциаций на материале стержневой коллекции B . rapa ВИР провели стандартизацию данных, при которой применяли молекулярную матрицу (1 — наличие, 0 — отсутствие маркера), а фенологическим показателям, связанным со временем цветения (начало стеблевания, полное стеблевание и цветение), присваивали размерность от 0 до 1, а затем ранжировали. Расчет генетической дистанции и анализ подобия выполняли с использованием программы NTSYSpc, кластерный анализ — методом neighbor joining (NJ). В результате изучаемые признаки были интегрированы в дендрограмму, а кластеризованные рядом с ними молекулярные фрагменты представляли собой искомые маркеры для этих признаков.
Результаты . Варьирование по признаку начала перехода к цветению между линиями расщепляющейся популяции DH38 было значительным и зависело от года испытаний. Так, в 2007 году показатели составили 32-64, в 2008 году — 76-89, в 2009 году — 33-55 сут. Нами выделены линии
DH38 (номера 46, 69, 77, 87, 142), устойчивые к раннему переходу в генеративную фазу, что коррелировало с высокой продуктивностью, более чем на 50 % превосходящей среднюю для популяции.
В результате анализа наблюдаемого по годам изменения позиции хромосомных локусов (QTL), определяющих время перехода к цветению в популяции DH38, мы обнаружили AFLP- и SSR-маркеры, сцепленные с этими локусами. Были выявлены QTL, входящие во 2-ю группу сцепления, причем в 2007-2008 годах большой QTL располагался на вершине группы, то есть там, где локализуется главный QTL с BrFLC2 как геном- кандидатом, участвующим в контроле времени цветения и ответе на яро визацию, эффект которого явно снижается под влиянием яровизирующих температур (16) (табл. 1). Этим эффектом объясняется отсутствие указанного QTL в прохладный 2009 год. Также установлен QTL, находящийся в середине 2-й группы сцепления (его действие отмечали все 3 года исследований) и QTL с невысокими значениями LOD (0,52-2,02), относящиеся к 7-й группе сцепления, из которых один, расположенный в середине группы, проявлялся в течение 3 лет в условиях Пушкинского филиала
ВИР (см. табл. 1), а также в Дагестане. В исследованиях, проведенных в Нидерландах, QTL в R07 (7-я группа сцепления) обнаружили в популяции F2, полученной при использовании той же родительской пары. Кроме того, QTL в 2008-2009 годах выявляли в 3-й, 5-й и 10-й группах сцепления, а в 2007 и 2009 годах — в 4-й группе сцепления (в близких позициях или на расстоянии друг от друга), что согласуется с результатами, полученными для той же картирующей популяции в Нидерландах (14, 21). В 2009 году в условиях Дербента QTL, контролирующие время начала появления цветоносного стебля, были найдены во 2-й, 3-й, 6-й, 7-й, 8-й и 10-й группах сцепления. Интересно отметить совпадающие или очень близкие позиции маркеров в нижней части R02, в верхней и средней части R07 и в нижней части R10 при анализе в Пушкинском филиале ВИР и на Дагестанской опытной станции ВИР. Таким образом, по нашим данным, здесь расположены наиболее стабильные геномные районы, связанные со вре менем перехода в генеративную фазу.
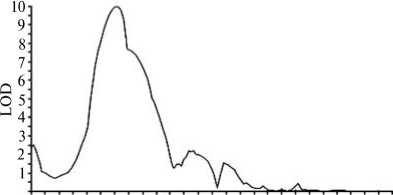
0 10 20 30 40 50 60 70 80 90 100 110 120 130 Длина группы сцепления, сМ
Рис. 1. QTL времени перехода к цветению (2-я группа сцепления) у вида Brassica rapa L. LOD — десятичный логарифм шансов (г. Санкт-Петербург—Пушкин, 2008 год).
Анализ условий вегетации в период исследований в обеих географических зонах заставляет предположить, что действие QTL, расположенного на вершине 2-й группы сцепления, проявляется в относительно жаркую погоду при отсутствии яровизирующих температур. Это согласуется с данными J. Zhao с соавт. (16), описавших, как уже отмечалось, снижение эффекта главного QTL с BrFLC2 на вершине R02 при яровизации. Они наблюдали, что на всех стадиях развития растений и во всех тканях уровень транскрипции BrFLC2 выше у поздноцветущих DH линий по сравнению с раноцветущими. Редукция экспрессии QTL с BrFLC2 у рано- и поздноцветущих линий была наиболее сильной при яровизации в стадии проростка, следо вательно, срок перехода к цветению определяется в онтогенезе очень рано. Авторы рассматривают BrFLC2 в качестве гена-кандидата в связи с контролем времени цветения и ответа на яровизацию у B. rapa (16).
-
1. Расположение QTL, контролирующих время начала перехода в репродуктивную фазу в популяции DH38 линий двойных гаплоидов Brassica rapa L. по годам исследований (г. Ca^кт-Пeтepбypг—Пy0ки^)
2007 ãîä
2008 ãîä
2009 ãîä
Ãðóïïà ñöåïëåíèÿ
LOD/èçìåí-÷èâîñòü, %
Ìàðêåð/ïîçèöèÿ, ñÌ
Ãðóïïà ñöåïëåíèÿ
LOD/èçìåí-÷èâîñòü, %
Ìàðêåð/ïîçèöèÿ, ñÌ
Ãðóïïà ñöåïëåíèÿ
LOD/èçìåí-÷èâîñòü, %
Ìàðêåð/ïîçèöèÿ, ñÌ
R02
1,01/8,9
Ks50030/0
R02
2,34/17,4
Ks50030-/0
R02
2,31/19,9
P23M47115.6/35,439
1,14/9,9
E34M16M122.2Y/46,260
9,95/82,0
/31,409
1,61/14,3
E34M15143.3/44,676
7,66/50,9
R11/34,84
0,86/7,9
E32M52136.7y/66,497
5,03/34,3
P23M47M115.6-/43,455
2,11/15,7
E32M52M317.7-/57,449
1,54/11,9
Br326t/69,076
R03
2,81/20,3
P23M48M149.0t/3,998
R03
0,80/7,4
E34M16M105.9y/69,414
1,05/8,4
E39M22M274.3-/13,283
1,16/8,9
E34M15M245.7-/16,505
1,04/8,1
BRMS-043t/18,900
R04
1,26/11,0
Na10D09R04/11,860
R04
1,11/10,1
P21M47178.6/47,165
1,11/9,7
E34M15456.4/19,427
R05
2,86/21,6
P23M48M63.6t/41,966
R05
2,47/21,1
P23M4864.7y/8,495
1,56/11,8
Myb2Hae3M263.7t/53,916
1,68/14,9
E44M2077.9/24,969
1,58/12,0
E44M20M89.8-/62,735
1,75/15,5
E36M15M153.9/40,740
1,92/16,8
E44M16M181.3/50,826
R06
1,71/14,6
E34M15446.7y/0
R07
0,52/4,7
E39M22290.7y/50,198
R07
1,16/9,5
P23M48M221.9t/41,742
R07
1,46/13,0
P23M50339.1/3,000
0,89/8,2
E32M16409.0/27,318
2,02/17,6
E39M20294.4/57,741
R09
1,52/13,1
E32M16188.3y/32,004
2,10/17,6
E32M16177.4Y/39,052
1,38/12,0
E34M16M366.9Y/51,784
R10
1,55/11,9
E44M21M190.7-/43,222
R10
0,90/8,3
FLC1/21,427
1,23/9,6
E34M16M204.0-/61,355
0,73/6,7
E44M21190.7/40,002
1,60/12,9
BRH80A08flc1t/73,081
Ï ð è ì å ÷
à í è å. LOD —
äåñÿòè÷íûé ëîãàðèôì øàíñîâ .
В популяции DH38 мы выявили QTL, которые характеризовались высокими значениями LOD в отдельные годы и контролировали одновременно несколько важных признаков. Например, QTL, расположенный в середине 2-й группы сцепления, в 2008 году объяснял до 82 % варьирования срока перехода к цветению (LOD — 9,95) (рис. 1), 35 % изменчивости диаметра листовой розетки (LOD — 4,67), 18 % изменчивости массы растения, 31-40 % изменчивости длины черешка, а также длины и ширины листовой пластинки, причем AFLP-маркер R11 маркировал все эти признаки. В 7-й группе сцепления находился QTL, контролирующий диаметр стебля, высоту и массу растения (соответственно 24, 25 и 11 % варьирования признаков). В 10-й группе сцепления имелся еще один QTL, контролирующий диаметр стебля и габитус растения, тип листа, длину черешка, длину и ширину листовой пластинки (LOD — 1,61-3,67). Наши данные подтверждают известный факт о сильной корреляционной зависимости между размерами растения и временем перехода к цветению у листовых культур B . rapa .
Таким образом, формирование сложного количественного признака обычно находится под контролем нескольких QTL, расположенных в разных группах сцепления. В популяции DH38 QTL, детерминирующие комплекс признаков (время перехода к цветению, размеры растения и его продуктивных органов — черешка и листовой пластинки), находятся в основном во 2-й, 3-й, 7-й и 10-й группах сцепления и формируют блоки коадаптированных генов и коадаптированные блоки генов (18), что подчеркивает важность вклада этих локусов в онтогенез растения.
Нами выявлены хромосомные локусы, экспрессия которых либо зависит, либо не зависит от условий окружающей среды. Во втором случае позиция QTL в группе сцепления сохранялась в течение всех лет испытания, но величина LOD при этом могла варьировать. Были также обнаружены QTL, позиции которых по годам меняются не более чем на 1-6 сМ, и хотя при этом у них разные маркеры, такие локусы можно рассматривать как неизменные. Часто константные QTL имели невысокие значения LOD и их вклад в изменчивость признаков составлял 10-20 %. По всей вероятности, именно с ними связана стабильность типичных морфологических признаков растения, а возможно, и повышенная адаптационная способность. Напротив, QTL, проявляющие действие только в отдельные годы, часто характеризовались высокими LOD и в значительной степени определяли изменчивость признаков растений в конкретных условиях. Обычно в случае независимых от влияния факторов среды QTL отмечаются высокие положительные аддитивные эффекты генов.
При поиске ассоциаций между молекулярными маркерами и признаками в естественных гетерозиготных и гетерогенных популяциях растений из двух стержневых коллекций, представляющих вид Brassica rapa , генетическое разнообразие, выраженное через аллельный полиморфизм набора маркеров, соотносили с наблюдаемым фенотипическим варьированием признаков листа и стручка, архитектоникой растений, временем цветения. Фенотипическая и генотипическая вариация у основных групп культур оказалась сравнима для обеих коллекций. При генотипировании обнаружили 88 полиморфных маркеров, из них 86 SSR-маркеров и BrFLCl -специфичный CAPS-маркер, которые использовали для анализа структуры популяции; число аллелей на маркер варьировало от 2 до 16. При анализе популяционной структуры была использована модель, которая допускает смешанное (гибридное) происхождение генотипов и наличие независимой частоты аллелей между подгруппами. Аллельное разнообразие, выраженное общим числом аллелей в каждой культуре/группе культур (пекинская ка-26
пуста, китайская капуста, японские листовые овощные, репа, брокколетто, озимая и яровая сурепица, китайские масличные), оказалось сходным в двух коллекциях. Фенотипическое варьирование внутри подвидов между двумя коллекциями также мало различалось, следовательно, морфологические типы были хорошо представлены в обеих коллекциях.
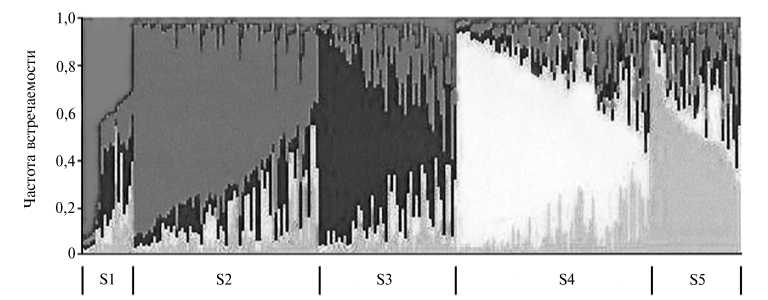
Рис. 2. Структура объединенной коллекции Brassica rapa L. по частоте встречаемости 88 полиморфных маркеров: S1 — 19 образцов яровых масличных из коллекции WUR (Университет Вагенингена, Нидерланды); S2 — 67 образцов пекинской капусты из обеих коллекций; S3 — 50 образцов (главным образом, китайская капуста) из обеих коллекций, по 2 образца пекинской капусты, китайских масличных и 3 образца японских листовых овощных; S4 — 70 образцов европейской репы из обеих коллекций, брокколетто, несколько масличных типов, а также китайские и индийские масличные из коллекции ВИР (Всероссийский НИИ растениеводства им. Н.И. Вавилова, г. Санкт-Петербург); S5 — 33 образца (главным образом, масличные типы из коллекции ВИР, а также масличные из Пакистана и японская репа).
Анализ популяционной структуры показал наличие в объединенной коллекции пяти подгрупп (рис. 2). Масличные культуры из коллекции ВИР образовали в ней отдельную, очень разнообразную группу, не представленную в коллекции WUR, послужив ценным дополнением последней. В то же время среди образцов из коллекции ВИР отсутствовали брокколетто и японская репа. Следует также отметить, что в сформированной коллекции структурные подгруппы оказались многочисленнее, что и требуется для более точной ассоциации маркеров с признаками.
|
2. Частота встречаемости (%) аллелей Brassica rapa L. |
гена BrFLCl у различных культур |
||
|
Культура | |
500 п.н. | |
500 п.н. и 800 п.н. |
| 800 п.н. |
|
Пекинская капуста |
7,0 |
49,3 |
43,7 |
|
Китайская капуста |
2,6 |
28,2 |
69,2 |
|
Брокколетто |
100 |
0 |
0 |
|
Японские листовые овощные |
35,7 |
35,7 |
28,6 |
|
Репа |
75,0 |
8,3 |
16,7 |
|
Масличные из коллекции ВИР |
37,0 |
51,9 |
11,1 |
|
Китайские масличные |
0 |
0 |
100 |
|
Яровые масличные |
18,2 |
9,1 |
72,7 |
|
Озимые масличные |
66,7 |
0 |
33,3 |
При ассоциативном картировании с использованием CAPS-маркера для гена-кандидата BrFLCl обнаружили, что его аллели размером 500 п.н. и 800 п.н., а также их совместное присутствие значительно ассоциированы со временем цветения у китайской капусты, японских листовых овощей и яровых масличных из коллекции ВИР (табл. 2). Интересно отметить, что для японских листовых овощей и масличных из коллекции ВИР эффект аллелей был аддитивным, в то время как у китайской капусты и репы гетерозиготы показали сверхдоминирование. Для пекинской капусты и яровых масличных из Нидерландов обнаружили только слабый эффект ассо- циации различных аллелей с изучаемым признаком у гетерозигот в один год испытаний. С использованным CAPS-маркером был визуализирован лишь единичный полиморфизм, однако в изученных образцах, видимо, присутствовало большее число аллелей с функциональными различиями. Следовательно, существует вероятность взаимодействий с другими аллелями или другими генами реализации цветения, что объясняет неодинаковую степень проявления признака в гетерозиготе у разных культур. Как и ожидалось, эффект BrFLCl в яровизирующих условиях падал, поскольку воздействие низких температур ведет к деградации экспрессии гена (10, 16). Корнеплодная репа требует продолжительного воздействия низких температур для сокращения времени до цветения, и действительно, у репы даже после яровизации BrFLCl-специфичный CAPS-маркер еще был ассоциирован со временем цветения. В исследованиях Y.X. Yuan с соавт. (15) также установлено, что BrFLCl задерживал время цветения в коллекции из 121 линии в среднем на 15 сут. Для точного понимания роли гена BrFLCl в регуляции времени цветения необходимо использование нескольких SNP-маркеров (SNP — single nucleotide polymorphism) для идентификации различных гаплотипов.
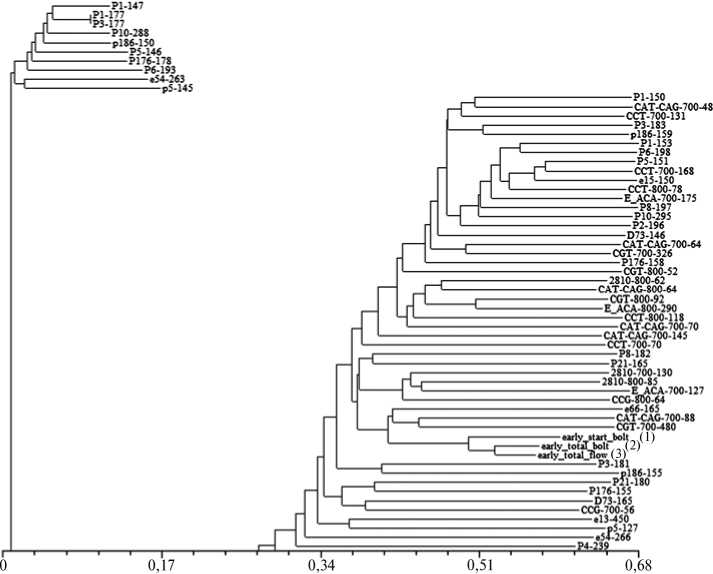
Коэффициент
Рис. 3. Фрагмент NJ-дендрограммы (NJ — neighbor joining) , показывающей взаимоотношения между SSR- и S-SAP-маркерами, с выделением кластера маркеров, ассоциированных с признаками раннего начала стеблевания (early start bolting) (1) , раннего полного стеблевания (early total bolting) (2) и раннего цветения (early total flowering) (3) у Brassica rapa L.
При скрининге аллельной вариации BrFLC2 специально созданным SSR-маркером BrH04D11-BrFLC2 значительную ассоциацию со временем цветения нашли у трех (211, 213 и 215 п.н.) из 16 аллелей BrFLC2, которые были относительно часты у корнеплодной репы, но в некоторых культурах встречались с низкой частотой или отсутствовали. Сходным образом эти аллели сегрегируют в популяции линий двойных гаплоидов DH38, что проиллюстрировало обнаружение главного QTL в локусе BrFLC2 (14). За- держка перехода к цветению у образцов репы может объясняться этими «поздними» аллелями, что представляется полезным для практической селекции. С помощью установленных маркеров могут быть выбраны образцы для скрещивания различных культур/типов с целью увеличения продолжительности времени до перехода в генеративную фазу. Полученные данные также объясняют причину обнаружения паралогов BrFLC в качестве генов-кандидатов при изучении различного материала (в двуродительских скрещиваниях участвуют аллели только двух исходных форм) (13, 14). Секвенирование аллелей BrFLC2 у образцов с неодинаковыми SSR-аллелями позволит установить, могут ли эти аллели служить надежными маркерами гаплотипов BrFLC2 или в ходе эволюции маркерные аллели и гаплотипы испытывают неодинаковое давление отбора и сегрегируют независимо друг от друга, что разрушает эту связь.

Р21-170
CAT-CAG-800-162
0,51
GT-800-238 ------CGT-800-124
CGT-800-112
РЮ-297
0,34
---Р94-250-14
CGT-800-280
—Р21-188
---Р176-172
Коэффициент
Рис. 4. Фрагмент NJ-дендрограммы (NJ — neighbor joining) , показывающей взаимоотношения между SSR- и S-SAP-маркерами, с выделением кластера маркеров, ассоциированных с признаками позднего начала стеблевания (late start bolting) (1) , позднего полного стеблевания (late total bolting) (2) и позднего цветения (late total flowering) (3) у Brassica rapa L.
— 2810-700-145 CAT-CAG-800-110
-CAT-CAG-700-118
-----2810-700-185
2810-700-118
---Р94-208-5 5 ------Р78-297
------Т4-233
Е АСА-800-220 -269 -152 '-119 — CCG-700-285 -----CCG-800-52 -----Р1-158 ---Р176-165
D73-149
ССТ-700-365
-------Р8-195
start of bo (1)
Р21-184 -134 . АСА-700-266
D73-135
Таким образом, оба маркера (CAPS и SSR) в значительной степени ассоциированы со временем цветения, но их эффекты ограничены несколькими культурами и/или аллелями. Поэтому при ассоциативном картировании популяция (коллекция) согласно статистическим расчетам должна быть численно увеличена до 400 образцов, а для облегчения фенотипирования и генотипирования необходимо фиксировать гетерогенные образцы через создание гомозиготных линий с использованием культуры микроспор.
Варьирование признака начала перехода к цветению между 96 образцами стержневой коллекции ВИР в условиях Пушкинского филиала ВИР было велико, но диапазон изменчивости в зависимости от года испы- таний менялся незначительно и составил в среднем 19-85 сут. Образцы корнеплодной репы, озимой сурепицы и японской капусты развивались по двулетнему типу, и у них начало появления цветоносного стебля отмечали на 210-245-е сут.
При анализе ассоциаций со временем цветения на материале B . rapa из коллекции ВИР обнаружили три SSR-маркера: для раннего цветения — аллель 165 п.н. биаллельного маркера Br372, локализованного в 7-й группе сцепления, для позднего — аллель 195 п.н. мультиаллельного маркера ВС89 (9 аллелей) в 6-й группе сцепления и, что очень интересно, аллель 202 п.н. мультиаллельного маркера BrH04D11 -FLC2 (16 аллелей) во 2-й группе сцепления. Из молекулярных маркеров, полученных на основе мобильных элементов II класса САСТА, с ранним цветением были связаны два (локализация в геноме неизвестна) (рис. 3, 4). В среднем по группе образцов, несущих маркер раннего перехода в генеративную стадию развития Br372-165, фаза стеблевания началась на 52-е сут, у образцов без маркера — на 112-е сут, у образцов с маркером CAT-CAG-700-88 — на 58-е сут, без этого маркера — на 27 сут позже, с маркером CGT-700-480 и без него — соответственно на 53-и и 108-е сут (табл. 3). Маркер позднего вступления в репродуктивную стадию ВС89-195 позволил выделить группу поздних генотипов с началом стеблевания на 137-е сут, в то время как образцы без маркера перешли в эту фазу на 45-е сут, а маркер BrH04D11- FLC2 — группу образцов, у которых она начиналась соответственно на 77-е и 59-е сут. Можно предположить, что эти молекулярные SSR- и САСТА-маркеры послужат эффективным генетическим и селекционным инструментом.
3. Средняя продолжительность фенофаз генеративного периода (сут) и их ассоциация с маркерами у образцов Brassica rapa L. из коллекции ВИР
|
Фенофаза |
Присутствие маркера |
Отсутствие маркера |
|
Начало стрелкования |
SSR Br372(e66), 165 п.н. 51,8 |
112,3 |
|
Полное стрелкование |
74,0 |
121,8 |
|
Цветение |
82,5 |
131,3 |
|
Начало стрелкования |
S-SAP CAT-CAG-700, 88 п.н. 58,0 |
85,4 |
|
Полное стрелкование |
73,1 |
118,6 |
|
Цветение |
82,3 |
128,3 |
|
Начало стрелкования |
S-SAP CGT-700, 480 п.н. 52,6 |
108,8 |
|
Полное стрелкование |
70,8 |
174,0 |
|
Цветение |
79,8 |
183,3 |
|
Начало стрелкования |
SSR BC189, 195 п.н. 137,3 |
45,2 |
|
Полное стрелкование |
160,7 |
71,4 |
|
Цветение |
170,3 |
74,8 |
|
Начало стрелкования |
SSR BrH04D11- FLC2 (P94), 202 п.н. 77,1 |
58,6 |
|
Полное стрелкование |
103,1 |
75,2 |
|
Цветение |
112,6 |
84,7 |
Итак, использование искусственных двуродительских сегрегирующих и естественных популяций для поиска ассоциаций между различными типами молекулярных маркеров и сроком перехода к цветению привело к сходным результатам и позволило обнаружить и картировать хромосомные локусы, расположенные во 2-й, 3-й, 5-й, 6-й, 7-й и 10-й группах сцепления у Brassica rapa , а также установить AFLP-, SSR- и S-SAP-маркеры, сцепленные со временем начала цветения. Применение этих маркеров (в особенности простых для определения микросателлитных маркеров) позволит осуществлять массовый скрининг коллекционных образцов вида, в том числе при пребридинговых исследованиях.
Выражаем искреннюю благодарность Н.В. Кочериной за помощь при математической обработке данных QTL-анализа, Г.Л. Чудовой и К.А. Артемьевой за помощь 30
â âûïîëíåíèè àãðîòåõíè÷åñêèõ ðàáîò ñ êîëëåêöèÿìè.
Ë È Ò Å Ð À Ò Ó Ð À
-
1. S p e c h t C.E., D i e d e r i c h s e n A. Brassica. Mansfeld’s Encyclopedia of agricultural and horticultural crops /P. Hanelt (ed.). Berlin, 2001, V. 3: 1435-1465.
-
2. H i n t u m T.J.L., B o u k e m a I.W. The establishment of the European database for Brassica . Plant Genet. Resour. Newsl., 1993, 94/95: 11-13.
-
3. B o u k e m a I.W., H i n t u m T.J.L. The European Brassica Database. Acta Hort. (ISHS), 1998, 459: 249-254.
-
4. K o o r n n e e f M., A l o n s o - B l a n c o C., V r e u g d e n h l i D. Naturally occur
ring genetic variation in Arabidopsis thaliana . Annu. Rev. Plant Biol., 2004, 55: 141-172.
-
5. A l e x a n d r C.M., H e n n i g L. FLC or not FLC: the other side of vernalization. J. Exp.
-
6. S e o E., L e e H., J e o n J., P a r k H., K i m H., N o h c Y.S., L e e I. Crosstalk
-
7. S c h m i t z R.J., A m a s i n o R.M. Vernalization: a model for investigating epigenetics and eukaryotic gene regulation in plants. Biochem. Biophys. Acta, 2007, 1769: 269-275.
-
8. S h e l d o n C.C., H i l l s M.J., L i s t e r C., D e a n C., D e n n i s E.S., P e ac o c k W.J. Resetting of FLOWERING LOCUS C expression after epigenetic repression by
vernalization. PNAS USA, 2008, 105: 2214-2219.
-
9. K i m J.S., C h u n g T.Y., K i n g G.J., J i n M., Y a n g T.J., J i n Y.M., K i m H.I.,
P a r k B.S. A sequence-tagged linkage map of Brassica rapa . Genetics, 2006, 174: 29-39.
-
10. K i m S.Y., P a r k B.S., K w o n S.J., K i m J., L i m M.H., P a r k Y.D. Delayed flowering time in Arabidopsis and Brassica rapa by the overexpression of FLOWERING LOCUS C ( FLC ) homologs isolated from Chinese cabbage ( Brassica rapa L.: ssp. pekinensis ). Plant Cell Rep., 2007, 26(3): 327-336.
-
11. Y a n g T.J., K i m J.S., K w o n S.J. Sequence-level analysis of the diploidization process in he triplicated FLOWERING LOCUS C region of Brassica rapa . The Plant Cell, 2006, 18: 1339-1347.
-
12. O s b o r n T.C., K o l e C., P a r k i n I.A., S h a r p e A.G., K u i p e r M., L y d i at e D.J., T r i c k M. Comparison of flowering time genes in Brassica rapa , B. napus and Arabidopsis thaliana. Genetics, 1997, 146(3): 1123-1129.
-
13. S c h r a n z M.E., Q u i j a d a P., S u n g S.B., L u k e n s L., A m a s i n o R., O sb o r n T.C. Characterization and effects of the replicated flowering time gene FLC in Brassica rapa. Genetics, 2002, 162(3): 1457-1468.
-
14. L o u P., Z h a o J., K i m J.S., S h e n S., P i n o D e l C a r p i o D., S o n g X. Quantitative trait loci for flowering time and morphological traits in multiple populations of Brassica rapa . J. Exp. Bot., 2007, 58: 4005-4016.
-
15. Y u a n Y.X., W u J., S u n R.F., Z h a n g X.W., X u D.H., B o n n e m a G., W a n g X.W.
-
16. Z h a o J., K u l k a r n i V., L i u N., P i n o D e l C a r p i o D., B u c h e r J., B o nn e m a G. BrFLC2 ( FLOWERING LOCUS C ) as a candidate gene for a vernalization re
sponse QTL in Brassica rapa. J. Exp. Bot., 2010, 61(6): 1817-1825.
-
17. F l i n t - G a r c i a S.A., T h o r n s b e r r y J.M., B u c k l e r E.S. Structure of linkage disequilibrium in plants. Annu. Rev. Plant Biol., 2003, 54(1): 357-374.
-
18. Æ ó ÷ å í ê î À.À., Ê î ð î ë ü À.Á. Ðåêîìáèíàöèÿ â ýâîëþöèè è ñåëåêöèè. Ì., 1985.
-
19. G u p t a P.K., R u s t g i S., K u l w a l P.L. Linkage disequilibrium and association studies in higher plants: present status and future prospects. Plant Mol. Biol., 2005, 57(4): 461-485.
-
20. M y l e s S., P e i f f e r J., B r o w n P.J., E r s o z E.S., Z h a n g Z., C o s t i c h D.E., B u c k l e r E.S. Association mapping: critical considerations shift from genotyping to experimental design. Plant Cell, 2009, 21(8): 2194-2202.
-
21. Z h a o J., P a u l o M.J., J a m a r D., L o u P., V a n E e u w i j k F., B o n n em a G. Association mapping of leaf traits, flowering time, and phytate content in Brassica rapa . Genome, 2007, 50(10): 963-973.
-
22. Z h a o J., A r t e m y e v a A., P i n o D e l C a r p i o D., B a s n e t R.K., Z h a n g N., G a o J., L i F., B u c h e r J., W a n g X., V i s s e r R.G.F., B o n n e m a G. Design of a Brassica rapa core collection for association mapping studies. Genome, 2010, 53: 884-898.
-
23. Ìåòîäè÷åñêèå óêàçàíèÿ ïî èçó÷åíèþ è ïîääåðæàíèþ ìèðîâîé êîëëåêöèè êàïóñòû. Ë., 1988.
-
24. L o u P., Z h a o J., H e H., H a n h a r t C., P i n o D e l C a r p i o D.P., V e r-
- k e r k R., C u s t e r s J., K o o r n n e e f M., B o n n e m a G. Quantitative trait loci for
glucosinolate accumulation in Brassica rapa leaves. New Phytologist, 2008, 179(4): 1017-1032.
-
25. A l i x K., J o e t s J., R y d e r C.D., M o o r e J., B a r k e r G.C., B a i l e y J.P.,
-
26. V a n O o i j e n J.W. MapQTL 6. Software for the mapping of quantitative trait loci in experimental populations of diploid species. Wageningen, Netherlands, 2009.
Bot., 2008, 59: 1127-1135.
between cold response and flowering in Arabidopsis is mediated through the flowering-time gene
SOC1 and its upstream negative regulator FLC. The Plant Cell, 2009, 21: 3185-3197.
A naturally occurring splicing site mutation in the Brassica rapa FLC1 gene is associated with variation in flowering time. J. Exp. Bot., 2009, 60(4): 1299-1308.
-
1 ГНУ Всероссийский НИИ растениеводства Поступила в редакцию
им. Н.И. Вавилова Россельхозакадемии, 22 августа 2011 года
190000 г. Санкт-Петербург, ул. Большая Морская, 42-44, e-mail: yu.chesnokov@vir.nw.ru , akme11@yandex.ru ;
-
2Laboratory of Plant Breeding, Wageningen University, P.O. Box 386, 6700 AJ Wageningen, the Netherlands;
-
3Institute for Breeding Research on Horticultural
Crops of JKI ,
Erwin-Baur-str., 27, D-06484 Quedlinburg, Germany
ASSOCIATIONS SEARCH OF MOLECULAR MARKERS WITH DETERMINANT OF BLOSSOM-TIME IN NATURAL AND ARTIFICIAL POPULATION OF Brassica rapa L.
A.M. Artem’eva1, E.N. Rudneva1, J. Zhao2, G. Bonnema2,
H. Budahn3, Yu.V. Chesnokov1
S u m m a r y
The authors studied the chromosomal loci, associated with blossom-time, in two-parental splitting population of double haploid and in pivotal collection of native and breeding varieties-populations of B. rapa, using the different types of molecular markers. Utilizing the techniques of QTL-analysis and association mapping the authors identified and mapped the chromosomal loci, situated in linkage group 2, 3, 5, 6, 7 and 10, and established the AFLP-, SSR- and S-SAP-markers, linked with blossom-time.
Научные конференции

24-26 августа 2011 года во Всероссийском НИИ цветоводства и субтропических культур (г. Сочи) состоялась Вторая Всероссийская научно-практическая конференция с международным участием «Декоративное садоводство России: состояние, проблемы, перспективы».
На конференции обсуждались достижения и проблемные вопросы в области цветоводства и декоративного садоводства. К числу основных проблем относится формирование ассортимента культур для наружного и внутреннего цветочно-декоративного оформления помещений, крупных рекреационных, производственных и жилых ком плексов. Исследования в этом направлении в последнее время достаточно актуальны, так как существующий ассортимент растений или весьма скуден, или формируется из малоизвестного и случайно приобретенного посадочного материала. В озеленении населенных пунктов и городов используется посадочный материал, предлагаемый иностранными фирмами, который, безусловно, обладает высокими декоративными качествами, но зачастую низкой приспособленностью к конкретным климатическим условиям. Эта проблема актуальна для каждого региона.
К необходимым условиям поддержания и развития отечественного цветоводства и декоративного садоводства относится создание автоматизированных баз данных генетических ресурсов цветочно-декоративных растений. Актуальными остаются вопросы подготовки специалистов в области декоративного садоводства. В погоне за престижностью специальности подготовку специалистов по этому направлению осуществляют и коммерческие учреждения высшего профессионального образования, не имеющие соответствующего профессорско-преподавательского

состава и учебно-экспериментальной базы. Базовыми площадками для подготовки специалистов должны быть опытные поля научных учреждений, а к преподавательской деятельности по профильным направлениям следует привлекать научных сотрудников.
В работе конференции участвовали ученые из шести регионов России и представители научного сообщества Азербайджана. Были представлены доклады (от научных и образовательных учреждений, ботанических садов, питомника) из Азербайджана, Москвы и Московской области, Белгорода, Волгограда, Ростова-на-Дону, Краснодара, Крымска, Санкт-Петербурга, Сочи.


