Поиск новых биоактивных соединений на основе микробной трансформации пентациклических тритерпеноидов олеананового ряда
Автор: Плотницкая Н.А., Гришко В.В., Ившина И.Б.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2024 года.
Бесплатный доступ
На фоне дефицита высокоэффективных фармакологических средств для лечения социально значимых заболеваний чрезвычайно актуален поиск новых химических соединений с биологической активностью на основе растительных пентациклических тритерпеноидов, в том числе олеаноловой (ОК) и глицирретовой (ГК) кислот. Данные тритерпеновые кислоты используются для получения производных с выраженной противовирусной, противомикробной, противовоспалительной, противоопухолевой и гепатопротекторной активностью. Преобразование тритерпеноидов в основном осуществляется с использованием химических методов, которые часто реализуются в условиях экстремальных показателей кислотности, температуры, применения дорогостоящих катализаторов или требуют введения защитных групп реакционно-активных центров молекулы. В настоящем обзоре изложены результаты собственных исследований и данные научной литературы последних лет, касающиеся оценки возможности применения биологической трансформации ОК и ГК на основе ферментативной активности микроорганизмов.
Олеаноловая кислота, глицирретовая кислота, микробная трансформация, биологически активные соединения
Короткий адрес: https://sciup.org/147244921
IDR: 147244921 | УДК: 579.222.4 | DOI: 10.17072/1994-9952-2024-2-176-189
Текст обзорной статьи Поиск новых биоактивных соединений на основе микробной трансформации пентациклических тритерпеноидов олеананового ряда
Вторичные метаболиты растений - неисчерпаемый источник биологически активных веществ благодаря их доступности и большому структурному разнообразию [Atanasov et al., 2021]. Одной из интенсивно разрабатываемых сегодня групп растительных производных являются пентациклические тритерпеноиды, представленные соединениями ряда олеанана, урсана, фриделана, гопана и лупана. Тритерпеновые соединения олеананового ряда, в частности олеаноловая (ОК, 1 ) и глицирретовая (ГК, 2 ) кислоты (рис. 1), широко распространены в природе и характеризуются обширным спектром биоактивности. Однако молекулы тритерпеноидов отличаются повышенной гидрофобностью, что ограничивает их применение в качестве эффективных фармакологических агентов. Химическая трансформация ОК и ГК позволяет включать в структуру их молекул азот-, бром-, хлорсодержащие заместители, что значительно усиливает фармакологический потенциал производных. Полусинтетические производные ОК и ГК известны своим антиоксидантным [Sattarova et al., 2023], иммуномодулирующим [Rakhimova et al., 2023], противоопухолевым [Lisiak et al., 2023], антибактериальным [Blanco-Cabra et al., 2019], антитуберкулезным [Vishwakarma et al., 2022] и др. действием. Однако классический органический синтез биоактивных соединений протекает чаще всего в экстремальных условиях среды или требует применения дорогостоящих катализаторов, а также агентов защиты реакционно-активных центров молекулы. Перспективной альтернативой химическому синтезу являются реакции биотрансформации тритерпеновых соединений с использованием ферментативной активности целых клеток микроорганизмов, которые реализуются в нормальных и экологически безопасных условиях среды, с высоким уровнем регио- и стереоселективности, в одну технологическую стадию. Кроме того, микробная конверсия позволяет осуществлять специфическую модификацию недоступных для химических методов сайтов тритерпеновых молекул [Shah et al., 2014]. Опубликованные ранее специализированные обзоры, посвященные анализу процессов микробной трансформации терпеноидов, включают информацию за период до 2014 года [Гришко, Ногови-цина, Ившина, 2014; Azerad, 2016]. С учетом активного развития данной области исследований в последнее десятилетие обобщение и обсуждение сведений о процессах микробной трансформации пентацикли-ческих тритерпеноидов олеананового ряда и оценка биоактивности их производных представляется актуальным. В настоящей обзорной работе с привлечением собственных экспериментальных данных и литературных сведений последних лет отмечены целесообразность и перспективность применения метода микробной трансформации ОК и ГК для получения новых эффективных лекарственных агентов.
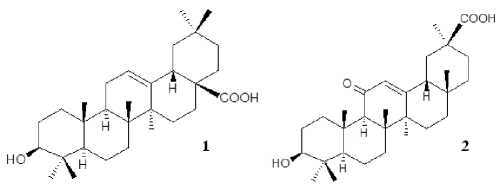
Рис. 1. Структурные формулы ОК ( 1 ) и ГК ( 2 ) [Structural formulas of OA (1) and GA (2) ]
Получение производных ОК и ГК с противовоспалительными свойствами
Подавляющее большинство известных метаболитов ОК и ГК, полученных в процессе микробной трансформации, характеризуется противовоспалительной активностью. Процессы трансформации ОК и ГК мицелиальными грибами, как правило, сопровождаются образованием широкого спектра метаболитов в результате введения гидроксильных или оксогрупп в положения С3, С7 и С15. Реже встречаются реакции карбоксилирования, ацетилирования и гликозилирования. Например, аскомицеты Trichothecium roseum (M 95.56) [Gong et al., 2014] и зигомицеты Circinella muscae AS 3.2695 [Yan et al., 2018] катализировали процесс окисления ОК с образованием 7β,15α-дигидрокси-3-оксо-ОК (3). При этом из среды биотрансформации T. roseum (M 95.56) был дополнительно выделен единичный интермедиат процесса мо- нодроксилирования – 15α-гидрокси-3-оксо-ОК (4) [Gong et al., 2014], в то время как зигомицетовые грибы C. muscae AS 3.2695 одновременно катализировали самые разнообразные реакции гидроксилирования и гликозилирования с образованием 7β-гидрокси-ОК (5), 7β,21β-дигидрокси-ОК (6), 7α,21β-дигидрокси-ОК (7), 7β,15α-дигидрокси-ОК (8), 7β-гидрокси-3-оксо-ОК (9), 7β,15α-дигидрокси-ОК 28-O-β-D-глюкопиранозилового эфира (10), 21β-гидрокси-ОК 28-O-β-D-глюкопиранозилового эфира (11) и ОК 28-O-β-D-глюкопиранозилового эфира (12) [Yan et al., 2018] (рис. 2).
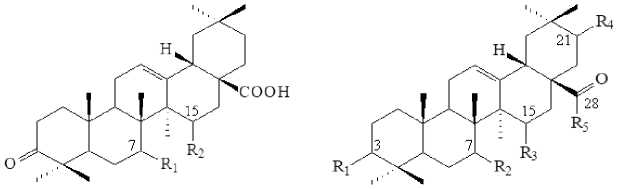
3R= pOH,R2= aOH
-
5: R] = Ra = ₽OH,R3 = & = H, R§ = OH
-
6: Ri = R2 = &= pOH, R3 = H, R$ = OH
-
7: R1 = R4=POH,R2 = aOH,R3 = H,& = OH
-
8: Rj = R2 = pOH,R3 = aOH, & = H, R5 = OH
-
9: R] = O?R2 = pOH,R3 = & = H 、 R5 = OH
-
10: Ri = R2 = pOH, R3 = aOH. R4 = H, R5 = G - p - £ - глюкогп q> ано зил
-
11: Ri = R4 = pOH, R2 = R3 = H 、 R5 = □- p- D- ЕЛЮКОГП ц^анознл
-
12: R] = pOH, R2 = R3 = R4 = H, R5 = C - p-D- ілюкопіірано зил
Рис. 2. Структурные формулы соединений 3–12
[Structural formulas of compounds 3–12 ]
Штамм C . muscae AS 3.2695 был также активен в отношении ГК и инициировал реакции окисления, ацетилирования и гликозилирования с образованием 7β-гидрокси-ГК ( 13 ), 15α-гидрокси-ГК ( 14 ), 7β,15α-дигидрокси-ГК ( 15 ), 7β-гидрокси-3-оксо-ГК ( 16 ), 7β,15α-дигидрокси-3-оксо-ГК ( 17 ), 7β-гидрокси-ГК 3- О -β- D -глюкопиранозида ( 18 ), 7β-гидрокси-ГК 3- О -β- D -6'- О -ацетил-глюкопиранозида ( 19 ), 15α-гидрокси-ГК 3- О -β- D -глюкопиранозида ( 20 ), 15α-гидрокси-ГК 3- О -β- D -6'- О -ацетил-глюкопиранозида ( 21 ) и 7β-гидрокси-ГК 30- О -β- D -глюкопиранозида ( 22 ) [Fan et al., 2019]. Этой же группой авторов показано, что зигомицет Rhizopus arrhizus AS 3.2893 осуществлял окислительную трансформацию ГК с образованием 7β-гидрокси-ГК ( 13 ), 15α-гидрокси-ГК ( 14 ), 7β,15α-дигидрокси-ГК ( 15 ), 3β-ацетокси-7β-гидрокси-ГК ( 23 ), 7-оксо-ГК ( 24 ), 7α-гидрокси-ГК ( 25 ) и 15α-гидрокси-7-оксо-ГК ( 26 ) [Fan et al., 2019] (рис. 3).
13 : R1 = R2 = pOH.R3 = H
15: R] = R? = pOH. R3 = aOH
L6: R] = O, Ra = ₽OH,R3 = H
17: Ri = O. R2 = BOH. R3 = aOH
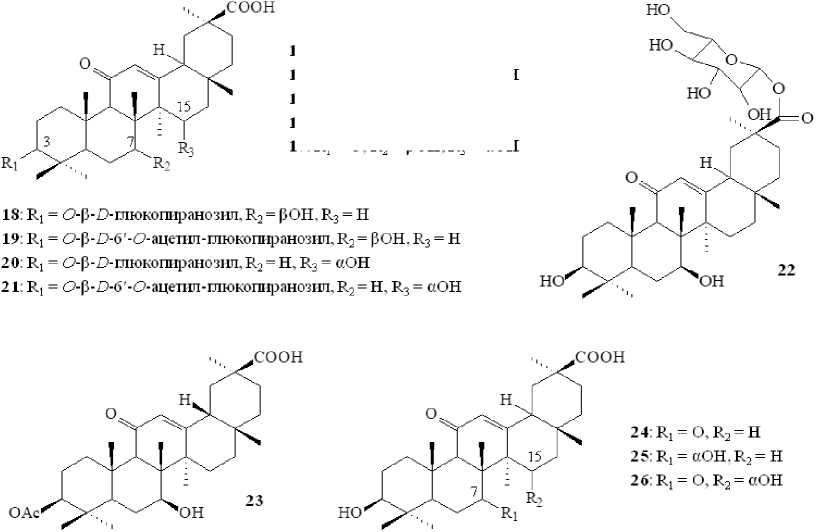
Рис. 3. Структурные формулы соединений 13–26 [Structural formulas of compounds 13–26 ]
Биологическое С7 и С15 гидроксилирование ГК с образованием в качестве основного метаболита 7β,15α-дигидрокси-ГК ( 15 ) протекало также с участием грибов Colletotrichum lini AS 3.4486 [He, Yang, Wu, 2015] и Absidia pseudocylinderospora ATCC 24169 [Maatooq et al., 2010] соответственно. Получение 7β-гидроксилированного производного ГК ранее было зафиксировано при использовании в качестве биокатализатора культур мукоровых зигомицетовых грибов рода Cunninghamella. Так, использование штамма C . elegans TSY-0865 приводило к трансформации ГК в единственное производное 7β-гидрокси-ГК ( 13 ) [Choudhary, Siddiqui, Nawaz, 2009], а C . blakealeana CGMCC 3.970 – к трансформации ГК в 7β-гидрокси-ГК ( 13 ), 3-оксо-7β-гидрокси-ГК ( 16 ) [Qin et al . , 2010], 15α,24-дигидрокси-ГК ( 27 ), 3-оксо-7β,15α,24-тригидрокси-ГК ( 28 ) и 3-оксо-7α,24-дигидрокси-ГК ( 29 ) [Ma et al . , 2017] (рис. 4).
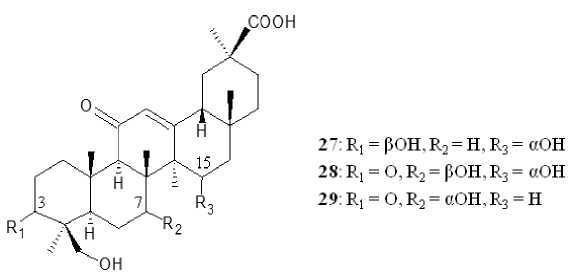
Рис. 4. Структурные формулы соединений 27–29 [Structural formulas of compounds 27–29 ]
Большинство из описанных выше производных ОК и ГК характеризуются противовоспалительным действием путем ингибирования липополисахарид (ЛПС)-индуцированной выработки NO в клетках RAW 264.7 при полумаксимальной ингибирующей концентрации (ИК 50 ) от 6.52 до 35.02 мкмоль. На примере 15α-гидрокси-ГК ( 14 ) группой авторов во главе с M. Zhang (2022) показано, что противовоспалительная активность тритерпеновых соединений может осуществляться путем избирательного действия на белок миелоидной дифференцировки 2 (MD2) для подавления активации сигнального пути ядерного фактора каппа B (NF-κB) посредством ингибирования ядерной транслокации p65 и подавления его целевых белков и генов в ЛПС-опосредованных RAW 264.7 клетках [Zhang et al., 2022]. Противовоспалительная активность производных тритерпеноидов показана также и на другой экспериментальной модели. Так, 15α,24-дигидрокси-ГК ( 27 ), 3-оксо-7β,15α,24-тригидрокси-ГК ( 28 ) и 3-оксо-7α,24-дигидрокси-ГК ( 29 ) продемонстрировали выраженную противовоспалительную активность в отношении нейронных тканей путем ингибирования ЛПС-индуцированного выделения NO в клетках микроглии мышей BV2 со значениями ИК 50 0.76, 0.94 и 0.16 ммоль/л соответственно [Ma et al., 2017]. В сравнительных исследованиях показано, что С7-гидроксилирование и С28-гликозилирование способствует повышению противовоспалительной активности производных ОК [Yan et al . , 2018], тогда как в случае ГК повышению ингибирующей активности в отношении выработки NO в клетках RAW 264.7 способствует гидроксилирование при 7 и 15 атомах углерода, а снижению – карбонилирование при 3 атоме углерода [Fan et al . , 2019].
При использовании бактериальных культур катализируемые реакции биотрансформации характеризуются более выраженной стерео- и региоселективностью. Так, бактериальная культура Streptomyces griseus ATCC 13273 катализировала процесс гидроксилирования и сайт-специфичного окисления С29 метильной группы ОК до карбоксильной с образованием 3β-гидрокси-олеан-12-ен-28,29-диовой кислоты ( 30 ), 3β,24-дигидрокси-олеан-12-ен-28,29-диовой кислоты ( 31 ) и 3β,21β,24-тригидрокси-олеан-12-ен-28,29-диовой кислоты ( 32 ) (рис. 5). Среди полученных соединений только 3β,21β,24-тригидрокси-олеан-12-ен-28,29-диовая кислота ( 32 ) проявляла противовоспалительный эффект путем ингибирования ЛПС-индуцированного выделения NO в клетках RAW 264.7 на уровне ИК 50 1.230 мкмоль [Xu, Zhang, et al., 2017]. Другая актиномицетальная культура Rhodococcus rhodochous ИЭГМ 1360 катализировала процесс С3-селективного окисления ОК с образованием 3-оксо-ОК ( 33 ) [Лучникова и др., 2023]. Ранее было показано, что 3-оксо-ОК проявляет выраженную противовоспалительную активность путем ингибирования продукции лейкотриена В в перитонеальных лейкоцитах крысы при ИК 50 17 мкмоль [Giner-Larza et al., 2001].
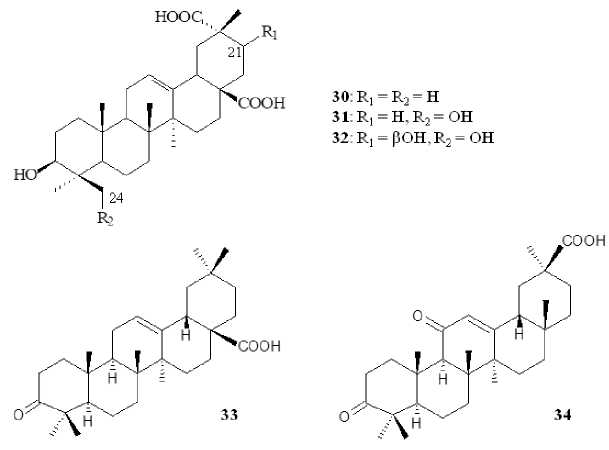
Рис. 5. Структурные формулы соединений 30–34 [Structural formulas of compounds 30–34 ]
Получение производных ОК и ГК с противоопухолевыми свойствами
Использование штамма Rhizomucor miehei CECT 2749 широко распространенных в природе грибов приводило к частичной метаболизации ОК с образованием 1β,30-дигидрокси-ОК ( 35 ), 7β,30-дигидрокси-ОК ( 36 ) и 30-гидрокси-ОК ( 37 ) [Martinez et al., 2013] (рис. 6). Соединение 36 , известное как кверетаровая кислота, впервые было выделено из произрастающих на территории Мексики кактусов Lemaireocereus queretaroensis и L . beneckei [Djerassi et al., 1956]. Ранее она была получена при трансформации ОК в течение 24 ч клетками E . coli , экспрессирующими гены цитохром P450 moxA актиномицетов Nonomuraea recticatena и Pseudomonas редокс-партнера camAB [Fujii et al., 2006]. Данное соединение проявляет in vitro умеренную противоопухолевую активность в отношении клеток HeLa (рак шейки матки) путем ингибирования эффектов, вызванных опухолевыми промоторами. В частности, кверетаровая кислота ингибирует 12- O -тетрадеканоилфорбол-13-ацетат-усиленное включение радиоактивной метки32P в структуру фосфолипидов опухолевых клеток [Kinoshita et al., 1999].
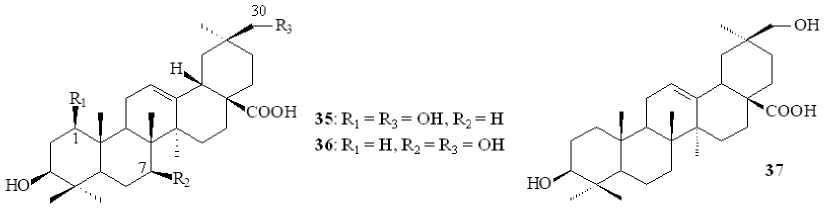
COOH
, COOH 35: Ri = R3 = OH 、 R2 = H
36:Rl = H.R2 = R3 = OH
Рис. 6. Структурные формулы соединений 35–37 [Structural formulas of compounds 35–37 ]
Актиномицеты рода Nocardia катализируют метилирование С28 карбоксильной группы пентацикли-ческих тритерпеноидов [Zhang et al., 2005]. Использование клеток N . iowensis (DSM 45197, NRRL 5646) в качестве биокатализатора процесса трансформации ОК приводило преимущественно к образованию метилового эфира ОК ( 38 ), а также небольшого количества метилового эфира 3-оксо-ОК ( 39 ) и не идентифицированного авторами метаболита 40 [Ludwig et al., 2015] (рис. 7). Показано, что процесс метилирования способствует повышению противоопухолевой активности тритерпеновых кислот. Так, метиловый эфир ОК 38 (10 мкмоль) ингибировал рост клеток SiHa (карцинома шейки матки), A-549 (карцинома легких) и IMR-32 (нейробластома) на 21, 48 и 55% соответственно и был в 2–7 раз более эффективен, чем ОК [Mallavadhani et al . , 2013]. Метиловый эфир 3-оксо-ОК ( 39 ) также характеризовался противоопухолевой активностью и подавлял рост клеток SR (лимфома), PC-3 (аденокарцинома простаты) и T-47D (рак груди) на 36, 18 и 24% соответственно при концентрации 10 мкмоль [Kaminskyy et al., 2012].
Рис. 7. Структурные формулы соединений 38–40 [Structural formulas of compounds 38–40 ]
Получение производных ОК и ГК с антибактериальными свойствами
Одной из естественных функций тритерпеноидов как вторичных метаболитов является защита растений от инфекций [Guimaraes et al., 2019], в связи с чем многие производные ОК и ГК характеризуются выраженным антибактериальным действием. Трансформация ОК клетками грибов Mucor rouxii NRRL 1894 приводила к образованию 3-оксо-21β-гидрокси-ОК ( 41 ) [Capel et al., 2011], которая ранее была получена с использованием Penicillium chrysogenum [Hikino, Nabetani, Takemoto, 1971]. 3-Оксо-21β-гидрокси-ОК ( 41 ) проявляла выраженную антибактериальную активность в отношении вызывающей парадантоз бактерии Porphyromonas gingivalis (минимальная ингибирующая концентрация (МИК) 13.2 мкмоль) [Capel et al., 2011]. Полиоксигенирование ОК клетками штамма R . rhodochrous ИЭГМ 757 приводило к образованию нового производного – 5α,22α-дигидроксигипсогеновой кислоты ( 42 ) (рис. 8), которая обладала умеренной (МИК 0.781 мг/мл) активностью в отношении грамположительных бактерий Micrococcus luteus , Staphylococcus aureus , Bacillus subtilis [Luchnikova et al . , 2022]. Широко распространенное производное ГК 7β-гидрокси-ГК ( 13 ), полученное с использованием целого ряда культур грибов ( C . muscae AS 3.2695, R. arrhizus AS 3.2893 [Fan et al., 2019], C. blakesleana CGMCC 3.970 [Qin et al., 2010], C. elegans TSY-0865 [Choudhary, Siddiqui, Nawaz, 2009], R. chinensis CICC 40335 [Xu et al., 2020]), как и его С3-окисленное производное 3-оксо-7β-гидрокси-ГК ( 16 ), демонстрировали ингибирующую активность в отношении антибиотикоустойчивого бактериального штамма Enterococcus faecalis с зоной ингибирования роста 15–20 мм при концентрации 40 мкл [Qin et al., 2010].
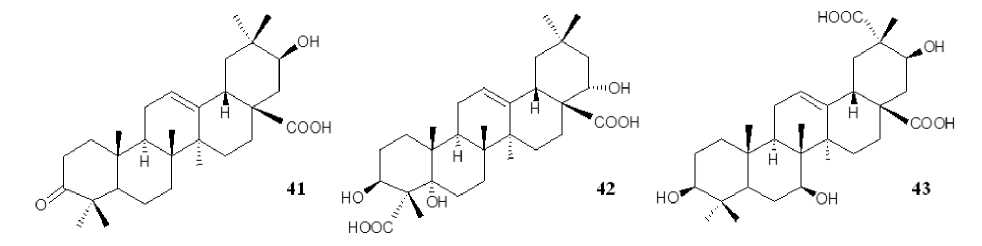
но ноос'
Рис. 8. Структурные формулы соединений 41–43 [Structural formulas of compounds 41–43 ]
Получение производных ОК и ГК с другими видами биологической активности
Помимо противовоспалительных, противоопухолевых и антибактериальных свойств, характерных для производных ОК и ГК, в литературе представлены исследования и других типов биоактивности данных соединений. В дополнение к противовоспалительному эффекту показано, что ОК 28- O -β- D -глюкопиранозиловый эфир ( 12 ), образующийся в процессе трансформации ОК грибами C. muscae AS 3.2695 [Yan et al., 2018] или бактериями B. subtilis ATCC 6633 [Wang et al . , 2017], проявлял ингибирующий эффект в отношении ЛПС-стимулированной прокоагулянтной активности тканевого фактора в клетках THP-1 человека (ИК 50 0.035 нмоль). Авторами сделано предположение, что количество и положение свободных гидроксильных групп в структуре производных ОК влияет на их антикоагулянтный эффект [Wang et al . , 2017]. Другой широко распространенный противовоспалительный агент 7β,15α-дигидрокси-ГК ( 15 ) проявлял также антиоксидантную и гепатопротекторную активность. Показано, что данное соединение в концентрации 50 мг/кг значительно снижало уровень АЛТ, АСТ и малонового диальдегида, которые являются маркерами повреждения тканей печени. Кроме того, 7β,15α-дигидрокси-ГК ( 15 ) обеспечивала увеличение продукции NO в макрофагах крыс, обработанных CCl 4 [Maatooq et al . , 2010]. Нейропротекторный эффект 3β,7β,21β-тригидрокси-олеан-12-ен-28,29-диовой кислоты ( 43 ) (рис. 8), полученной с использованием S . griseus ATCC 13273, заключался в ее способности увеличивать выживаемость CoCl 2 -индуцированных нейроноподобных клеток PC12. При этом производные с С3-глюкопиранозиловой группой в структуре молекулы ОК теряли нейро-протекторные свойства, тогда как карбоксилирование при С29, вероятно, являлось ключевым для проявления данной активности [Xu et al . , 2020]. Антипаразитарная активность 3-оксо-ОК ( 33 ) заключалась в обеспечении 80% смертности популяции Meloidogyne incognita (галловая нематода) в течение 72 ч при концентрации 0.0625% [Begum et al . , 2015], а также ингибировании роста эпимастигот-ной формы Trypanosoma cruzi , вызывающей болезнь Шагаса, и промастиготной формы Leishmania amazonensis , вызывающей лейшманиоз, при ИК 50 18.5 и 29.9 мкмоль соответственно [Funari et al . , 2016]. С применением in silico анализа показана перспективность 3-оксо-ГК ( 34 ) в качестве агента ингибирования репликации вируса Sars-Cov-2 [Florez, Singh, 2020].
Заключение
Микробная трансформация пентациклических тритерпеноидов олеананового ряда является перспективным подходом для получения производных с выраженной биологической активностью, которые могут быть использованы для разработки новых высокоэффективных противовоспалительных, противоопухолевых, антибактериальных, антиоксидантных, антикоагулянтных, нейро- и гепатопро-текторных средств (таблица). Данный метод получения биологически активных соединений и их интермедиатов при условии его более активного развития как междисциплинарного инструмента перспективен для разработки новых лекарственных агентов для борьбы со злокачественными образованиями и нейродегенеративными заболеваниями, а также новых антибактериальных препаратов, эффективных в отношении антибиотикоустойчивых патогенных микроорганизмов. Стоит отметить, что среди эффективных биотрансформаторов ОК и ГК наиболее часто используются представители мицелиальных грибов, применение которых технологически нецелесообразно вследствие спорового характера роста и потенциальной опасности из-за их способности их к выработке микотоксинов с выраженным мутагенным и канцерогенным действием [Paterson, 2006; Dean et al., 2012]. При этом бактериальные катализаторы представлены лишь единичными видами родов Bacillus , Nocardia , Strepto-myces , среди которых нередко встречаются патогенные штаммы. Недавно появились сведения об успешном использовании штаммов непатогенных актиномицетов рода Rhodochrous , способных катализировать полную конверсию ОК и ГК в крайне высоких концентрациях [Лучникова и др., 2023; Luchnikova, Grishko, Ivshina, 2020; Luchnikova et al., 2022]. Необходимы дальнейшие исследования процессов биологической трансформации пентациклических тритерпеноидов олеананового ряда и поиск новых непатогенных бактериальных штаммов, использование которых позволит реализовать высокоэффективный синтез тритерпеновых производных с выраженной биологической активностью.
Биоактивные производные ОК и ГК, полученные в результате микробной трансформации [Biologically active OA and GA derivatives obtained by microbial transformation]
|
Соединение (номер структурной формулы) |
Механизм действия |
Микробный трансформатор |
|
Противовоспалительная активность |
||
|
7β,15α-дигидрокси-3-оксо-ОК ( 3 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 34.63 ± 1.74 мкмоль [Yan et al . , 2018] |
Trichothecium roseum (M 95.56) [Gong et al . , 2014] Circinella muscae AS 3.2695 [Yan et al . , 2018] |
|
7β-гидрокси-ОК ( 5 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 9.24 ± 0.62 мкмоль [Yan et al . , 2018] |
C. muscae AS 3.2695 [Yan et al . , 2018] |
|
7β,15α-дигидрокси-ОК ( 8 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 10.06 ± 2.17 мкмоль [Yan et al . , 2018] |
|
|
7β,15α-дигидрокси-ОК 28- O -β- D - глюкопиранозиловый эфир ( 10 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 8.28 ± 0.74 мкмоль [Yan et al . , 2018] |
|
|
21β-гидрокси-ОК 28- O -β- D - глюкопиранозиловый эфир ( 11 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 40.74 ± 2.84 мкмоль [Yan et al . , 2018] |
|
|
7β-гидрокси-ГК ( 13 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 19.32 мкмоль [Fan et al . , 2019] |
C. muscae AS 3.2695 [Fan et al., 2019] Rhizopus arrhizus AS 3.2893 [Fan et al . , 2019] Cunninghamella blakesleana CGMCC 3.970 [Qin et al . , 2010] C. elegans TSY-0865 [Choudhary, Siddiqui, Nawaz, 2009] R. chinensis CICC 40335 [Xu et al . , 2020] |
|
15α-гидрокси-ГК ( 14 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 20.24 мкмоль [Fan et al . , 2019] |
C. muscae AS 3.2695 [Fan et al . , 2019] R. arrhizus AS 3.2893 [Fan et al., 2019] Aspergillus niger RG13B1 [Zhang et al . , 2022] |
|
ОК 28- O -β- D -глюкопиранозиловый эфир ( 12 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 11.28 ± 1.03 мкмоль [Yan et al . , 2018] |
C. muscae AS 3.2695 [Yan et al . , 2018] Bacillus subtilis ATCC 6633 [Wang et al . , 2017] |
|
7β,15α-дигидрокси-ГК ( 15 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 9.07 мкмоль [Fan et al . , 2019] |
C. muscae AS 3.2695 [Fan et al . , 2019] R. arrhizus AS 3.2893 [Fan et al . , 2019] Colletotrichum lini AS 3.4486 [He, Yang, Wu, 2015] Absidia pseudocylinderospora ATCC 24169 [Maatooq et al . , 2010] |
|
3-оксо-7β-гидрокси-ГК ( 16 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 57.63 мкмоль [Fan et al . , 2019] |
C. muscae AS 3.2695 [Fan et al., 2019] C. blakesleana CGMCC 3.970 [Qin et al . , 2010] |
Продолжение таблицы
|
Соединение (номер структурной формулы) |
Механизм действия |
Микробный трансформатор |
|
7β,15α-дигидрокси-3-оксо-ГК ( 17 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 33.09 мкмоль [Fan et al., 2019] |
C. muscae AS 3.2695 [Fan et al., 2019] |
|
7β-гидрокси-ГК 3- О -β- D -глюкопиранозид ( 18 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 8.39 мкмоль [Fan et al., 2019] |
|
|
7β-гидрокси-ГК 3- О -β- D -6'- О -ацетил-глюкопиранозид ( 19 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 6.52 мкмоль [Fan et al., 2019] |
|
|
15α-гидрокси-ГК 3- О - β- D -глюкопиранозид ( 20 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 12.42 мкмоль [Fan et al., 2019] |
|
|
15α-гидрокси-ГК 3- О -β- D -6'- О -ацетил-глюкопиранозид ( 21 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 10.13 мкмоль [Fan et al., 2019] |
|
|
7β-гидрокси-ГК 30- О - β- D -глюкопиранозид ( 22 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 30.27 мкмоль [Fan et al., 2019] |
|
|
3β-ацетокси-7β-гидрокси-ГК ( 23 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 15.54 мкмоль [Fan et al., 2019] |
R. arrhizus AS 3.2893 [Fan et al., 2019] |
|
7-оксо-ГК ( 24 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 35.02 мкмоль [Fan et al., 2019] |
|
|
7α-гидрокси-ГК ( 25 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 20.43 мкмоль [Fan et al., 2019] |
|
|
15α-гидрокси-7-оксо- ГК ( 26 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 12.25 мкмоль [Fan et al., 2019] |
|
|
3β,21β,24-тригидрокси-олеан-12-ен-28,29- диовая кислота ( 32 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках RAW 264.7 при ИК 50 1.230 мкмоль [Xu, Wang, et al., 2017] |
Streptomyces griseus ATCC 13273 [Xu, Wang, et al., 2017] |
|
3-оксо-ОК ( 33 ) |
Ингибирование продукции лейкотриена В в перитонеальных лейкоцитах крысы при ИК 50 17 мкмоль [Giner-Larza et al . , 2001] |
Rhodococcus rhodochrous ИЭГМ 1360 [Лучникова и др., 2023] |
|
15α,24-дигидрокси-ГК ( 27 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках BV2 микроглии мышей при ИК 50 0.76 мкмоль/л [Ma et al . , 2017] |
C. blakesleana CGMCC 3970 [Ma et al . , 2017] |
|
3-оксо-7β,15α,24-тригидрокси-ГК ( 28 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках BV2 микроглии мышей при ИК 50 0.94 мкмоль/л [Ma et al . , 2017] |
|
|
3-оксо-7α,24-дигидрокси-ГК ( 29 ) |
Ингибирование ЛПС-индуцированного выделения NO в клетках BV2 микроглии мышей при ИК 50 0.16 мкмоль/л [Ma et al . , 2017] |
Противоопухолевая активность
|
30-гидрокси-ОК ( 37 ) |
Ингибирование усиленного 12-O-тетрадеканоилфорбол-13-ацетатом включение 32Pi в фосфолипиды опухолевых клеток на 41.4% при дозе 50 мкг/мл [Kinoshita et al . , 1999] |
R. miehei CECT 2749 [Martinez et al . , 2013] |
|
3-оксо-ГК ( 34 ) |
Ингибирование действия липоксигеназ при ИК 50 144.2 ммоль [Choudhary, Siddiqui, Nawaz, 2009] |
R. rhodochrous ИЭГМ 1360 [Лучникова и др., 2023] Fusarium lini NRRL-68751 [Choudhary, Siddiqui, Nawaz, 2009] |
|
Продолжение таблицы |
||
|
Соединение (номер структурной формулы) |
Механизм действия |
Микробный трансформатор |
|
3-оксо-ОК ( 33 ) |
Ингибирование роста клеток HepG2 при ИК 50 1.4 мкмоль [Irungu et al . , 2014]. Ингибирование роста клеток A549 при ИК 50 14.7 мкмоль, H460 при ИК 50 17.5 мкмоль, HGC27 при ИК 50 15.4 мкмоль [Wu et al . , 2011]. Ингибирование роста клеток B16-BL6 при 10.8 мкмоль [Huang et al . , 2006] |
R. rhodochrous ИЭГМ 1360 [Лучникова и др., 2023] |
|
Метиловый эфир ОК ( 38 ) |
Ингибирование роста клеток SiHa на 21%, HeLa на 18%, A-549 на 48%, IMR-32 на 55% при концентрации 10 мкмоль [Mallavadhani et al., 2013] |
Nocardia iowensis (DSM 45197, NRRL 5646) [Ludwig et al . , 2015] |
|
Метиловый эфир 3- оксо-ОК ( 39 ) |
Ингибирование роста клеток SR на 36%, PC-3 на 18%, T-47D на 24% при концентрации 10 мкмоль [Kaminskyy et al . , 2012] |
|
|
Антибактериальная активность |
||
|
5α,22α- дигидроксигипсогено-вая кислота ( 42 ) |
Ингибирование роста клеток Micrococcus luteus , Staphylococcus aureus , Bacillus subtilis при МИК 0.781 мг/мл [Luchnikova et al . , 2022] |
R. rhodochrous ИЭГМ 757 [Luchnikova et al . , 2022] |
|
3-оксо-21β-гидрокси-ОК ( 41 ) |
Ингибирование роста клеток Porphyromonas gingivalis при МИК 13.2 мкмоль [Capel et al . , 2011] |
Mucor rouxii NRRL 1894 [Capel et al . , 2011] Penicillium chrysogenum [Hikino, Nabetani, Takemoto, 1971] |
|
3-оксо-7β-гидрокси-ГК ( 16 ) |
Ингибирование роста клеток антибиотикоустойчивого штамма Enterococcus faecalis при концентрации 40 мкл (зона ингибирования 15 мм) [Qin et al . , 2010] |
C. muscae AS 3.2695 [Fan et al . , 2019] C. blakesleana CGMCC 3.970 [Qin et al . , 2010] |
|
7β-гидрокси-ГК ( 13 ) |
Ингибирование роста клеток антибиотикоустойчивого штамма Enterococcus faecalis при концентрации 40 мкл (зона ингибирования 20 мм) [Qin et al., 2010] |
C. muscae AS 3.2695 [Fan et al . , 2019] R. arrhizus AS 3.2893 [Fan et al . , 2019] C. blakesleana CGMCC 3.970 [Qin et al . , 2010] C. elegans TSY-0865 [Choudhary, Siddiqui, Nawaz, 2009] R. chinensis CICC 40335 [Xu et al . , 2020] |
|
Антикоагулянтная активность |
||
|
ОК 28- O -β- D -глюкопиранозиловый эфир ( 12 ) |
Ингибирование ЛПС-стимулированной прокоагулянтной активности тканевого фактора в клетках THP-1 человека при ИК 50 0.035 нмоль [Wang et al . , 2017] |
C. muscae AS 3.2695 [Yan et al . , 2018] B. subtilis ATCC 6633 [Wang et al . , 2017] |
|
Нейропротекторная активность |
||
|
3β,7β,21β-тригидрокси-олеан-12-ен-28,29- диовая кислота ( 43 ) |
Увеличение выживаемости CoCl 2 -индуцированных нейроноподобных клеткок PC12 при ЭД 50 0.48 мкмоль [Xu et al . , 2020] |
S. griseus ATCC 13273 [Xu et al . , 2020] |
|
Антипротозойная активность |
||
|
3-оксо-ОК ( 33 ) |
Обеспечение 80% смертности популяции Meloidogyne incognita в течение 72 ч при концентрации 0.0625% [Begum et al . , 2015] Ингибирование роста эпимастиготной формы Trypanosoma cruzi при ИК 50 18.5 мкмоль [Funari et al . , 2016] Ингибирование роста промастиготной формы Leishmania amazonensis при ИК 50 29.9 мкмоль [Funari et al . , 2016] |
R. rhodochrous ИЭГМ 1360 [Лучникова и др., 2023] |
|
Соединение (номер структурной формулы) |
Механизм действия |
Микробный трансформатор |
Антиоксидантная активность
|
7β,15α-дигидрокси-ГК ( 15 ) |
Защитное действие от перекисного окисления липидов, индуцированного аскорбатом железа, с антиоксидантным индексом 61±6.1 [Maatooq et al . , 2010] |
C. muscae AS 3.2695 [Fan et al . , 2019] R. arrhizus AS 3.2893 [Fan et al., 2019] C. lini AS 3.4486 [He, Yang, Wu, 2015] A. pseudocylinderospora ATCC 24169 [Maatooq et al . , 2010] |
Гепатопротекторная активность
|
7β,15α-дигидрокси-ГК ( 15 ) |
Дозозависимое стимулирование продукции NO в макрофагах крыс, обработанных CCl 4 . Снижение уровня АЛТ, АСТ и малонового диальдегида в гепатоцитах мышей, обработанных CCl 4 , при концентрации 50 мг/кг [Maatooq et al., 2010] |
C. muscae AS 3.2695 [Fan et al., 2019] R. arrhizus AS 3.2893 [Fan et al . , 2019] C. lini AS 3.4486 [He, Yang, Wu, 2015] A. pseudocylinderospora ATCC 24169 [Maatooq et al . , 2010] |
Список литературы Поиск новых биоактивных соединений на основе микробной трансформации пентациклических тритерпеноидов олеананового ряда
- Гришко В.В., Ноговицина Е.М., Ившина И.Б. Бактериальная трансформация терпеноидов // Успехи химии. 2014. Т. 83, № 4. С. 323-342.
- Лучникова Н.А. и др. Rhodococcus rhodochrous ИЭГМ 1360 - эффективный биокатализатор С3 окислительной трансформации олеанановых тритерпеноидов // Микробиология. 2023. Т. 92, № 2. С. 184196.
- Atanasov A.G. et al. Natural products in drug discovery: advances and opportunities // Nature Reviews Drug Discovery. 2021. Vol. 20. P. 200-216.
- Azerad R. Microbial transformations of pentacyclic triterpenes // Green Biocatalysis. 2016. P. 675-714.
- Begum S. et al. Nematicidal triterpenoids from Lantana camara // Chemistry and Biodiversity. 2015. Vol. 12. P. 1435-1442.
- Blanco-Cabra N. et al. Novel oleanolic and maslinic acid derivatives as a promising treatment against bacterial biofilm in nosocomial infections: an in vitro and in vivo study // ACS Infectious Diseases. 2019. Vol. 5. P. 1581-1589.
- Capel C.S. et al. Biotransformation using Mucor rouxii for the production of oleanolic acid derivatives and their antimicrobial activity against oral pathogens // Journal of Industrial Microbiology & Biotechnology. 2011. Vol. 38. P. 1493-1498.
- Choudhary M.I., Siddiqui Z.A., Nawaz S.A. Microbial transformation of 18p-glycyrrhetinic acid by Cunninghamella elegans and Fusarium lini, and lipoxygenase inhibitory activity of transformed products // Natural Product Research. 2009. Vol. 23. P. 507-513.
- Dean R. et al. The top 10 fungal pathogens in molecular plant pathology // Molecular Plant Pathology. 2012. Vol. 13. P. 414-430.
- Djerassi C. et al. Terpenoids. XXIV. The structure of the cactus triterpene queretaroic acid // Journal of the American Chemical Society. 1956. Vol. 78. P. 3783-3787.
- Fan B. et al. Anti-inflammatory 18p-glycyrrhetinic acid derivatives produced by biocatalysis // Planta Medica. 2019. Vol. 85. P. 56-61.
- Florez H., Singh S. Bioinformatic study to discover natural molecules with activity against COVID-19 // F1000Research. 2020. Vol. 9. P. 1-15.
- Fujii Y. et al. Hydroxylation of oleanolic acid to queretaroic acid by cytochrome P450 from Nonomuraea recticatena // Bioscience, Biotechnology, and Biochemistry. 2006. Vol. 70. P. 2299-2302.
- Funari C.S. et al. Oleanonic acid from Lippia lupulina (Verbenaceae) shows strong in vitro antileishmanial and antitrypanosomal activity // Acta Amazonica. 2016. Vol. 46. P. 411-416.
- Giner-Larza E.M. et al. Oleanonic acid, a 3-oxotriterpene from Pistacia, inhibits leukotriene synthesis and has anti-inflammatory activity // European Journal of Pharmacology. 2001. Vol. 428. P. 137-143.
- Gong T. et al. Microbial transformation of oleanolic acid by Trichothecium roseum // Journal of Asian Natural Products Research. 2014. Vol. 16. P. 383-386.
- Guimaraes A.C. et al. Antibacterial activity of terpenes and terpenoids present in essential oils // Molecules. 2019. Vol. 24. P. 2471.
- He C.J., Yang Y.M., Wu K.Y. Microbial transformation of glycyrrhetinic acid by Colletotrichum lini AS 3.4486 // Advanced Materials Research. 2015. Vol. 1120-1121. P. 877-881.
- Hikino H., Nabetani S., Takemoto T. Microbial transformation of oleanolic acid // Yakugaku Zasshi. 1971. Vol. 91. P. 637-640
- Huang D. et al. Anti-tumor activity of a 3-oxo derivative of oleanolic acid // Cancer Letters. 2006. Vol. 233. P. 289-296.
- Irungu B.N. et al. Constituents of the roots and leaves of Ekebergia capensis and their potential antiplasmodial and cytotoxic activities // Molecules. 2014. Vol. 19. P. 14235-14246.
- Kaminskyy D. et al. Synthesis of new potential anticancer agents based on 4-thiazolidinone and oleanane scaffolds // Medicinal Chemistry Research. 2012. Vol. 21. P. 3568-3580.
- Kinoshita K. et al. Inhibitory effect of some triterpenes from cacti on 32Pi-incorporation into phospholipids of HeLa cells promoted by 12-O-tetradecanoylphorbol-13-acetate // Phytomedicine. 1999. Vol. 6. P. 73-77.
- Lisiak N. et al. Biological activity of oleanolic acid derivatives HIMOXOL and Br-HIMOLID in breast cancer cells is mediated by ER and EGFR // International Journal of Molecular Sciences. 2023. Vol. 24. P. 5099.
- Luchnikova N.A. et al. Biotransformation of oleanolic acid using Rhodococcus rhodochrous IEGM 757 // Catalysts. 2022. Vol. 12. P. 1352.
- Luchnikova N.A., Grishko V.V., Ivshina I.B. Biotransformation of oleanane and ursane triterpenic acids // Molecules. 2020. Vol. 25. P. 5526.
- Ludwig B. et al. Whole-cell biotransformation of oleanolic acid by free and immobilized cells of Nocardia iowensis: Characterization of new metabolites // Engineering in Life Sciences. 2015. Vol. 15. P. 108115.
- Ma Y. et al. Microbial transformation of glycyrrhetinic acid and potent neural anti-inflammatory activity of the metabolites // Chinese Chemical Letters. 2017. Vol. 28. P. 1200-1204.
- Maatooq G.T. et al. Bioactive microbial metabolites from glycyrrhetinic acid // Phytochemistry. 2010. Vol. 71. P. 262-270.
- Mallavadhani U.V. et al. Synthesis and anti-cancer activity of some novel C-17 analogs of ursolic and oleanolic acids // Medicinal Chemistry Research. 2013. Vol. 22. P. 1263-1269.
- Martinez A. et al. Biotransformation of oleanolic and maslinic acids by Rhizomucor miehei // Phytochemistry. 2013. Vol. 94. P. 229-237.
- Paterson R.R.M. Fungi and fungal toxins as weapons // Mycological Research. 2006. Vol. 110. P. 10031010.
- Qin Y.J. et al. Biotransformation of glycyrrhetinic acid by Cunninghamella blakesleeana // Chinese Journal of Natural Medicines. 2010. Vol. 8. P. 373-381.
- Rakhimova M.B. et al. Effect of glycyrrhetic acid derivatives on regulation of thymocyte volume // Bulletin of Experimental Biology and Medicine. 2023. Vol. 175. P. 27-31.
- Sattarova I. et al. Research of antioxidant and prooxidant properties of glycyrrhetic acid derivatives // Science and Innovation. 2023. Vol. 2. P. 5-9.
- Shah S.A.A. et al. Microbial-catalyzed biotransformation of multifunctional triterpenoids derived from phytonutrients // International Journal of Molecular Sciences. 2014. Vol. 15. P. 12027-12060.
- Vishwakarma S. et al. In vitro and in silico studies of glycyrrhetinic acid derivatives as antitubercular agents // Letters in Drug Design & Discovery. 2022. Vol. 20. P. 479-487.
- Wang W.W. et al. Microbial hydroxylation and glycosylation of pentacyclic triterpenes as inhibitors on tissue factor procoagulant activity // Bioorganic and Medicinal Chemistry Letters. 2017. Vol. 27. P. 1026-1030.
- Wu S.B. et al. Cytotoxic triterpenoids and steroids from the bark of Melia azedarach // Planta Medica. 2011. Vol. 77. P. 922-928.
- Xu S.H., Zhang C. et al. Site-selective biotransformation of ursane triterpenes by Streptomyces griseus ATCC 13273 // RSC Advances. 2017. Vol. 7. P. 20754-20759.
- Xu S.H., Wang W.W. et al. Site-selective oxidation of unactivated C-H sp3 bonds of oleanane triterpenes by Streptomyces griseus ATCC 13273 // Tetrahedron. 2017. Vol. 73. P. 3086-3092.
- Xu S.H. et al. Application of tandem biotransformation for biosynthesis of new pentacyclic triterpenoid derivatives with neuroprotective effect // Bioorganic and Medicinal Chemistry Letters. 2020. Vol. 30. P. 126947.
- Yan S. et al. Microbial hydroxylation and glycosidation of oleanolic acid by Circinella muscae and their anti-inflammatory activities // Natural Product Research. 2018. Vol. 33. P. 1849-1855.
- Zhang J. et al. Novel biotransformation of pentacyclic triterpenoid acids by Nocardia sp. NRRL 5646 // Tetrahedron Letters. 2005. Vol. 46. P. 2337-2340.
- Zhang M. et al. Biotransformation of 18p-glycyrrhetinic acid by human intestinal fungus Aspergillus niger RG13B1 and the potential anti-inflammatory mechanism of its metabolites // Journal of Agricultural and Food Chemistry. 2022. Vol. 70. P. 15104-15115.


