Поиск природных пептидаз в микробном мате горячего источника Гарга и их разнообразие
Автор: Лаврентьева Е.В., Раднаев В.С.
Журнал: Вестник Бурятского государственного университета. Химия. Физика @vestnik-bsu-chemistry-physics
Статья в выпуске: 1, 2020 года.
Бесплатный доступ
Цель исследования - определить природные пептидазы в микробном мате горячего источника Гарга и их разнообразие. Статья посвящена комплексному исследованию пептидаз, которые представляют отдельную группу гидролитических ферментов участвующие в разложение органического вещества. Научная новизна работы заключается в анализе препаратов микробных сообществ горячих источников Байкальской рифтовой зоны методом высокопроизводительного секвенирования, которые обеспечивают гидролиз биополимеров на первых этапах деструкции органического вещества. В результате был проведен метагеномный анализ, который позволил выявить распространение пептидаз класса металлопептидаз в изученных микробных сообществах. В метагеномных последовательностях были идентифицированы потенциальные пептидазы, которые могут представлять биотехнологический интерес.
Пептидазы, микробный мат, гидролитические ферменты, металло- пептидазы, метагеномомы, секвенирование, байкальская рифтовая зона
Короткий адрес: https://sciup.org/148316720
IDR: 148316720 | УДК: 579.262(282.256.3) | DOI: 10.18101/2306-2363-2020-1-45-53
Текст научной статьи Поиск природных пептидаз в микробном мате горячего источника Гарга и их разнообразие
Гидролитические бактерии являются инициаторами процесса разложения органического вещества в микробных сообществах природных местообитаний. За последнее десятилетие появляется все больше информации о наличии полного комплекса гидролитических ферментов у представителей прокариот [1–3]. Интенсивность их деятельности очень сильно зависит от многих экологических факторов, в том числе температуры, окислительно-восстановительных условий, реакции среды. В составе органического вещества одним из основных компонентов является белок. Процесс протеолиза имеет важное биологическое значение, так как играет регулирующую роль в функционировании как клетки, так и экосистемы в целом.
Пептидазы (EC. 3.4) представляют собой отдельную подгруппу гидролитических ферментов, которые катализируют расщепление пептидных связей в белковых субстратах. В зависимости от способа действия и каталитического механиз- ма пептидазы делятся на шесть основных классов, включая сериновые пептидазы (EC. 3.4.21), цистеиновые пептидазы (EC. 3.4.22), аспарагиновые пептидазы (EC. 3.4.23), металлопептидазы (EC. 3.4.24), треониновые эндопептидазы (3.4.25) и глутаминовые (3.4.23.32) . В дополнение к их ключевой метаболической и физиологической значимости, они имеют различное коммерческое применение во всем мире.
Процесс деструкции белка пептидазами в природных экосистемах слабоизу-чен, известно лишь несколько работ, посвященных изучению гидролиза белка в морских экосистемах [2, 4] и в почве [5] .
Объекты и методы исследования
Высокотемпературный источник Гарга находится в долине р. Гарги, расположен в отрогах Икатского хребта, окаймляющего котловину с восточной стороны (54о19'203'' N и 110о59'646'' E. Участок выхода сложен водноледниковыми верхнечетвертичными отложениями, которые перекрывают палеозойские граниты, и связаны с мощным Гаргинским разломом, протягивающимся в северо-восточном направлении на 30-40 км. Температура воды на изливе достигает 74°С, рН 8,3.
Поиск пептидаз в микробном мате горячего источника Гарга проведен в ООО «Биоспарк», г. Москва.
Результаты и обсуждение
Физико-химические условия горячего источника Гарга
Термальная сульфатно-натриевая вода изливается со скоростью 5 л/с в небольшой грот, расположенный на правом берегу реки Гарга, на высоте около 100 м от уреза воды (674 м над уровнем моря). Температура воды на выходе достигает 74°С. Вода, стекая по ручью, образует травертин высотой 1,5-2 м, длиной до 50 м, шириной до 25 м и является одним из самых крупных в Байкальском регионе.
Химический состав воды (табл. 1). Доминирующий катион — Na+, его содержание составило 312,04 мг/дм3. Концентрации ионов Mg2+, К+ и Са2+ составили 0,08, 11,3 и 23 мг/дм3, соответственно. Содержание карбонатов составило 6 мг/дм3, гидрокарбонатов — 109 мг/дм3. Концентрация сульфатов 390 мг/дм3. Содержание хлоридов и фторидов 51 мг/дм3 и 11 мг/дм3, соответственно. Для источника Гарга характерно высокое содержание радона, до 43 эман.
Таблица 1
|
Na+ |
K+ |
Ca2+ |
Mg2+ |
СО 3 2- |
НСО 3 - |
NO 3 - |
NO2- |
SO 4 2- |
Н 2 SiO 3 |
F |
PO 4 3- |
Cl- |
|
312,04 |
11,3 |
23 |
0,08 |
6 |
109,83 |
7,4 |
0,004 |
390 |
89 |
10,5 |
2,02 |
51,41 |
Химический состав воды горячего источника Гарга, мг/дм3 (в месте отбора микробного мата)
Микроэлементный состав воды показал, что в Гаргинских водах отмечены повышенные концентрации B, Rb, Li, Ba, Sr. Повышенные содержания данных элементов в целом характерны для термальных источников, разгружающихся в 46
пределах Икатского хребта. Высокие содержания Sr и некоторых других элементов в горячем источнике связаны с их высоким содержанием в гранитоидных породах Баргузинского комплекса.
Для поиска природных пептидаз был отобран микробный мат при температуре воды 54,2°С, рН воды составила 8,3 и минерализация 0,74 г/ дм3.
Метагеномный анализ
На первой стадии выполнения работ по метагеномному анализа были получены данные по поглощению света препаратом ДНК (рис. 1, табл. 2)
Таблица 2
Качество и количество ДНК в полученных препаратах (Гарга)
|
A260 A230 A260 A280 Raw A260 A260 A260 Concent- A340 Turbidi (10 (10 (10 /A23 /A28 mm) mm) mm) 0 0 (ng/ul) mm) mm) |
Общее кол-во ДНК, мкг |
|
215,94 3,24 4,32 2,22 0,9 1,33 1,94 2,23 |
21,6 |
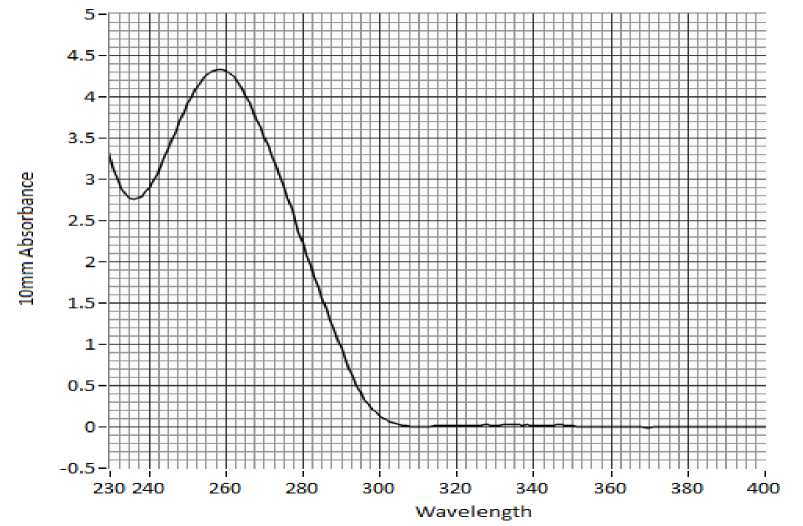
Рис. 1. Кривая поглощения света препаратами ДНК
Секвенирование полученных библиотек на платформе Illumina HiSeq
Качественные и количественные характеристики полученных данных секвенирования (табл. 3) Усредненные показатели качества прочтения (Q) каждого нуклеотида (рис. 2).
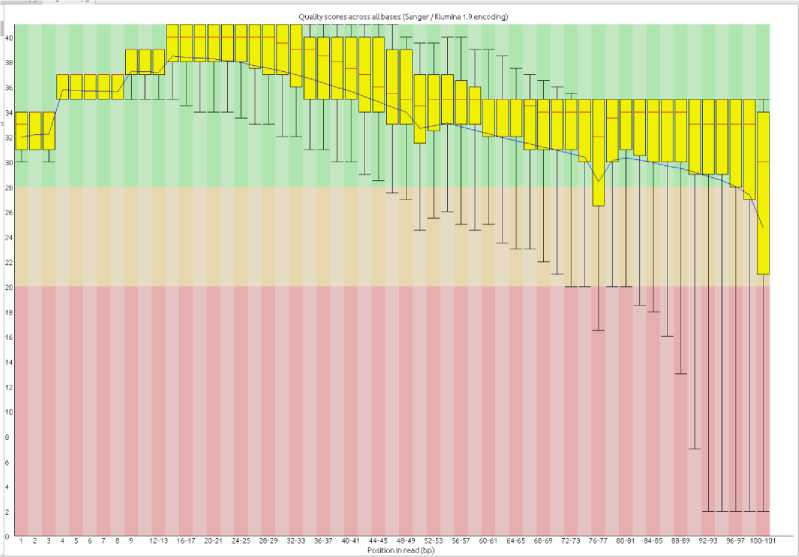
Рис. 2. Усредненные показатели качества прочтения (Q — ось ординат) каждого нуклеотида (позиции обозначены по оси абсцисс)
Качественные и количественные характеристики полученных данных секвенирования
Таблица 3
|
Образец |
Количество прочтений |
Длина прочтений |
Усредненный GC cостав прочтений |
|
Гарга |
94242298 |
101 |
59% |
На основании полученной аннотации в изученном образце был получен перечень всех выявленных типов протеаз (табл. 4)
Ферменты, идентифицированные в метагеномных последовательностях, которые могут представлять интерес для биотехнологии
Таблица 4
Перечень всех выявленных типов протеаз для каждого образца (Гарга)
|
Тип протеазы |
Код фермента по EC |
Номенклатура |
|
ATP-dependent Clp protease |
3.4.21.92 |
Сериновая пептидаза Гидролиз белка на мелкие пептиды в присутствии АТФ и Mg2+ |
|
ATP-dependent zinc metalloprotease |
3.4.24.- |
Металлоэндопептидаза |
|
CAAX amino terminal protease self- immunity |
||
|
Carboxy-terminal processing protease |
3.4.21.102 |
Сериновая пептидаза |
|
Caudovirus prohead protease |
||
|
Cysteine protease StiP |
3.4.22.- |
Цистеиновая эндопептидаза |
|
DNA-binding ATP-dependent protease La |
||
|
Extracellular basic protease |
3.4.21.- |
Сериновая эндопептидаза |
|
Extracellular metalloprotease |
3.4.21.- |
Сериновая эндопептидаза |
|
Extracellular serine protease |
3.4.21.- |
Сериновая эндопептидаза |
|
Germination protease precursor |
3.4.24.78 |
Металлоэндопептидазы Принадлежит семейству пептидаз M63 |
|
Hydrogenase maturation protease |
||
|
Intracellular serine protease |
3.4.21.- |
Сериновая эндопептидаза |
|
intramembrane serine protease GlpG |
||
|
Lon protease |
3.4.21.53 |
Сериновая эндопептидаза La Принадлежит семейству S 16 |
|
Metalloprotease LoiP |
3.4.24.- |
Металлоэндопептидаза |
|
Metalloprotease MmpA |
3.4.24.- |
Металлоэндопептидаза |
|
Minor extracellular protease Epr |
3.4.21.- |
Сериновая эндопептидаза |
|
Minor extracellular protease vpr |
3.4.21.- |
Сериновая эндопептидаза |
|
Multifunctional acyl-CoA thioesterase I and protease I and lysophospholipase L1 |
||
|
Neutral metalloprotease |
3.4.24.- |
Металлоэндопептидааз |
|
Neutral protease B |
3.4.24.- |
Металлоэндопептидаза |
|
Papain family cysteine protease |
||
|
Periplasmic pH-dependent serine endoprotease DegQ |
3.4.21.107 |
Сериновая эндопептидаза Принадлежит семейству S1B |
|
Periplasmic serine endoprotease DegP |
3.4.21.107 |
Сериновая эндопептидаза Принадлежит семейству S1B |
|
Prohead core protein protease |
|
Protease 1 |
3.4.21.50 |
Сериновая эндопептидаза Lysyl endopeptidase |
|
Protease 2 |
3.4.21.83 |
Сериновая эндопептидаза Oligopeptidase B |
|
Protease 3 |
3.4.24.55 |
Металлоэндопептидаза Pitrilysin |
|
Protease 4 |
3.4.21.- |
Сериновая эндопептидаза |
|
Protease HtpX |
3.4.24.- |
Металлоэндопептидаза |
|
Protease LasA |
3.4.24.- |
Металлоэндопептидаза |
|
Protease PrsW |
||
|
Protease TldD |
||
|
Putative CtpA-like serine protease |
3.4.21.- |
Сериновая эндопептидаза |
|
Putative cysteine protease YraA |
||
|
Putative metalloprotease YpwA |
3.4.24.- |
Металлоэндопептидаза |
|
Putative peptide zinc metalloprotease protein YydH |
||
|
Putative protease YdeA |
||
|
Putative protease YhbU |
||
|
Putative serine protease HhoA |
||
|
Putative serine protease HtrA |
||
|
Putative subtilase-type serine protease precursor |
3.4.21.- |
Сериновая эндопептидаза |
|
Putative zinc metalloprotease Rip3 |
||
|
Putative zinc protease AlbF |
3.4.24.- |
Металлоэндопептидаза |
|
Retroviral aspartyl protease |
||
|
Rhomboid protease AarA |
3.4.21.105 |
Сериновая эндопептидаза Rhomboid protease |
|
Rhomboid protease GlpG |
3.4.21.105 |
Сериновая эндопептидаза Rhomboid protease |
|
Rhomboid protease GluP |
3.4.21.105 |
Сериновая эндопептидаза Rhomboid protease |
|
Serine endoprotease DegS |
3.4.21.107 |
Сериновая эндопептидаза Принадлежит семейству S1B |
|
Serine protease AprX |
3.4.21.- |
Сериновая эндопептидаза |
|
Serine protease Do-like HtrA |
3.4.21.107 |
Сериновая эндопептидаза Принадлежит семейству S1B |
|
Serine protease Do-like HtrB |
3.4.21.107 |
Сериновая эндопептидаза Принадлежит семейству S1B |
|
Serine protease HtrA-like protein |
3.4.21.- |
Сериновая эндопептидаза |
|
Serine protease SplB |
3.4.21.- |
Сериновая эндопептидаза |
|
Sporulation-specific protease YabG |
||
|
Tail-specific protease |
3.4.21.102 |
Сериновая эндопептидаза Re |
|
Thermophilic metalloprotease (M29) |
||
|
Thermostable alkaline protease |
3.4.21.- |
Сериновая эндопептидаза |
|
Transglutaminase-activating metalloprotease |
||
|
Zinc metalloprotease Rip1 |
3.4.24.- |
Металлоэндопептидаза |
В природных местообитаниях гидролитические бактерии занимают нишу первичных деструкторов, благодаря способности гетеротрофно расти на биополимерах различной природы. Особенностью изученных микробных сообществ термальных источников Прибайкалья является его термофилия и алкалитолернат-ность, что предполагает термо- и рН стабильность соответствующих ферментов.
Проведенный метагеномный анализ позволил выявить гены пептидаз в природном образце микробного мата горячего источника Гарга. Анализ собранных метагеномных последовательностей позволил систематизировать и дать характеристику выявленных генов. Сравнение метагеномных последовательностей репрезентативных данных показало доминирование ферментов класса сериновых пептидаз. Ферменты, относящиеся к этому классу, ингибируются диизопропил-фторфосфатом и фенилметилсульфонилфторидом, а также субстратоподобными галоидметилкетонами, такими как тозиллизинхлорметилкетон (TLCK) или тозилфенилаланинхлорметилкетон (TPCK). Из литературных данных известно, что сериновые пептидазы обычно активны при нейтральных и щелочных значениях рН и имеют оптимум рН между 7 и 11 [6]. На основании аминокислотной последовательности, пептидазы делят на семейства и в настоящее время выделено более 20 семейств. В нашем исследовании было выявлено 7 представителей сериновых пептидаз (табл. 4). Принято считать, что эволюционное родство ферментов выражается в гомологии первичной и сходстве пространственной структур. Поэтому этим признакам придается большое значение. Известны случаи, когда сходство структуры каталитического центра не сопровождается гомологией пространственной и первичной структур. Вероятно, такое сходство является следствием конвергентной эволюции.
Метагеномный анализ позволил выявить распространение пептидаз класса металлопептидаз в изученных микробных сообществах. В классе металлопепти-дазы выделяют 25 семейств, обнаруженных в разных систематических группах. Металлопептидазы, как правило, синтезируются в неактивной форме и активируются в присутствии ионов металлов (магния, марганца, кобальта, цинка). Активность металлопротеиназ подавляется веществами, связывающими металлы — ЭДТА, 1,10-фенантролином, версеном, цитратом, фосфамидом и др. Оптимальные значения рН для металлопротеиназ также лежат в диапазоне 7–9. Также известны металлопротеиназы, обладающие свойствами термостабильности [3].
Обнаружены единичные последовательности генов класса цистеиновых пептидаз в микробном сообществе Гарга. Возможно, это связано с тем, что цистеиновые пептидазы эффективны при нейтральных значениях рН; реже зона оптимума лежит в слабокислой или слабощелочной среде (pH 4–9) в зависимости от природы гидролизуемого белка [3]. У изученного нами микробного сообщества диапазон развития находится в высокотемпературной зоне и щелочной области рН. В состав активного центра цистеиновых пептидаз входит цистеин и гистидин [7]. Цистеиновые пептидазы активируются синильной кислотой и сульфгидрильными соединениями — восстановленным глутатионом, дитиотреи-толом, 2-меркаптоэтанолом и цистеином.
Таким образом, на основе анализа препаратов тотальной ДНК микробных сообществ горячих источников Байкальской рифтовой зоны методом высокопроизводительного секвенирования были получены данные о высоком разнообразии природных пептидаз в исследуемом микробном сообществе, которые обеспечи- 51
вают гидролиз биополимеров на первых этапах деструкции органического вещества.
В метагеномных последовательностях были идентифицированы потенциальные пептидазы, которые могут представлять биотехнологический интерес. Их использование в разных областях промышленности, медицины, биоремедиации обусловлено несколькими факторами: снижением риска контаминации, увеличением скорости процессов и повышением общей стабильности ферментов.
Работа поддержана бюджетной темой ИОЭБ СО РАН АААА-А17-117011810034-9
Список литературы Поиск природных пептидаз в микробном мате горячего источника Гарга и их разнообразие
- Замана Л. В., Хахинов В. В., Данилова Э. В., Бархутова Д. Д. Гидрохимия минеральных вод // Геохимическая деятельность микроорганизмов гидротерм Байкальской рифтовой зоны. Новосибирск: Академическое изд-во "Гео". 2011. С. 62-101.
- Obayashi Y., Ueoka N., Suzuki S. Degradation and utilization of protein derived from Pseudomonas aeruginosa by marine microbial community // J. Oceanogr. 2010. V. 6. P. 513- 521.
- Oliveira A. S., Filho J. X., Sales M. P. Cysteine proteinases cystatins // Braz Arch Biol Technol. 2003. V. 46, № 1. P. 91-104.
- Orsi W. D., Smith J. M., Liu S. and oth. Diverse, uncultivated bacteria and archaea underlying the cycling of dissolved protein in the ocean // ISME J. 2016. V. 10. P. 2158-2173.
- Vranova V., Rejsek K., Formanek P. Proteolytic activity in soil: A review // Applied Soil Ecology. 2013. V. 70. P. 23-32.
- Rao M. B., Tanksale A. M., Ghatge M. S., Deshpande V. V. Molecular and biotechnological aspects of microbial proteases // Microbiol. Mol. Biol. Rev. 1998. V. 62, № 3. P. 597-635.
- Rawlings N. D. and Barrett A. J. Evolutionary families of peptidases // Biochem. J. 1993. V. 290. P. 205-218.


