Показатели свободных аминокислот плазмы крови человека при нормобарической гипоксии в зависимости от пищевого статуса
Автор: Черных Алексей Анатольевич, Потолицына Наталья Николаевна, Бурых Эдуард Анатольевич, Бойко Евгений Рафаилович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 1, 2020 года.
Бесплатный доступ
Цель исследования: изучить воздействие острой нормобарической гипоксии на метаболизм свободных аминокислот (АК) плазмы крови у добровольцев, участвовавших в исследовании натощак и после лёгкого завтрака. Материалы и методы. Первая группа добровольцев (22-32 года, n=13) участвовала в исследовании утром натощак, вторая группа (22-32 года, n=9) - через 2-3 ч после лёгкого безжирового завтрака. Гипоксия создавалась путём подачи через маску дыхательной смеси, содержащей 9 % О2 и 91 % N2. В соответствии с протоколом проводился периодический забор крови из локтевой вены для анализа. Оценка уровней свободных АК плазмы крови производилась с помощью аминокислотного анализатора Aracus. Результаты. До начала гипоксии, на 5-й и 20-й мин гипоксии уровни свободных АК в первой и второй группах значимо не различались (p>0,05). На 10-й мин гипоксии между первой и второй группами наблюдались статистически значимые различия уровней четырёх АК: глутамина, серина, треонина и гистидина (p
Острая нормобарическая гипоксия, свободные аминокислоты плазмы крови, человек
Короткий адрес: https://sciup.org/14117545
IDR: 14117545 | УДК: 612.014.464:612.015.348 | DOI: 10.34014/2227-1848-2020-1-108-117
Текст научной статьи Показатели свободных аминокислот плазмы крови человека при нормобарической гипоксии в зависимости от пищевого статуса
Введение. Гипоксия – снижение парциального давления кислорода в тканях – один из наиболее универсальных патологических факторов, воздействующих на живые организмы. Целый ряд профессий сопряжён с повышенным риском развития острой гипоксии: экипажи самолётов, персонал горноспасательных команд, горнолыжных курортов, работники высокогорных рудников, пожарные [1]. Адаптация к гипоксии обеспечивается одновременной активацией сложных, координированных и взаимосвязанных процессов, охватывающих множество различных анатомиче- ских и функциональных систем [2–4]. Эти изменения в гомеостазе нацелены на поддержание жизненно важных функций в условиях дефицита кислорода.
Адаптивные процессы в тканях при гипоксии включают изменения множества метаболических путей, в т.ч. метаболизма белков и аминокислот [5]. Аминокислоты (АК) являются субстратами для синтеза функциональных и структурных белков организма, для энергетического метаболизма. Помимо этого, было показано, что свободные АК участвуют в поддержании работы и регуляции ключевых метаболических путей, которые обеспечивают жизнедеятельность, рост, развитие, иммунитет и размножение организмов [6], регулируют экспрессию генов, метилирование ДНК, активацию mTOR [7].
С одной стороны, полагают, что системный гомеостаз АК у человека жёстко регулируется, даже в условиях недостаточного поступления белка [8–10]. С другой стороны, в организме человека отсутствует истинное депо АК, поэтому пул свободных АК плазмы крови (рис. 1) играет очень важную роль в обмене и межорганном транспорте АК [11]. Ранее было показано, что пул АК плазмы реагирует на гипоксию: у морских пехотинцев США было обнаружено значимое снижение уровня свободного триптофана плазмы после подъёма на высоту 2130 м и тренировок на высотах от 2400 до 3000 м над уровнем моря [12]. В другой работе было показано, что во время пребывания на высоте 5300 м над уровнем моря в плазме крови повышались уровни свободных пролина, аланина, гидроксипролина и метионина и снижались уровни свободного валина [13].
Вместе с тем единого взгляда на метаболизм свободных АК при гипоксических состояниях до настоящего времени нет, особенно в ситуации острой гипоксии. Также не выяснено, каким образом может отразиться прием пищи на метаболизме свободных АК при острой гипоксии.
Цель исследования. Изучить воздействие острой нормобарической гипоксии на метаболизм свободных аминокислот плазмы крови у добровольцев, участвовавших в исследовании натощак и после лёгкого завтрака.
Материалы и методы. Дизайн исследования и протокол гипоксического воздействия соответствовали положениям Хельсинкской декларации Всемирной медицинской ассоциации [14] и были одобрены комитетом по этике Института физиологии Коми НЦ УрО РАН (г. Сыктывкар). Участники – здоровые молодые мужчины (22–32 года) – получили всю необходимую информацию о протоколе исследования, используемых процедурах, возможном риске и дискомфорте, связанных с воздействием гипоксии. Они также были проин- формированы, что могут отказаться от участия в исследовании в любой момент без каких-либо последствий. После полного инструктажа все добровольцы-участники дали письменное информированное согласие.
Подробно процедура исследования была описана нами ранее [15]. Все исследования проводились в лаборатории отдела экологической и медицинской физиологии Института физиологии Коми НЦ УрО РАН в апреле, в первую половину дня, при температуре 20 ºС. Добровольцы из первой группы (n=13) участвовали в исследовании утром натощак (после 12 часов без приёма пищи), добровольцы из второй группы (n=9) – через 2–3 ч после лёгкого безжирового завтрака. Для проведения исследования участники размещались в медицинском кресле «КМ» («Диакос», Россия). Для отбора образцов крови на анализ в локтевую вену устанавливался периферический катетер (TROGE MEDICAL GmbH, Германия). В промежутках между заборами крови по катетеру осуществлялась медленная инфузия физиологического раствора хлорида натрия для обеспечения проходимости катетера и восполнения потерь объема циркулирующей крови. Гипоксия создавалась путём подачи через маску дыхательной смеси, содержащей 9 % О 2 и 91 % N 2 (ГГС-9). Схема гипоксического воздействия и забора крови приведена на рис. 1.
Забор крови осуществлялся до начала гипоксии (фон), на 5-й, 10-й и 20-й мин гипоксии. В каждой точке отбиралось 2–3 мл крови из локтевой вены. После забора образцы крови центрифугировались при 3000 об/мин для отделения форменных элементов. Плазма отбиралась, расфасовывалась в пробирки-эп-пендорфы и замораживалась для дальнейшего анализа.
Оценка уровней свободных АК в плазме крови участников производилась с помощью классического метода ионообменной градиентной жидкостной хроматографии с постколоночной дериватизацией нингидрином на специализированном аминокислотном анализаторе Aracus (MembraPure GmbH, Германия). Для обсчёта полученных хроматограмм использовалась программа AminoPeak (MembraPure GmbH, Германия).
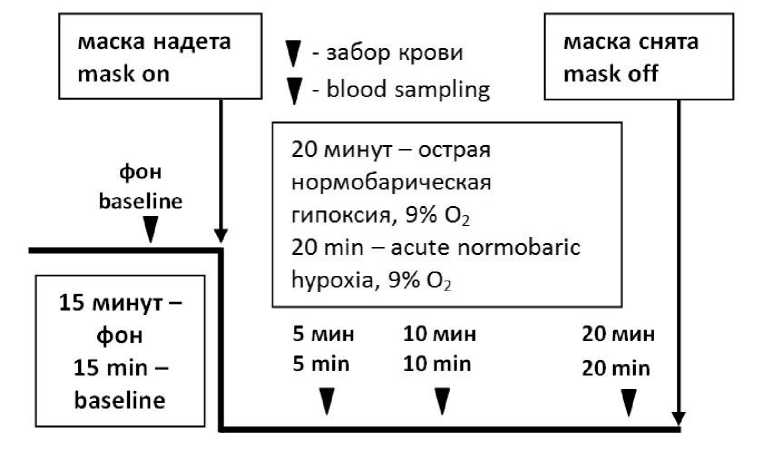
Рис. 1. Схема эксперимента и протокол забора образцов крови
Fig. 1. Experimental and blood sampling protocols
Статистическая обработка результатов производилась с применением статистической программы R (v.3.6.0, R Development Core Team, 2018) с помощью пакетов WRS2 (v.1.0-0, Mair P., Wilcox R.R., 2019), PMCMR-plus (v.1.4.2, Pohlert T., 2018). Графики создавались с помощью пакета ggplot2 (v. 3.2.1, Wickham H., 2016). Значимость различий между первой и второй группами оценивалась по критерию Баумгартнера–Вайса– Шиндлера. Данные представлены как медиана, 25-й и 75-й перцентили: Me (25 %; 75 %).
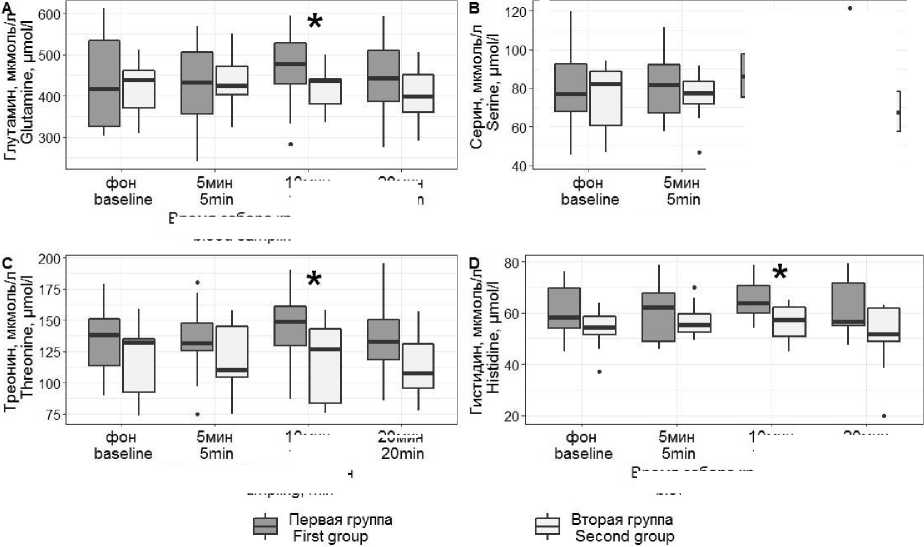
Результаты. До начала гипоксического воздействия и на 5-й мин гипоксии уровни свободных АК в первой и второй группах значимо не различались (p>0,05, табл. 1). На 10-й мин гипоксии между первой и второй группами наблюдались статистически значимые различия уровней четырёх АК: глутамина, серина, треонина и гистидина. На 20-й мин гипоксии различия по уровням АК нивелировались (p>0,05, табл. 1).
Обсуждение. Данные литературы свидетельствуют, что системный гомеостаз АК в организме человека достаточно жёстко регулируется, даже в условиях недостаточного поступления белка [8, 9]. Это подтверждается тем, что кратковременное голодание не ведёт к снижению уровней отдельных АК в плазме, и даже длительное голодание вызывает достаточно умеренные изменения профиля АК плазмы [10]. Вместе с тем нет единого мнения относительно влияния приема пищи на содержание свободных АК плазмы крови у человека; ряд исследователей считают, что только при высокобелковой диете обнаруживается их значимое постпрандиальное повышение [16].
В ряде работ было продемонстрировано изменение уровней отдельных свободных АК плазмы крови при различных воздействиях, в т.ч. гипоксических [12, 13, 17]. Так, в частности, нами ранее было показано, что острое гипоксическое воздействие (ГГС-9, 20 мин) приводит к значимым изменениям уровней ряда АК плазмы у добровольцев в динамике гипоксического воздействия и восстановительного периода после него.
Таким образом, можно говорить о высокой эффективности гомеостаза АК в человеческом организме. Такой контроль требует наличия взаимосвязанных и взаимозависимых процессов, включающих всасывание поступивших извне АК в ЖКТ, синтез АК de novo в тканях организма, высвобождение АК при деградации внутри- и внеклеточных белков, обмен АК между цитоплазмой и межклеточной жидкостью, плазмой крови с помощью специфических белков-переносчиков.
Таблица 1
Table 1
Уровни свободных глутамина, серина, треонина и гистидина плазмы крови у добровольцев в динамике гипоксического эксперимента, мкмоль/л
Plasma levels of free glutamine, serine, threonine, and histidine in volunteers during a hypoxic experiment, µmol/l
|
Группа Group |
Фон Baseline |
Гипоксия Hypoxia |
||
|
5-я мин гипоксии 5th minute of hypoxia |
10-я мин гипоксии 10th minute of hypoxia |
20-я мин гипоксии 20th minute of hypoxia |
||
|
Глутамин Glutamine |
||||
|
Первая группа Group 1 |
416,1 (326,0; 533,9) |
432,3 (356,5; 504,5) |
478,1 (429,0; 526,8)* |
442,3 (385,6; 508,9) |
|
Вторая группа Group 2 |
439,0 (369,2; 460,0) |
425,1 (401,6; 471,4) |
437,2 (380,7; 440,1)* |
397,2 (359,4; 451,7) |
|
Серин Serine |
||||
|
Первая группа Group 1 |
76,9 (67,9; 92,5) |
81,9 (67,0; 92,0) |
86,2 (75,4; 97,9)* |
77,3 (73,1; 91,7) |
|
Вторая группа Group 2 |
82,2 (60,7; 88,6) |
77,5 (71,8; 83,5) |
73,5 (54,3; 87,6)* |
67,4 (57,7; 78,2) |
|
Треонин Threonine |
||||
|
Первая группа Group 1 |
138,5 (113,4; 150,6) |
131,6 (125,8; 147,5) |
148,7 (129,3; 160,6)* |
132,9 (118,5; 150,4) |
|
Вторая группа Group 2 |
132,2 (92,4; 135,1) |
110,4 (104,1; 144,8) |
127,2 (83,9; 142,8)* |
107,63 (95,9; 131,0) |
|
Гистидин Histidine |
||||
|
Первая группа Group 1 |
58,1 (53,9; 69,7) |
62,3 (48,8; 67,8) |
63,9 (59,8; 70,7)* |
56,7 (55,1; 71,5) |
|
Вторая группа Group 2 |
54,4 (51,3; 58,7) |
55,2 (52,5; 59,5) |
57,2 (51,0; 62,1)* |
51,8 (48,7; 61,7) |
Примечание. * - различия между первой и второй группами достоверны при p<0,05.
Note. * - the differences between Group 1 and Group 2 are significant at p<0.05.
В проведённом исследовании две группы добровольцев подвергались гипоксическому воздействию либо с утра натощак (первая группа), либо после лёгкого безжирового завтрака (вторая группа). Известно, что при ограничении поступления АК в организм внутриклеточная концентрация незаменимых АК, особенно метионина, АК с разветвлённой цепью, увеличивается [18]. Такие изменения объясняют двумя механизмами: активацией высвобождения этих АК из внутриклеточных белков в результате аутофагии и увеличением их транспорта в клетки извне [19].
Согласно полученным результатам, между группами не наблюдалось различий по показателям большинства АК, включая большую часть незаменимых АК, ни до гипоксии, ни в течение 20 мин гипоксического воздействия. Это говорит о том, что регуляторные механизмы в целом эффективно справляются с поддержанием гомеостаза АК даже на фоне острой гипоксии, несмотря на различия между первой и второй группами. Статистически значимые различия были выявлены только для четырёх АК: глутамина, серина, треонина и гистидина – и только на 10-й мин гипоксии (рис. 2). При этом изменения были сходны: уровни этих свободных АК плазмы были зна- чимо выше в первой группе по сравнению со второй. Такая избирательность в отношении отдельных АК свидетельствует о наличии специфического механизма. Предположительно, наблюдаемая картина объясняется различиями работы транспортных систем АК, осуществляющих перенос молекул АК через клеточную мембрану.
20 мин
Юмин 10min Время забора крови, мин blood sampling, min
Юмин 10min
Время забора крови, мин blood sampling, min
Группы:
Groups:
Юмин 20мин
10min 20min
Рис. 2. Уровни свободных глутамина, серина, треонина и гистидина плазмы крови у добровольцев в динамике гипоксического эксперимента, мкмоль/л (* – различия между первой и второй группами достоверны при p<0,05)
20мин
Юмин 20мин
10min 20 min
время забора крови, мин blood sampling, min
Время забора крови, мин blood sampling, min
Fig. 2 . Plasma levels of free glutamine, serine, threonine, and histidine in volunteers during a hypoxic experiment, µmol/l
(* – the differences between Group 1 and Group 2 are significant at p≤0.05)
У человека имеется множество типов мембранных транспортёров АК, обладающих специфичностью в отношении переносимых АК [20]. Важную роль в системном гомеостазе АК играют универсально встречающиеся «гармонизирующие» транспортёры, ключевая функция которых – компенсация дисбалансов АК, возникающих в клетке при активном потреблении и недостаточном поступлении различных АК [8]. Эти транспортные системы работают по принципу антипорта, т.е. переносят молекулы определённых АК из внеклеточного пространства в цитоплазму в обмен на молекулы других АК, которые таким образом выводятся из клетки («обменные субстраты») [20]. Движущей силой этих антипортов являются градиенты концентрации АК-обменных субстратов, существующие между цитоплазмой и межклеточной жидкостью (уровни АК в цитоплазме значительно превышают уровни в плазме) [21].
Четыре АК, уровни которых продемонстрировали значимые различия между группами, являются такими обменными субстра- тами для важных «гармонизирующих» транспортёров: ASCT1 (SLC1A4), ASCT2 (SLC1A5) и LAT1 (SC7A5).
Известно, что ASCT1 (SLC1A4) и ASCT2 (SLC1A5) транспортируют небольшие нейтральные АК и могут использовать в качестве обменных субстратов заменимый серин и незаменимый треонин [8]. Другой важный транспортёр – LAT1 (SC7A5) – обеспечивает перенос большей части незаменимых АК – триптофана, фенилаланина, гистидина, лейцина, изолейцина, валина, метионина (а также тирозина) – внутрь клетки также по механизму антипорта [20]. При этом гистидин является одним из основных обменных субстратов для LAT1, и считается, что именно градиент по гистидину между цитоплазмой и межклеточной жидкостью движет переносом других АК через мембрану при участии LAT1. Глутамин – это АК, «объединяющая» транспортёры ASCT2 (SLC1A5) и LAT1 (SC7A5) и способная выступать обменным субстратом в обеих системах. Таким образом, эта АК может обмениваться на незаменимые АК из межклеточной среды, если клетка испытывает потребность в них [22].
Можно предположить, что причиной наблюдавшихся различий уровней четырёх АК на 10-й мин гипоксии послужили различия в активности упомянутых переносчиков АК между двумя группами.
В литературе внимание преимущественно уделяется регуляции экспрессии генов этих транспортных белков – ключевому регуляторному механизму, не способному, однако, обеспечить кратковременное изменение активности. В то же время имеются свидетельства наличия быстрой регуляции: для транспортёров семейства А был продемонстриро- ван рекрутинг транспортёров в мембраны [23], в т.ч. под действием таких гормонов, как инсулин [24]. Для ASCT1, в частности, было показано быстрое изменение активности под действием лейкотриена D4 [25]. Ещё большие пробелы остаются в понимании регуляции активности LAT1 [20], но было показано, что изменение содержания холестерина в мембране влияет на работу этого переносчика [25].
Заключение. Полученные данные свидетельствуют об удовлетворительном поддержании гомеостаза АК у двух групп добровольцев, подвергавшихся воздействию острой нормобарической гипоксии натощак и после лёгкого завтрака. Выявленные на 10-й мин острой гипоксии значимые различия между группами в уровнях ряда свободных АК плазмы крови могли быть обусловлены изменениями в работе «гармонизирующих» мембранных транспортёров, для которых эти АК – глутамин, серин, треонин и гистидин – являются обменными субстратами. Известно, что на работу переносчиков АК оказывают влияние быстрые механизмы изменения их активности, в т.ч. и опосредованные питанием. Можно заключить, что острая нормобарическая гипоксия у добровольцев-мужчин при различном статусе питания (натощак и после лёгкого завтрака) оказывает разнонаправленное влияние на уровни отдельных свободных АК плазмы крови. Наблюдаемые изменения уровней свободных АК при гипоксии, вероятно, отражают срочные адаптивные перестройки обмена АК в ответ на воздействие экстремального раздражителя. Мы полагаем, что это может иметь значение для обеспечения адаптации организма человека к острой гипоксии и эффективной коррекции последствий гипоксического воздействия.
Список литературы Показатели свободных аминокислот плазмы крови человека при нормобарической гипоксии в зависимости от пищевого статуса
- Küpper T., Milledge J.S., Hillebrandt D., Kubalovâ J., Hefti U., Basnyat B. Work in hypoxic conditions-consensus statement of the Medical Commission of the Union Internationale des Associations d'Alpinisme (UIAA MedCom). Ann. Occup. Hyg. 2011; 55 (4): 369-386.
- Сороко С.И., Бурых Э.А., Бекшаев С.С., Сергеева Е.Г. Комплексное многопараметрическое исследование системных реакций организма человека при дозированном гипоксическом воздействии. Физиология человека. 2005; 31 (5): 88-109.
- Балыкин М.В., Сагидова С.А., Айзятулова Е.Д., Антипов И.В., Жарков А.В. Гипоксия: системные, органные, молекулярно-клеточные механизмы компенсации и адаптации. Ульяновский медико-биологический журнал. 2016; 4: 12-14.
- Ветош А.Н. Взаимодействие кислородчувствительных механизмов в клетке. Ульяновский медико-биологический журнал. 2019; 3: 52-62.
- Solberg R., Enot D., Deigner H.P., Koal T., Scholl-Burgi S., Saugstad O.D. Metabolomic Analyses of Plasma Reveals New Insights into Asphyxia and Resuscitation in Pigs. Plos One. 2010; 5 (3): e9606.
- Wu G. Functional amino acids in nutrition and health. amino acids. 2013; 45 (3): 407-411.
- Dillon E.L. Nutritionally essential amino acids and metabolic signaling in aging. amino acids. 2012; 45 (3): 431-441.
- Bröer S., Bröer A. Amino acid homeostasis and signalling in mammalian cells and organisms. Biochemical Journal. 2017; 474 (12): 1935-1963.
- Cynober L.A. Plasma amino acid levels with a note on membrane transport: characteristics, regulation, and metabolic significance. Nutrition. 2002; 18 (9): 761-766.
- Felig P., Owen O.E., Wahren J., Cahill G.FJr. Amino acid metabolism during prolonged starvation. The Journal of clinical investigation. 1969; 48 (3): 584-594.
- Brosnan J.T. Interorgan amino acid transport and its regulation. Journal of Nutrition. 2003; 133 (6): 2068S-2072S.
- Castell L.M., Thake C.D., Ensign W. Biochemical markers of possible immunodepression in military training in harsh environments. Military medicine. 2010; 175 (3): 158-165.
- Liao W. T., Liu B., Chen J., Cui J.H., Gao Y.X., Liu F. Y. Metabolite Modulation in Human Plasma in the Early Phase of Acclimatization to Hypobaric Hypoxia. Scientific reports. 2016; 6: 22589.
- World Medical Association Declaration of Helsinki. Ethical principles for medical research involving human subjects. Bull World Health Organ. 2001; 79 (4): 373-374.
- Бойко Е.Р., Людинина А.Ю., Бурых Э.А., Потолицына Н.Н., Канева А.М., Пономарев М.Б., Шадрина В.Д., Паршукова О.И., Иржак Л.И., Сороко С.И. Изменение пула жирных кислот в плазме крови у человека при воздействии острой нормобарической гипоксии. Российский физиологический журнал им. И.М. Сечернова. 2010; 96 (5): 441-454.
- Milsom J.P., Morgan M.Y., Sherlock S. Factors affecting plasma amino acid concentrations in control subjects. Metabolism. 1979; 28 (4): 313-319.
- Bailey D.M., Castell L.M., Newsholme E.A., Davies B. Continuous and intermittent exposure to the hypoxia of altitude: implications for glutamine metabolism and exercise performance. British Journal of Sports Medicine. 2000; 34 (3): 210-212.
- Millward D.J., Nnanyelugo D.O., James W.P.T., Garlick P.J. Protein metabolism in skeletal muscle: the effect of feeding and fasting on muscle RNA, free amino acids and plasma insulin concentrations. British Journal of Nutrition. 1974; 32 (1): 127-142.
- Mizushima N. The role of the Atg1/ULK1 complex in autophagy regulation. Current Opinion in Cell Biology. 2010; 22 (2): 132-139.
- Scalise M., Galluccio M., Console L., Pochini L., Indiveri C. The Human SLC7A5 (LAT1): The Intriguing Histidine/Large Neutral Amino Acid Transporter and Its Relevance to Human Health. Frontiers in Chemistry. 2018; 6 (243).
- Bergstrom J., Furst P., Noree L.O., Vinnars E. Intracellular free amino acid concentration in human muscle tissue. J. Appl. Physiol. 1974; 36 (6): 693-697.
- Bhutia Y.D., Ganapathy V. Glutamine transporters in mammalian cells and their functions in physiology and cancer. Biochim Biophys Acta. 2016; 1863 (10): 2531-2539.
- Ling R., Bridges C.C., Sugawara M., Fujita T., Leibach F.H., Prasad P.D. Involvement of transporter recruitment as well as gene expression in the substrate-induced adaptive regulation of amino acid transport system A. Biochimica et Biophysica Acta (BBA) - Biomembranes. 2001; 1512 (1): 15-21.
- Hyde R., Peyrollier K., Hundal H.S. Insulin promotes the cell surface recruitment of the SAT2/ATA2 system A amino acid transporter from an endosomal compartment in skeletal muscle cells. The Journal of biological chemistry. 2002; 277 (16): 13628-13634.
- Dickens D., Chiduza G.N., Wright G.S.A., Pirmohamed M., Antonyuk S.V., Hasnain S.S. Modulation of LAT1 (SLC7A5) transporter activity and stability by membrane cholesterol. Scientific reports. 2017; 7: 43580.


