Полиамины как регуляторы биоплёнкообразования природных изолятов Escherichia coli с разной степенью устойчивости к фторхинолонам
Автор: Нестерова Лариса Юрьевна, Караваева Елена Анатольевна, Ткаченко Александр Георгиевич
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2011 года.
Бесплатный доступ
На основе анализа природных штаммов Escherichia coli показано, что микроорганизмы, устойчивые к действию фторхинолонов, обладают повышенной способностью к биоплёнкообразованию и высокой активностью орнитиндекарбоксилазы - ключевого фермента системы синтеза полиаминов. Установлено, что сублетальные концентрации фторхинолонов стимулируют биоплёнкообразование. Полиамины путресцин и спермидин оказывают стимулирующее действие на способность к биоплёнкообразованию у штаммов с разной степенью устойчивости к фторхинолонам как в присутствии антибиотика, так и в его отсутствие.
Биоплёнкообразование, антибиотикорезистентность, полиамины, орнитиндекарбоксилаза, левофлоксацин
Короткий адрес: https://sciup.org/147204545
IDR: 147204545 | УДК: 579.22
Текст научной статьи Полиамины как регуляторы биоплёнкообразования природных изолятов Escherichia coli с разной степенью устойчивости к фторхинолонам
Образование биопленок микроорганизмами представляет собой одну из основных проблем не только в области медицины, но и в экономической сфере, что связано с большим материальным уроном, наносимым обрастанием внутренней поверхности трубопроводов различного назначения.
Ранее показано, что в естественной среде обитания микроорганизмы часто образуют биоплёнки, которые представляют собой одну из наиболее распространенных форм их существования в природе. В структуре биоплёнок бактерии, находясь в состоянии поверхностной или межклеточной адгезии, заключены в синтезированный ими полимерный матрикс и по сравнению с планктонными клетками характеризуются специфичными физиологическими и метаболическими свойствами, обусловленными изменением их генной экспрессии. (Pratt, Kolter, 1999; Landini, 2009). Существование в виде биоплёнки даёт микроорганизмам ряд преимуществ, основным из которых является повышенная устойчивость к различным неблагоприятным воздействиям. Чувствительность бактерий, включенных в структуру биоплёнки, к антибактериальным препаратам может снижаться в 10–1000 раз по сравнению с планктонными формами (Naves et al., 2008), что создает трудности в терапии инфекционных заболеваний. Известно, что возбудителями более 60% внутрибольничных инфекций являются микроорга- низмы, растущие в виде биоплёнок (Davey, O’Toole, 2000). Однако, несмотря на интенсивные исследования в области структуры биоплёнкообразования, проблема регуляции этого процесса до сих пор остаётся малоизученной. Экспериментально доказано, что неблагоприятные внешние воздействия различной природы могут индуцировать и поддерживать образование биоплёнок (Landini, 2009), установлена роль многочисленных внутриклеточных факторов в их биогенезе, что указывает на сложность процесса биопленкообразования (Ghannoum, O’Toole, 2004). Показано, что в формировании биопленок существенную роль играют различные системы общей клеточной адаптации (Beloin, Roux, Ghigo, 2008).
Полученные в последнее время данные свидетельствуют о том, что существенную роль в адаптации микроорганизмов к различным видам стресса играют полиамины, универсальные клеточные регуляторы, присутствующие в клетках всех живых организмов (Tkachenko, Nesterova, Pshenichnov, 2001; Ткаченко, Нестерова, 2003; Ткаченко, Пожидаева, Шумков, 2006). Основными представителями соединений этого класса у прокариот являются аминосодержащие алифатические углеводороды путресцин и спермидин (Igarashi, Kashivagi, 2000). Ранее нами показано, что в ответ на воздействие фторхинолоновых антибиотиков в клетках E. coli происходит рост активности ферментов синтеза
полиаминов, что приводит к внутриклеточному накоплению этих соединений, где они играют роль фактора адаптации (Ахова, Ткаченко, 2009).
В связи с этим значительный интерес представляет изучение распространенности этого механизма адаптации среди природных штаммов микроорганизмов, что могло бы прояснить вопрос о его селективной значимости как признака антибиотико-устойчивости и повлиять на выбор стратегии усиления действия антибиотиков.
Исходя из этого, целью настоящей работы является изучение активности полиаминсинтезирующей системы в связи со способностью к образованию биоплёнок у природных штаммов Escherichia coli , выделенных из различных источников и обладающих разной степенью устойчивости к фторхиноло-ну левофлоксацину. Работа направлена также на исследование возможной роли полиаминов в механизме биопленкообразования у E. coli как в обычных условиях, так и при сублетальных воздействиях антибиотика.
Материалы и методы
Культивирование микроорганизмов. Природные штаммы E.coli сохраняли на скошенном агаре. При подготовке экспериментов штаммы высевали на пробирки, содержащие 5мл LB бульона и культивировали в термостате при 37°С. Затем полученную культуру доводили до оптической плотности (OD) 0.1 при λ=625 нм, готовили соответствующие методу разведения и инокулировали в 96-луночные иммунологические планшеты, после чего культивировали при 37°С.
Определение антибиотикочувствительности . Антибиотикочувствительность штаммов оценивали по значению минимальной подавляющей концентрации (МПК), которую определяли методом двукратных серийных разведений (Методические указания МУК 4.2.1890-04) с использованием иммунологических планшетов.
Определение ферментативной активности. Активность орнитиндекарбоксилазы определяли по количеству образующегося конечного продукта путресцина в единицу времени. Для этого исходную культуру (OD625=0.1) в объёме 50 мкл вносили в 96-луночные иммунологические планшеты, содержащие в лунках по 150 мкл LB бульона и культивировали при 37°С 4 ч. Оптическую плотность (OD600) контролировали на мультимодальном планшетном ридере Infinite M200 (Tecan, Швейцария). Клетки осаждали центрифугированием планшетных культур в течение 15 мин. при 3700 об/мин и температуре 0 ° С на центифуге 5804 R (Eppendorf, Германия), после чего отмывали физиологическим раствором. Ресуспендированные клетки разрушали ультразвуком (20 кГц, 130 Вт, 2 раза по 20 сек.) на ультразвуковом дезинтеграторе (Cole
Parmer, США), обломки клеток осаждали центрифугированием (20 мин., 3700 об/мин). Надосадочную жидкость использовали для проведения ферментативной реакции. Инкубационная смесь включала 100 мМ буфера ТРИС HCl (рН 8.0), 0.04 мМ пиридоксальфосфата, 1 мМ дитиотрейтола, 10 мМ орнитина и 50 мкл супернатанта, в конечном объеме 0.2 мл. Реакцию запускали добавлением субстрата, смесь инкубировали в течение 60 мин. при 37 ° С, реакцию останавливали внесением 50 мкл хлорной кислоты.
Определение содержания путресцина проводили методом ВЭЖХ его дансилированного производного. Хроматографическая система включала хроматограф Shimadzu LC-20A (Shimadzu, Япония); колонку Luna С18(2) размером 250 мм × 4.6 мм, 5 мкм (Phenomenex, США), предколонку С18 Securityguard, 4 мм × 3 мм, 5 мкм (Phenomenex, США); флуоресцентный детектор RF-10A XL (Shimadzu, Япония). Длины волн экстинкции и эмиссии устанавливали на 400 и 516 нм, соответственно. В качестве мобильной фазы использовали смесь воды и ацетонитрила, которую подавали на колонку со скоростью 1 мл/мин в линейном градиенте концентрации ацетонитрила от 40 до 100% в течение 10 мин. с последующим уравновешиванием в течение 10 мин. 40%-ным ацетонитрилом.
Определение количества белка проводили методом Лоури.
Биоплёнкообразование. С целью определения способности E. coli к биоплёнкообразованию культуру выращивали на синтетической глюкозо-минеральной среде М-9. В экспериментах по изучению влияния полиаминов на биопленкообразование в качестве инокулята использовали клетки, предварительно истощенные по эндогенным полиаминам с помощью 3-кратных пересевов на среде М-9. Планктонные клетки после культивирования удаляли из планшетов вместе со средой и лунки дважды отмывали 200 мкл дистиллированной воды. Планшеты подсушивали в течение 20 мин., после чего в каждую лунку добавляли по 150 мкл 0.1% генциан-виолета и выдерживали в течение 30 мин. при комнатной температуре. Краситель удаляли и лунки 5кратно промывали (добавление в лунки 200 мкл дистиллированной воды, встряхивание в течение 5 сек.). С целью стандартизации обработки все процедуры по промыванию планшетов проводили автоматически, в микропланшетном ридере. Планшеты высушивали, краситель экстрагировали абсолютным этанолом, после чего измеряли оптическую плотность (OD570). Измерения проводили в 16-кратной повторности. Способность к биоплёнкообразова-нию подсчитывали с использованием следующего уравнения: Биоплёнкообразование = (A – B) / C, где А – OD570 в опытной лунке; В – OD570 в контроль- ной лунке; C – OD625 культуры клеток (Naves et al., 2008).
Статистическая обработка результатов исследования проведена с использованием пакета стандартных программ Statistica 6.0 (StatSoft, Inc., 2001). На рисунках приведены данные из серии однотипных экспериментов (не менее трех), представленные в виде медианы с указанием величины 25 и 75 процентилей. Оценка статистической значимости различий произведена с использованием непараметрического критерия Манна-Уитни. Различия считали значимыми при р ≤ 0.05.
Результаты и их обсуждение
В качестве объекта исследования использованы природные штаммы E. coli , изолированные на птицеводческих предприятиях Пермского края. Выбор источника штаммов обусловлен широким использованием антибиотиков, в том числе фтор-хинолового ряда, для лечения и профилактики бактериальных инфекций на предприятиях промышленного птицеводства (Кузнецова и др., 2010). Систематическое использование летальных, сублетальных и суббактериостатических концентраций антибактериальных препаратов является селективным фактором для отбора среди естественной комменсальной микрофлоры птиц антибиотикорезистентных форм микроорганизмов с разным уровнем устойчивости.
По величине минимальной подавляющей концентрации (МПК) левофлоксацина (ЛФЦ) 74 штамма E. сoli были разделены на 3 группы: 1 – менее 2 мкг/мл; 2 – в диапазоне от 2 до 8 мкг/мл; 3 – более 8 мкг/мл. Это распределение соответствует группам чувствительных, переходных и устойчивых штаммов по классификации, применяемой в клинической практике (Методические указания …, 2004).
Предварительный анализ 216 природных штаммов Е. coli , выделенных из различных источников, показал, что минимальная подавляющая концентрация левофлоксацина для большинства штаммов, не обладающих резистентностью к фторхинолоновым антибиотикам, составляет 0.038 мкг/мл. Группа из 45 штаммов, имеющих это значение МПК, использована в настоящей работе в качестве контрольной.
Анализ экспериментальных данных показал, что штаммы с высоким уровнем антибиотикорези-стентности к левофлоксацину обладают повышенной способностью к биоплёнкообразованию (рис. 1). Это согласуется с данными о более высокой устойчивости клеток в составе биоплёнок к действию антибиотиков (Naves et al., 2008). Биоплёнкообразо-вание, наряду с другими неспецифическими механизмами, такими как ограничение транспорта антибиотиков в клетку, их активный выброс, общая стрессорная адаптация, может участвовать в фор- мировании устойчивости к действию антибактериального препарата. Однако антибиотикорезистент-ность высокого уровня, как правило, обеспечивается действием высокоэффективных специфических механизмов устойчивости, таких как модификация мишени действия и ферментативная инактивация антибиотика.
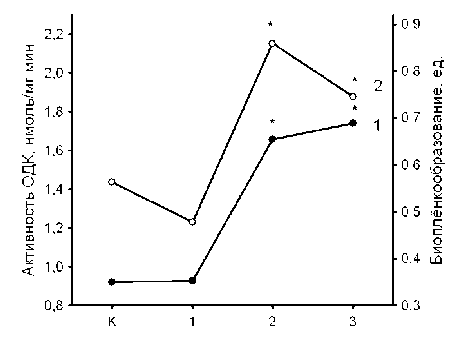
Рис. 1 . Зависимость интенсивности био-плёнкообразования и активности орнитиндекарбоксилазы E. coli от степени устойчивости к левофлоксацину:
К – контрольная группа; 1, 2, 3 – группы чувствительных, переходных и устойчивых к ЛФЦ штаммов, соответственно
В связи с этим представляло интерес изучение зависимости между интенсивностью биоплёнкооб-разования и уровнем устойчивости природных штаммов в условиях сублетального воздействия антибиотиков. С этой целью культуры штаммов E. сoli , относящиеся к разным группам по степени устойчивости к фторхинолонам, подвергали действию сублетальных концентраций левофлоксацина, оказывающих приблизительно 50%-ный ингибирующий эффект на уровень плотности культуры к 4-му часу культивирования по сравнению с контролем. Значения сублетальных концентраций (отдельно для каждого штамма) предварительно подбирали экспериментально. Добавка в среду антибиотика оказывала существенный стимулирующий эффект на интенсивность биоплёнкообразования как среди штаммов с низкой устойчивостью, так и у штаммов, имеющих высокий уровень устойчивости к левофлоксацину (рис. 2).
Известно, что ключевым ферментом синтеза полиаминов в клетках E. coli является орнитиндекарбоксилаза (ОДК), продукт которой, путресцин, является предшественником спермидина (Tabor, Tabor, 1985). Исследования базовой (неиндуциро-ванной антибиотиками) активности ОДК показали, что природные штаммы с высокой резистентностью к действию фторхинолонов обладают повышенной активностью этого фермента (рис. 1). Данная зависимость почти полностью повторяла описанную выше для биопленкообразования (рис. 1). Эти ре- зультаты свидетельствуют о том, что повышенная активность ОДК и высокая способность к биоплён-кообразованию являются признаками, свойственными фенотипу большинства устойчивых природных штаммов, прошедших отбор в условиях действия фторхинолонов. В то же время, сходный профиль кривых, описывающих эти зависимости, указывает на возможность существования взаимосвязи содержания полиаминов в клетках и их способности формировать биопленки.
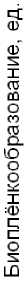
Рис. 2. Влияние сублетальной концентрации антибиотика на интенсивность биоплёнкооб-разования природных штаммов E. coli , обладающих разной степенью устойчивости к левофлоксацину.
Столбцами обозначены группы чувствительности к ЛФЦ: серые столбцы – чувствительная; заштрихованные – переходная, светлые - устойчивая.
1 – культура без добавки антибиотика; 2 – культура с добавкой сублетальной концентрации ЛФЦ.
* - статистически значимое отличие от контроля
Многолетние исследования функций полиаминов свидетельствуют о том, что эти соединения принимают участие в широком спектре адаптивных реакций бактериальной клетки (Ткаченко, Шумков, 2004; Ткаченко, Пожидаева, Шумков, 2006; Rhee, Kim, Lee, 2007), в том числе формируемых в ответ на действие антибиотиков (Ткаченко, Шумков, Ахова, 2009). Поскольку одним из механизмов, определяющих роль полиаминов в приспособлении бактерий к неблагоприятным условиям среды, является регуляция экспрессии адаптивных генов, мы предположили возможность участия этих соединений в регуляции генов биоплёнкообразования.
Результаты экспериментов с добавлением полиаминов в среду культивирования показали, что в контрольной культуре, выращенной в отсутствие антибиотика, экзогенные добавки 1 мМ путресцина и спермидина не проявляли заметного действия в разных группах чувствительности к антибиотику (рис. 3). Высокие концентрации полиаминов (10 мМ) оказывали умеренный эффект, в 1.5–2.5 раза повышая способность E. coli образовывать биоплёнки. В то же время на фоне добавки сублетальной концентрации антибиотика полиамины вызывали 2–3.5-кратную стимуляцию биоплёнкообразо-вания, причем выраженный эффект в данном случае имел место уже в ответ на добавку 1мМ путресцина и спермидина к среде культивирования (рис. 3).
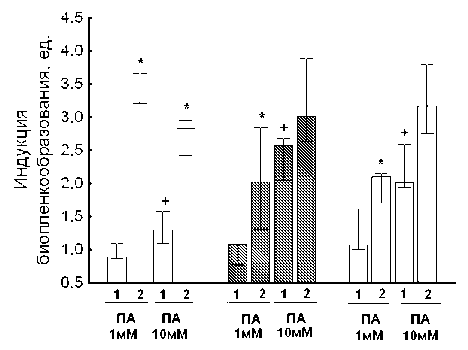
Рис. 2. Влияние полиаминов на биоплёнко-образование в отсутствие (1) и в присутствии (2) антибиотика.
Столбцами обозначены группы чувствительности к ЛФЦ: серые столбцы – чувствительная; заштрихованные – переходная, светлые - устойчивая. Сублетальные концентрации антибиотика и смесь полиаминов (ПА) путресцина и спермидина в концентрации 1 мМ и 10 мМ вносили в среду культивирования изначально.
Уровень индукции – отношение биоплёнкообразо-вания в культуре с добавкой полиаминов к контролю без полиаминов. В экспериментах с добавкой антибиотика в качестве контроля использовали культуру с добавкой левофлоксацина в отсутствие полиаминов.
* - статистически значимое отличие от контроля;
+ - статистически значимое отличие от культуры без добавки полиаминов, принятой за единицу
Исследованиями, проведенными на Y. pestis, показано, что полиамины принимают участие в регуляции синтеза белков, участвующих в первой стадии биоплёнкообразования – взаимодействии с твёрдой поверхностью (Patel et al., 2006; Wortham et al., 2010). Исходя из этого, можно предположить, что наблюдаемый нами положительный эффект путресцина и спермидина на биоплёнкообразование природных штаммов E. coli может быть обусловлен их способностью воздействовать на адгезию бактериальной клетки. Наряду с этим эффект полиаминов на биоплёнкообразование может быть опосредован через регуляцию полиаминами уровня экспрессии гена rpoS (Ткаченко, Шумков, Ахова, 2009). Под контролем продукта этого гена, σS-субъединицы РНК-полимеразы, находится по меньшей мере 14 из 17 генов, экспрессия которых возрастает в клетках E. coli во время биоплёнкооб-разования (Landin, 2009). На основании этого ка- жется обоснованным предположение, что полиамины, оказывая стимулирующее влияние на экспрессию гена rpoS (Ткаченко, Шумков, 2004; Ткаченко, Шумков, Ахова, 2009), могут оказать положительный эффект на интенсивность образования биопленок. Исходя из этого, складывается впечатление о том, что полиамины способны потенциировать индуцирующий эффект антибиотиков на биопленко-образование (рис. 3), посредством усиления экспрессии генов, участвующих в этом процессе.
Роль полиаминов в регуляции биоплёнкообразования в зависимости от присутствия левофлоксацина в среде
|
Добавка полиаминов |
Чувствительные |
Переходные |
Устойчивые |
|
1 мМ |
3.62 |
1.88 |
1.97 |
|
10 мМ |
2.18 |
1.17 |
1.58 |
Приведены значения отношения уровня индукции биоплёнкообразования полиаминами в присутствии левофлоксацина к индукции в отсутствие антибиотика.
Положительный эффект полиаминов на уровень индукции биоплёнкообразования был более выраженным в присутствии левофлоксацина у штаммов с низким уровнем устойчивости и существенно ослабевал в группе с высоким значением анртибио-тикоустойчивости (таблица). Эти различия могут быть обусловлены более существенной значимостью неспецифических механизмов адаптации, к которым относится синтез полиаминов, на начальных этапах отбора антибиотикоустойчивых вариантов. Данный признак может, по-видимому, сохраняться также в процессе селекции высокоустойчивых штаммов. С другой стороны, разница в эффекте экзогенных полиаминов на биоплёнкообразование может быть следствием повышенного содержания эндогенных путресцина и спермидина как результата высокой активности ферментов полиаминсинте-зирующей системы у высокоустойчивых штаммов, по сравнению с низкоустойчивыми (см. рис. 1).
Заключение
Результаты проведенных исследований свидетельствуют о том, что развитие антибиотикорези-стентности природных штаммов E. coli к фторхинолоновым антибиотикам сопровождается отбором признаков высокой активности системы синтеза полиаминов, связанной с повышенной способностью к биоплёнкообразованию. Фторхинолон левофлоксацин стимулирует биоплёнкообразование у штаммов как с низким, так и с высоким уровнем устойчивости к антибиотику. Полиамины оказывают положительное влияние на способность к био-плёнкообразованию у штаммов с различным уровнем устойчивости, которое существенно усиливается на фоне действия антибиотика и более выражено в группе чувствительных штаммов.
Таким образом, полиамины принимают участие в регуляции биоплёнкообразования – одного из об- щих механизмов адаптации, который участвует в развитии резистентности природных штаммов E. coli к фторхинолоновым антибиотикам как на начальных, так и на последующих этапах развития устойчивости. Полученные данные подтверждают предположение о том, что высокий уровень устойчивости E. coli к антибиотикам является результатом комбинации специфических и неспецифических механизмов резистентности.
Работа выполнена по программе Президиума РАН «Молекулярная и клеточная биология» (проект № 0120096390) и поддержана грантом РФФИ № 11-04-96001-р_урал_а.
Список литературы Полиамины как регуляторы биоплёнкообразования природных изолятов Escherichia coli с разной степенью устойчивости к фторхинолонам
- Ахова А.В., Ткаченко А.Г. Лизиндекарбоксилазная активность как фактор резистентности Escherichia coli к фторхинолонам//Микробиология. 2009. Т. 7, № 5. С. 636-640
- Кузнецова М.В. и др. Видовое разнообразие и антибиотикочувствительность грамотрицательных бактерий, изолированных в птицеводческом хозяйстве//Вестн. НГУ. 2010. Т. 8, вып. 3. С. 70-77.
- Методические указания МУК 4.2.1890-04. Определение чувствительности микроорганизмов к бактериальным препаратам//Клин. микробиол. антимикроб. химиотер. 2004. Т. 6. С. 306-359.
- Ткаченко А.Г., Нестерова Л.Ю. Полиамины как модуляторы экспрессии генов окислительного стресса у Escherichia coli//Биохимия. 2003. Т. 68. С. 1040-1048
- Ткаченко А.Г., Шумков М.С. Роль путресцина в регуляции уровня сигма S субъединицы РНК-полимеразы в клетках Escherichia coli при переходе к стационарной фазе//Биохимия. 2004. Т. 69, вып. 8. С. 1079-1087.
- Ткаченко А.Г., Пожидаева О.Н., Шумков М.С. Роль полиаминов в формировании множественной антибиотикоустойчивости Escherichia coli в условиях стрессорных воздействий//Биохимия. 2006. Т. 71, вып. 9. С. 1287-1296.
- Ткаченко А.Г., Шумков М.С., Ахова А.В. Адаптивные функции полиаминов Escherichia coli при сублетальных воздействиях антибиотиков//Микробиология. 2009. Т. 78, вып. 1. C. 32-41.
- Beloin C., Roux A., Ghigo J.M. Escherichia coli biofilms//Current topics in microbiology and immunology. 2008. Vol. 322. P. 249-289.
- Davey M.E., O'Toole G.A. Microbial Biofilms from Ecology to Molecular Genetics//Microbiol. Mol. Biol. Rev. 2000. Vol. 64, № 4. P. 847-867.
- Ghannoum M.А., O'Toole G.A. Microbial biofilms. Washington DC.: ASM Press, 2004. P. 426.
- Igarashi K., Kashiwagi K. Polyamines: mysterious modulators of cellular functions//Biochem. Biophis. Res. Commun. 2000. Vol. 271. P. 559-564.
- Landini P. Cross-talk mechanisms in biofilm formation, and responses to environmental and physiological stressin Escherichia coli//Research in Microbiology. 2009. Vol. 160. P. 259-266.
- Naves P. et al. Correlation between virulence factors and in vitro biofilm formation by Escherichia coli strains//Microbiоl. Pathogenesis. 2008. Vol. 45. P. 86-91.
- Patel C.N. et al. Polyamines are essential for the formation of plague biofilm//J. of bacterial.. 2006. Vol. 188, № 7. P. 2355-2363.
- Pratt L.A., Kolter R. Genetic analyses of bacterial biofilm formation//Curr. Opin. Microbiol. 1999. Vol. 2. P. 598-603.
- Rhee H.J., Kim E.J., Lee J.K. Physiological polyamines: simple primordial stress molecules//J. Cell Mol. Med. 2007. Vol. 11, № 4. P. 685-703.
- Tabor C.W., Tabor H. Polyamines in microorganisms//Microbiol. Rev. 1985. Vol. 49. P. 81-99.
- Tkachenko А., Nesterova L., Pshenichnov M. The role of the natural polyamine putrescine in defense against oxidative stress in Escherichia coli//Arch. Microbiol. 2001. Vol. 176. P. 155-157.
- Worthman B.W. et al. Polyamines are required for the expression of key Hms proteins important for Yersinia pestis biofilms formation//Environmental Microbiology. 2010. Vol. 12, № 7. P. 2034-2047.


