Полиамины повышают толерантность Escherichia coli к нетилмицину
Автор: Кашеварова Н.М., Ткаченко А.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Изучено влияние полиаминов на толерантность E. coli к аминогликозидному антибиотику нетил-мицину. В периодических культурах полиаминпрофицитных штаммов E. coli по мере увеличения плотности культуры и перехода ее в стационарную фазу наблюдалось увеличение числа перси-стерных клеток, толерантных к нетилмицину. На полиаминдефицитном мутанте показано, что в контрольной культуре на протяжении всего периода культивирования число персисторов варьировало в пределах одного порядка. Однако добавка в среду полиаминов вызывала концентрационно-зависимое возрастание числа толерантных клеток при переходе в стационарную фазу роста. Эффективность действия полиаминов на частоту персистообразования снижалась в ряду: спермидин - путресцин - кадаверин. Установлена пороговая концентрация нетилмицина, приводящая к полной гибели всех клеток, в то время как при более низких концентрациях антибиотика наблюдалась двухфазная модель отмирания, при которой после 5-часовой обработки погибали все чувствительные клетки, и оставалась фракция толерантных клеток. Одновременная добавка путресцина в зависимости от концентрации аминогликозида либо полностью снимала отрицательное действие антибиотика, либо приводила к снижению числа жизнеспособных клеток на 1-1.5 порядка. Эффективность действия путресцина на выживаемость клеток зависит от времени его внесения в культуру с момента добавки антибиотика.
Нетилмицин, полиамины, толерантные клетки, персистообразование, полиаминзависимый мутант
Короткий адрес: https://sciup.org/147204791
IDR: 147204791 | УДК: 579.22
Текст научной статьи Полиамины повышают толерантность Escherichia coli к нетилмицину
Поиск и синтез новых антибактериальных препаратов неизбежно сопровождается совершенствованием адаптивных механизмов микроорганизмов С целью выживания в условиях действия новых стрессовых факторов. Эго приводит к тому, что ус тойчивость бактерий к антибиотикам продолжает расти и является серьезной угрозой здоровью человечества, В связи с этим понимание механизмов бактериальной устойчивости к действию антибиотиков является необходимым условием для даль не Кашеварова Н. М., Ткаченко А. Г., 2016
нейшей разработки новых, более эффективных способов борьбы с патогенными бактериями.
Нетилмицин - полу синтетический антибиотик широкого спектра действия, ОТНОСЯЩИЙСЯ К Группе аминогликозидов - бактерицидных антибиотиковк мишенью которых является 30S-субъединица бактериальной рибосомы. Антибактериальное действие аминогликозидов обусловлено тем. что они: 1) ингибируют белковый синтез; 2) приводят к синтезу нефункциональных белков, нарушая правильность считывания генетического кода и повышая количество ошибок при трансляции; 3) в больших концентрациях снижают барьерные функции клеточных мембран [Jana, Deb, 20061; 4) вызывают окислительный стресс в результате стимуляции образования гидроксильных радикалов [Kohanski et al. ,2007].
В формировании резистентности к аминогликозидам выделяют следующие механизмы: 1) ферментативная инактивация аминогликозидов путем присоединения к молекуле антибиотика остатка уксусной кислоты, фосфорной кислоты или аденина, что приводит к потере его способности связываться с рибосомами и подавлять биосинтез белка; 2) снижение их концентрации внутри клетки в результате изменения проницаемости наружной мембраны, сниженного транспорта через внутреннюю мембрану; активного выброса из клетки; 3) модификации мишени антибиотика - мутационные (16S рРНК и рибосомальных белков) или химическая (в результате метилирования сайта связывания антибиотика (молекулы 16S рРНК) в специфических позициях с использованием ферментов метила з и метилтрансфераз) [Jana, Deb, 2006; Shaki! et aL 2008].
Помимо вышеперечисленных механизмов ан-тнбиогикорезисгентносги, которые функционируют. когда клетки находятся в активном состоянии, существует альтернативная стратегия выживания. При ее реализации бактерии избегают легального действия антибиотиков, находясь в состоянии, которое характеризуется замедлением скорости роста и метаболических функций [Gcfcn, Balaban. 2009; Dorr. Vulic, Lewis, 2010]. Лишь относительно небольшая часть клеток популяции способна «персистировать» (выживать) в условиях пролонгированного действия летальных концентраций антибиотика благодаря тому, что мишень антибиотика находится В неактивном СОСТОЯНИИ, недоступном ДЛЯ его повреждающего воздействия. Такие медленно растущие или нерастущие (дормантные) клетки -персисторы - генетически идентичны остальной чувствительной к антибиотикам части популяции, но проявляют фенотипическую толерантность к антибиотикам [Lewis, 2010]. Количество персисто-ров в популяции определяется фазой роста периодической культуры.
В настоящее время в литературе имеется много данных о вовлеченности полиаминов (путресцина, кадаверина, спермидина) в разнообразные клеточные процессы. Эти биогенные полпкатионы участвуют в формировании адаптации бактериальных клеток к различным стрессовым факторам посредством регуляции транспортных процессов, улавливания свободных радикалов. компактизации ДНК, регуляции экспрессии глобальных транскрипционных регуляторов и адаптивных генов [Tabor, Tabor. 1985; Igarashi, Kashiwagi, 2006]. Целью данной работы является исследование роли полиаминов в повышении толерантности бактерий £s- chenchia cob к аминогликозиду нетилмицину,
Материалы и методы исследования
Использованные в работе штаммы Е. со И приведены в таблице.
Бактериальные штаммы» использованные в работе
|
Штаммы Е. cob |
Генотип |
Источник или ссылка |
|
BW25141 |
F-, d(araD-ar^B)567, AlacZ4787(: :rmB-3)t A(phoB-phoR)58 Я\ galU95t zhMdA3::pir\ recAL endA9(del-ins): :FRT, rph-L A(rhaD-rhcB)568y bdR5I4 |
Datsenko. Wanner, 2000 |
|
МС4100 |
F-,c7raD139, ^4argF-lac\ U169, deoCl^ rpsIASVb reLil РЬВЗЗОЬ ptsF25s rbsR |
Coli Genetic Stock Center (CGSC) |
|
SHT03 |
F-, thr-b сгаС14^ ЛяреОУВ, A(gpt-prnA)62, tacY /,gMA^^AS), #сЖ2(Ос), Я', A(speB-speA)97> A(speC-glcB)63: rpsL25(stiR\ xylAS^ mtl-L thiEb omK^p-L cadA2, lacZ- ШЕЗ XRZ5rpoS742::tacZfhvbr |
Лабораторный музей |
|
SHT03pSOPR |
Как SHT03, но трансформирован плазмидой SOPR |
Лабораторный музей |
Штаммы Е. cob культивировали на минеральной среде М-9, содержащей 0.4% глюкозы, в колбах объемом 250 мл в термостатируемом шейкере (37°С. 120 об/мин) или в 96-лу ночных иммунологических планшетах (Медполимер, Россия) в мультимодальном планшетном ридере «Тесан» (Швейцария). При работе с полиаминзависимыми штаммами Е. cob SHT03 и SHT03pSOPR к среде М-9 добавляли 1 мкг/мл тиамина, 100 мкг/мл пролина и 1 мкг/мл пантотената (Sigma, Germany). Нетил-мицин (Верофарм, Россия) и полиамины путресцин, спермидин и кадаверин (Sigma, Switzerland) вносили в культуры в экспоненциальной фазе роста в концентрациях, указанных в подписях к рисункам.
В экспериментах по изучению влияния путресцина на выживаемость клеток Е. coli BW25141 при обработке сублетальными концентрациями (СЛК)
антибиотика ночную культуру разводили в среде М-9 до ODy)o=0405. разливали в лунки планшета по 200 мкл и культивировали в мультимодальном планшетном ридерс «Тссап» е периодическим встряхиванием. При 006(Ю=0.08-0.09 вносили СЛК нетилмицина (0.8: 1.0; 1.4 мкг/мл). За 10 мин. до добавки антибиотика и спустя 20. 40 и 60 мин. в соответствующие лунки вносили 5 мМ путресцина. После 3 ч. воздействия антибиотика пробы разводили в растворе NaCl (0.9%) и делали высев на чашки с LB-агаром, Через 24 ч. подсчитывали выросшие колонии (КОЕ).
С целью изучения динамики персистообразова-ния ночные культуры полиаминпрофицитных штаммов Е> coli BW25141 и МС4100 разводили в свежей среде М-9 до OD^f 0.1. Пробы отбирали каждые 2 ч. в течение первых 8 ч.. а далее с 24-часовыми интервалами для определения общего числа культивируемых клеток и персисторов, толерантных к 2.8 мкг/мл нетилмицина. Определение числа персисторных клеток осуществляли на основе протокола, представленного в статье [Keren et al., 2004]. Для этого пробы разводили в соотношении 1:1 в свежей среде М-9, содержащей антибиотик (2 к). После 3-часовой обработки со встряхиванием пробы отмывали от антибиотика, делали разведения б физиологическом растворе и высевали по 10 цл на чашки с LB-агаром. Через 24 ч. культивирования производили подсчет выросших клонов персисторных клеток. Частоту персистооб-разования определяли как отношение числа персисторов к общей численности культивируемых клеток на момент отбора образцов. Культуру полкам индефицитного мутанта Е coli SHT03. предварительно истощенного на среде М-9, разводили в свежей среде М-9 и культивировали ночь (15-17 ч.) до экспоненциальной фазы роста. При ОПб1Ю= 0.5 вносили разные концентрации полиаминов и далее отбирали пробы каждые 2 ч., затем через 24 и 48 ч. с момента добавки полиаминов для определения общего числа культивируемых клеток и частоты персистообразования.
В серии экспериментов изучали влияние путресцина на выживаемость клеток полна минза ви-енмого штамма Е. coli SHTOSpSOPR, обработанных в течение 5, 24 и 48 ч. возрастающими концентрациями нетилмицина в диапазоне от субингибиторных до летальных (0.01; 0.1; 0.4; 1.0 мкг/мл), которые вносились в культуру в логарифмической фазе роста. С целью оценить содержание псрсисторов в культуре в момент добавки антибиотика и после 5-. 24- и 48-часовой обработки НИЗКИМИ концентрациями аминогликозида клетки далее подвергали дополнительному’ 3-часовому’ воздействию более высокой концентрации антибиотика (2.8 мкг/мл). Культуру полиаминдефицит-ного штамма Е. cob SHTOSpSOPR, предварительно истощенного на минеральной среде М-9, разводили в соотношении 1:250 в свежей среде М-9 и разливали по 200 мкл в лунки планшета, далее куль тивировали ночь в мультимодальном планшетном ридерс «Тесан» с периодическим встряхиванием. 5 мМ путресцина и нетилмицин (0.01—1.0 мкг/мл) вносили при достижении экспоненциальной фазы роста (ODtioi^O.06-0.07). В образцах культуры, отобранных в момент внесения нетилмицина и спустя 5, 24 и 48 ч. действия антибиотика, определяли содержание клеток, выживших после обработки НИЗКИМИ концентрациями аминогликозида (жизнеспособных клеток), и персисторов, толерантных к 2.8 мкг/мл нетилмицина.
Статистическую обработку результатов проводили с использованием пакета стандартных программ Statistica 6.0 («StatSoft Inc.», 2001).
Результаты и их обсуждение
В экспериментах со штаммом Е. colt BW25I41 в экспоненциальную культуру вносили сублетальные концентрации нетилмицина. а также 5 мМ путресцина в разное время с момента добавки антибиотика. Результаты проведенных нами исследований показали, что эффективность положительного действия путресцина на выживаемость клеток зависела от времени его внесения в культуру относительно добавки антибиотика (рис. 1) Внесение путресцина, предшествующее добавке антибиотика, наиболее эффективно снимало бактерицидный эффект. Однако положительное действие полиамина ослабевало пропорционально удлинению временного интервала его внесения после
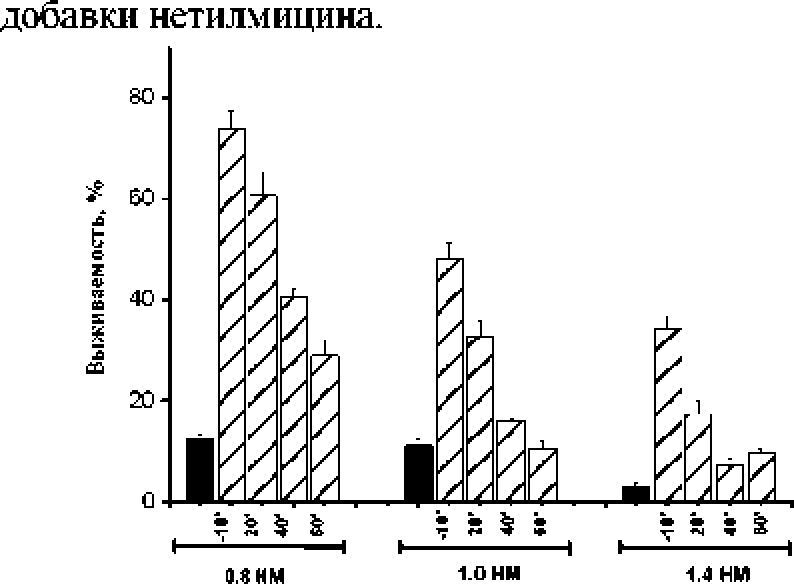
Рис. L Влияние путресцина на выживаемость Е. coli BW25141 в зависимости от времени его внесения в культуру и концентрации нетилмицина.
Нетилмицин (НМ) вносили в сублегальных концентрациях (0.8; 1.0; 1.4 мкг/мл). Добавку 5 мМ путресцина делали за 10 мин. до, через 20, 40 и 60 мин. после внесения нетилмицина Черные столбцы - культуры без добавки путресцина, заштриховатшые - культуры с добавкой путресцина
Изучение динамики численности бактерий, толерантных к 2.8 мкг/мл нетилмицина. в периодических культурах полиаминпрофицитных штаммов E.coh MC4I00 и BW2514I, растущих на синтети- ческой среде М-9, выявило их низкое содержание в экспоненциальной фазе роста и дальнейшее возрастание их числа (на 4-5 порядков) по мере уве личения плотности культуры и перехода ее в стационарную фазу (рис. 2), Следует отметить штам-моспецифичность динамики персистообразования изученных полиаминпрофицитных штаммов.
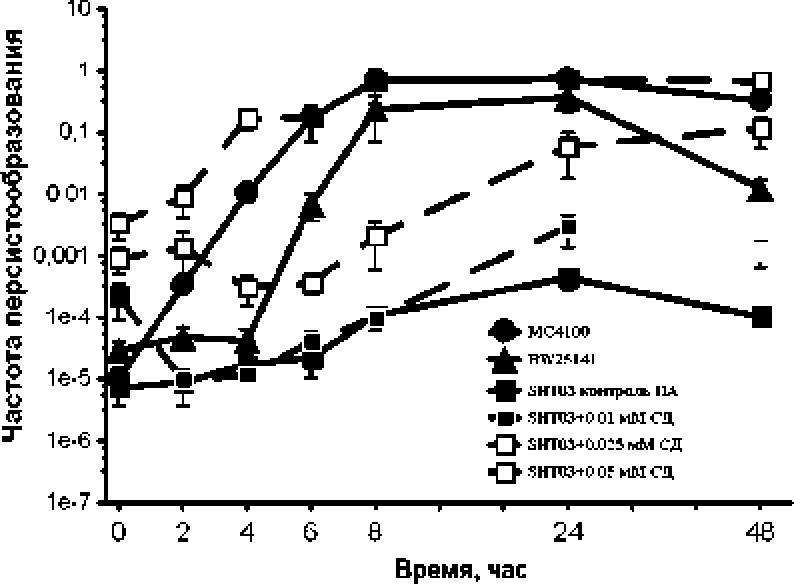
Рис. 2, Динамика персистообразования в периодических культурах разных штаммов Е. соН на минеральной среде М-9.
Полна минпрофицитные штаммы Е. colt МС4100 и BW25141 культивировали без добавки полиаминов. 11олиаминзависимый мутант SH ГОЗ -контроль без полиаминов (ПА ) (сплошная линия) и с добавлением разных концентраций спермидина (0.01; 0,025; 0,05 мМ СД) (пунктирные линии)
Б то же время в контрольной культуре поли-аминдефицитного мутанта Е.соН SHTO3, не содержащей полиаминов, на протяжении всего периода культивирования число толерантных бактерий варьировало в пределах одного порядка. Однако добавка в средуг культивирования разных концентраций спермидина (0.01; 0,025; 0.05: ОД мМ) вызывала концентрационно-зависимое возрастание числа толерантных клеток при переходе в стационарную фазу роста (рис. 2). При этом при концентрациях 0,05 и 0.1 мМ отмечался уже одинаковый эффект (рис, 3), Таким образом, максимальный эффект спермидина, который повышал частоту7 персисторных клеток полиаминзависимого штамма ДО уровня полиаминпрофицитных ШТамМОВк проявлялся при концентрации 0,05 мМ.
Ранее нами было показано, что добавка путресцина в концентрациях 0.1: 1,0; 5.0 мМ в экспоненциальную культуру полиаминзависимого штамма на среде М-9 приводила к концентрационнозависимому' возрастанию числа клеток, толерантных к 2,8 мкг/мл нетилмицина, при переходе культуры в стационарную фазу роста [Tkachenko et aL 2014], Путресцин в концентрациях 1,0 и 5.0 мМ проявлял одинаковый по силе эффект на динамику частоты персистенции в культуре E.coli SHT03h которая соответствовала этому показателю в поли-аминпрофицитном штамме МС4100, Следователь но, эффективность действия путресцина на частоту персистенции примерно в 20 раз ниже таковой спермидина, Также нами были проведены исследования по влиянию кадаверина на частоту' персистообразования, однако его эффект был значительно ниже такового для спермидина и путресцина и проявлялся только в стационарной фазе. Таким образом, эффективность действия полиаминов на частоту персистенции снижалась в ряду7: спермидин —* путресцин —* кадаверин (рис. 3).
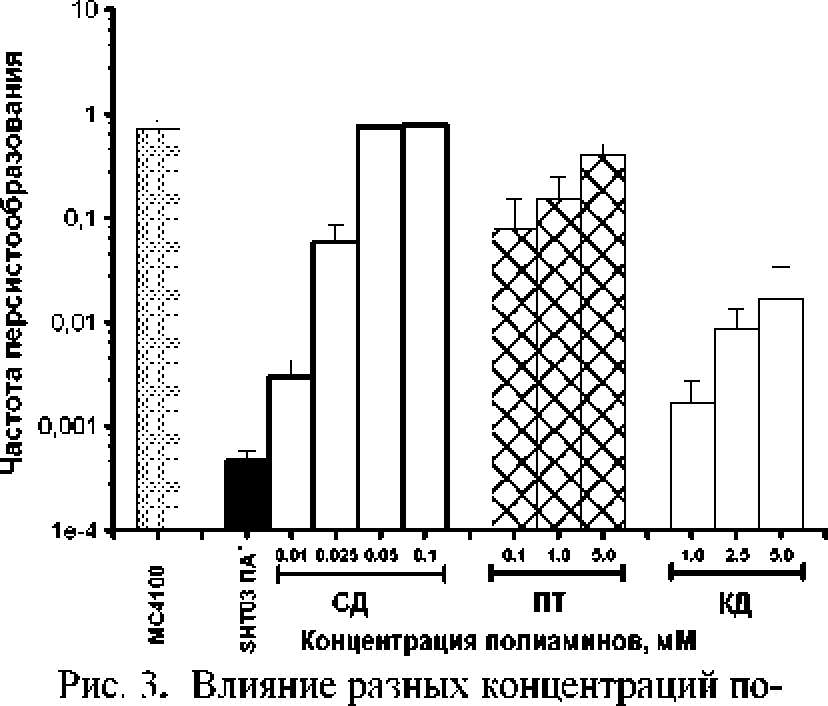
лиаминов на частоту7 персистообразования в культу ре полиаминдефицитного штамма Е.
coli SHT03 на синтетической среде М-9 спустя 24 ч, после внесения пол нам инов,
Черный столбец - контрольная культура SHT03 без полиаминов (ПА); светлые столбцы - с добавкой спермидина СД (0.01; 0.025; 0.05:0.1 мМ); заштрихованные - путресцина ПТ (0. к кО; 5,0 мМ); серые - кадаверина КД (1.0; 2,5; 5,0 мМ). Для сравнения приведена частота персистенции в стационарной (24-часовой) культуре полиами! [профицитного штамма МС4100 (без добавки псыиа\гинов)
Эксперименты с полиаминзависимым штаммом Е* со И SHT03pSOPR, в экспоненциальную культуру которого вносились возрастающие концентрации нетилмицина в диапазоне от субингибиторных до летальных (0.01; 0.1; 0.4; 1.0 мкг/мл), показали концентрационно-зависимое отмирание чувствительных клеток (рис. 4А). При субингибиторной концентрации нетилмицина (0.01 мкг/мл) количество культивируемых клеток не отличалось от их числа в контрольной культуре. При сублетальных концентрациях (0.1 и 0.4 мкг/мл) наблюдалась двухфазная модель отмирания, характерная для получения персисторных клеток [Lewis, 2007]: после 5-часовой обработки антибиотиком наблюдалась гибель основной массы (0.1 мкг/мл) или всех (0,4 мкг/мл) чувствительных клеток. Оставшиеся фракции толерантных клеток показали дальнейший незначительный рост к 48 ч, действия нетилм ицина, Концентрация ам иногликозида 1,0 мкг/мл оказалась летальной, при которой постепенное отмирание привело к полной гибели всех клеток б результате 4 8-часового воздействия антибиотика.
Добавка 5 мМ путресцина в экспоненциальную культуру пород внесением аминогликозида ПОЛНОСТЬЮ снимала отрицательное действие антибиотика на выживаемость клеток при субингибиторной и суб летальных концентрациях. Летальная концентрация (1.0 мкг/мл). при которой в ПТ"-культуре после 48-часового воздействия антибиотика живые клетки отсутствовали, в присутствии путресцина давала снижение числа КОЕ относительно контроля на 1-1.5 порядка (рис. 4Б).
Высокую выживаемость бактериальных клеток при одновременном внесении путресцина с антибиотиком можно объяснить рядом причин. Одна из них - способность полиаминов повышать антибио-тикорезистентность штамма, о чем судят по изменению минимальной ингибиторной концентрации [Tkachenko et al., 2012]. Защитный эффект полиаминов на уровне мишени антибиотика проявляет ся за счет конкурентного связывания полиаминов с рибосомами. поскольку' как полиамины. так и аминогликозиды имеют поликатионную природу. К тому же. поликатионная структура полиаминов позволяет ИМ функционировать в качестве ловушек активных форм кислорода. Ингибирование белкового синтеза аминогликозидами сопровождается развитием окислительного стресса в результате повышения продукции гидроксильных радикалов, что усиливает бактерицидный эффект антибиотика [Kohanski et al. 2007]. Было показано, что в условиях повреждающего действия аминогликозидов по л намины проявляют антиоксидантные и ДНК-протекторные свойства, выступая в качестве ловушек свободных радикалов и благодаря способности полиаминов связываться с ДНК и компакгизи-ровать ее структуру [Tkachenko et al., 2012]. Эти свойства полиамннов обусловливают повышение выживаемости клеток при действии аминогликозидов.
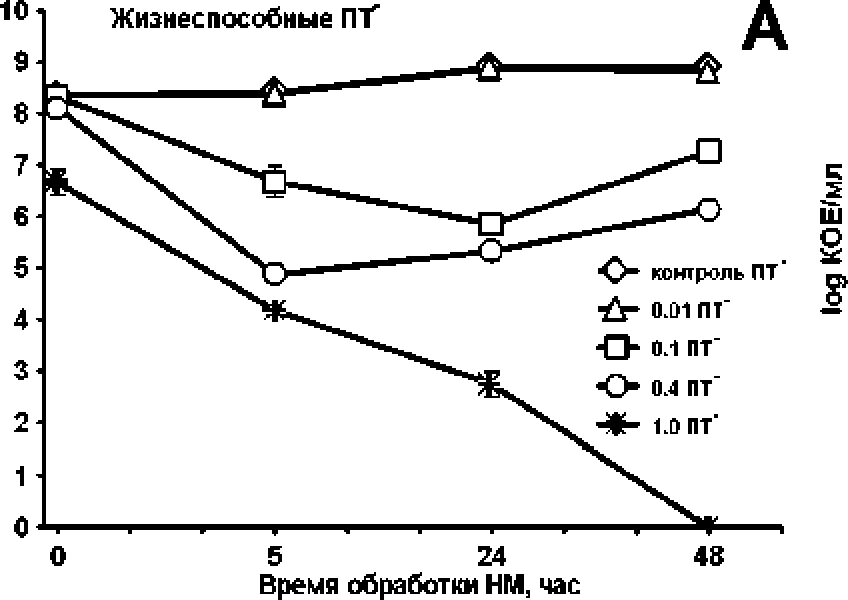
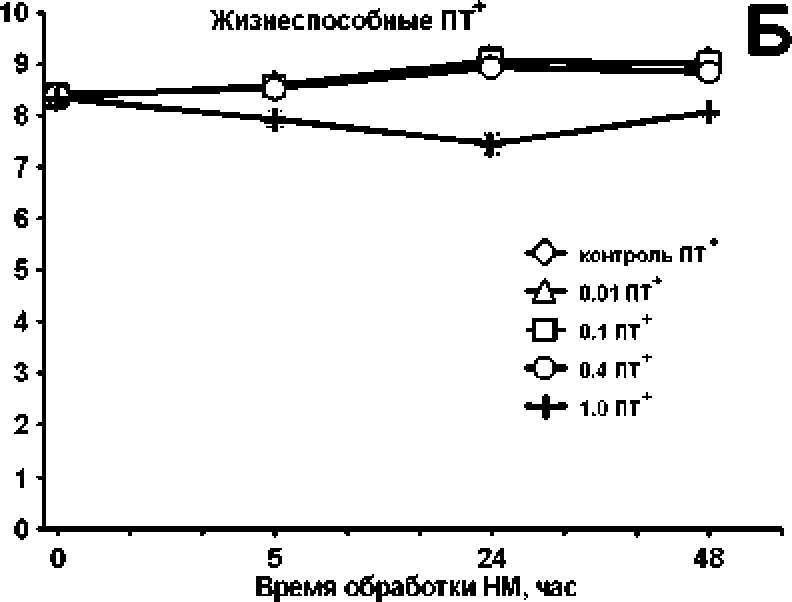
Рис. 4. Кривые отмирания/роста клеток, обработанных возрастающими концентрациями нетилмицина (НМ) (0.01; 0.1; 0.4; 1.0 мкг/мл), в культуре полиаминдефицитного штамма Е. colt SHT03pSOPR без добавки (А) и в присутствии 5 мМ путресцина (Б)
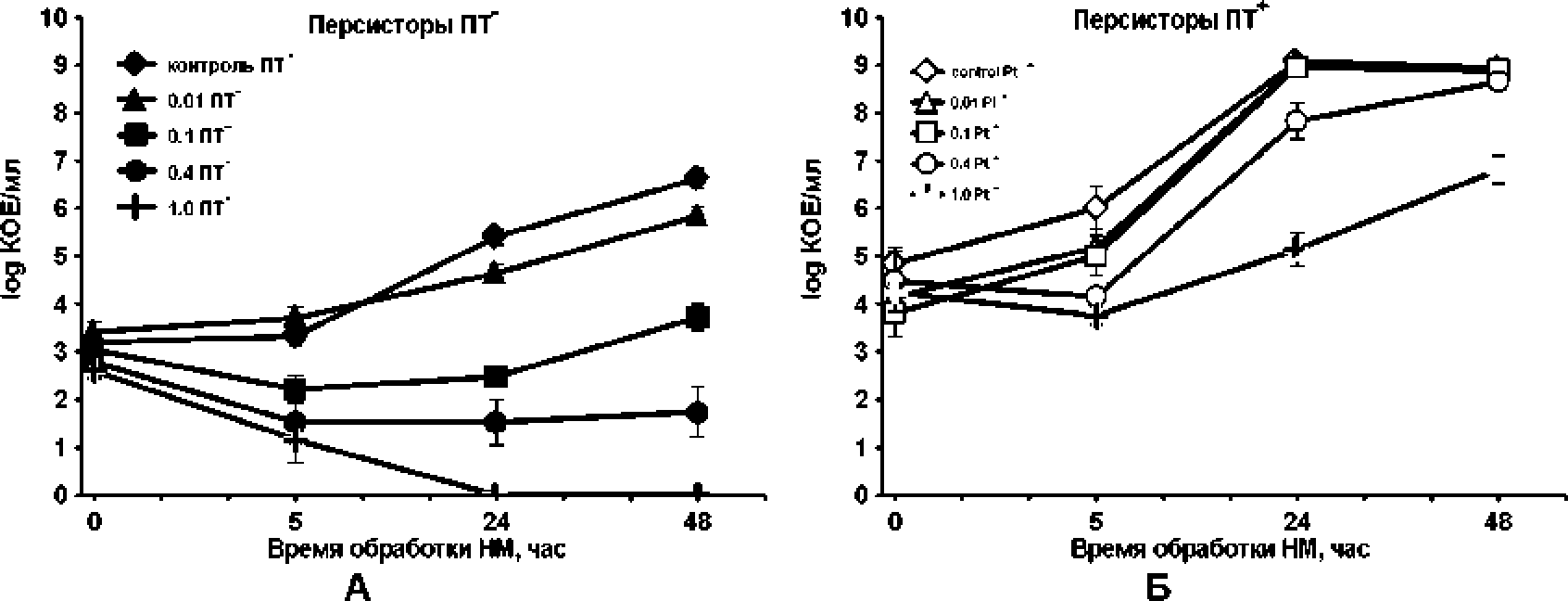
Рис. 5, Динамика псрсистерных клеток, толерантных к 2.8 мкг/мл нетилмицина. в культуре Е. coli SHT03pSOPR. предварительно обработанных низкими концентрациями нетилмицина (0.1 - 1.0 мкг/мл), без добавки (А) и в присутствии 5 мМ путресцина (Б)
С целью выяснения как изменяется содержание персисторов в контрольной и обработанных разными концентрациями (0.1-1.0 мкг/мл) аминогликозида культурах (ПТ" и ПТ+) после 5-? 24- и 4 8-часового воздействия антибиотика, из лунок часового воздействия антибиотика, из лунок планшета параллельно с высевом на подсчет жизнеспособных клеток отбирали аликвоты для определения персисторов. Дополнительная 3-часовая обработка клеток высокой концентрацией нетилмицина (2.8 мкг/мл) сопровождалась дальнейшим отмиранием чувствительных к данной концентрации клеток (рис. 5). В культурах без добавки путресцина (ПТ-) в момент внесения антибиотика количество персисторов к 2.8 мкг/мл нетилмицина было примерно одинаково (МО3 клеток). В контрольной культуре и культуре, подвергнутой субингибиторной концентрации антибиотика (0.01 мкг/мл), в экспоненциальной фазе роста (0-5 ч.) число толерантных клеток к 2.8 мкг/мл нетилмицина сохранялось на одном уровне с последующим возрастанием их количества при переходе в стационарную фазу (24-48 ч). При этом в контрольной культуре наблюдалось их незначительное превышение. В культурах. обработанных су б л стальным и концентрациями нетилмицина (0.1; 0.4 мкг/мл). дополнительное стрессирование высокой концентрацией антибиотика выявило похожую картину, как и в случае с предварительной обработкой С ЛК (рис. 4): число клеток, толерантных к су б летальным концентрациям после 5-часовой обработки. снизилось на порядок после дополнительного воздействия 2.8 мкг/мл аминогликозида и далее сохранялось на этом же уровне (0.4 мкг/мл) или даже показало незначительный рост (0.1 мкг/мл). В популяции клеток, толерантных к 1.0 мкг/мл нетилмицина после 24-часовой обработки, персисторов к 2.8 мкг/мл антибиотика не оставалось. Полученные нами результаты согласуются с гипотезой о гетерогенности бактериальных популяций. содержащих различные персисторные субпопуляции. для каждой из которых характерны свойственные им уникальные механизмы толерантности [Allison, Brynildsen. Collins. 2011]. что обусловлено, в свою очередь, разнообразием генов. принимающих участие в формировании пер-систорного фенотипа [Amato el aL 2014].
Количество персисторных клеток, толерантных к 2.8 мкг/мл нетилмицина. в культурах с добавлением путресцина (ПТ+) было на 1-2 порядка выше, чем в ПТ"-культурах в экспоненциальной фазе роста. достигая максимального различия (до 7 порядков) в стационарных культурах. Различия в содержании персисторов в ПТ" и ПТ+-культурах в нулевой точке (момент внесения полиамина и антибиотика в экспоненциальной фазе), предположительно, можно объяснить тем. что добавка полиаминов повышает антибиотикоре зистентность по лиам ин-дефицитного штамма Е. coli SHT03pSOPR.
Следует отметить, что динамика персисгообра-зования в ПТ -культурах, предварительно стрессированных нетилмицином в диапазоне концентраций от субингибиторной до летальной, полностью отражает таковую в контрольной культуре с возрастанием числа персисторов до максимума в стационарной фазе роста. При этом число персисто ров в контроле и в культурах, обработанных субингибиторной (0.01 мкг/мл) и суб летальной (0.1 мкг/мл) концентрациями антибиотика, достигало максимума уже в 24-часовых культурах и к 48 ч. не изменялось, что соответствовало числу жизнеспособных клеток, высеваемых до дополнительного стрессирования высокой концентрацией нетилмицина (рис. 4Б). Таким образом, добавка путресцина в экспоненциальной фазе роста способствовала переходу' всех культивируемых клеток (в том числе жизнеспособных, выживающих после предварительной обработки 0.01 и 0.1 мкг/мл нетилмицина) в персисторное состояние, обеспечивающее толерантность к 2.8 мкг/мл нетилмицина во время вступления б стационарную фазу. В культурах, стрессированных су б летальной (0.4 мкг/мл) и летальной (1.0 мкг/мл) концентрациями нетилмицина. отмечалось пропорциональное концентрационно-зависимое снижение числа персисторов по отношению к контролю. Однако динамика персисто-образования в этих культурах также, как и в описанных выше, показала стабильное возрастание числа персисторов до максимума к 48 ч. Максимальное содержание персисторов в стационарных ку льтурах. когда происходит замедление клеточного метаболизма, свидетельствует в пользу того, что в процессе персистообразования принимают участие гены, продукты которых накапливаются в стационарной фазе роста.
Заключение
Таким образом, полиамины вызывают повышение выживаемости бактерий при действии аминогликозида нетилмицина в диапазоне от субингибиторных до летальных концентраций. В культуре полнаминзависимого мутанта добавка полиаминов приводит к концентрационнозависимому возрастанию персистообразования до уровня профицитных штаммов.
Исследование выполнено при финансовой поддержке РФФИ (проект № 16-44-5 90279-р_а).
Список литературы Полиамины повышают толерантность Escherichia coli к нетилмицину
- Allison K., Brynildsen M., Collins J. Heterogeneous bacterial persisters and engineering approaches to eliminate them//Current Opinion in Microbiology. 2011. Vol. 14. P. 593-598
- Amato S. et al. The role of metabolism in bacterial persistence//Frontiers in Microbiology/Microbial Physiology and Metabolism. 2014. Vol. 5. Art. 70
- Datsenko K., Wanner B. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products//Proceedings of the National Academy of Sciences of the USA. 2000. Vol. 97, № 13. P. 6640-6645.
- Dorr Т., Vulic M., Lewis K. Ciprofloxacin Causes Persister Formation by Inducing the TisB toxin in Escherichia coli//PLoS Biology. 2010. Vol. 8, № 2. e1000317
- Igarashi K., Kashiwagi K. Polyamine Modulon in Escherichia coli: genes involved in the stimulation of cell growth by polyamines//Journal of Biochemistry. 2006. Vol. 139. P. 1116
- Jana S., Deb J. Molecular understanding of aminoglycoside action and resistance//Applied Microbiology and Biotechnology. 2006. Vol. 70. P. 140-150
- Gefen O., Balaban N. The importance of being persistent: heterogeneity of bacterial populations under antibiotic stress//FEMS Microbiology Reviews. 2009. Vol. 33. P. 704-717
- Keren I. et al. Persister cells and tolerance to antimicrobials//FEMS Microbiology Letters. 2004. Vol. 230. P. 13-18
- Kohanski M. et al. A common mechanism of Cellular death induced by bactericidal antibiotics//Cell. 2007. Vol. 130, № 5. P. 797-810
- Lewis K. Persister cells, dormancy and infectious disease//Nature Reviews Microbiology. 2007. Vol. 5. P. 48-56
- Lewis K. Persister cells//Annual Review of Microbiology. 2010. Vol. 64. P. 357-372
- Shakil S. et al. Aminoglycosides versus bacteria -a description of the action, resistance mechanism, and nosocomial battleground//Journal of Biomedical Science. 2008. Vol. 15. P. 5-14
- Tabor C., Tabor H. Polyamines in microorganisms//Microbiological reviews. 1985. Vol. 49. P. 81-99
- Tkachenko A. et al. Polyamines reduce oxidative stress in Escherichia coli cells exposed to bactericidal antibiotics//Research in Microbiology. 2012. Vol. 163, № 2. P. 83-91
- Tkachenko A. et al. Putrescine controls the formation of Escherichia coli persister cells tolerant to aminoglycoside netilmicin//FEMS Microbiology Letters. 2014. Vol. 361. P. 25-33


