Полифункциональная модификация биологически активных веществ
Автор: Москвичева Яна Борисовна, Петровский Станислав Викторович, Гинак Анатолий Иосифович
Журнал: Природные системы и ресурсы @ns-jvolsu
Рубрика: Биология и биотехнология
Статья в выпуске: 1 (7), 2014 года.
Бесплатный доступ
Изучали взаимодействие окисленных циклических декстранов-циклодекстрина (далее - ЦД) с белком - бактериальной стрептокиназой. При максимальном молярном трехсоткратном избытке ЦД молекулярная масса коньюгата стрептокиназы с циклодекстрином достигает 65 кД, причем с одной макромолекулярной стрептокиназы связывается 14 остатков ЦД. Включение аденозина в конъюгат стрептокиназы с ЦД приводит к образованию тройного комплекса, где один остаток циклодекстрина поглощает одну молекулу аденозина.
Циклодекстрин, стрептокиназа, аденозин, химическая модификация, гель-хроматография, окисление олигосахаридов, комплексы
Короткий адрес: https://sciup.org/14967405
IDR: 14967405 | УДК: 547.144.615.281
Текст научной статьи Полифункциональная модификация биологически активных веществ
Известно, что стрептокиназа [К.Ф.3.4.99.22] – бактериальный белок, обладающий тромболитической активностью [6].
Ранее подробно описан процесс химической модификации стрептокиназы окисленным декстраном [2].
В некоторых случаях тромболитической терапии целесообразно сочетать такой курс
лечения с применением вазодилятаторов. Так, аденозин оказывает отчетливое сосудорасширяющее действие. Аденозин участвует в обменных процессах, усиливает ресинтез АТФ в миокарде при ишемии, оказывает коронаро-расширяющее действие, что позволяет рекомендовать аденозин в качестве гипотензивного антиаритмического средства [5].
Представляло интерес осуществить такую модификацию стрептокиназы, которая бы позволила сочетать в препарате тромболитическую активность и гипотензивное действие.
В качестве модифицирующего агента мы выбрали окисленный олигосахарид. Взаимодействие белков с окисленными декстранами – хорошо изученный процесс [3]. Здесь мы выбрали в качестве олигосахарида д -циклодекст-рин, являющийся циклическим олигосахаридом с молекулярной массой равной 1298 Да. Циклодекстрины способны включать в свою внутреннюю полость малые молекулы.
Нами использован метод иммобилизации при включении в д -циклодекстрин аденозина (Ад). Предварительно д -циклодекстрин ( д -ЦД) окисляли периодатом калия и затем химически связывали с белком стрептокиназой (СК) в условиях, аналогичных тем, в которых была изучена химическая модификация стрептокиназы окисленным декстраном [1].
В водном растворе СК представляет глобулу с радиусом Стокса равным 31,1 Ао. Концентрацию белка СК в растворе определяли по оптической плотности в ультрафиолетовой области спектра, используя приведенные значения удельного коэффициента поглощения е 1 2 280 =8,8 и е 0277 = 0,98 [4]. Спектральные характеристики растворов исследовали с помощью спектрофотометра Hitachi U-2900 производства Японии.
В качестве олигомера-модификатора использовали д -ЦД фирмы «Pharmatec. Jnc.»
Количество ковалентных связей в конъюгатах, образованных между стрептокиназой и окисленным д -циклодекстрином, определяли по убыли свободных аминогрупп в конъюгатах по сравнению с нативным белком.
д -циклодекстрин окисляли периодатом калия. Реакцию проводили в течение 1 часа при постоянном перемешивании. Количество пери-одата калия, необходимое для окисления ЦД, рассчитывали по уравнению реакции:
д -ЦД + JO " 4 ® д -ЦД (окисленный) +
+ JO. - НСОО - НО
-
3 + + 2
Активация ЦД заключалась в окислении его глюкопиранозных звеньев с образованием свободных альдегидных групп с помощью калия йоднокислого мета. Перед проведением реакции химического связывания активированного ЦД со СК проводили его очистку от избытка ионов окислителя JQ. и образовавшихся ионовJQ3.
Для этой цели использовали слабоосновный анионит типа АРА. Анионит предварительно переводили в ацетатную форму с помощью 0,5 М раствора уксусной кислоты.
Определение содержания альдегидных групп в окисленном ЦД, а также в восстановленных препаратах основано на реакции этих групп с солянокислым гидроксиламином. При этом взаимодействии выделяется соляная кислота, которую оттитровывают стандартным раствором NaOH и по количеству щелочи, пошедшей на титрование, рассчитывают содержание альдегидных групп [1].
Контроль за степенью модификации СК осуществляли с помощью метода гель-хро-матографии. Хроматографию проводили на стеклянной колонке объемом 100 мл, заполненной гелем Сефадекс G-200 в качестве неподвижной фазы.
В качестве элюента на колонку подавался физиологический раствор со скоростью 5 мл/час. Под действием потока подвижной фазы вещества, нанесенные на колонку, перемещаются вдоль нее с различными скоростями, величины которых обратно пропорциональны коэффициенту распределения ( Kav ) хроматографируемых веществ, причем чем меньше размер молекулы, тем больше Кav .
Для калибровки колонки использовали набор фирмы Serva со стандартизованными белками известной молекулярной массы (Мм).
Коэффициент распределения определяли по формуле:
к- V V
К av , av m 0
где Vm – максимальный объем удерживания, соответствующий веществу полностью включенному в гранулы геля (фенилаланин, Vm =100 мл); V 1 – объем удерживания исследуемого вещества; V 0 – свободный объем данной колонки, определяемый веществом, полностью исключенным из гранул геля (голубой декстран, V 0 =40 мл);
В таблице 1 приведены результаты калибровки колонки с Сефадексом G-200. На рисунке 1 приведена зависимость Кav от величины lg (Мм).
За степень окисления g -ЦД принимали величину, численно равную количеству пар альдегидных групп, приходящихся на 100 элементарных звеньев a -D-глюкозы.
Определение количества свободных аминогрупп и степени модификации белка (a) проводили спектрофотометрически с помощью 2,4,6-тринитробензолсульфокислоты (ТНБС). Калибровочную прямую строили по растворам глицина. Степень модификации рассчитывали на основе 3–5 измерений оптической плотности растворов с различными концентрациями белка. Результаты измерений a рассчитывали как долю аминогрупп, вступивших в реакцию образования ковалентных связей с олигомерной матрицей от общего числа свободных аминогрупп исходной СК.
При определении концентрации вещества в растворе спектрофотометрическими методами погрешность определения составляла < 5 %.
Содержание альдегидных групп по результатам иодометрического титрования определяется с погрешностью 10 %. Погрешность определения степени модификации СК с помощью ТНБС составляет 3–5 %.
Погрешность определения молекулярных масс по данным гель-хроматографии составила 15 %.
Модификацию стрептокиназы окисленным очищенным ЦД проводили в 0,5 М содовом буферном растворе при рН 9,5 в течение
Таблица 1
Объемы удерживания и коэффициенты распределения веществ с известной молекулярной массой на колонке с Сефадексом G-200 в 0,9 % NaCl, объем геля V = 100 мл
|
№ |
Наименование |
Молекулярная масса (Мм), Да |
Объем удерживания, мл |
К аv |
lg (Мм) |
|
1 |
Голубой декстран |
2 000 000 |
40 |
– |
– |
|
2 |
Бычий сывороточный альбумин |
66 000 |
65 |
0,42 |
4,8 |
|
3 |
Стрептокиназа |
47 300 |
69 |
0,49 |
4,7 |
|
4 |
Химотрипсиноген |
25 000 |
77 |
0,62 |
4,4 |
|
5 |
Цитохром С |
12 400 |
84 |
0,73 |
4,1 |
|
6 |
Фенилаланин |
165 |
100 |
– |
– |
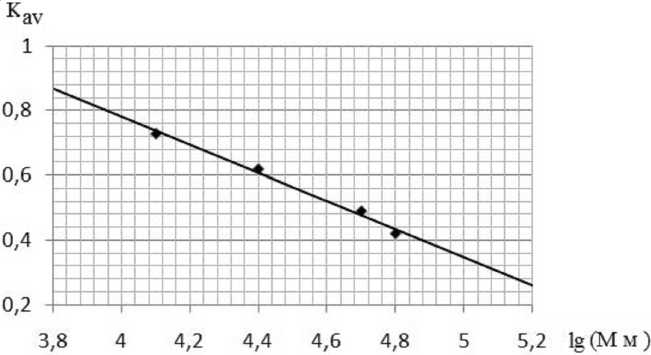
Рис. 1. Зависимость коэффициента распределения белков ( Каv ) с известной молекулярной массой от величины lg (Мм)
-
1 часа при комнатной температуре и постоянном перемешивании. В результате взаимодействия e -аминогрупп лизиновых остатков белка с альдегидными группами окисленного g -ЦД образуется высокомолекулярный продукт СК-ЦД, содержащий неустойчивые двойные С=N-связи (основание Шиффа).
Для восстановление двойных связей С=N вносили в реакционную смесь двукратный молярный избыток боргидрида Na или К. При этом происходит стабилизация двойных связей с превращением их в одинарные, а непрореагировавших (избыточных) альдегидных групп декстрана в спиртовые.
Очистку, деминерализацию и концентрирование модифицированного раствора СК проводили на ультрафильтрационной установке Vivaflow 200, используя мембранный модуль 5 кДа HYS.
Деминерализацию проводили 4 раза десятикратным объемом очищенной воды. Контроль за степенью очистки вели спектрофотометрически по оптической плотности (D235) при длине волны l = 235 нм, добиваясь ее значения ниже 0,25 в кювете 1 см.
Для исследования связывания СК с окисленным г-циклодекстрином использовали препарат g-ЦД со степенью окисления 10,1 %. В таблице 2 приведены исходные соотношения СК и окисленного g-ЦД в реакционной среде и характеристика полученного продук- та модифицированной СК. В последнем столбце приведены рассчитанные молекулярные массы модифицированной СК. При максимальном молярном трехсоткратном избытке g-ЦД в реакционной среде молекулярная масса конъюгата достигает 65 кД, причем на одну макромолекулу СК оказывается присоединенным до 14 остатков g-ЦД. Объемы удерживания полученных продуктов систематически снижаются при увеличении степени модификации СК, но это снижение не очень сильно выражено.
Получение тройного комплекса СК-ЦД-Ад проводили с модифицированной СК, полученной при десятикратном массовом избытке g -ЦД (см. табл. 2, строка 1).
Полученную на первом этапе модифицированную СК-ЦД после очистки высушивали лиофильно. Включение Ад в полученный препарат модифицированной СК проводили, растворяя 100 мг препарата СК-ЦД в 10 мл 0,01 М Na2CO3 при рН = 11,05. Затем в полученный раствор внесли 0,2 ммоль (54,3 мг) аденозина. Смесь выдерживали 1 час при температуре 20 ± 2 оС и хроматографировали на колонке с сефадексом G-10. 100 мг препарата СК-ЦД соответствует 1,53 ∙ 10-3 ммоль модифицированной СК, причем ЦД в этом препарате содержится 0,02 ммоль. Таким образом избыток Ад по отношению к количеству ЦД в растворе составляет 0,2 ммоль
Таблица 2
Условия химической модификации стрептокиназы окисленным g -циклодекстрином
|
№ п/п |
Исходное соотношение СК и γ-ЦД в реакционной среде СК : ЦД |
Объем удержания ( V мл ), мл |
Соотношения в конечном продукте СК : ЦД, моль/моль |
Степень модификации ( α ), % |
К аv |
Рассчитанная молекулярная масса |
||
|
Мм |
lg (Мм) |
|||||||
|
мг/мг |
моль/моль |
|||||||
|
1 |
1 : 10 |
1 : 364 |
66 |
1 : 14 |
44 |
0,43 |
65 472 |
4,82 |
|
2 |
1 : 5 |
1 : 182 |
66 |
1 : 14 |
44 |
0,43 |
65 472 |
4,82 |
|
3 |
1 : 1 |
1 : 36 |
68 |
1 : 8 |
25 |
0,45 |
57 684 |
4,76 |
|
4 |
1 : 0,5 |
1 : 18 |
68 |
1 : 6 |
19 |
0,49 |
55 088 |
4,74 |
|
5 |
1 : 0 |
1 : 0 |
69 |
1 : 0 |
0 |
0,49 |
47 300 |
4,70 |
Примечание. CК – стрептокиназа; g -ЦД – циклодекстрин; V мл – объем удерживания модифицированной СК.
Таблица 3
Характеристика модельной смеси модифицированной СК в присутствии Ад в соотношении СК-ЦД 0,003 ммоль/л : Ад 0,044 ммоль/л (1:14)
|
Название вещества |
Концентрация вещества С, моль/л |
Оптическая плотность D * |
Оптическая плотность D ** |
|
Стрептокиназа |
0,003 |
0,050 |
0,050 |
|
Аденозин |
0,044 |
0,695 |
0,695 |
|
Стрептокиназа + аденозин |
0,003 : 0,044 |
0,735 |
0,685 |
|
γ-ЦД |
0,044 *** |
0 |
0 |
Примечание . D* – оптическая плотность при l =259 нм; D** – оптическая плотность с учетом плотности стрептокиназы при l =259 нм; *** – концентрация g -ЦД (рассчитано из молекулярной массы 1 звена).
Ад на 0,02 ммоль ЦД, входящего в структуру СК-ЦД.
Колонка с Сефадексом G-10 диаметром 1,3 см и высотой 15 см содержала 64 мл набухшего геля G-10. Скорость элюции составляла 26,5 мл/час ∙ см2. Объем удерживания голубого декстрана составлял 27 мл, тирозина – 60 мл. На колонку с Сефадексом G-10 нанесли 10 мл приготовленного ранее раствора СК-ЦД-Ад в содовом буфере. Собрали высокомолекулярную фракцию, соответствующую объему удерживания голубого декстрана, в объеме 30 мл.
Если предположить, что потери модифицированной СК при хроматографии на колонке с Сефадексом G-10 отстутствовали, то ее концентрация составила в собранной фракции 0,51∙10-4 ммоль/мл.
Спектр поглощения СК в указанной концентрации показан на рисунке 2 (1). Спектр g -ЦД приведен на рисунке 2 (2). На рисунке 2 (3) приведен спектр Ад. Видно, что в зоне максимума поглощения Ад при длине волны l =259 нм СК и полиглюкин практически не вносят заметный вклад в оптическую плотность.
Таким образом, замерив оптическую плотность раствора модифицированной СК и Ад можно при длине волны l =259 нм определить концентрацию Ад в растворе высокомолекулярной фракции, то есть рассчитать количественно Ад, включенного в модифицированную СК. Предварительно определив оптическую плотность контрольного раствора Ад, расчетным путем нашли, что соотношение Ад и СК-ЦД в полученном растворе соответствует одному молю Ад, включенному в один моль ЦД (см. табл. 3).
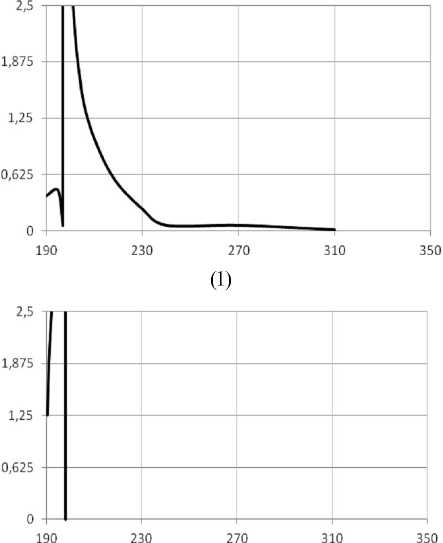
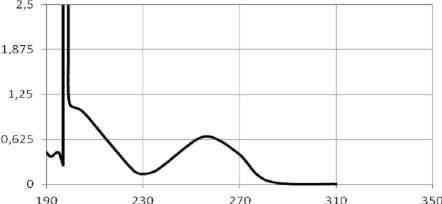
Рис. 2. Спектральные характеристики модифицированной стрептокиназы (1), g -ЦД (2) и аденозина (3)
В заключение можно отметить, что циклодекстрин, связанный с белком стрептокиназой в результате взаимодействия окисленных глюкопиранозных звеньев с аминогруппами белка, сохраняет способность поглощать малые молекулы в свою внутреннюю полость.
Список литературы Полифункциональная модификация биологически активных веществ
- А. с. 1371004 СССР. Способ получения иммобилизованной стрептокиназы/Москвичев Б. В., Таратина Т. М., Иванова Г. П. [и др.] (СССР).
- Москвичев, Б. В. Иммобилизованные ферменты в медицине и медицинской промышленности/Б. В. Москвичев, М. С. Поляк. -М.: Медбиоэкономика, 1983. -С. 51-71.
- Пат. 1622986 Российская Федерация, Способ получения препарата Терридеказа, обладающего протеолитической активностью для парентерального введения/Москвичев Б. В., Иванова Г. П., Таратина Т. М., Безъязычная Т. С., Гринберг Г.Е.; заявитель и патентообладатель ВНИТИ Антибиотиков и ферментов медицинского назначения. -Приоритет -прекратил действие 24.12.1994; опубл. 1997, Бюл. № 11.
- Conformational properties of streptokinasedifferential scanning calorimetric investigations/K. Welfle et al.//International Journal Biological -Macromolecules 14. -1992. -P. 19-22.
- Munoz, A. Arch. Intern. Physiol. Cardiovascular Pharmacotherapy International Symposium/A. Munoz et al.//Int. Symp. -1985. -№ 45 -Р. 37-39.
- Yoshinori, M. Fibrinolytic enzymes in Asian traditional fermented foods/M. Yoshinori, H. K. Wong, B. Jiang//Food Research International. -2005. -Vol. 38. -Iss. 3. -P. 243-250.


