Полимиксин в клинической практике онколога
Автор: Дмитриева Наталья Владимировна, Петухова Ирина Николаевна, Григорьевская Злата Валерьевна, Багирова Наталья Сергеевна, Терещенко Инна Васильевна, Григорьевский Евгений Дмитриевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 3 т.17, 2018 года.
Бесплатный доступ
Цель исследования - представить современные данные об антибиотике из класса полимиксинов, активном в отношении мультирезистентных (MDR) грамотрицательных возбудителей госпитальных инфекций, включая Acinetobacter baumannii, Klebsiella pneumoniae, Pseudomonas aeruginosa. Материал и методы. В обзор включены данные клинических, а также in vitro исследований за период 1998-2017 гг. Поиск соответствующих источников производился в системах Medline, Cochrane Library, Elibrary и других. Результаты. Анализ данных показал наличие синергизма и аддитивной активности полимиксина в комбинации с карбапенемами, рифампицином, азитромицином, однако прямой корреляции полученных экспериментальным данных по эффективности добавления азитромицина и рифампицина нет, так как в клинической практике чаще всего используются комбинации с карбапенемами или другими антибиотиками. В клинических исследованиях при госпитальных пневмониях, в том числе ВАП, клиническая эффективность полимиксина В варьировала от 38 до 88 % при использовании его в комбинации с другими антибиотиками в зависимости от схемы лечения и основной патологии. Высокие нефро- и нейротоксичность полимиксина, наблюдавшиеся в ранних исследованиях, могут объясняться отсутствием понимания его токсикодинамики или использования неправильной дозы и не подтверждаются более поздними исследованиями. Заключение. Эффективность полимиксина В, возможность включения его в комбинации и меньшая, чем ранее ожидалось, токсичность способствовали «возрождению» препарата и включению в арсенал средств, активных при лечении MDRграмотрицательных инфекций.
Множественная лекарственная резистентность, полимиксин в, онкологические больные
Короткий адрес: https://sciup.org/140254191
IDR: 140254191 | УДК: 616-006:616.98-08:615.33:615.015.8 | DOI: 10.21294/1814-4861-2018-17-3-88-93
Текст обзорной статьи Полимиксин в клинической практике онколога
чивость этих микроорганизмов к полимиксину В по-прежнему встречается редко [6]. С позиции современного подхода, комбинированная терапия является предпочтительной в лечении инфекций, вызванных MDR и XDR микроорганизмами, так как более эффективна и снижает вероятность развития резистентности в сравнении с монотерапией [5, 7]. Комбинации полимиксина В с другими антибиотиками в исследованиях in vitro , синергизм и аддитивная активность полимиксинов в сочетании с другими антибиотиками были продемонстрированы в ряде исследований. Так, комбинация полимиксина В и рифампицина, изученная на пяти различных изолятах MDR A. baumannii , была синергидной в трех и аддитивной в двух случаях [8]. В исследовании J. Yoon et al. (2004) на 8 различных изолятах A. baumannii тройная комбинация полимиксин B-рифампицин-имипенем была синергидной по отношению ко всем изолятам [9]. Причем при изучении зависимости гибели бактерий от времени экспозиции антибиотика (англ. – time-kill study) было показано, что все исследуемые микроорганизмы элиминировались в течение 24 ч, чего не наблюдалось при использовании каждого антибиотика в отдельности [9].
Также был продемонстрирован in vitro эффект комбинации полимиксина B и азитромицина или рифампицина в отношении 24 штаммов A. baumannii [10]. При комбинации азитромицина 4 мг/л с полимиксином В отмечался синергизм в отношении 20 изолятов, включая два резистентных к полимиксину штамма, а в отношении 4 изолятов наблюдался аддитивный эффект. Комбинация рифампицина (1 мг/л) и полимиксина В продемонстрировала синергизм в отношении половины изолятов и аддитивный эффект у остальных [10]. В другом исследовании изучалась комбинация полимиксина В и рифампицина в отношении 16 штаммов К. pneumoniae – продуцента карбапенемазы KPC-2, включая 6 отличающихся штаммов и 10 изолятов, представляющих собой 2 других риботипа [11]. Комбинация полимиксина В (1 мг/л) с рифампицином (1 мг/л) была синергидна в отношении 15 из 16 изолятов. Комбинация полимиксина В (0,5 × МИК) с имипенемом (4 мг/л) была синергидна в отношении 10 из 16 изолятов, но была антагонистической для трех изолятов. При этом добавление имипенема (4 мг/л) к комбинации полимиксина В (0,5 × МИК) и рифампицина (1 мг/л) было неэффективно [11]. В исследовании D. Landman et al. (2005) на 10 изолятах MDR P.aeruginosa, включающих 7 различных риботипов, был показан синергизм полимиксина В в сочетании с азитромицином в концентрации 4 мг/л в отношении 6 изолятов, полимиксина В в комбинации с имипенемом 4 мг/л в отношении двух изолятов и с рифампицином 1 мг/л – в отношении одного изолята. Наиболее эффективной была комбинация из трех лекарственных препаратов [12]. Следует иметь в виду, что прямой корреляции полученных экспериментальным путем данных по эффективности добавления азитромицина или рифампицина к полимиксину В нет. В клинических исследованиях использовались другие комбинации, которые следует тщательно изучить и при необходимости применять в связи с ограниченным арсеналом антибиотиков, действующих на мультирезистент-ные грамотрицательные бактерии.
В клинических исследованиях по лечению резистентных грамотрицательных инфекций получены интересные данные. В клиническом исследовании полимиксин В применяли у 60 пациентов с внутрибольничными инфекциями (в большинстве случаев при вентилятор-ассоциированных пневмониях), вызванными A. baumannii. Внутривенную дозу полимиксина В корректировали в соответствии с клиренсом креатинина (КК): при КК 20–50 мл/мин вводили 75 % от общей суточной дозы, равной 2,5 мг/кг; при КК менее 20 мл/мин вводили 33 % от общей суточной дозы [13]. Общая летальность в исследуемой группе составила 20 %. Элиминация бактерий имела место у 88 % пациентов; исследование антибиотикочувствительности показало, что в оставшихся случаях персистировавшие бактерии по-прежнему были чувствительны к полимиксину. При этом 90 % больных получали комбинированное лечение полимиксином В и одним из антибиотиков, активных в отношении синегнойной палочки и А. baumannii [13]. В другое исследование были включены пациенты, получившие только комбинированную терапию [14]. Из них в отделениях реанимации и интенсивной терапии находились 92 % пациентов, у 88 % – проводилась ИВЛ. У всех пациентов были инфекции дыхательных путей, вызванные A. baumannii (55 %), P. aeruginosa (41 %) и Alcaligenes xilosoxidans (3 %). Только 7 штаммов A. baumannii и 5 штаммов P. aeruginosa были устойчивы ко всем антибиотикам, за исключением полимиксина B. Поскольку все пациенты одновременно получали и другие антибиотики, оценить эффективность полимиксина B было затруднительно. Общая летальность составила 48 %. В процессе дальнейшего наблюдения были получены 22 культуры микроорганизмов, причем в 9 случаях наблюдался достигнутый поздно (на фоне длительной терапии) микробиологический эффект. Устойчивости к полимиксину В во время лечения не наблюдалось [14]. K.P. Holloway et al. (2006) опубликовали результаты лечения 37 пациентов с инфекциями, вызванными чувствительными к полимиксину штаммами A. baumannii [15]. Терапию полимиксином В получали 33 больных, в 27 случаях проводилась монотерапия данным препаратом. В основном лечение проводилось по поводу ВАП. На фоне лечения полимиксином B умерли 9 (27 %) пациентов. Микробиологический эффект был достигнут у 17 (81 %) пациентов из 21 [15]. В другом исследовании 13 пациентов по- лучали внутривенное лечение полимиксином B по поводу инфекций, вызванных MDR штаммами P. аeruginosa, продуцирующими металло-бета-лактамазы [16]. Общая летальность составила 54 %. Из шести пациентов, получавших полимиксин В по поводу ВАП, четверо (67 %) умерли в течение 30 дней после начала терапии [16]. G.H. Pereira et al. (2007) описали результаты лечения 19 пациентов, получавших ингаляционный полимиксин B [17]. У 14 из 19 больных имела место нозокомиальная пневмония, а 11 больным проводилась ИВЛ. Все они одновременно получали полимиксин В внутривенно. P aeruginosa была выделена в 11 из 14 случаев. У 13 (94 %) больных отмечался хороший клинический эффект при лечении пневмонии. Несмотря на это, 9 (64 %) из 14 пациентов умерли во время пребывания в стационаре. Интересно, что некоторые из пациентов ранее не отвечали на терапию внутривенным полимиксином В. Это свидетельствует о необходимости дополнительного исследования фармакокинетики в/в и ингаляционной формы полимиксина В у больных пневмонией [17]. M. Ostronoff et al. (2006) описали два случая успешного лечения целлюлита/флегмоны, вызванных MDR P. aeruginosa (один из которых был осложнен бактериемией), у пациентов с нейтропенией. Полимиксин B сочетали с рифампицином. Доза полимиксина В составляла 1,0 мг/кг внутривенно каждые 12 ч [18]. В наблюдательном исследовании Crusio R. et al. (2014) оценивали различные комбинации полимиксина В при инфекциях, вызванных карбапенем-резистентными грамотрицательны-ми бактериями, в том числе A.baumannii (n=34), K.pneumoniae (n=25), P.aeruginosa (n=11), и смешанной грамотрицательной микрофлорой (n=34). Бактериемия присутствовала у 5 больных.
Клиническая и микробиологическая эффективность, а также летальность во время пребывания в стационаре и через 6 мес оценивались в 5 лечебных группах (рис. 1). Достоверных различий в летальности в зависимости от схемы лечения не отмечено. Во время пребывания в стационаре летальность зависела от возраста больного, тяжести инфекции и оценки больного по шкале Charlson [19]. В целом, несмотря на то, что терапия полимиксином В в комбинации с другими антибиотиками при тяжелых инфекциях, вызванных MDR и XDR грамотрицательными бактериями, представляется привлекательным вариантом, достаточного количества клинических данных, показывающих преимущество комбинаций перед монотерапией полимиксином В, нет [6].
Производилась подробная оценка токсичности препарата. Нефро- и нейротоксичность являются наиболее частыми токсическими эффектами при парентеральном введении полимиксинов [19, 20]. При этом токсичность, наблюдавшаяся в ранних клинических исследованиях с использованием ко-листиметата натрия (полимиксина Е), скорее всего, объясняется отсутствием понимания его фармакокинетики, фармакодинамики и токсикодинамики, а также неверно выбранной дозировкой [19]. Также следует отметить, что большинство исследований, посвященных оценке токсичности полимиксинов, проводили с использованием метансульфоната колистина, и они не обязательно отражают токсичность полимиксина В [6].
Основываясь на данных систематического обзора «старых» публикаций и ограниченного количества последних публикаций, M.E. Falagas et al. (2006) пришли к выводу, что показатели нефротоксичности при применении полимиксинов в
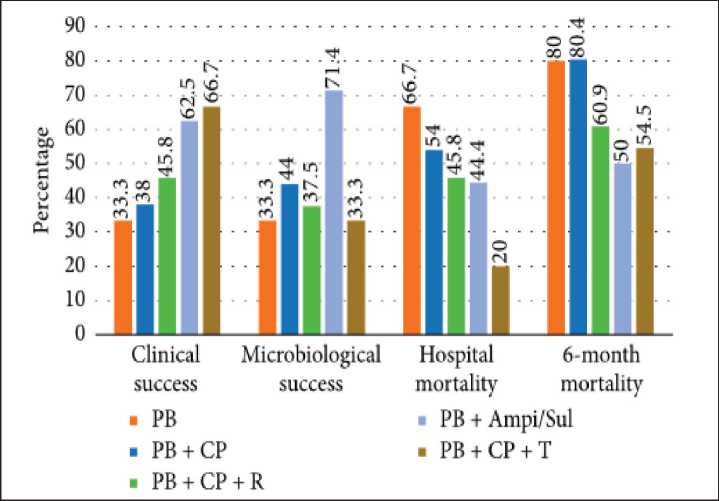
Рис. 1. Сравнение эффективности и смертности при использовании различных комбинаций полимиксина В (по оси абсцисс, слева направо: клинический эффект, микробиологический эффект, смертность во время пребывания в стационаре, смертность через 6 мес; по оси ординат – процент).
Список литературы Полимиксин в клинической практике онколога
- Григорьевская З.В., Петухова И.Н., Багирова Н.С., Шильникова И.И., Терещенко И.В., Григорьевский Е.Д., Дмитриева Н.В. Нозокомиальные инфекции у онкологических больных: проблема нарастающей резистентности грамотрицательных микроорганизмов. Сибирский онкологический журнал. 2017; 16 (1): 91-97. DOI: 10.21294/1814-4861-2017-16-1-91-97
- Григорьевская З.В., Петухова И.Н., Дьякова С.А., Дмитриева Н.В. Эпидемиология внутрибольничных инфекций в онкологическом стационаре, вызванных высокорезистентными (XDR) штаммами А. baumannii. Сибирский онкологический журнал. 2016; 15 (3): 62-66. DOI: 10.21294/1814-4861-2016-15-3-62-66
- Дмитриева Н.В., Петухова И.Н., Багирова Н.С., Григорьевская З.В., Дьякова С.А., Терещенко И.В., Соколова Е.Н. Распространенность нозокомиальных микроорганизмов в онкологической клинике. Клиническая лабораторная диагностика. 2016; 61 (9): 619-620.
- Evans M.E., Feola D.J., Rapp R.P. Polymixin B sulfate and colistin: old antibiotics for emerging multiresistant gram-negative bacteria. Ann Pharmacother. 1999; 33: 9607.
- Дмитриева Н.В., Петухова И.Н., Громова Е.Г. Сепсис. Избранные вопросы диагностики и лечения. М.: АБВ-пресс, 2018. 161-202.


