Полиморфизм и уровень дифференциации островных и материковых популяций полевой мыши Apodemus agrarius юга дальнего востока России по данным анализа микросателлитов
Автор: Фрисман Л.В., Шереметьева И.Н., Картавцева И.В., Павленко М.В., Родимцева Д.В.
Журнал: Региональные проблемы @regionalnye-problemy
Рубрика: Биоразнообразие и заповедное дело
Статья в выпуске: 2 т.25, 2022 года.
Бесплатный доступ
Проведена оценка полиморфизма и уровня дифференциации в островных и материковых популяциях полевой мыши. Протестированы особи четырех островов залива Петра Великого Японского моря и четырех районов на материковой части юга Дальнего Востока России. Исследованы ядерные маркеры 5 микросателлитных локусов. Результаты демонстрируют более высокое аллельное разнообразие в материковой части ареала при значительно более высоком уровне дифференциации в островной части ареала.
Полевая мышь, юг дальнего востока России, микросателлиты, аллель, генетическая дифференциация, изоляты
Короткий адрес: https://sciup.org/143178883
IDR: 143178883 | УДК: 575.22:599.323.45(571.6) | DOI: 10.31433/2618-9593-2022-25-2-77-80
Текст научной статьи Полиморфизм и уровень дифференциации островных и материковых популяций полевой мыши Apodemus agrarius юга дальнего востока России по данным анализа микросателлитов
Анализ внутривидовой изменчивости и генетической дифференциации является важнейшим этапом исследования микроэволюционного процесса. Востребованными объектами такого исследования являются виды, ареал которых обширен и представлен системой изолятов. Полевая мышь Apodemus agrarius Pallas, 1771 распространена от Центральной Европы до Тихоокеанского побережья Азии. Материковая часть ареала подразделяется в Забайкалье на два крупных изолированных массива. Известен слабый уровень дифференциации этих изолятов по аллозимным [3], кариологическим [2], RAPD [4] и микросателлит-ным [6, 9] характеристикам. Дискуссионным остается вопрос о времени разделения этих массивов.
На восточной периферии ареала вид заселяет множество островов, в том числе восемь островов залива Петра Великого в Приморье. Острова залива Петра Великого в периоды максимального оледенения в плейстоцене составляли с территорией современного материка единое целое. Отделение островов от материка произошло в голоцене 7000– 9500 лет тому назад [1].
Цель настоящей работы – на примере ми-кросателлитных локусов исследовать полиморфизм и дифференциацию островных и материковых популяций полевой мыши. Рассмотрены выборки из популяций полевых мышей четырех островов: Большой Пелис – 27 экз., Русский – 30 экз., Попова – 29 экз., Путятина – 30 экз. На
материковой части ареала рассматривали выборки южной части Приморского края: Хасанский р-н – 23 экз., Артемовский городской округ – 29 экз., Ханкайский р-н – 30 экз. Кроме того, рассмотрена выборка окрестностей г. Зея, Амурская область – 30 экз.
ДНК выделена стандартным солевым методом из тканей, фиксированных в 96%-м этаноле. Последовательности праймеров и режимы амплификации локусов GTTDS8, GATAE10A, CAA2A, GTTF9A взяты из работы [10], а для локуса SFM2 из работы [7]. Анализ длин фрагментов проведен на 8-канальном генетическом анализаторе АВ-3500 (Applied Biosystems, США). Оценки наблюдаемой и ожидаемой гетерозиготности, соответствия распределению Харди-Вайнберга и F-статистик проведены в программе Arlequin [5]. Работа проведена на приборной базе ИКАРП ДВО РАН.
В общем пуле 228 экземпляров для локуса CAA2A обнаружено 15 аллелей, для GTTF9A – 12, GATAE10A – 12, DSFM2 – 14 и GTTDS8 – 2 аллеля. Соотношение наблюдаемой и ожидаемой гетерозиготности в большинстве рассматриваемых популяций показало статистически значимый недостаток гетерозигот. Суммарно по 5 локусам в островных популяциях обнаружено 44 аллеля, а в материковых – 54. 11 аллелей обнаружены только на материковой части ареала. На островах (Попова, Путятина) обнаружен только один аллель, не встреченный на материке. В островных популяциях, в сравнении с материковыми, наблюдается уменьшение аллельного разнообразия для всех локусов, кроме DSFM2. Наименьшее аллельное разнообразие наблюдалось в популяции полевой мыши острова Большой Пелис (23 аллеля). Этот остров характеризуется наименьшей площадью, наибольшей удаленностью от побережья и са-
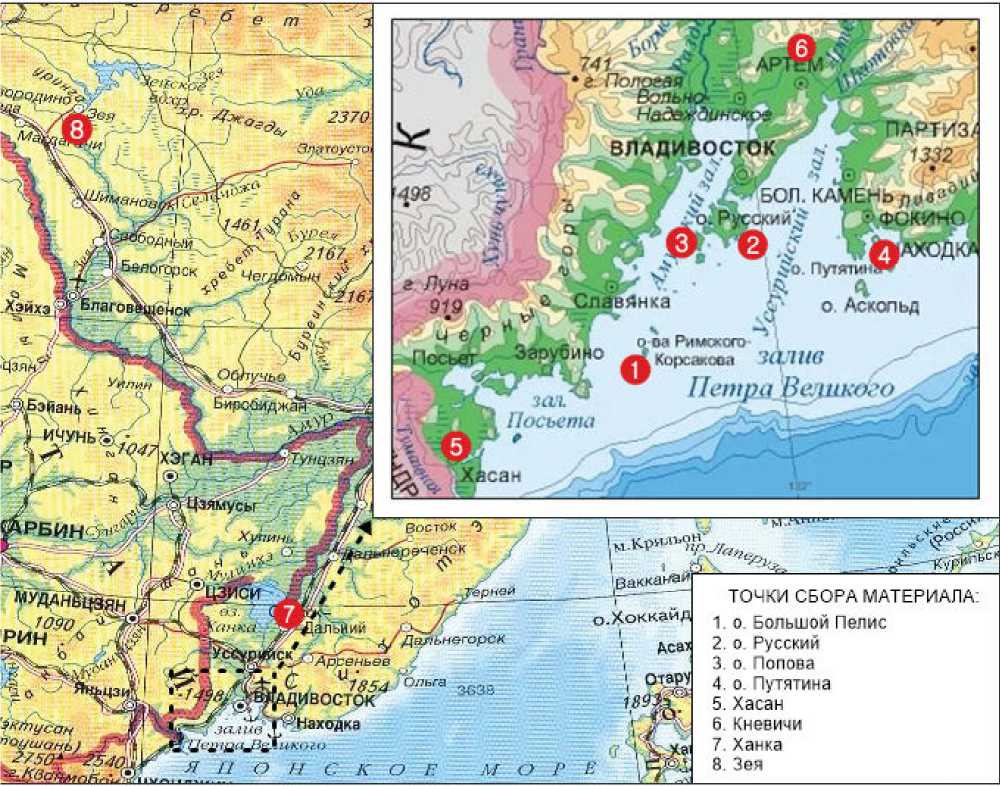
Рис. Карта мест сбора материала полевой мыши
Fig. Sampling locations map of the striped fi eld mouse мым ранним временем отделения от материка (9500 лет тому назад) [1]. В популяциях островов Русский, Попова и Путятина, близких к материку, обнаружено по 31–33 аллеля. В популяциях материковой части ареала наблюдается уменьшение аллельного разнообразия при движении с юга на север от побережья Приморского края до северной оконечности ареала в Амурской области (от 45 до 35 аллелей). Слабый уровень генетической дифференциации материковых популяций (Fst≤0.03) совпадает с данными по уровню дифференциации популяций внутри западного и восточного материковых изолятов, а также популяций Корейского полуострова и близлежащих к нему островов Намхэ и Кодже [8]. Наиболее отличающейся оказалась популяция острова Большой Пелис, показавшая высокий уровень дифференциации как с материковыми (0.15
Список литературы Полиморфизм и уровень дифференциации островных и материковых популяций полевой мыши Apodemus agrarius юга дальнего востока России по данным анализа микросателлитов
- Велижанин А.Г. Время изоляции материковых островов северной части Тихого океана II Доклады АН СССР. 1976. Т. 231, № 1. С. 205-207.
- Картавцева И.В., Павленко М.В. Хромосомная изменчивость полевой мыши Apodemus agarius (Rodentia, Muridae) II Генетика. 2000. Т. 36, № 2. С. 223-236.
- Межжерин С.В., Зыков А.Е. Генетическая дивергенция и аллозимная изменчивость мышей рода Apodemus s. lato (Muridae, Rodentia) Il Цитология и генетика. 1991. Т. 25, № 4. С. 51-58.
- Atopkin D.M., Bogdanov A.S., Chelomina G.N. Genetic variation and differentiation in striped field mouse Apodemus agrarius inferred from RAPD-PCR analysis II Russian Journal of Genetics. 2007. Vol. 43, N 6. P. 665-676.
- Excoffier L.G., Laval C., Schneider S. Arlequin (version3.0): An integrated software package for population genetics data analysis II Evol. Bioinform. Online. 2005. Vol. 1. P. 47-50.
- Frisman L.V., Bogdanov A. S., Kartavtseva I.V., Sheremetyeva I.N., Pavlenko M.V., Shlufman K.V., Kovalskaya Yu.M. Differentiation of continental isolates of the striped field mouse (Apodemus agrarius Pallas, 1771) by microsatellite loci // Biology Bulletin Reviews. 2020. Vol. 10, N 5. P. 383-393.
- Hua Wu, Xiang-Jiang Zhan, Li Yan et al. Isolation and characterization of fourteen microsatellite loci for striped field mouse (Apodemus agrarius) // Conservation Genetics. 2008. Vol. 9, N 6. P. 1691-1693.
- Jo Y.S., Kim H.N., Baccus J.T., Jung J., Genetic differentiation of the Korean striped field mouse, Apodemus agrarius (Muridae, Rodentia), based on microsatellite polymorphism // Mammalia. 2016. Vol. 81, N 3. P. 1-11.
- Latinne A., NavascuMs M., Pavlenko M., Kartavtseva I., Ulrich R.G., Tiouchichine M.-L., Catteau G., Sakka H., QuMm J.-P., Chelomina G., Bogdanov A., Stanko M., Hang L., Neumann K., Henttonen H., Michaux J. Phylogeography of the striped field mouse, Apodemus agrarius (Roden-tia: Muridae), throughout its distribution range in the Palaearctic region // Mammalian Biology. 2020. Vol.100, N 1. P. 19-31.
- Makova K.D., Patton J.C., Krysanov E.Yu., Chessery R.K., Baker R.J. Microsatellite markers in wood mouse and striped field mouse (Genus Apodemus) // Molecular Ecology. 1998. Vol. 7, N 2. P. 247-255.
- Sheremetyeva I.N., Kartavtseva I.V., Pavlenko M.V., Kostenko V.A., Sheremetyev I.S., Katin I.O., Kosoy M.E. Morphological and genetic variability in small island populations of the striped field mouse Apodemus agrarius Pallas, 1771 // Biology Bulletin. 2017. Vol. 44, N 2. P. 159-171.


