Полиморфизм эстеразных изоферментов в зрелых семенах редьки посевной (Raphanus sativus L.)
Автор: Рудакова А.С., Рудаков С.В., Артемьева А.М., Курина А.Б., Кочерина Н.В., Чесноков Ю.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Физиология, биохимия
Статья в выпуске: 5 т.55, 2020 года.
Бесплатный доступ
Существующие внутривидовые классификации делят образцы редьки посевной ( Raphanus sativus L.), проявляющие широкое разнообразие морфологических признаков, по географическому принципу в зависимости от региона происхождения (Европа, Китай, Япония). Вместе с тем известно, что в растениях комплекс ферментов, гидролизующих эфирные связи (эстеразный комплекс), имеет внутривидовую и тканевую специфичность. Ранее образцы из коллекций генетических ресурсов редьки посевной никогда не оценивались на наличие изоферментных форм эстераз в зрелых семенах этой культуры. Установление общей изменчивости изоферментных систем и выявление их генетического контроля позволяют вскрывать тонкие механизмы взаимоотношения организма с окружающей средой и гомеостаза, что особенно важно при длительном хранении образцов в генетических коллекциях семян. Существенное значение имеет и разработка эффективных биохимических маркеров для экспресс-оценки коллекционного, а также генетически и селекционно значимого материала. Проведение подобного рода работ позволяет восполнить пробел, существующий в отношении образцов генетических ресурсов редьки посевной. В настоящей работе мы впервые исследовали изоферментные формы эстераз в зрелых семенах редьки посевной и на основе полученных данных построили дендрограммы, определяющие филогенетические отношения образцов из мировой коллекции ВИР и соответствующие их ботаническому, агробиологическому и географическому положению. Была установлена средняя гетерозиготность изоферментных форм эстераз в изученных образцах и их дисперсия, указывающие на достоверность полученных результатов. Цель работы - оценить полиморфизм эстераз в зрелых семенах редьки, его зависимость от происхождения и агробиологической принадлежности образцов, а также возможность использования эстераз в качестве биохимических маркеров разнообразия вида Raphanus sativus L. Из коллекции Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (ВИР) были отобраны 49 образцов редьки, принадлежащие к трем подвидам, разделенным по географическому принципу, - редька китайская, японская и европейская. Эстеразные изоферменты разделяли методом нативного электрофореза в полиакриламидном геле. Для обнаружения изоферментов гель отмывали в реактиве на неспецифическую эстеразу. Полученные зимограммы сканировали (Epson Expression 10000XL, «GE Healthcare», США). Определяли гетерозиготность популяции Hl по каждому локусу, среднюю (общую) гетерозиготность Hобщ. , дисперсии гетерозиготности Var(Hl) по каждому локусу и дисперсию средней гетерозиготности внутри популяции Var(Hобщ.). Основными морфологическими и фенологическими маркерами для внутривидового деления R. sativus на разновидности и сортотипы были форма и окраска корнеплода и продолжительность вегетационного периода. По своему эстеразному составу все образцы подразделились на 7 зимотипов, отличающихся наличием или отсутствием тех или иных зон. Всего в эстеразном комплексе семян редьки было обнаружено 5 основных изоферментов с разной молекулярной массой, варьирующей от 45,3 кД до 35,0 кД. Все пять зон характеризовались высокой степенью полиморфизма среди представленных образцов. В зимотип № 1, представленный максимальным количеством эстераз (пять зон), входили 43 % от общего числа генотипов. Зимотип № 2 составляли 33 % образцов. Самые редкие зимотипы № 5 и № 7 (4 %) имели минимальное количество эстеразных ферментов - по две зоны, зимотипы № 2 и № 4 - по четыре зоны, представители зимотипов № 3 и № 6 - по три зоны. Количественное соотношение эстеразных зон в образцах сильно варьировало. Минимальное содержание было выявлено для зоны В5 (4,78 %), максимальное (67,44 %) - для зоны В1. Степень распространенности каждой зоны среди образцов составляла от 13 до 23 %. Самыми часто встречающимися среди всех эстеразных изоферментов были зона В3 (Mr = 39,7 кД) и В4 (Mr = 37,1 кД), они наблюдались у 23 % генотипов. Для 22 % представителей была характерна зона В2 (Mr = 42,9 кД). Зоны В1 (Mr=45,3 кД) и В5 (Mr = 35 кД) встречались реже - 19 и 13 %. Средняя гетерозиготность изоферментных форм эстераз изученных образцов редьки составила Hобщ. = 0,212, дисперсия для тех же образцов Var ( Hобщ. ) = 0,0007. Кластерный анализ эстеразных ферментов разделил изученный набор образцов редьки на европейские и азиатские подвиды и разновидности, а в совокупности с фенотипическими признаками позволил построить дендрограмму, соответствующую ботаническому, агробиологическому и географическому положению образцов. Следует отметить, что образцы редьки европейского подвида расположились в двух кластерах, причем образцы российского происхождения формировали отдельную группу в первом кластере, а образцы европейского происхождения входили в третий кластер, включающий также японские редьки европейского происхождения. Возможно, такое деление связано с особенностями селекции этих образцов. На основании полученных данных эстеразные ферменты рекомендуются в качестве биохимических маркеров в генетико-селекционных экспериментах.
Raphanus sativus l, морфологические признаки, фенологические признаки, семена, эстеразы, изоформы, зимотипы, полиморфизм, биохимические маркеры, кластеризация
Короткий адрес: https://sciup.org/142229438
IDR: 142229438 | УДК: 635.153:577.152.31:577.151.64:582 | DOI: 10.15389/agrobiology.2020.5.956rus
Текст научной статьи Полиморфизм эстеразных изоферментов в зрелых семенах редьки посевной (Raphanus sativus L.)
Вид редька посевная ( Raphanus sativus L.) отличается широким морфологическим разнообразием признаков листовой розетки и корнеплода. Существующие внутривидовые классификации, которыми пользуются в России (1-4), делят вид по географическому принципу в зависимости от региона происхождения (Европа, Китай, Япония). Они основаны главным образом на сильно варьирующих и зависящих от условий выращивания морфологических признаках корнеплода (окраска, форма) гетерогенных и гетерозиготных перекрестноопыляющихся образцов. В связи с этим важно найти дополнительные признаки, которые позволили бы яснее определить ход формообразовательного процесса и филогенетические связи внутри вида.
За последние два десятилетия разработаны ДНК-маркеры (5, 6), генетические карты (7-9) и определена последовательность всего генома японской и китайской редьки (10-12). В ряде работ отмечается эффективность и перспективность использования молекулярных маркеров RAPD (random amplified polymorphic DNA) и ISSR (inter simple sequence repeats), а также некоторых биохимических маркеров для оценки генетической изменчивости сортов редьки (13, 14). Такими биохимическими генетическими маркерами могут быть неспецифичные эстеразы (НЭ) — комплекс ферментов, гидролизующих эфирные связи (ЕС 3.1.1.) (15-17). Известно, что в растениях эстеразный комплекс имеет внутривидовую специфичность, кроме того, этим ферментам свойственна тканевая специфичность (18-20).
Из-за способности гидролизовать поперечные связи полисахаридов НЭ важны в создании и реорганизации клеточных стенок. Активность и изоферментный состав НЭ играют значительную роль в определенных механизмах взаимодействия растения-хозяина с патогеном (21-23), в метаболизме жирных кислот (24) и сложных эфиров холина (25). Неспецифические эстеразы также вовлечены в формирование устойчивости растений к гербицидам (26).
Показано, что активность НЭ, тесно связанная с физиологическим и метаболическим состояниями клетки, служит индикатором токсического эффекта загрязняющих веществ (27, 28). Факторы окружающей среды, в частности температура культивирования (29) и водный стресс (30), также влияют на активность НЭ, то есть эстеразы можно рассматривать и как потенциальные стресс-маркеры.
Коллекция Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (ВИР) включает 1200 образцов редьки R. sativus из 75 стран всех континентов, в том числе 573 образца в постоянном каталоге, все подвиды, разновидности и сортотипы культуры.
Мы впервые исследовали изоферментные формы эстераз в зрелых семенах редьки посевной и на основе полученных данных построили дендрограммы, определяющие филогенетические отношения образцов из мировой коллекции ВИР и соответствующие их ботаническому, агробиологическому и географическому положению. Была установлена средняя гетерозиготность изоферментных форм эстераз в изученных образцах и их дисперсия, указывающие на достоверность полученных результатов.
Цель работы — оценить полиморфизм эстераз в зрелых семенах редьки, его зависимость от происхождения и агробиологической принадлежности образцов, а также возможность использования эстераз в качестве биохимических маркеров разнообразия вида Raphanus sativus L.
Методика. Зрелые семена восьми разновидностей вида Raphanus sa-tivus L . (всего 49 генотипов) различного происхождения (коллекция ВИР) растирали в фарфоровой ступке до состояния муки. В пробирки типа эп-пендорф вносили по 100 мг полученной муки и приливали по 2 мл предварительно охлажденного гексана. Образцы периодически встряхивали и оставили на ночь в холодильнике при 4-8 °С. На следующий день пробирки центрифугировали (Eppendorf centrifuge 5410, «Eppendorf AG», Германия) 10 мин при 15000 об/мин, надосадочную жидкость удаляли, а осадок обезжиренной муки оставляли под тягой для высушивания на воздухе. Эстеразные ферменты из обезжиренного и высушенного растительного материала экстрагировали 0,05 М Трис-HCl буфером (соотношение му-ка:буфер — 1:4) при pH 8,3 и 4-8 °С на протяжении 14-18 ч. После центрифугирования при 15000 об/мин в течение 10 мин ферментные вытяжки сливали с осадка и замораживали при -20 °С. Образцы размораживали перед проведением электрофореза и вносили в карманы концентрирующего геля.
Эстеразные изоферменты разделяли методом нативного электрофореза в полиакриламидном геле (31) с концентрациями разделяющего и концентрирующего геля соответственно 11 и 5 %. Для электрофореза использовали камеру Мini-PROTEAN Tetra Cell («Bio-Rad Laboratories, Inc.», США). Концентрацию белков в ферментных вытяжках оценивали методом M.M. Bradford (32). Для определения молекулярных масс исследуемых ферментов в последний карман геля вносили маркер Prestained Protein Ladder («Thermo Scientific», США). Все образцы вносились в карманы геля по 1520 мкл в зависимости от концентрации белка в ферментной вытяжке. Электрофорез проводили при 6-10 °С и 10 B/см в течение 2,5 ч. Для обнаружения изоферментов гель отмывали в реактиве на неспецифическую эстеразу (33) в течение 10-15 мин до проявления зон. Для этого гель флотировали в свежем растворе красителя и субстратов, состоящем из 100 мг а-нафти-лацетата и 120 мг р-нафтилацетата («Sigma-Aldrich Chemie GmbH», Швейцария), растворенных в 10 мл 70 % этанола, 500 мг Fast Blue RR («Sigma-Aldrich Со.», США), 4 мл пропанола и 60 мл 0,1 М фосфатного буфера (рН 6,0). Остатки красителя удаляли 7 % уксусной кислотой.
Полученные зимограммы сканировали (Epson Expression 10000XL, «GE Healthcare», США). Расчет количественного соотношения всех зон, обнаруженных в треке, и определение молекулярных масс по соответствующим стандартам на основе показателя Rf рассчитывали в программе Phoretix 1D Advansed («TotalLab, Ltd.», Великобритания).
Гетерозиготность популяции H l по каждому локусу, а также среднюю (общую) гетерозиготность H общ. вычисляли по формулам (34, 35):
H t = 2п(1-’£кх ^ )/2п-1 , НО бщ, = X i=i Hjr , где l — порядковый номер локуса, n — размер популяции, x k — частота k -го аллеля l -го локуса, r — общее число локусов.
Рассчитывали дисперсии гетерозиготности Var ( H l ) по каждому локусу и дисперсию средней гетерозиготности внутри популяции Var ( H общ. ) (36):
Var(Hi) = Hl(1-Hl)/n ,
Уаг(НО бщ ) = ^M(1 - H) + ^^-(H ,,- - HA) .
Морфологическое и агробиологическое описание образцов проводили по Л.В. Сазоновой с соавт. (37) (научно-производственная база «Пушкинские и Павловские лаборатории ВИР», г. Санкт-Петербург).
Основными морфологическими и фенологическими маркерами для внутривидового деления R. sativus на разновидности и сортотипы были форма и окраска корнеплода и продолжительность вегетационного периода (1, 37). При построении матрицы для кластерного анализа использовали следующие количественные и качественные признаки: длина и диаметр корнеплода, индекс корнеплода (отношение длины к диаметру), окраска поверхности коры корнеплода (1 — белая, 3 — зеленая, 5 — розовая, 7 — красная, 9 — черная), форма корнеплода (2 — коническая, 3 — цилиндрическая, 4 — эллиптическая, 5 — округлая, 6 — плоскоокруглая, 7 — цилиндрическая со сбегом вверх), тип листа (1 — цельный, 3 — лировидный), опушенность листовой пластинки (0 — без опушения, 1 — опушенный), продолжительность вегетационного периода. Качественные признаки оценивали в баллах согласно дескриптору (38).
Кластерный анализ образцов по результатам анализа только эстеразных ферментов и комплекса признаков (морфологических, фенологических и эстеразного состава семян) выполняли методом UPGMA с использованием программы PAST , включая bootstrap-анализ.
Результаты. Список образцов редьки, изученных в работе, представлен в таблице 1.
1. Список образцов редьки посевной Raphanus sativus L. (коллекция Всероссийского института генетических ресурсов растений им. Н.И. Вавилова — ВИР), у которых был изучен полиморфизм эстераз в зрелых семенах Номер в каталоге ВИР Название образца Происхождение Группа разновидностей (convar.) Разновидность (var.) Номер на зимо грамме к-1675 Р е д ь к а е в р о п е й с к а я R. sativus subsp. sativus (L.) Sazon. Белая Аджарская Грузия sativus Sazon. sativus Sazon. 3 к-1833 Одесская 5 Белоруссия sativus Sazon. sativus Sazon. 7 к-2163 Майская белая Россия sativus Sazon. sativus Sazon. 44 к-1778 Зимняя круглая черная Германия hybernus (Alef.) Sazon. niger (L.) Sinsk. 4 к-1892 Dazwish ali Египет hybernus (Alef.) Sazon. niger (L.) Sinsk. 9 к-1971 Round Black Spanish США hybernus (Alef.) Sazon. niger (L.) Sinsk. 15 к-1764 Местная Россия hybernus (Alef.) Sazon. niger (L.) Sinsk. 26 к-2115 Черная Россия hybernus (Alef.) Sazon. niger (L.) Sinsk. 35 к-2124 Турция hybernus (Alef.) Sazon. niger (L.) Sinsk. 36 к-1914 Зимняя круглая белая Россия hybernus (Alef.) Sazon. hybernus (Alef.) Sazon. 28 к-2025 Сквировская белая Украина hybernus (Alef.) Sazon. hybernus (Alef.) Sazon. 32 к-698 Редька китайская Малая Азия R. sativus subsp. sinensis Sazon. et Stankev. lobo Sazon. et Stankev. lobo Sazon. et Stankev. 1 к-1805 Средняя Азия lobo Sazon. et Stankev. lobo Sazon. et Stankev. 5 к-1902 Белая зеленоголовая Китай lobo Sazon. et Stankev. lobo Sazon. et Stankev. 11 к-1978 Местная Киргизия lobo Sazon. et Stankev. lobo Sazon. et Stankev. 16 к-2101 Chinese White Winter Чили lobo Sazon. et Stankev. lobo Sazon. et Stankev. 21 к-2074 Местная Египет lobo Sazon. et Stankev. lobo Sazon. et Stankev. 33 к-2151 Altari mu Южная Корея lobo Sazon. et Stankev. lobo Sazon. et Stankev. 39 к-1815 Маргиланская Узбекистан lobo Sazon. et Stankev. virens Sazon. 6 к-1865 Вэй-сян Китай lobo Sazon. et Stankev. virens Sazon. 8 к-2000 Местная Узбекистан lobo Sazon. et Stankev. virens Sazon. 17 к-2148 Местная Казахстан lobo Sazon. et Stankev. virens Sazon. 38 к-725 Малая Азия lobo Sazon. et Stankev. rubidus Sazon. 2 к-1895 Хун-дын-лун Китай lobo Sazon. et Stankev. rubidus Sazon. 10 к-1903 Красная Китай lobo Sazon. et Stankev. rubidus Sazon. 12 к-1935 Nerima Pointed rooted Япония lobo Sazon. et Stankev. rubidus Sazon. 13 к-1857 Чан-шун-лобо Китай lobo Sazon. et Stankev. rubidus Sazon. 27 к-1967 Местная Афганистан lobo Sazon. et Stankev. rubidus Sazon. 30 к-1983 Нежная Россия lobo Sazon. et Stankev. rubidus Sazon. 31 к-1958 Р е д ь к а я п о н с к а я R. Hakata haruwaka Япония sativus subsp. acanthiformis (Blanch) Stankev. minowase (Kitam.) Sazon. minowase Kitam. 14 к-2033 Turnip Япония minowase (Kitam.) Sazon. minowase Kitam. 18 к-2063 Unzen shigatsu Япония minowase (Kitam.) Sazon. minowase Kitam. 20 к-2111 Минотоки ¹2 Япония minowase (Kitam.) Sazon. minowase Kitam. 22 к-1946 Unsen-4-gatsu Япония minowase (Kitam.) Sazon. minowase Kitam. 29 к-2134 Eifuku 2 Япония minowase (Kitam.) Sazon. Minowase Kitam. 37
Продолжение таблицы 1
|
к-2154 |
Mikura gross F1 |
Нидерланды |
minowase (Kitam.) Sazon. minowase Kitam. |
40 |
|
к-2155 |
Местная |
Япония |
minowase (Kitam.) Sazon. minowase Kitam. |
41 |
|
к-2159 |
Ясато рисо F1 |
Япония |
minowase (Kitam.) Sazon. minowase Kitam. |
42 |
|
к-2161 |
Хорийоу |
Япония |
minowase (Kitam.) Sazon. minowase Kitam. |
43 |
|
к-2184 |
Cheng sugeng zung |
Южная Корея |
minowase (Kitam.) Sazon. minowase Kitam. |
47 |
|
к-2335 |
April cross |
Франция |
minowase (Kitam.) Sazon. minowase Kitam. |
48 |
|
к-2336 |
Spring Feller |
Япония |
minowase (Kitam.) Sazon. minowase Kitam. |
49 |
|
к-2034 |
Миясигэ Оонага |
Япония |
acanthiformis (Blanch) Stankev. – |
19 |
|
к-2133 |
Eifuku |
Япония |
acanthiformis (Blanch) Stankev. – |
23 |
|
к-2136 |
Shinuchi Sobutori F 1 |
Япония |
acanthiformis (Blanch) Stankev. – |
24 |
|
к-2177 к-2093 |
Back-ok Mijshige long pointed rooted |
Южная Корея Япония |
acanthiformis (Blanch) Stankev. – acanthiformis (Blanch) Stankev. – |
25 34 |
|
к-2175 |
Sodam |
Южная Корея |
acanthiformis (Blanch) Stankev. – |
45 |
|
к-2178 |
Shinmyeong |
Южная Корея |
acanthiformis (Blanch) Stankev. – |
46 |
Прим еч ани е. Прочерки означают, что разновидности не выделены.
При помощи нативного электрофореза в семенах 49 генотипов редьки были выявлены пять основных изоферментов эстераз: B1 (молекулярная масса 45,3 кД), B2 (42,9 кД), B3 (39,7 кД), B4 (37,1 кД), B5 (35,0 кД) (рис. 1). Все пять зон характеризовались полиморфизмом среди представленных образцов (табл. 2). Мономорфных зон (то есть присутствующих во всех образцах) мы не обнаружили.
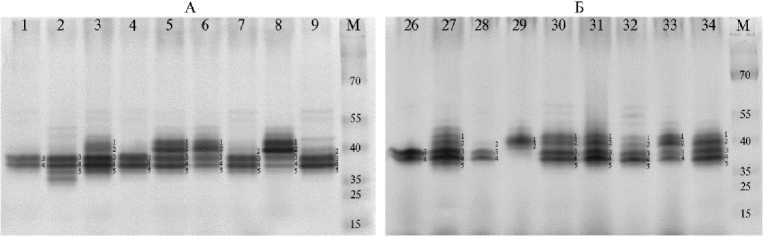
Рис. 1. Зимограммы эстеразных ферментов в зрелых семенах редьки посевной Raphanus sativus L . (коллекция Всероссийского института генетических ресурсов растений им. Н.И. Вавилова — ВИР) . Вдоль дорожек справа обозначены зоны эстераз, над дорожками указаны номера образцов в соответствии с таблицей 1. М — маркеры молекулярных масс (15-70 кД; Prestained Protein Ladder, «Thermo Scientific», США).
-
2. Эстеразный состав зимотипов в зрелых семенах редьки посевной Rahanus sa-tivus L. (коллекция Всероссийского института генетических ресурсов растений им. Н.И. Вавилова — ВИР)
Зимотип
B1
(45,3 кД)
B2
(42,9 кД)
B3
(39,7 кД)
B4
(37,1 кД)
B5
(35,0 кД)
Общее
число зон
¹ 1
+
+
+
+
+
5
¹ 2
+
+
+
+
4
¹ 3
+
+
+
3
¹ 4
+
+
+
+
4
¹ 5
+
+
2
¹ 6
+
+
+
3
¹ 7
+
+
2
Всего
38
45
48
48
26
205
Частота зоны, %
19
22
23
23
13
100
3. Распределение образцов зрелых семян редьки посевной
Rahanus sativus
L.
(коллекция Всероссийского института генетических ресурсов растений им. Н.И. Вавилова — ВИР)
по эстеразным зимотипам
4. Количественное содержание эстеразных изоферментов в зрелых семенах редьки посевной
Rahanus sativus
L.
(коллекция Всероссийского института генетических ресурсов растений им. Н.И. Вавилова — ВИР)
По эстеразному составу все образцы были разделены на семь зимотипов, отличающихся друг от друга наличием или отсутствием тех или иных зон (табл. 2, 3).
Количественное соотношение эстеразных зон в исследованных образцах сильно варьировало (табл. 4). Распространенность каждой зоны составляла от 13 до 23 %. Минимальное содержание было выявлено для зоны
В5 (4,78 %), максимальное — для В1 (67,44 %). Среднестатистическое значение содержания эстеразных изоферментов варьировало от 11,48 (для зоны В5) до 29,28 % (для зоны В3).
|
Зимотип |
Число зон в зимотипе |
Номера образцов на зимограмме |
Всего генотипов |
Доля от общего числа генотипов, % |
|
¹ 1 (B1-B5) |
5 |
3, 5, 6, 8, 10-14, 16, 17, 23, 24, 27, 30-32, 34, 38, 40, 48 |
21 |
43 |
|
¹ 2 (B1-B4) |
4 |
18-22, 25, 33, 36, 37, 39, 41, 42, 44-46, 49 |
16 |
33 |
|
¹ 3 (B2-B4) |
3 |
28, 35, 43, 47 |
4 |
8 |
|
¹ 4 (B2-B5) |
4 |
7, 9, 15 |
3 |
6 |
|
¹ 5 (B3-B4) |
2 |
1, 26 |
2 |
4 |
|
¹ 6 (B3-B5) |
3 |
2, 4 |
2 |
4 |
|
¹ 7 (B1-B2) |
2 |
29 |
1 |
2 |
П р и м е ч а н и е. Описание образцов см. в таблице 1, эстеразный состав зимотипов см. в таблице 2.
|
Показатель |
В1 |
1 В2 |
1 В3 |
1 В4 |
1 В5 |
|
M r , кД |
45,3 |
42,9 |
39,7 |
37,1 |
35,0 |
|
Мin, % |
7,06 |
7,78 |
16,77 |
8,74 |
4,78 |
|
Мах, % |
67,44 |
39,91 |
54,22 |
52,10 |
25,96 |
|
Среднее, % |
20,11 |
25,16 |
29,28 |
26,60 |
11,48 |
|
П р и м е ч а н и е. M r — личество. |
молекулярная масса, Мin — |
минимальное |
количество, Мах — |
максимальное ко- |
|
К зимотипу ¹ 1 (5 зон эстераз) относились 43 % от общего количества генотипов. Основная часть этой группы была представлена образцами китайского подвида зеленой (var. virens Sazon.), розово-красной (var. rubidus Sazon.) и белой (var. lobo ) разновидностей из Китая и Средней Азии. Кроме того, в эту группу входили шесть образцов японской редьки европейского и японского происхождения и образец летней европейской редьки. Зимотип ¹ 2 (4 зоны) был характерен для 33 % изученных образцов. В эту группу вошли в основном образцы редьки японского подвида из Японии и Южной Кореи, несколько генотипов лобы белой разновидности из Египта и Чили и два образца европейской летней и зимней редьки. Зимотип ¹ 3 (3 зоны) был представлен двумя образцами зимней европейской редьки из России и двумя образцами дайкона осеннего типа и составил 8 % от всех генотипов. Зимотип ¹ 4 (4 зоны) составили три образца (6 %) европейской редьки, в то время как зимотипы ¹ 5 (2 зоны) и ¹ 6 (3 зоны) включали по два образца (4 %) — местные лобы малоазиатского происхождения и зимние черные редьки. Наименее распространенным, то есть имеющим самый редкий состав эстераз, оказался один образец дайкона Unzen-4-gatsu (к-1946, Япония), принадлежащий к зимотипу ¹ 7 (2 зоны). Частота встречаемости такого зимотипа составила 2 %.
Определение частоты гетерозигот — один из важнейших этапов исследования популяции, поскольку каждая гетерозигота несет разные аллели и иллюстрирует наличие изменчивости. Следует отметить, что чем меньше разница между величинами частот аллелей локуса, тем выше получаемое значение гетерозиготности по этому локусу. По результатам проведенного нами подсчета самое большое значение гетерозиготности Hl = 0,503 было установлено у изоформы B5 (табл. 5). У изоформ В3 и В4 было выявлено всего по одному полиморфному аллелю и, соответственно, значения гетерозиготности оказались самыми низкими (по Hl = 0,039). Дисперсия — это зависимая от гетерозиготности величина, и потому выявленные для гетерозиготности закономерности аналогичны таковым для дисперсии. Применение формулы расчета дисперсии средней гетерозиготности (36) обусловлено ковариациями между гетерозиготностями по локусам l и Z, определяемыми частотами двойных гетерозигот HL-L по этим локусам.
-
5. Результаты расчета гетерозиготности популяции и дисперсии гетерозиготности у образцов редьки посевной Rahanus sativus L. (коллекция Всероссийского института генетических ресурсов растений им. Н.И. Вавилова — ВИР) по результатам изоферментного анализа
Статистический показатель
Изоферментные локусы (зоны эстераз)
B1
B2 B3 B4
B5
Гетерозиготность H l 0,328 0,152 0,039 0,039 0,503
Дисперсия Var ( H l ) 0,004 0,002 0,001 0,001 0,005
П р и м еч а ни е. Средняя гетерозиготность H общ. — 0,212, дисперсия средней гетерозиготности внутри популяции Var ( H общ. ) — 0,0007.
67,5 60,0
_______11_______
52,5 _______L_______
Генетическое расстояние
45,0 37,5 30,0 22,5 10,0 7,5
I I i 1 I i
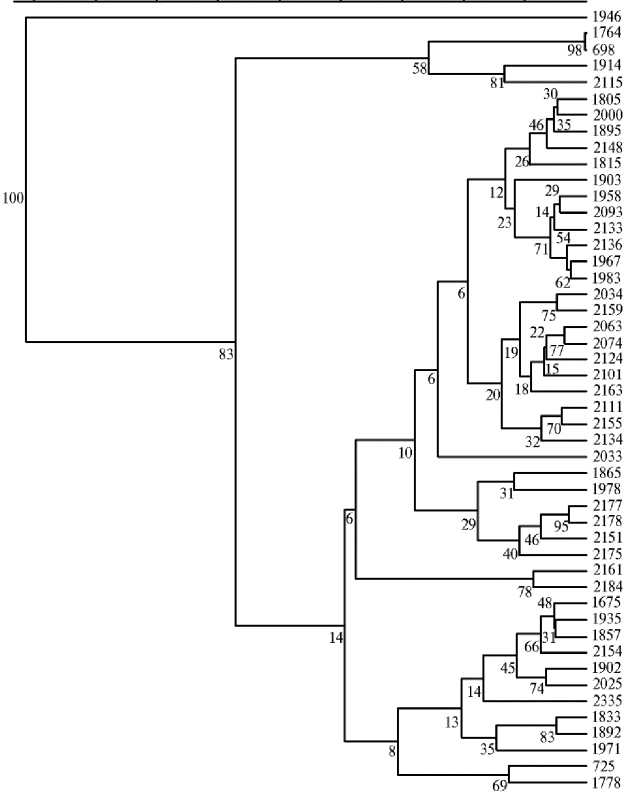
Рис. 2. UPGMA-дендрограмма, характеризующая степень генетического сходства образцов редьки посевной Rahanus sativus L. (коллекция Всероссийского института генетических ресурсов растений им. Н.И. Вавилова — ВИР) по эстеразному составу семян. Значения bootstrap-анализа на ветвях древа указывают расстояния связывания. Описание генотипов (номера справа) представлено в таблице 1.
Необходимо отметить, что использованные в нашей работе формулы дают возможность решить любой многочлен в наборе переменных, распределенных мультиноминально, и рассчитываемая гетерозиготность расценивается как мера информационного полиморфизма, активно применяемая при составлении и реализации генетико-селекционных программ.
В целом по результатам изоферментного анализа было найдено 205 электрофоретических полос изоформ эстераз, которые использовали для построения дендрограммы (рис. 2). Образцы редьки оказались сгруппированы в один большой и два малых кластера. При этом образец дайкона Unzen-4-gatsu (к-1946, Япония) занял позицию out-group. Первый малый кластер включал образцы европейских зимних редек из России (var. niger (L.) Sinsk.; var. hybernus ) и местный образец белой лобы из Малой Азии (к-698). Второй большой кластер в основном включал образцы редьки китайского и японского подвида и был разделен на четыре подкластера. Первый подкластер образовывали образцы лобы из России, Афганистана, Китая (var. rubidus Sazon.), Узбекистана и Казахстана (var. virens Sazon.), а также дайконы весеннего и осеннего сортотипов. Второй подкластер включал образцы японских и европейских редек (var. sativus ; var. niger (L.) Sinsk.), лобы из Египта и Чили (var. lobo ). За пределами первых двух подкластеров оказался расположен образец дайкона к-2033. В третий подкластер входили образцы лобы из Южной Кореи, Киргизии, Китая (var. lobo ; var. virens Sazon.) и дайконы из Южной Кореи и Японии, при этом генотипы из Южной Кореи и Японии образовывали две отдельных группы внутри подкластера. Четвертый подкластер включал два образца дайкона из Южной Кореи и Японии.
В третьем кластере на дендрограмме были расположены преимущественно образцы редьки европейского подвида, а также японского подвида, но европейского происхождения. Кластер разделился на два подкластера: в первом находились европейские зимние редьки из Канады и Египта (var. niger (L.) Sinsk.) и летняя редька из Белоруссии (var. sativus ), во втором — дайконы из Франции и Нидерландов, белые европейские редьки из Украины и Грузии (var. hybernus ; var. sativus ) и китайские редьки из Китая и Японии (var. rubidus Sazon.; var. lobo ). За пределами подкластеров остались два образца: зимняя черная редька из Германии и лоба из Малой Азии.
По фенотипическим признакам изученные образцы редьки сгруппировались в пять кластеров (полученная нами дендрограмма не показана, поскольку она соответствовала их ботаническому и агробиологическому делению). В отдельные кластеры вошли образцы зимних и летних европейских редек. Азиатские редьки были представлены двумя кластерами (образцами японского и китайского подвида), причем не отмечалось существенных различий между образцами разного эколого-географического происхождения. Последний кластер объединял несколько образцов лобы из Средней и Малой Азии и Чили и образец дайкона местной сортопопуляции из Японии. То есть филогенетическая картина, полученная при использовании только фенотипических признаков, не совсем полно отражала особенности формообразования изученных образцов редьки.
На дендрограмме, построенной на основе результатов комплексного анализа морфологических и фенологических признаков, включая эстеразный состав семян (рис. 3), присутствовали большой и два малых кластера. За их пределами, как и на рисунке 2, находился японский образец дайкона Unzen-4-gatsu (к-1946). В первом кластере группировались образцы редек европейского подвида, разделенного на два подкластера. Первый включал образцы зимней редьки черной (var. niger (L.) Sinsk.) и белой (var. hybernus) разновидности, второй — генотипы редьки китайской малоазиатского происхождения (к-725, к-698), которые были местными сортопопуляциями.
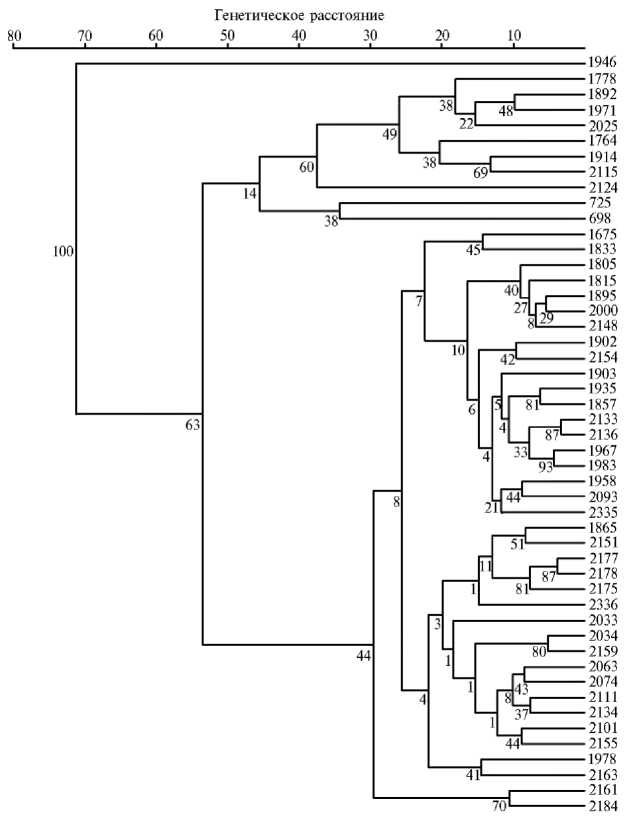
Рис. 3. UPGMA-дендрограмма, характеризующая степень генетического сходства образцов редьки посевной Rahanus sativus L. (коллекция Всероссийского института генетических ресурсов растений им. Н.И. Вавилова — ВИР) по комплексу морфологических и фенологических признаков, включая эстеразный состав семян. Значения bootstrap-анализа на ветвях древа указывают расстояния связывания. Описание генотипов (номера справа) представлено в таблице 1.
Во втором большом кластере располагались образцы китайского и японского подвида, а также летней европейской редьки. Кластер был разделен на четыре подкластера. Первый включал два образца летней европейской редьки (var. sativus) из Белоруссии и Грузии. Во второй входили отдельная группа образцов лобы среднеазиатского происхождения, группа образцов лобы розово-красной разновидности (var. rubidus Sazon.) из Китая, России, Афганистана и дайконы из Японии, Франции и Нидерландов. В третьем подкластере были расположены две большие группы образцов: первая включала генотипы лобы и дайкона из Южной Кореи с примыкающим образцом дайкона из Японии (к-2336), вторая — образцы дайкона из Японии и два образца лобы белой разновидности из Египта (к-2074) и Чили (к-2101). Четвертый подкластер включал лишь два образца: лоба белой разновид- ности из Киргизии (Местная, к-1978) и летняя европейская редька из России (Майская, к-2163). В третьем малом кластере находились два образца дайкона из Японии и Южной Кореи.
Сравнительное изучение образцов редьки по изоферментному составу эстераз позволило выявить внутривидовой полиморфизм и разделить их на семь зимотипов с разным количественным соотношением эстеразных зон. Наличие всех пяти эстеразных зон (зимотип ¹ 1) было характерно в большей степени для образцов китайского подвида, что указывает на большие межсортовые различия внутри подвида. Наличие четырех эстеразных зон (зимотипы ¹ 2 и ¹ 4) наблюдалось в основном у образцов японского и европейского подвида. Три (группы ¹ 3 и ¹ 6) и две (группы ¹ 5 и ¹ 7) эстеразные зоны обнаруживали у образцов европейской зимней редьки из России, дайкона из Японии и Южной Кореи и лобы из Малой Азии. Образцы, принадлежащие к зимотипам ¹ 3 и ¹ 6, были селекционными сортами, созданными предположительно в результате индивидуального отбора из сортопопуляций или посредством гибридизации с последующим отбором. К зимотипам ¹ 5 и ¹ 7 относились образцы местного происхождения, несмотря на это им присуща высокая внутри-сортовая однородность, возможно, их селекция происходила локализовано в определенной местности.
Следовательно, наличие у этих образцов редко встречающихся эстеразных зон связано с особенностями их селекции или агробиологической принадлежностью, что согласуется с результатами других работ (15-17, 39). Так, нами (15-17) впервые была показана возможность использования оценки полиморфизма изоферментных форм эстераз для установления генетического полиморфизма не только у редиса ( Raphanus sativus L.) и линий удвоенных гаплоидов Brassica rapa L., но и у гексаплоидной яровой пшеницы ( Triticum aestivum L.). Схожие результаты были получены и при изучении полиморфизма различных сортов пшеницы ( Triticum L.) (39). Во всех указанных работах выявлен полиморфизм изоферментного профиля эстераз, выделенных из зрелых семян, у образцов сортового, линейного и коллекционного селекционного материала. Показано широкое разнообразие электрофоретических профилей эстеразных изоферментов зрелых семян и установлена возможность определения полиморфизма эстераз в гибридных поколениях. Наряду с полученными нами в настоящем исследовании результатами это позволяет не только выделить перспективный исходный материал для селекции, но и рекомендовать такой тип биохимических маркеров для решения практических задач в качестве средства, способного ускорить и упростить процесс отбора селекционно значимого материала. Тот факт, что аналогичных работ на редисе, редьке посевной, B. rapa , пшенице ранее не проводили, еще раз подчеркивает перспективность использования предложенного нами подхода.
Кластерный анализ эстеразного состава семян показал, что образцы группировались в основном по происхождению и частично в связи с ботанической принадлежностью. Образцы редьки европейского подвида располагались в двух кластерах, причем образцы российского происхождения формировали отдельную группу в первом кластере, а образцы европейского происхождения входили в третий кластер, включающий также японские редьки европейского происхождения. Возможно, такое деление связано с особенностями селекции этих образцов.
Во второй большой кластер азиатских редек попали не только образцы китайского и японского подвида, но и несколько образцов европейского подвида летней и зимней групп разновидностей, что могло быть связано с особенностями формообразования этих образцов или с ошибкой при репродуцировании. Интересно, что южнокорейские образцы, независимо от их ботанической принадлежности, сформировали отдельную группу внутри третьего подкластера, что внесло важное дополнение во внутривидовую дифференциацию.
Таким образом, в отдельные кластеры оказались распределены европейские и азиатские образцы, что подтверждает происхождение разнообразия редек из двух первичных географических центров — Средиземноморского и Азиатского (2, 4).
Кластеризация образцов по комплексу признаков (морфологические, фенологические и эстеразный состав семян) показала результаты, наиболее согласующиеся с ботаническим и агробиологическим делением. Первый кластер включал все образцы зимних европейских редек и две сортопопуляции лобы. Второй большой кластер объединял образцы китайского и японского подвида, а также летней европейской редьки. Летние европейские редьки считаются промежуточными формами между европейской зимней редькой и редисом, а лобы — исходными формами японских редек и китайских редисов. Возможно, эта особенность и объединяет эти две группы разновидностей в один кластер. В третьем кластере была расположена группа образцов лобы и дайкона из Южной Кореи, как и на первой дендрограмме. Это уточнение выявлено благодаря анализу эстеразных ферментов и, вероятно, указывает на множественное происхождение японских редек (3).
Образец дайкона Unzen-4-gatsu (к-1946, Япония) выделился редким наличием эстеразных зон (зимотип ¹ 7) и занял позицию out-group. Он принадлежал к морфологически резко отличному от остальных сортотипу Ниненго, характерной особенностью которого было наличие длинного тонкого корнеплода (длина 50-55 см, диаметр 5-6 см) и крупной розетки листьев (высота 25-30 см, диаметр 35-40 см). Сорта этой группы наиболее устойчивы к заморозкам и стеблеванию (40).
Итак, проведенный биохимический анализ эстераз зрелых семян образцов редьки разного происхождения выявил наличие полиморфизма изоформ этого фермента. Расчет гетерозиготности в каждом локусе H l и общей гетерозиготности популяции H общ. позволил установить наиболее (В5) и наименее (В3 и В4) гетерозиготные изоформы эстераз. Использованные в настоящей работе формулы дают возможность решить любой многочлен в наборе переменных, распределенных мультиноминально. При составлении и реализации генетико-селекционных программ рассчитанная гетерозиготность H общ. = 0,212 и дисперсия для тех же образцов Var ( H общ. ) = 0,0007 могут расцениваться как эффективная мера информационного полиморфизма. Кроме того, проведенный кластерный анализ по эстеразному составу семян, а также фенотипическим признакам показал результаты, наиболее согласующиеся с ботаническим и агробиологическим делением разнообразия редек по происхождению из двух первичных географических центров. Следовательно, эстеразы зрелых семян редьки посевной — удобные биохимические маркеры, которые могут быть использованы при проведении как физиолого-биохимических, так и генетико-селекционных исследований образцов этой культуры.
Список литературы Полиморфизм эстеразных изоферментов в зрелых семенах редьки посевной (Raphanus sativus L.)
- Синская Е.Н. Редис и редька (Raphanus sativus L.). Труды по прикладной ботанике, генетике и селекции, 1928, 19(3): 448-534.
- Синская Е.Н. К генезису культурных форм рода Raphanus L. Труды по прикладной ботанике, генетике и селекции, 1931, 26(2): 3-58.
- Сазонова Л.В. Внутривидовая классификация корнеплодных форм Raphanus sativus L. Труды по прикладной ботанике, генетике и селекции, 1971, 45(1): 42-75.
- Шебалина М.А., Сазонова Л. В. Культурная Флора СССР. Т. 18. Корнеплодные растения (семейство Капустные — репа, турнепс, брюква, редька, редис) /Под ред. В.Т. Красочкина, B.И. Буренина. Л., 1985.
- Tsuro M., Suwabe K., Kubo N., Matsumoto S., Hirai M. Mapping of QTLs controlling root shape and red pigmentation in radish, Raphanus sativus L. Breeding Science, 2008, 58(1): 55-61 (doi: 10.1270/jsbbs.58.55).
- Mun J.H., Chung H., Chung W.H., Oh M., Jeong Y.M., Kim N., Ahn B.O., Park B.S., Park S., Lim K.B., Hwang Y.J., Yu H.J. Construction of a reference genetic map of Raphanus sativus based on genotyping by whole-genome resequencing. Theoretical and Applied Genetics, 2015, 128(2): 259-272 (doi: 10.1007/s00122-014-2426-4).
- Xu L., Wang L., Gong Y., Dai W., Wang Y., Zhu X., Wen T., Liu L. Genetic linkage map construction and QTL mapping of cadmium accumulation in radish (Raphanus sativus L.). Theoretical and Applied Genetics, 2012, 125(4): 659-670 (doi: 10.1007/s00122-012-1858-y).
- Hashida T., Nakatsuji R., Budahn H., Schrader O., Peterka H., Fujimura T., Kubo N., Hirai M. Construction of a chromosome-assigned, sequence-tagged linkage map for the radish, Raphanus sativus L. and QTL analysis of morphological traits. Breeding Science, 2013, 63(2): 218-226 (doi: 10.1270/jsbbs.63.218).
- Yu X., Choi S.R., Dhandapani V., Rameneni J.J., Li X., Pang W., Lee J.Y., Lim Y.P. Quantitative trait loci for morphological traits and their association with functional genes in Raphanus sativus. Frontiers in Plant Science, 2016, 7: 255 (doi: 10.3389/fpls.2016.00255).
- Kitashiba H., Li F, Hirakawa H., Kawanabe T, Zou Z., Hasegawa Y., Tonosaki K., Shirasawa S., Fukushima A., Yokoi S., Takahata Y., Kakizaki T., Ishida M., Okamoto S., Sakamoto K., Shirasawa K., Tabata S., Nishio T. Draft sequences of the radish (Raphanus sativus L.) genome. DNA Research, 2014, 21(5): 481-490 (doi: 10.1093/dnares/dsu014).
- Mitsui Y., Shimomura M., Komatsu K., Namiki N., Shibata-Hatta M., Imai M., Katayose Y., Mukai Y., Kanamori H., Kurita K., Kagami T., Wakatsuki A., Ohyanagi H., Ikawa H., Minaka N., Nakagawa K., Shiwa Y., Sasaki T. The radish genome and comprehensive gene expression profile of tuberous root formation and development. Scientific Reports, 2015, 5: 10835 (doi: 10.1038/srep10835).
- Jeong Y.M., Kim N., Ahn B.O., Oh M., Chung W.H., Chung H., Jeong S., Lim K.B., Hwang Y.J., Kim G.B., Baek S., Choi S.B., Hyung D.J., Lee S.W., Sohn S.H., Kwon S.J., Jin M., Seol Y.J., Chae W.B., Choi K.J., Park B.S., Yu H.J., Mun J.H. Elucidating the triplicated ancestral genome structure of radish based on chromosome-level comparison with the Brassica genomes. Theoretical and Applied Genetics, 2016, 129(7): 1357-1372 (doi: 10.1007/s00122-016-2708-0).
- Ivy N.A., Biswas M.S., Rasul G., Hossain T., Mian M.A.K. Variations of genotypes of radish at molecular level using isozyme analysis for the identification of self-incompatible lines. Global Journal of Biotechnology & Biochemistry, 2010, 5(1): 19-26.
- Cruz S.M., Nery M.C., Pinho E.V, Luiz M. Molecular characterization of radish cultivars. Revista Ciencia Agronómica, 2014, 45(4): 815-822 (doi: 10.1590/S1806-66902014000400020).
- Рудакова А.С., Рудаков С.В., Артемьева А.М., Курина А.Б., Кочерина Н.В., Чесно-ков Ю.В. Изучение полиморфизма эстеразного состава зрелых семян образцов редиса (Raphanus sativus L.) коллекции ВИР. Овощи России, 2017, 5(38): 3-8 (doi: 10.18619/20729146-2017-5-3-8).
- Рудакова А.С., Рудаков С.В., Давыдова Н.В., Мирская Г.В., Журавлева Е.В., Чесно-ков Ю.В. Изоферментный анализ эстераз в зрелых семенах гексаплоидной мягкой пшеницы (Triticum aestivum L.). Сельскохозяйственная биология, 2016, 51(3): 327-334 (doi: 10.15389/agrobiology.2016.3.327rus).
- Рудакова А.С., Рудаков С.В., Артемьева А.М., Фатеев Д.А., Кочерина Н.В., Чесноков Ю.В. QTL картирование изоферментных форм эстераз зрелых семян у Brassica rapa L. Сельскохозяйственная биология, 2019, 54(3): 469-480 (doi: 10.15389/agrobiology.2019.3.469rus).
- Nakagahra M., Okuno K., Vaughan D. Rice genetic resources: history, conservation, investigative characterization and use in Japan. In: Oryza: from molecule to plant /T. Sasaki, G. Moore (eds.). Springer, Dordrecht, 1997: 69-77 (doi: 10.1007/978-94-011-5794-0_7).
- Alexandre F., Morvan, O., Gaffe J., Mareck A., Jauneau A., Dauchel H., Balange A.P., Morvan C. Pectin methylesterase pattern in flax seedlings during their development. Plant Physiology and Biochemistry, 1997, 35(6): 427-436.
- Timonen S., Sen R. Heterogeneity of fungal and plant enzyme expression in intact Scots pine— Suillus bovinus and —Paxillus involutus mycorrhizospheres developed in natural forest humus. New Phytologist, 1998, 138(2): 355-366 (doi: 10.1046/j.1469-8137.1998.00103.x).
- Muarlidharan J., John E., Channamma L., Theerthaprasad D. Changes in esterases in response to blast infection in fingermillet seedlings. Phytochemistry, 1996, 43(6): 1151-1155 (doi: 10.1016/S0031-9422(96)00478-5).
- Pappas A.C., Paplomatas E.J. Pyriculria leaf spot: a new disease of ornamental plants of the family Marantaceae. Plant Desease, 1998, 82(5): 465-469 (doi: 10.1094/PDIS.1998.82.5.465).
- Parker D.M., Koller W. Cutinase and other lipolytic esterases protect bean leaves from infection by Rhizoctonia solani. Molecular Plant-Microbe Interactions, 1998, 11(6): 514-522 (doi: 10.1094/MPMI.1998.11.6.514).
- Aung U.T., McDonald M.D. Changes in esterase activity associated with peanut (Arachis hypogea L.) seed deterioration. Seed Science and Technology, 1995, 23(1): 101-111.
- Miura G.A., Broomfield C.A., Lawson M.A., Worthley E.G. Widespread occurrence of cholin-esterase activity in plants. Physiologia Plantarum, 1982, 56(1): 28-32 (doi: 10.1111/j.1399-3054.1982.tb04895.x).
- Feng P.C.C., Ruff T.G., Rangwala S.H., Rao S.R. Engineering plant resistance to thiazopyr herbicide via expression of a novel esterase deactivation enzyme. Pesticide Biochemistry and Physiology, 1997, 59(2): 89-103 (doi: 10.1006/pest.1997.2312).
- Maier R. Blei und seine Auswirkung auf Aktivitot und multiple Formen der Alpha-Naphtyl-Easterase in bleichteten und verdunkelten pflanzen. Berichte der Deutschen Botanischen Gesellschaft, 1978, 91(1): 339-350.
- Cachot J., Romana L.A., Galgani F. In vivo esterase activity in protoplasts as a bioassay of environmental quality. Aquatic Botany, 1994, 48(3-4): 297-312 (doi: 10.1016/0304-3770(94)90022-1).
- Krasnuk M., Witham F.H., Jung G.A. Hydrolytic enzyme differences in cold-tolerant and cold-sensitive alfalfa. Agronomy Journal, 1978, 70(4): 597-605 (doi: 10.2134/agronj1978.00021962007000040019x).
- Taskakorie A., Clerc M., Thi A.T.P., da Silva J.V. Evidence of esterase activity in cotton leaves: effect of drought on this activity. Comptes rendus del'Academie des Sciences. Serie III. Sciences de la Vie, 2013, 301(6): 343-346.
- Davis B.J. Disc electrophoresis. II. Method and application to human serum proteins. Annals of the New York Academy of Sciences, 1964, 121(2): 404-427 (doi: 10.1111/j.1749-6632.1964.tb14213.x).
- Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding. Analytical Biochemistry, 1976, 72(1-2): 248254 (doi: 10.1016/0003-2697(76)90527-3).
- Meon S. Protein, esterase and peroxidase patterns of Phytophtora isolates from cocoa in Malaysia. Journal of Islamic Academy of Sciences, 1988, 1(2): 154-158.
- Nei M. Estimation of average heterozygosity and genetic distance from a small number of individuals. Genetics, 1978, 89(3): 583-590.
- Lefevre F., Charrie A. Isozyme diversity within African Manihot germplasm. Euphytica, 1992, 66(1): 73-80 (doi: 10.1007/BF00023510).
- Вейр Б. Анализ генетических данных. М., 1995.
- Сазонова Л.В., Власова Э.А. Методические указания по изучению и поддержанию мировой коллекции корнеплодов. Л., 1989.
- IBPGR. Descriptors for Brassica and Raphanus. International Board for Plant Genetic Resources, Rome, Italy, 1990.
- Шаяхметов И.Ф., Ахмадиева А.А., Леонова С.А., Никонов В.И. Использование молеку-лярно-множественных форм белков в изучении полиморфизма сортов пшеницы (Triticum L.). Вестник Башкирского университета, 2012, 17(1): 89-93.
- Курина А.Б., Корнюхин Д.Л., Артемьева А.М. Генетическое разнообразие и биохимическая ценность корнеплодных овощных растений семейства Капустные (Brassicaceae Burnett). Вестник Новосибирского государственного аграрного университета, 2018, 4(49):81-92 (doi: 10.31677/2072-6724-2018-49-4-81-92).


