Полиморфизм реакции проростков пшенично-пырейных гибридов на засолени
Автор: Крупин П.Ю., Дивашук М.Г., Баженов М.С., Гриценко Л.А., Тараканов И.Г., Упелниек В.П., Белов В.И., Почтовый А.А., Старикова Е.В., Кхуат Тхи май Л., Климушина М.В., Давыдова А.Н., Карлов Г.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Молекулярное маркирование и селекция
Статья в выпуске: 5 т.48, 2013 года.
Бесплатный доступ
Пшеница относится к растениям-гликофитам, которые не способны расти в условиях засоления. Один из подходов к повышению продуктивности земель, страдающих от засоления, заключается в создании устойчивых сортов, что предполагает поиск доноров генов устойчивости среди видов дикорастущих сородичей пшеницы, включая пырей (Thinopyrum). Нами проведена оценка 10 образцов пшенично-пырейных гибридов на устойчивость к засолению на основании измерения скорости роста корня и листа на 3-и и 7-е сут проращивания из семян в контроле (вода) и водном растворе NaCl (100, 150 или 200 мM). В результате выделены образцы со стабильно высоким, средним и низким угнетением роста, а также с варьирующейся ответной реакцией в зависимости от концентрации соли, дня испытания или органа. На основе ПЦР маркеров iPBS, RAPD и ISSR проведено определение генетических расстояний между исследуемыми образцами. Образцы сформировали кластеры 2087 и М-3202 (стабильно высокая устойчивость корня), 2087, 4082 и 548 (стабильно средняя устойчивость листа), 4082 и М-12 (стабильно низкая устойчивость корня) (можно предположить наличие у этих пар разных генетических систем, обеспечивающих близкий тип ответной реакции листа или корня); ЗП-26 и 4044 (устойчивость варьировалась от слабой до средней, возможно, пара обладает сходными механизмами солеустойчивости и регулирующими их генами).
Пшеница, пырей, пшенично-пырейные гибриды, устойчивость к засолению, полимеразная цепная реакция, молекулярный маркер, генетическое расстояние
Короткий адрес: https://sciup.org/142133442
IDR: 142133442 | УДК: 633.1:574.24:
Текст научной статьи Полиморфизм реакции проростков пшенично-пырейных гибридов на засолени
Повысить продуктивность земель, страдающих от засоления, можно либо с помощью их мелиорации, либо создавая устойчивые сорта. Второй подход предполагает поиск доноров генов устойчивости среди видов дикорастущих сородичей пшеницы, включая пырей (Thinopyrum). Представители этого рода эволюционно формировались в экстремальных условиях (засуха, засоление). Многочисленные исследования продемонстрировали возможность использования различных видов пырея в качестве доноров со- леустойчивости. Было установлено, что замещение хромосом пшеницы хромосомами 3E и 7E пырея удлиненного Thinopyrum elongatum в геноме мягкой пшеницы увеличивает калий-натриевую селективность тканей (4). Известно о возрастании толерантности пшеницы к осмотическому стрессу у генотипов в присутствии короткого плеча хромосомы 1E (5) и ее снижении в присутствии длинного плеча чужеродной хромосомы 2-й гомеологичной группы (5-7). W.C. Botes и G.F. Marais (8) показали повышенную соле-устойчивость линий тритикале, дополненных по хромосомам Th. distchum (по убыванию) 3J, 5J и 7J. Факторы, отвечающие за экспорт ионов натрия из клетки, локализованы на хромосоме Th. bessarabicum 5J (9). Среди видов пырея устойчивостью к засолению выделяется также пырей понтийский Th. ponticum (10, 11). На его основе были созданы интрогрессивные формы мягкой пшеницы, устойчивые к засолению (12, 13).
В Отделе отдаленной гибридизации Главного ботанического сада (ГБС) им. Н.В. Цицина РАН получена коллекция октаплоидных пшенично-пырейных гибридов (ППГ). Образцы ППГ различаются по морфологическим признакам (плотность колоса, цвет соломины и др.), скороспелости, многолетности, способности к отрастанию, устойчивости к полеганию и ржавчине, глубине покоя семян, а также по составу запасных белков и хлебопекарным качествам (14-16). Эти формы появились в процессе последовательной гибридизации различных сортов мягкой пшеницы, пырея среднего (2 n = 42) и пырея понтийского (2 n = 70). Следовательно, среди большого разнообразия ППГ можно ожидать присутствия форм, устойчивых к засолению.
Геном октаплоидных ППГ представлен, как правило, 42 хромосомами пшеницы и 14 хромосомами пырея, при этом каждый образец ППГ несет индивидуальную комбинацию хромосом пырея, а следовательно, свой набор генов пырейного происхождения и их аллелей (17), и устойчивость ППГ к засолению может быть обусловлена различными либо одинаковыми генетическими системами. Перенос пырейных генов из октаплоидного ППГ в геном пшеницы осуществляется значительно легче, чем непосредственно из пырея. Поэтому поиск солеустойчивых форм ППГ, их изучение как потенциальных доноров пырейных генов солеустойчивости и использование найденных доноров в селекции пшеницы позволит получить желаемый результат в более короткие сроки.
Для того чтобы определить степень сходства генотипов, обычно используют маркеры, основанные на полимеразной цепной реакции (ПЦР-маркеры). Системы маркеров iPBS (inter primer binding site), RAPD (random amplification of polymorphic DNA) и ISSR (inter-simple sequence repeat) не требуют предварительного знания нуклеотидной последовательности исследуемого генома и основаны на ПЦР с одним праймером. В результате ПЦР с этого праймера амплифицируется большое число полиморфных фрагментов, благодаря чему упомянутые маркерные системы широко используются для изучения наследственного разнообразия.
Цель исследования состояла в определении реакции проростков образцов пшенично-пырейных гибридов на засоление водной среды хлоридом натрия и оценке их генетического разнообразия с помощью молекулярных маркеров.
Методика . Объектом исследования послужили следующие образцы озимых пшенично-пырейных гибридов (получены в ГБС): ЗП-26 (сорт Останкинская), М-12, 4044, 1876, 2087, 548, 5542, М-3202 (сорт Истра 1), 4082, 4015; также в схему опыта были включены сорта мягкой пшеницы
Triticum aestivum Айвина (селекции Краснодарского НИИ сельского хозяйства им. П.П. Лукьяненко) и Немчиновская (селекции НИИ сельского хозяйства Центральных районов Нечерноземной зоны).
Для предотвращения развития микроорганизмов поверхность семян десяти образцов ППГ и двух сортов пшеницы предварительно обрабатывали 10 мин 5 % раствором гипохлорита натрия. Стерилизующий раствор отмывали дистиллированной водой в течение 30 мин. В чашку Петри в зависимости от варианта наливали по 8 мл воды (контроль) либо раствора хлорида натрия (100, 150 или 200 мМ), помещали 25 семян и проращивали в течение 3 сут в термошкафу при 22 ° С. Опыт проводили в 3-кратной повторности. На 3-и сут бережно в стерильных условиях измеряли длину корня и 1-го настоящего листа, после чего проросток возвращали в чашку Петри. На 7-е сут проросток извлекали и повторно определяли длину корня и листа.
Для ПЦР-анализа ДНК выделяли CTAB-методом из этиолированных проростков по методу R. Bernatzky и S.D. Tanksley (18). ПЦР проводили в объеме смеси 25 мкл. ПЦР-смесь включала 2,5 мкл буферного раствора для Taq-полимеразы (10х), содержащего Трис-HCl (700 мМ, pH 8,6), (NH4)2SO4 (166 мМ), MgCl2 (25 мМ), 2,5 мкл 10х раствора dNTP (по 2,5 мМ дезоксинуклеотидтрифосфатов dATP, dCTP, dGTP, dTTP), 25 пкмоль соответствующего праймера, 1,25 ед. Taq-полимеразы и 100 нг матричной ДНК. Для проведения ПЦР использовали следующие условия. Программа для амплификации iPBS: 95 ° С 3 мин; 30 циклов — 95 ° С 15 с, Tm 1 мин, 72 ° С 1 мин; 72 ° С 5 мин; 4 ° С (хранение). Программа для амплификации RAPD: 94 ° С 4 мин, 5 циклов — 92 ° С 30 с, 35 ° С 2 мин, 72 ° С 90 с; 35 циклов — 92 ° С 5 с, Tm 20 с, 92 ° С 90 с, 72 ° С 5 мин; 4 ° С (хранение). Температура отжига Tm указана в таблице 1. Для всех ISSR-праймеров применяли единую программу амплификации: 94 ° С 5 мин; 45 циклов — 94 ° С 30 с, 55 ° С 45 с, 72 ° С 2 мин; 72 ° С 2 мин; 4 ° С (хранение). Полученные в результате ПЦР фрагменты ДНК разделяли в 1,5 % агарозном геле при напряженности поля 6 В/см.
Кластеризацию образцов по фенотипу и генотипу проводили в программе Past (19) с помощью вычисления евклидовых расстояний.
При статистической обработке данных анализа реакции проростков ППГ на засоление учитывали только выборки с числом проанализированных растений не менее пяти. Кроме того, результаты исключали, если корень или лист не достигли длины 5 мм на 3-и сут и 10 мм — на 7-е сут испытания. После такой браковки данных проверяли наличие «сомнительных» результатов измерений с помощью т -критерия (20).
Для оценки реакции i -го растения j -го образца на к -ю концентрацию соли для каждого растения каждого образца рассчитывали коэффициент угнетения D ijk (от англ. depression) в соответствии с формулой [1]:
D ,= ' A, [1]
Lj 0
где L j 0 — средняя по всем растениям j -го образца ППГ длина корня (листа) в контрольном опыте (вода), L ijk — значение длины корня (листа) у i -го растения j -го образца ППГ при к -й концентрации хлорида натрия. Для j -го образца определяли среднее значение D j по всем растениям. Доверительный интервал для каждого образца находили на основании коэффициента Стьюдента (20).
Долю выживших растений j-го образца при к-й концентрации оп- ределяли по формуле [2]:
N jk
P jk N. 0 , [2]
где N jk — число растений j-го образца, проросших на 7-е сут эксперимента (независимо от длины корня/листа) при к -й концентрации; N . о — число растений, сформировавшихся на 7-е сут в контроле (на воде). Доверительный интервал рассчитанной частоты определяли на основании коэффициента Стьюдента (20).
Результаты . Характеристика использованных праймеров приведена в таблице 1.
1. Нуклеотидные последовательности праймеров, примененные при оценке генетического разнообразия пшенично-пырейных гибридов с помощью молекулярных маркеров
|
Наименование |
| 5'-3' последовательность |
| Температура отжига Tm, ° C |
|
iPBS-м а р к е р ы |
||
|
iPBS 2076 |
GCT CCG ATG CCA |
60 |
|
iPBS 2083 |
CTT CTA GCG CCA |
55 |
|
iPBS 2081 |
GCA ACG GCG CCA |
63 |
|
iPBS 2380 |
CAA CCT GAT CCA |
63 |
|
iPBS 2385 |
CCA TTG GGT CCA |
51 |
|
iPBS 2075 |
CTC ATG ATG CCA |
51 |
|
iPBS 2077 |
CTC ACG ATG CCA |
55 |
|
iPBS 2078 |
GCG GAG TCG CCA |
63 |
|
iPBS 2415 |
CAT CGT AGG TGG GCG CCA |
60 |
|
iPBS 2402 |
TCT AAG CTC TTG ATA CCA |
51 |
|
RAPD-м а р к е р ы |
||
|
Apr5.5 |
AAC GCG TTC T |
40 |
|
Opnl |
CTC ACG TTG G |
42 |
|
RA-18 |
GGG CCG TTT A |
41 |
|
RA-23 |
CCC GCC TTC C |
40 |
|
RA-29 |
CCG GCC TTA C |
41 |
|
RA-31 |
CCG GCC TTC C |
40 |
|
RA-52 |
TTC CCG GAG C |
41 |
|
RA-82 |
GGG CCC GAG G |
40 |
|
Thinl |
GGA AGT CGC C |
40 |
|
ISSR-м а р к е р ы |
||
|
K10 |
(AC)8YG |
50 |
|
K18 |
(GA)8C |
52 |
|
K20 |
(CT)8T |
54 |
|
K24 |
(GA)8A |
52 |
|
K34 |
(CT)8G |
50 |
|
UBC810 |
(GA)8T |
52 |
|
UBC812 |
(GA)8A |
52 |
|
UBC814 |
(CT)8A |
52 |
|
UBC815 |
(CT)8G |
52 |
|
UBC822 |
(TC)8A |
52 |
|
UBC834 |
(AG)8YT |
52 |
|
UBC840 |
(GA)8YT |
50 |
|
UBC852 |
(TC)8RA |
53 |
Десять образцов ППГ и два сорта пшеницы испытывали на устойчивость при моделировании условий засоления почвенного раствора в первые дни развития растения из семени. В этот период, во-первых, солевой стресс снижает процент проросших семян из-за окислительного стресса, во-вторых, в ответ на засоление в результате изменения гормонального статуса замедляется рост растений. Ингибирование роста представляет собой адаптивную реакцию организма, так как позволяет высвобождать ресурсы (метаболиты и энергию) для ответа на стресс. Наблюдаемые нами у образцов ППГ изменения в скорости роста отражают различия в генетических программах по распределению метаболитов и энергии между ростовыми процессами и стрессовой реакцией в условиях засоления. По сравнению с контролем (вода) у всех образцов наблюдалось замедленное развитие кор-
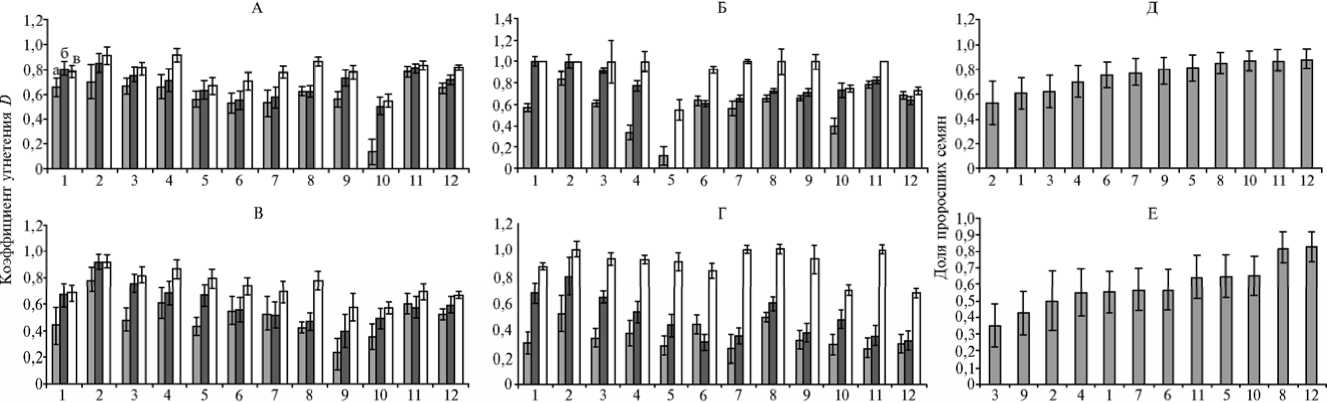
Рис. 1. Коэффициенты угнетения роста корня (А и Б, соответственно на 3-и и 7-е сут) и листа (В и Г, соответственно на 3-и и 7-е сут) у проростков при солевом стрессе (а, б, в — концентрация NaCl соответственно 100, 150 и 200 мМ) и доля проросших семян на фоне NaCl (Д и Е — соответственно 150 и 200 мМ) у десяти образцов пшенично-пырейных гибридов и двух сортов пшеницы: 1 — ЗП-26, 2 — М-12, 3 — 4044, 4 — 1876, 5 — 2087, 6 — 548, 7 — сорт Айвина, 8 — сорт Немчиновская, 9 — 5542, 10 — М-3202, 11 — 4082, 12 — 4015.
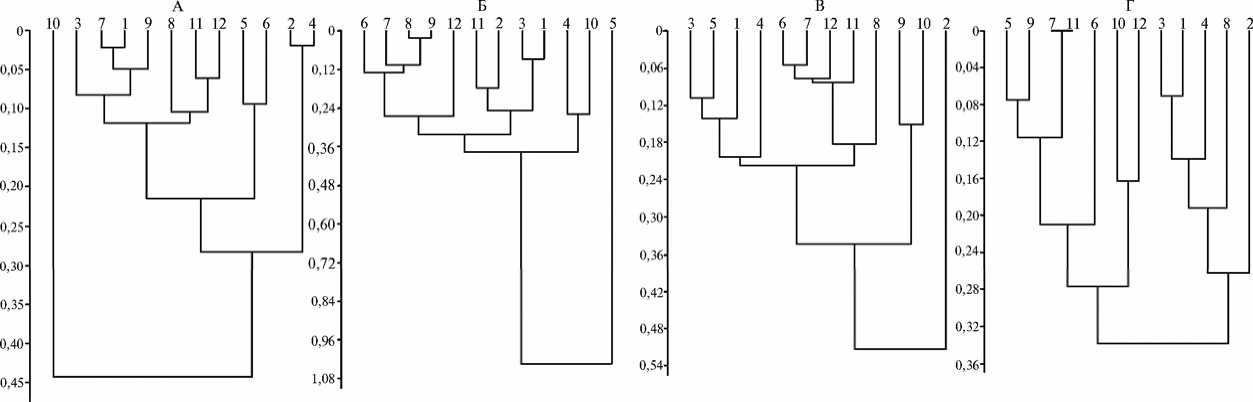
Рис. 2. Кластеризация десяти образцов пшенично-пырейных гибридов и двух сортов пшеницы на основании оценки на солеустойчивость по угнетению роста корня (А, Б — соответственно на 3-и и 7-е сут) и листа (В, Г — соответственно на 3-и и 7-е сут) у проростков: 1 — ЗП-26, 2 — М-12; 3 — 4044, 4 — 1876, 5 — 2087, 6 — 548, 7 — сорт Айвина, 8 — сорт Немчиновская, 9 — 5542, 10 — М-3202, 11 — 4082, 12 — 4015.
ней и листьев (рис. 1).
Для разделения образцов на группы по устойчивости была проведена их кластеризация c помощью расчета евклидова расстояния по коэффициенту угнетения для каждого органа в среднем при засолении (рис. 2). Это позволило выявить формы со стабильно высоким, средним и низким значением D (табл. 2).
2. Кластеризация десяти образцов пшенично-пырейных гибридов и двух сортов пшеницы в зависимости от значения коэффициента угнетения ( D ) у проростков в среднем при засолении
|
Время, сут |
Значение D |
||
|
стабильно низкое |
стабильно среднее |
стабильно высокое |
|
|
3-и |
(М-3202), (2087, 548) |
Корень (сорт Айвина, 5542, ЗП-26, 4044) |
(4015, 4082); (М-12, 1876) |
|
7-е |
(2087), (1876), (М-3202) |
(548, сорта Айвина, Немчиновская, |
(4044, ЗП-26); (4082, М-12) |
|
3-и |
(5542, М-3202) |
5542); (4015) Лист (2087, 4044, ЗП-26); (548, сорт Айвина, |
(М-12) |
|
7-е |
(4015, М-3202) |
4082, 4015) (2087, 5542, сорт Айвина, 4082); (548) |
(М-12); (1876, ЗП-26, 4044) |
В проведенных тестах стабильно низкий коэффициент угнетения D показал образец М-3202, стабильно средний — сорт Айвина, стабильно высокий — М-12, для образцов 2087, 548, 5542 он варьировался от стабильно низкого до стабильно среднего.
У образца 2087 стабильно низким был коэффициент угнетения роста корня, средним — листа, то есть происходило преимущественное развитие корня за счет листа. Вероятная причина, в частности, — накопления ионов натрия в листьях, что и вызывает их большее угнетение по сравнению с корнем. В полевых условиях это может привести к более позднему появлению листа над поверхностью почвы, что в совокупности с другими факторами (почвенная корка, патогены и др.) способно вызвать гибель растения. Образец 4082, напротив, демонстрировал стабильно высокий коэффициент угнетения роста корня и стабильно средний — листа. Возможно, из-за меньшего угнетения листа растение образца 4082 сможет накопить достаточное количество ассимилятов для регенерации поврежденной из-за засоления корневой массы.
У образцов ЗП-26 и 4044 на 3-и сут коэффициент угнетения корня и листа оказался стабильно средним, но на 7-е сут увеличился до стабильно высокого; при этом они кластеризовались вместе во всех вариантах теста на чашках Петри. Однако, как видно на рисунке 1, эти образцы на 7-е сут при концентрации 100 мМ имели относительно низкий коэффициент D . Следовательно, при снижении концентрации соли в почвенном растворе на 7-е сут до 100 мМ они были способны выжить. Обратную реакцию наблюдали у образца 4015: у него на 3-и сут коэффициент D принимал стабильно высокие значения как для корня, так и в среднем для листа, а на 7-е сут — стабильно средние и низкие соответственно у корня и листа. Следовательно, со временем у образца 4015 происходит подключение дополнительных механизмов устойчивости.
Так как при высокой концентрации (200 мМ) большая часть образцов оказалась не способна формировать полноценный корень и лист, мы определили долю выживших растений в стрессовых условиях (рис. 3). При концентрации 150 мМ NaCl у образцов М-12, 4044 и ЗП-26 процент таких растений был низким, у образцов М-3202, 4082 и 4015 — высоким, причем разница оказалась значительной. Алогичным образом в варианте с 200 мМ NaCl образцы 4044, 5542, М-12, 1876, ЗП-26, 548 и сорт Айвина
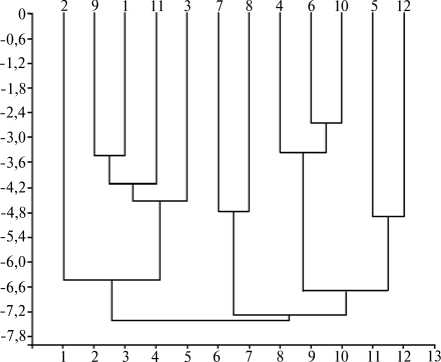
Рис. 3. Кластеризация десяти образцов пшенично-пырейных гибридов и двух сортов пшеницы с разной реакцией на засоление на основе анализа с использованием ПЦР-маркеров: 1 — ЗП-26, 2 — М-12, 3 — 4044, 4 — 1876, 5 — 2087, 6 — 548, 7 — сорт Айвина, 8 — сорт Немчиновская, 9 — 5542, 10 — М-3202, 11 — 4082, 12 — 4015.
(низкий процент) отличались образца 4015 и сорта Немчиновская (высокий процент). В целом образцы 4044 и ЗП-26 характеризовались низкой долей проросших семян как при 150 мМ, так и при 200 мМ, а 4015 — высокой при обеих концентрациях.
Таким образом, образец 4015 даже в экстремальных условиях способен сформировать корни и листья, которые при наступлении более благоприятных условий (разбавление почвенного раствора и снижение концентрации соли) обеспечат растению шанс на выживание.
Для оценки генетического разнообразия изучаемой коллекции ППГ мы использовали различные системы ПЦР-маркеров (см. табл. 1) и на основе выявленного полиморфизма получили дендрограмму (см. рис. 3). Как видно из представленных данных, сорта мягкой пшеницы Айвина и Немчиновская кластеризовались отдельно от образцов ППГ, которые, помимо генома пшеницы, содержат дополнительный геном, состоящий из хромосом пырея. Следовательно, использованные нами маркеры выявляют различия по дополнительному пырейному геному и позволяют достоверно оценить его разнообразие у изучаемых форм ППГ.
На основе сходства фенотипической реакции и кластеризации с использованием ДНК-маркеров можно предполагать наличие близких генетических систем пырейного происхождения, обусловливающих высокую или низкую устойчивость соответствующих образцов ППГ.
Следующие группы образцов проявили сходный тип реакции корня или листа на засоление при том, что на основании ПЦР-маркеров образцы из группы попали в разные кластеры: 2087 и М-3202 (стабильно высокая устойчивость корня); 2087, 4082 и 548 (стабильно средняя устойчивость листа); 4082 и М-12 (стабильно низкая устойчивости корня). Следовательно, вероятно наличие у этих пар различных генетических систем, обеспечивающих близкий тип ответной реакции корня или листа на засоление. Образцы ЗП-26 и 4044 на основании ПЦР-анализа объединялись в один кластер и имели близкий тип реакции листа и корня на увеличение концентрации соли: их устойчивость варьировалась от слабой до средней. Таким образом, можно предположить, что ЗП-26 и 4044 обладают сходными механизмы солеустойчивости и регулирующими их генами. Образец М-12 выделился в отдельный кластер на основе ПЦР-маркеров и показал самую низкую устойчивость во всех вариантах опыта. Возможно, у него имеется уникальная среди изучаемых образцов система, не обеспечивающая устойчивости к засолению.
Ранее нами было показано отличие образца М-3202 (сорт Истра 1) от ЗП-26 (сорт Останкинская) по составу хромосом пырея с использованием метода дифференциальной геномной гибридизации in situ (17). Про- веденная в настоящем исследовании кластеризация на основе ПЦР-ана-лиза также показала удаленность этих образцов. При этом с образцом ЗП-26 кластеризовался образец 4044. Согласно данным испытания коллекции ППГ на устойчивость к листовой ржавчине (14), ЗП-26 и 4044 имели один сходный тип реакции (средняя устойчивость), а в настоящем исследовании — сходную реакцию корня и листа на засоление. Эти данные позволяют предположить у ЗП-26 и 4044 наличие одинаковых хромосом пырея.
Итак, у устойчивых и неустойчивых к засолению образцов пшенично-пырейных гибридов выявлены полиморфные продукты амплификации, которые можно использовать для поиска генетических факторов пырейного происхождения, обеспечивающих устойчивость проростков к солевому и осмотическому шоку.


