Полногеномный поиск ассоциаций однонуклеотидных полиморфизмов с шириной груди у овец северокавказской мясо - шерстной породы
Автор: Зуев Р.В., Криворучко А.Ю., Лиховид Н.Г., Криворучко О.Н.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Генетика
Статья в выпуске: 3, 2024 года.
Бесплатный доступ
Растущий в мире спрос на баранину ставит перед селекционерами задачу повышения мясной продуктивности пород овец. Она зависит от совокупного воздействия большого числа генов, влияющих на развитие мышечной ткани. Многие из них на данный момент ещё не описаны как гены-кандидаты продуктивных качеств, т.к. влияние генов может различаться в зависимости от породы и условий обитания животных. Одним из наиболее эффективных методов поиска таких генов является полногеномный поиск ассоциаций (GWAS). В статье представлены результаты GWAS для параметра «ширина груди», связанного с мясной продуктивностью у овец Северокавказской мясо-шерстной породы. Генотипирование животных проведено с использованием ДНК-биочипов Illumina Ovine Infinium HD BeadChip 600K. Контроль качества генотипирования и GWAS проведены с помощью программного обеспечения PLINK V.1.07. Визуализация и построение графиков выполнены с использованием пакета «QQman» на языке программирования «R». В результате удалось выявить 9 однонуклеотидных замен (SNP), показавших достоверную связь с изучаемым признаком фенотипа. Восемь замен локализованы в интронах белок-кодирующих генов, а замена rs417623542 - в экзоне. На этом основании нами предложено 5 генов-кандидатов, ассоциированных с изучаемым параметром: DPYD, FSHR, PRR16, SLC19A3 и BMPR1B. Гены DPYD и SLC19A3 играют важную роль в обмене веществ, гены FSHR, PRR16 и BMPR1B участвуют в регуляции роста клеток и клеточной дифференцировки. Последующие исследования должны быть направлены на изучение структуры данных генов для выявления механизма их влияния на параметры мясной продуктивности животных. SNP, выявленные в ходе исследования, могут использоваться как молекулярные маркеры при селекции овец.
Овцеводство, северокавказская мясо-шерстная порода, полногеномный поиск ассоциаций, однонуклеотидные замены, gwas, snp, гены-кандидаты
Короткий адрес: https://sciup.org/147246122
IDR: 147246122 | УДК: 575.224.22 | DOI: 10.17072/1994-9952-2024-3-318-326
Текст научной статьи Полногеномный поиск ассоциаций однонуклеотидных полиморфизмов с шириной груди у овец северокавказской мясо - шерстной породы
Растущий в мире спрос на баранину ставит перед селекционерами задачу повышения мясной продуктивности имеющихся пород овец. Одним из перспективных подходов к решению этой задачи является использование методов маркер-ассоциированной селекции по аллелям генов, влияющих на мясную продуктивность. Ранее был выявлен ряд генов, связанных с количественными и качественными признаками мясной продуктивности овец: MSTN (myostatin) [Aiello et al., 2018; Osman et al., 2021], MYOD1 (myogenic differentiation 1) [Sousa-Junior et al., 2022], FST (follistatin) [Nissinen et al., 2021] и др. Однако кроме них в развитии мышечной ткани участвует большое число генов, влияние которых может быть относительно невелико. Многие из них на данный момент ещё не выявлены, т.к. параметры мясной продуктивности в значительной степени зависят от факторов окружающей среды, что маскирует эффект экспрессии отдельных генов [Tobar et al., 2020].
Одним из наиболее эффективных методов поиска новых генов-кандидатов является полногеномный поиск ассоциаций (GWAS). Он основывается на обработке результатов генотипирования животных по отдельным однонуклеотидным полиморфизмам (SNP), проведённого с использованием ДНК-биочипов [Benavides et al., 2018]. С его помощью на данный момент удалось выявить ряд геномных регионов и предложить гены-кандидаты, ассоциированные с экономически важными признаками у овец [Gebreselassie et al., 2019].
Поскольку для овец характерна высокая экологическая пластичность, генетические маркеры продуктивности могут отличаться у отдельных пород из-за того, что их селекция проводилась в разных условиях окружающей среды. В связи с этим перспективным является поиск генов-кандидатов у пород, приспособленных к определенным условиям содержания и кормления [Яцык, 2017].
Одной из таких пород, разводимых на территории Ставропольского края, является Северокавказская мясо-шерстная, выведенная в условиях засушливых степей Юга России. Овцы этой породы легко приспосабливаются к различным условиям разведения и характеризуются достаточно высокой мясной продуктивностью: бараны-производители имеют среднюю массу более 100 кг, а ярки – 60 кг. Для породы характерна дисперсия фенотипа мясных форм, что указывает на высокое генетическое разнообразие и возможности селекции в направлении увеличения мясной продуктивности животных [Омаров, Гайда-шов, 2021]. Одним из важных промеров, характеризующих мясную продуктивность у овец, является ширина груди, определяющая поперечный размер туши и степень развития сердечно-легочной системы у животного. Он важен для оценки овец при селекционном отборе, и выявление его генетической основы позволит использовать новые молекулярные маркеры для улучшения породы.
В связи с вышеизложенным, целью нашего исследования стали поиск SNP, ассоциированных с параметром «ширина груди» и выявление новых генов-кандидатов продуктивности у овец Северокавказской мясо-шерстной породы.
Объекты и методы исследования
Объектом исследования служили бараны (n=50) Северокавказской мясо-шерстной породы в возрасте 12 месяцев, разводимые в СПК «Племенной завод Восток» Степновского р-на Ставропольского края. Все животные были клинически здоровы, не стрижены, содержались в оптимальных условиях и получали полноценный рацион [Абонеев и др., 2009]. Забор крови для выделения ДНК проводился Зуевым Р.В. и Криворучко О.Н. в феврале-марте 2018 г. Кровь, отобрали из яремной вены в асептических условиях.
Лабораторные исследования проведены Криворучко А.Ю. и Лиховид Н.Г. на базе лабораторий ВНИИОК – филиала ФГБНУ «Северо-Кавказский ФНАЦ» и ФГБОУ ВО «Ставропольский государственный аграрный университет».
Выделение тотальной ДНК проводилось при помощи набора Pure Link Genomic DNA MiniKit (Invitrogen Life Technologies, США) согласно протоколу производителя. Генотипирование животных осуществляли с использованием ДНК-биочипов Ovine Infinium HD BeadChip 600K (Illumina Inc., Калифорния, США) в соответствии с протоколом производителя. Первоначальная обработка результатов генотипирования проведена с помощью программы Genome Studio 2.0 (Illumina Inc., Калифорния, США).
Контроль качества генотипирования выполнен с помощью программы PLINK V.1.07. В обработку данных были включены образцы с показателем количества обнаруженных SNP (Call Rate) более 0,95, полиморфизмы, имеющие физическую локализацию и частоту минорных аллелей более 0,01. Из 606 006 генотипированных SNP для дальнейшего анализа было использовано 562 549 полиморфизмов.
GWAS выполняли с помощью программного обеспечения PLINK V.1.07, функция – qassoc [Purcell, Neale, Todd-Brown, 2007]. Достоверными считали различия при –log 10 (p)>5. Визуализацию и построение графиков производили с применением пакета «QQman» на языке программирования «R».
Картирование SNP проведено с помощью сборки генома Oar_v3.1. Поиск ближайших генов-кандидатов выполняли в области 250 000 п.н. вокруг SNP, показавших достоверную связь с шириной спины у животных исследуемой группы. Аннотации генов выполнялись с использованием геномного браузера Ensemble (.
Результаты исследования и их обсуждение
При проведении GWAS для параметра «ширина груди» было выявлено 9 однонуклеотидных замен, преодолевших порог достоверности -log 10 (p) = 5 (рис. 1). Эти SNP были расположены на 1, 2, 3, 5 и 6-й хромосомах.
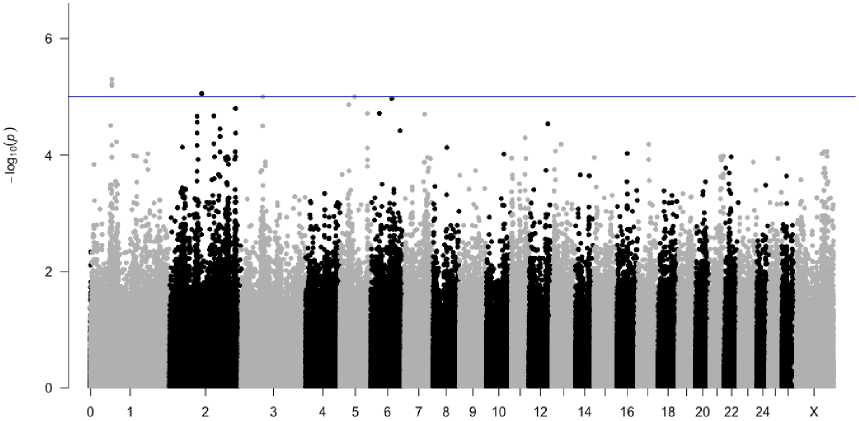
Chromosome
Рис. 1. Манхэттенский график результатов GWAS с набором значений –log 10 (p) для исследуемых SNP. Горизонтальная линия обозначает порог достоверности различий при значении –log 10 (p) = 5 [Manhattan plot of GWAS results with a set of –log10(p) values for the studied SNPs.
The horizontal line indicates a difference reliability threshold at –log10(p) = 5]
На представленном квантиль-квантиль графике показаны результаты оценки распределения достоверностей различий. Отклонение от теоретически ожидаемого распределения в случае подтверждения нулевой гипотезы наблюдается, начиная с –log 10 (р)>5 (рис. 2).
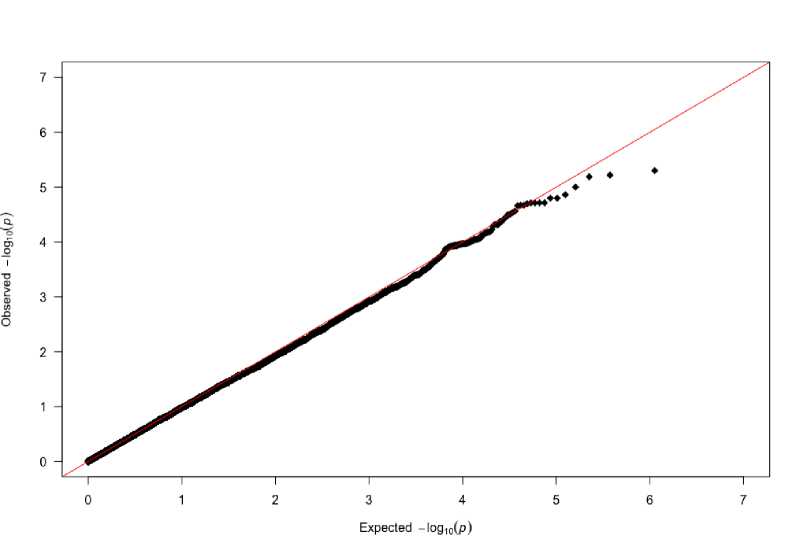
Рис. 2. Q-Q график для вероятностей распределения достоверности оценок однонуклеотидных полиморфизмов
[Q-Q plot for the probability distribution of reliability in single nucleotide polymorphism estimates ]
В областях локализации выявленных SNP, достоверно ассоциированных с шириной спины, были обнаружены 5 генов-кандидатов, предположительно влияющих на продуктивные показатели овец. Восемь замен были локализованы в интронах белок-кодирующих генов, одна – в экзоне (таблица).
Характеристики однонуклеотидных замен, ассоциированных с шириной груди у овец Северокавказской мясо-шерстной породы
[Characteristics of single nucleotide substitutions associated with chest width in sheep of the Severocavcazskaya sheep breed]
|
№ |
SNP |
Хромосома/позиция |
P |
Ген/расстояние до гена |
|
1 |
rs412308293 |
1/73858834 |
5.007e-06 |
DPYD/intron |
|
2 |
rs400857844 |
1/73648184 |
6.042e-06 |
DPYD/intron |
|
3 |
rs399781046 |
1/73672374 |
6.473e-06 |
DPYD/intron |
|
4 |
rs398315636 |
3/75299649 |
1.000e-05 |
FSHR/intron |
|
5 |
rs405039164 |
5/30848833 |
1.373e-05 |
PRR16/intron |
|
6 |
rs417623542 |
2/228929830 |
1.586e-05 |
SLC19A3/exon |
|
7 |
rs423233667 |
2/228930690 |
1.586e-05 |
SLC19A3/intron |
|
8 |
rs424473282 |
6/29385966 |
1.930e-05 |
BMPR1B/intron |
|
9 |
rs403874313 |
6/29386809 |
1.930e-05 |
BMPR1B/intron |
На хромосоме 1 нами выявлено 3 замены, все они находятся в интронах гена DPYD (dihydropyrimidine dehydrogenase). Фермент, кодируемый этим геном, участвует в катаболизме пиримидинов и синтезе β-аланина [Wei et al., 1998]. Последний является предшественником в скелетных мышцах карнозина – дипептида, выступающего в роли pH буфера в мышцах, повышая их производительность и замедляя время наступления нервно-мышечного утомления [Artioli et al., 2010]. Предыдущие исследования крупного рогатого скота и свиней указали DPYD как ген-кандидат, ассоциированный с развитием мышц и качеством мяса. Так, GWAS на бычках зебувидных пород показал, что этот ген ассоциирован с размерами мышечного глазка [Santana et al., 2015]. Методом анализа сети коэкспрессии генов была продемонстрирована связь DPYD с мраморностью говядины [Lim et al., 2014]. В полногеномном ассоциативном исследовании у свиней породы дюрок DPYD рассматривается как ген-кандидат, связанный с развитием внутримышечного жира [Ding et al., 2019]. Таким образом, учитывая предыдущие исследования и важную роль DPYD в обмене веществ, мы считаем его геном-кандидатом, ассоциированным с параметром «ширина груди» у овец.
Две значимые замены были выявлены на хромосоме 2. Обе локализованы в гене SLC19A3 (solute carrier family 19 member 3). SNP rs423233667 расположена в интроне, а rs417623542 – синонимичная замена во втором экзоне. SLC19A3 кодирует один из белков-переносчиков тиамина (витамина B 1 ) [Rajgopal et al., 2001]. Тиамин входит в состав простетических групп многих ферментов, участвующих в катаболизме углеводов, у животных, грибов, растений и бактерий. Он играет важную роль в развитии и функционировании нервной и иммунной систем, почек и мышц у человека и животных [Manzetti et al., 2014]. У чёрных тибетских овец ген SLC19A3 указывался как один из важных регуляторов развития мышечной ткани в эмбриональном периоде и молодом возрасте [Wu et al., 2023]. Таким образом, мы считаем SLC19A3 перспективным геном-кандидатом, ассоциированным с параметром «ширина груди» у овец.
На хромосоме 3 выявлен полиморфизм rs398315636, локализованный в интроне гена FSHR (follicle stimulating hormone receptor). Продукт этого гена представляет собой рецептор и отвечает за возможность клеток реагировать на фолликулостимулирующий гормон. FSHR напрямую связан с развитием яичников и семенников, сперматогенезом и женским репродуктивным циклом [Suocheng et al., 2017; Su et al., 2023]. У овец данный ген ассоциирован с размером помёта и фертильностью [Wang et al., 2015; Xiaoyun et al., 2022]. Кроме того, в последнее время появляются данные о внегонадной экспрессии FSHR в различных тканях, например в хондроцитах, плюрипотентных клетках костного мозга и эндотелии кровеносных сосудов [Kong et al., 2018; Bhartiya et al., 2021b; Utami et al., 2023]. Дисфункция подобных клеток может являться причиной возникновения некоторых онкологических заболеваний [Bhartiya, Patel, 2021a] и иных нарушений, например артериовенозных мальформаций [Utami et al., 2023]. Учитывая важную роль FSHR в размножении и индивидуальном развитии, мы считаем его важным геном-кандидатом, влияющим на продуктивность овец.
SNP rs405039164 расположен на хромосоме 5 в интроне гена PRR16 (proline rich 16). Этот ген кодирует белок Largen, который участвует в регуляции размеров клеток млекопитающих и стимулирует трансляцию специфических мРНК, связанных, в том числе, с функциями митохондрий. Повышенная экспрессия PRR16 приводит к увеличению размеров клеток, а также к повышению количества и активности митохондрий [Yamamoto et al., 2014]. У гибридов коммерческих пород свиней (Duroc х Landrace х Large White) PRR16 указывался как ген-кандидат, ассоциированный с цветом мяса [Li et al., 2022]. Исходя из вышесказанного, мы можем считать PRR16 геном-кандидатом, ассоциированным с исследуемым признаком.
На хромосоме 6 выявлено 2 значимых полиморфизма: rs424473282 и rs403874313. Они оба расположены в локусе FecB в интронах гена BMPR1B (bone morphogenetic protein receptor type 1B). Продукт этого гена является рецептором к костным морфогенетическим белкам (BMP) и играет важную роль в развитии хрящевой ткани в период эмбрионального и постэмбрионального развития [Mang et al., 2020]. Кроме того, BMPR1B экспрессируется в яичниках и влияет на развитие ооцитов и овуляцию. У овец породы Бурула мутация FecBB в данном гене приводит к гиперплодовитости [Fabre et al., 2003]. Согласно исследованиям породы Китайский меринос, эта мутация также положительно влияет на прирост массы тела и ширину груди ягнят в первые 3 месяца после рождения [Guan et al., 2007]. Схожий эффект был показан на особях линии МЕГА (меринос Х гарут), гетерозиготных по данной мутации [Margawati et al., 2023]. GWAS у мериносовых овец европейских пород показал, что BMPR1B ассоциирован с параметром «масса тела» [Tuersuntuoheti et al., 2023]. Учитывая важную роль выявленного гена в формировании костно-мышечной системы, мы можем считать его геном-кандидатом, ассоциированным с шириной груди у овец.
Ранее исследования связи локусов генома с показателем ширины спины были проведены для пород Джалгинский меринос и Российский мясной меринос [Krivoruchko et al., 2022; Криворучко и др., 2023]. Оказалось, что с шириной груди у всех трёх пород, включая Северокавказскую мясо-шерстную, были ассоциированы разные гены-кандидаты. Отсутствие общих генов, предположительно связанных с исследуемым признаком, показывает, с одной стороны, что количественные фенотипические признаки зависят от большого числа генов, а с другой стороны, это ещё раз подтверждает тезис о различии генетических маркеров для разных пород овец.
Заключение
Таким образом, в результате проведённого нами исследования были выявлены достоверные ассоциации между шириной груди и девятью SNP на 1, 2, 3, 5 и 6-й хромосомах у овец Северокавказской мясошерстной породы. Полиморфизм rs417623542 был расположен в экзоне, а остальные – в интронах белок-кодирующих генов. Картирование выявленных замен позволило предложить 5 новых генов-кандидатов, ассоциированных с изучаемым параметром: DPYD , FSHR , PRR16 , SLC19A3 и BMPR1B . Гены DPYD и SLC19A3 играют важную роль в обмене веществ, гены FSHR , PRR16 и BMPR1B участвуют в регуляции роста клеток и клеточной дифференцировки.
Последующие исследования должны быть направлены на проверку влияния данных генов на параметры мясной продуктивности животных, а SNP, выявленные в ходе исследования, могут использоваться как молекулярные маркеры при селекционной работе.
Список литературы Полногеномный поиск ассоциаций однонуклеотидных полиморфизмов с шириной груди у овец северокавказской мясо - шерстной породы
- Абонеев В.В., Квитко Ю.Д., Селькин И.И. Методика оценки мясной продуктивности овец. Ставрополь: СНИИЖК. 2009. 34 с.
- Криворучко А.Ю. и др. Гены-кандидаты, связанные с шириной груди у овец породы российский мясной меринос // Сельскохозяйственный журнал. 2023. № 16(4). С. 2687-1254. https://doi.org/10.48612/FARC/2687-1254/015A16.2023
- Омаров А.А., Гайдашов С.И. Продуктивные показатели овец Северокавказской мясошерстной породы и их взаимосвязь с основными селекционируемыми признаками // Вестник Алтайского государственного аграрного университета. 2021. № 2(196). С. 66-72.
- Яцык О.А. Сравнительная оценка показателей мясной продуктивности мериносовых овец российских пород // Вестник Курганской ГСХА. 2017. № 3(23). С. 58-60.
- Aiello D., Patel K., Lasagna E. The myostatin gene: An overview of mechanisms of action and its relevance to livestock animals // Animal Genetics. 2018. Vol. 49, № 6. P. 505-519. https://doi.org/10.1111/age.12696
- Artioli G.G. et al. Role of beta-alanine supplementation on muscle carnosine and exercise performance // Medicine & Science in Sports & Exercise. 2010. Vol. 42(6). P. 1162-1173. https://doi.org/10.1249/mss.0b013e3181c74e38
- Benavides M.V., Souza C.J.H., Moraes J.C.F. How efficiently Genome-Wide Association Studies (GWAS) identify prolificity-determining genes in sheep // Genetics and Molecular Research. 2018. Vol. 17(2). P. 9-14. http://dx.doi.org/10.4238/gmr16039909
- Bhartiya D., Patel H. An overview of FSH-FSHR biology and explaining the existing conundrums // Journal of Ovarian Research. 2021a. Vol. 14(1). Art. 144. https://doi.org/10.1186/s13048-021-00880-3
- Bhartiya D. et al. Endogenous, tissue-resident stem/progenitor cells in gonads and bone marrow express FSHR and respond to FSH via FSHR-3 // Journal of Ovarian Research. 2021b. Vol. 14(1). Art. 145. https://doi.org/10.1186/s13048-021-00883-0
- Ding R. et al. Single-Locus and Multi-Locus Genome-Wide Association Studies for Intramuscular Fat in Duroc Pigs // Frontiers in genetics. 2019. Vol. 10. Art. 619. https://doi.org/10.3389/fgene.2019.00619
- Fabre S. et al. The Booroola mutation in sheep is associated with an alteration of the bone morphogenetic protein receptor-IB functionality // Journal of endocrinology. 2003. Vol. 177(3). P. 435-444. https://doi.org/10.1677/joe.0.1770435
- Gebreselassie G. et al. Review on Genomic Regions and Candidate Genes Associated with Economically Important Production and Reproduction Traits in Sheep (Ovis aries) // Animals. 2019. Vol. 10, № 1. Art. 33. https://doi.org/10.3390/ani10010033
- Guan F. et al. Polymorphism of FecB gene in nine sheep breeds or strains and its effects on litter size, lamb growth and development // Animal reproduction science. 2007. Vol. 99(1-2). P. 44-52. https://doi.org/10.1016/j.anireprosci.2006.04.048
- Kong D. et al. Expression of FSHR in chondrocytes and the effect of FSH on chondrocytes // Biochemical and biophysical research communications. 2018. Vol. 495(1). P. 587-593. https://doi.org/10.1016/j.bbrc.2017.11.053
- Krivoruchko A. et al. Genome-Wide Search for Candidate Genes of Meat Production in Jalgin Merino Considering Known Productivity Genes // Genes. 2022. Vol. 13(8). Art. 1337. https://doi.org/10.3390/genes13081337
- Li H. et al. Genome-Wide Association Studies for Flesh Color and Intramuscular Fat in (Duroc x Land-race x Large White) Crossbred Commercial Pigs // Genes. 2022. Vol. 13(11). Art. 2131. https://doi.org/10.3390/genes13112131
- Lim D. et al. Characterization of genes for beef marbling based on applying gene coexpression network // International journal of genomics. 2014. Vol. 2014. Art. 708562. https://doi.org/10.1155/2014/708562
- Mang T. et al. BMPR1A is necessary for chondrogenesis and osteogenesis, whereas BMPR1B prevents hypertrophic differentiation // Journal of cell science. 2020. Vol. 133(16). Art. jcs246934. https://doi.org/10.1242/jcs.246934
- Manzetti S., Zhang J., van der Spoel D. Thiamin function, metabolism, uptake, and transport // Biochemistry. 2014. Vol. 53(5). P. 821-835. https://doi.org/10.1021/bi401618y
- Margawati E.T. et al. Detection of carrier Booroola (FecB) allele in BMPR1B gene of MEGA (Merino x Garut) sheep and its association with growth traits // Journal, genetic engineering & biotechnology. 2023. Vol. 21(1). Art. 19. https://doi.org/10.1186/s43141-023-00475-z
- Nissinen T.A. et al. Muscle follistatin gene delivery increases muscle protein synthesis independent of periodical physical inactivity and fasting // FASEB journal: official publication of the Federation of American Societies for Experimental Biology. 2021. Vol. 35(3). Art. e21387. https://doi.org/10.1096/fj.202002008r
- Osman N.M. et al. Genetic variations in the Myostatin gene affecting growth traits in sheep // Veterinary World. 2021. Vol. 14, № 2. Art. 475. https://doi.org/10.14202/vetworld.2021.475-482
- Purcell S., Neale B., Todd-Brown K. PLINK: a tool set for whole-genome association and population-based linkage analyses // American Journal of Human Genetics. 2007. Vol. 81. P. 559-575. https://doi.org/10.14202/vetworld.2021.475-482
- Rajgopal A. et al. SLC19A3 encodes a second thiamine transporter ThTr2 // Biochimica et biophysica acta. 2001. Vol. 1537(3). P. 175-178. https://doi.org/10.1016/s0925-4439(01)00073-4
- Santana M.H. et al. A genomewide association mapping study using ultrasound-scanned information identifies potential genomic regions and candidate genes affecting carcass traits in Nellore cattle // Journal of animal breeding and genetics. 2015. Vol. 132(6). P. 420-427. https://doi.org/10.1111/jbg. 12167
- Sousa-Junior L.P.B. et al. Variants in myostatin and MyoD family genes are associated with meat quality traits in Santa Inês sheep // Animal biotechnology. 2022. Vol. 33, № 2. P. 201-213. DOI: 10.1080/10495398.2020.1781651
- Su J. et al. Study on the changes of LHR, FSHR and AR with the development of testis cells in Hu sheep // Animal reproduction science. 2023. Vol. 256. Art. 107306. https://doi.org/10.1016/j.anireprosci.2023.107306
- Suocheng W. et al. Maturation rates of oocytes and levels of FSHR, LHR and GnRHR of COCs response to FSH concentrations in IVM media for sheep // Journal of Applied Biomedicine. 2017. Vol. 15(3). P. 180-186. https://doi.org/10.1016/jjab.2017.01.001
- Tobar K.M.C., Alvarez D.C.L., Franco L. Â.Â. Genome-wide association studies in sheep from Latin America. Review // Revista Mexicana de Ciencias Pecuarias. 2020. Vol. 11(3). P. 859-883. https://doi.org/10.22319/rmcp.v11i3.5372
- Tuersuntuoheti M. et al. Exploring the growth trait molecular markers in two sheep breeds based on Genome-wide association analysis // PLoS One. 2023. Vol. 18(3). Art. e0283383. https://doi.org/10.1371/journal.pone.0283383
- Utami A.M. et al. Relative expression of hormone receptors by endothelial and smooth muscle cells in proliferative and non-proliferative areas of congenital arteriovenous malformations // European journal of medical research. 2023. Vol. 28(1). Art. 449. https://doi.org/10.1186/s40001-023-01436-5
- Wang W. et al. Polymorphisms of the Ovine BMPR-IB, BMP-15 and FSHR and Their Associations with Litter Size in Two Chinese Indigenous Sheep Breeds // International journal of molecular sciences. 2015. Vol. 16(5). P. 11385-11397. https://doi.org/10.3390/ijms160511385
- Wei X. et al. Characterization of the human dihydropyrimidine dehydrogenase gene // Genomics. 1998. Vol. 51 (3). P. 391-400. https://doi.org/10.1006/geno.1998.5379
- Wu Z. et al. Regulation mechanism and functional verification of key functional genes regulating muscle development in black Tibetan sheep // Gene. 2023. Vol. 868. Art. 147375. https://doi.org/10.1016/j.gene.2023.147375
- Xiaoyun H. et al. Expression and Polymorphism of FSHR Gene in Sheep with Different Fecundity // Pakistan Journal of Zoology. 2022. Vol. 54. P. 667-675. https://dx.doi.org/10.17582/journal.pjz/20190215010208
- Yamamoto K. et al. Largen: a molecular regulator of mammalian cell size control // Molecular cell. 2014. Vol. 53(6). P. 904-915. https://doi.org/10.1016/j.molcel.2014.02.028


