Полногеномный поиск ассоциаций с показателями экстерьера царскосельской породы кур
Автор: Азовцева А.И., Дементьева Н.В., Рябова А.Е.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Генетика
Статья в выпуске: 1, 2025 года.
Бесплатный доступ
Отрасль птицеводства, обеспечивающая население ценным белком животного происхождения, на сегодняшний день практически полностью зависит от закупки зарубежных кроссов. В связи с этим особое внимание необходимо уделить отечественному птицеводству и имеющимся генетическим ресурсам. Экстерьерная оценка является важным элементом в селекции, т.к. внешний вид позволяет судить о здоровье, породной принадлежности, предрасположенности к продуктивному использованию и приспособленности животного к условиям содержания. Тем не менее, темп селекции зависит от использования как фенотипических, так и генетических данных о животных. Особое внимание в последнее время уделяется GWAS-исследованиям - полногеномному поиску ассоциаций, который позволяет выявить участки генома, предположительно ответственные за проявление того или иного признака. Целью данного исследования было выявить генетические ассоциации с экстерьером у царскосельской породы кур. Для этого была проведена экстерьерная оценка птиц (n = 96), отбор крови и выделение ДНК, а также полногеномное генотипирование при помощи чипа средней плотности Illumina Chicken 60K SNP iSelectBeadChip (Illumina Inc., США). На основании данных полногеномного генотипирования было проведено GWAS-исследование и аннотирование кандидатных генов. В результате было получено 6 предположительно значимых SNP, ассоциированных с обхватом груди, длиной голени, длиной плюсны, а также с углом груди. Бо́льшая часть генов в идентифицированных локусах была вовлечена в процессы костеобразования и костного гомеостаза, которые косвенно регулируют биологический потенциал особи к росту. Выявленные гены-кандидаты могут быть рекомендованы к использованию в маркерной селекции для царскосельской породы кур. Для подтверждения фундаментальной роли выявленных генов в формировании генетического потенциала размерно-весовых характеристик необходимы исследования и на других породах птиц.
Селекция, экстерьерная оценка, птицеводство, промеры
Короткий адрес: https://sciup.org/147251167
IDR: 147251167 | УДК: 575.162 | DOI: 10.17072/1994-9952-2025-1-69-79
Текст научной статьи Полногеномный поиск ассоциаций с показателями экстерьера царскосельской породы кур
Селекционная работа в животноводстве в той или иной степени подразумевает использование знаний об экстерьере животных – т.е. особенностей их внешнего вида, телосложения. Это обусловлено тем, что экстерьерные данные позволяют судить о здоровье, породной принадлежности, предрасположенности к продуктивному использованию, конституциональной крепости, а также приспособленности к конкретным условиям разведения [Вахрамеев, Макарова, 2021]. Отметим, что экстерьер указывает на продуктивный потенциал животного, а не на фактический уровень продуктивности, который, в свою очередь, зависит как от генотипа животного, так и от влияния антропогенных факторов, в частности условий кормления и содержания. Отсюда следует, что повышение эффективности селекции происходит благодаря улучшению как условий содержания, так и генетики животных. Значительно повысить эффективность селекции позволило повсеместное развитие генетических технологий, способных расшифровать ДНК и установить взаимосвязь между ней и проявлением какого-либо конкретного признака.
Особое значение приобретает селекционная работа в сфере птицеводства, т.к. оно является динамично развивающейся и наукоёмкой отраслью, интенсификация которой требует создания специализированных пород и линий, на основе которых получают высокопродуктивные промышленные кроссы [Гришина, 2021]. В связи с этим в птицеводстве активно используются последние достижения генетики и смежных с ней наук. Особую популярность приобрел полногеномный поиск ассоциаций (Genome-wide association study, GWAS) генетической информации с фенотипическими признаками, который выявляет однонуклеотидные полиморфизмы (single nucleotide polymorphism, SNP) с высокой частотой встречаемости у особей со схожими значениями признака. На сегодняшний день существуют исследования, посвященные геномным ассоциациям с показателями яичной продуктивности [Kang et al., 2024; Yang et al., 2024], длиной шпор у петухов [Chen, Zhao, Zhao et al., 2024], цветом скорлупы яиц и пигментацией голени [Wang X.G. et al., 2024], продолжительностью оплодотворяемости кур-несушек [Luo et al., 2024], формой клюва [Chen, Zhao, Wen et al., 2024], качественными характеристиками мяса разных пород [Xiao et al., 2024], конверсией корма и среднесуточными приростами [Cai et al., 2024], крепостью костяка [Азов-цева, Дементьева, 2023], ростом и развитием в породах разных направлений продуктивности [Ларкина и др., 2021], а также с окрасом оперения [Hua et al., 2021] и др.
Царскосельская порода кур является результатом 30-летнего труда научных сотрудников ВНИИГРЖ, целью которых было выведение аутосексной породы комбинированного направления продуктивности с приятным декоративным окрасом [Вахрамеев и др., 2024]. Комбинированное направление характеризуется оптимальными значениями яйценоскости при сохранении хороших мясных характеристик, и это, наравне с экспоненциальным ростом интереса потребителей к органическим продуктам питания [Ales-sandroni, Sagratini, Gagaoua, 2024], делает царскосельскую породу перспективным объектом выращивания для фермеров. Тем не менее, успешное развитие породы во многом зависит от наличия интереса промышленности к ней. В большинстве промышленных предприятий РФ для производства мяса и яйца птицы используются зарубежные кроссы [Федорова, Станишевская, Дементьева, 2020], что обеспечивает рентабельность производства, но пагубно сказывается на сохранении биоразнообразия и на уровне развития отечественного птицеводства, а также создает угрозу для продовольственной безопасности страны [Буяров, Буяров, 2022]. Целесообразной является деятельность по внедрению российских пород в промышленное производство, однако для этого необходимо предоставить доказательства их практической и племенной ценности. Как упоминалось ранее, экстерьер является хорошим индикатором здоровья, потенциального уровня продуктивности и приспособленности к условиям содержания. В связи с этим целью данного исследования стало выявление геномных ассоциаций с показателями экстерьерной оценки царскосельской породы и аннотирование генов-кандидатов экстерьерных признаков.
Материалы и методы
В качестве материала для исследования была использована птица царскосельской породы (n = 96), содержащаяся в ЦКП «Генетическая коллекция редких и исчезающих пород кур» (ВНИИГРЖ, г. Санкт-Петербург – Пушкин). Для проведения исследования в возрасте 42 недель был проведен прижизненный сбор фенотипических данных птицы и отбор проб крови для выделения ДНК. Сбор фенотипических данных заключался в проведении экстерьерной оценки со следующими показателями: живая масса (ЖМ), обхват груди (ОГ), обхват плюсны (ОП), косая длина туловища (КДТ), длина корпуса и шеи (КШ), длина киля (ДК), длина бедра (ДБ), длина голени (ДГ), длина плюсны (ДП), глубина груди (ГГ), ширина в ключицах (ШК), ширина таза (ШТ), угол груди (УГ).
Выделение ДНК из крови проводилось по стандартной методике фенол-хлороформной экстракции. Определение концентрации и чистоты ДНК образцов проводилось методом спектрофотометрии при помощи прибора NanoDrop 2000c (Thermofisher Scientific Inc., США). Полученные образцы были отправлены на полногеномное генотипирование с использованием чипа Illumina Chicken 60K SNP iSelectBeadChip (Illumina Inc., США) с плотностью покрытия 57,636 SNP. Контроль качества генотипирования проводился при помощи программы Genome Studio (Illumina Inc., США). Образцы с качеством генотипирования более 95% были использованы в дальнейшем анализе. Редактирование полученных данных для создания файлов адаптивного расширения (.ped, .map, .fam, .bed, .bim) было проведено при помощи программного обеспечения PLINK 1.9. с частотой минорных аллелей (MAF) > 0.05. В результате применения данного фильтра количество однонуклеотидных полиморфизмов, участвующих в анализе, сократилось до 43,123 SNP.
Полногеномный поиск ассоциаций генетической информации с продуктивными признаками был проведен при помощи статистического программного обеспечения EMMAX. Для этого в EMMAX была сгенерирована матрица родства «идентичность по штатам» («identity-by-state»). Влияние SNP на признак было рассчитано в соответствии с моделью:
Y = Xb+u+e , где Y – вектор фенотипов; b – эффект SNP; X – расчётная матрица генотипов SNP, u – вектор аддитивных генетических эффектов, который считается нормально распределенным со средним значением, равным 0, и (ко)дисперсией σ2aG , где σ2a – аддитивная генетическая дисперсия, а G – матрица геномных отношений; e — вектор случайных остаточных эффектов.
С целью исключения ложноположительных результатов и установления уровней значимости для эффекта SNP была применена поправка Бонферрони. Достоверно значимый и предположительно значимый уровни были установлены как 1,16E-06 (0.05/43,123) и 2,31E-05 (1.00/43,123) соответственно. Общегеномная значимость оценена при помощи метода simple в R, а расчет эффективного числа независимых тестов – с помощью программы Meff. На основании результатов GWAS с использованием пакета qqman и ggplot2 в среде программирования R построены диаграммы типа Манхэттэн и графики «квантиль-квантиль» (Q-Q plot); при помощи пакета corrplot – корреляционная матрица для изучаемых признаков.
Гены, совпадающие с геномным регионом кандидатного SNP или близкие к нему, были аннотированы в геномном браузере ENSEMBL на основании сборки генома Chicken (Red Jungle Fowl) GRCg6a. Поиск информации по функциональным характеристикам кандидатных генов был осуществлен в базе данных NCBI.
Результаты и обсуждение
В результате проведения полногеномного анализа ассоциаций для прижизненно полученных фенотипических показателей было идентифицировано 6 предположительно значимых SNP (таблица). Из 12-ти анализируемых показателей ассоциации были получены только для 4, что, вероятно, обусловлено наличием высоких корреляционных связей между большинством признаков (рис. 1).
Для показателя ОГ был получен SNP rs312492432 (1,73E-05), локализованный в интронной части гена с неустановленной функцией (рис. 2 А).
Предположительно значимые SNP, ассоциированные с показателями экстерьера
[Suggestive SNPs associated with exterior traits]
ДГ 0.84 0.77 q
ИМ 0.77 0.7S 0.76 1
КДТ 0.82 0.77 0.76 0.68 S'
ДБ 0.72 0.72 0.68 0.64 ■ Ct
ОГ 0.04 0.67 0.68 0.76 0.57 0.03 О
ДК ■■143 0.50 0.56 0.53 0.52 § _ кш ■■■■ИВ ’41 *1 §
-
™ ЯВДВ^РРИД
ГГ 0Л9 Ml 0.42 0.33 0.37 0.38 0.34 0.48 0.27 0.37 lZ
ШТ 0.33 0.36 0.3 0.5 0.25 0.25 0.49 0.24 0.24 0.37 0.11 g
УГ 0.16 0.14 0.13 0.21 0.16 0.13 0.05 0.12 0.24 0.14 0.03 0.12
^......м
-
-1 -0.8 -0.6 -0.4 -0.2 0 0.2 0.4 0.6 0.8 1
Рис. 1 . Корреляционная матрица для показателей экстерьерной оценки царскосельской породы кур: ДП – длина плюсны, ОП – обхват плюсны, ДГ – длина голени, ЖМ – живая масса, КДТ – косая длина туловища, ДБ – длина бедра, ОГ – обхват груди, ДК – длина киля, КШ – длина корпуса и шеи, ШК – ширина в ключицах, ГГ – глубина груди, ШТ – ширина таза, УГ – угол груди [Correlation matrix of the exterior assessment traits of the Tsarskoye Selo chicken breed:
ДП is metatarsal length, OП – metatarsal girth, ДГ – shin length, ЖМ – body weight, KДТ – oblique body length, ДБ – thigh length, OГ – chest girth, ДК – keel length, KШ – the neck and body length, ШK – clavicle width, ГГ – chest depth, ШТ – pelvis width, УГ – chest angle]
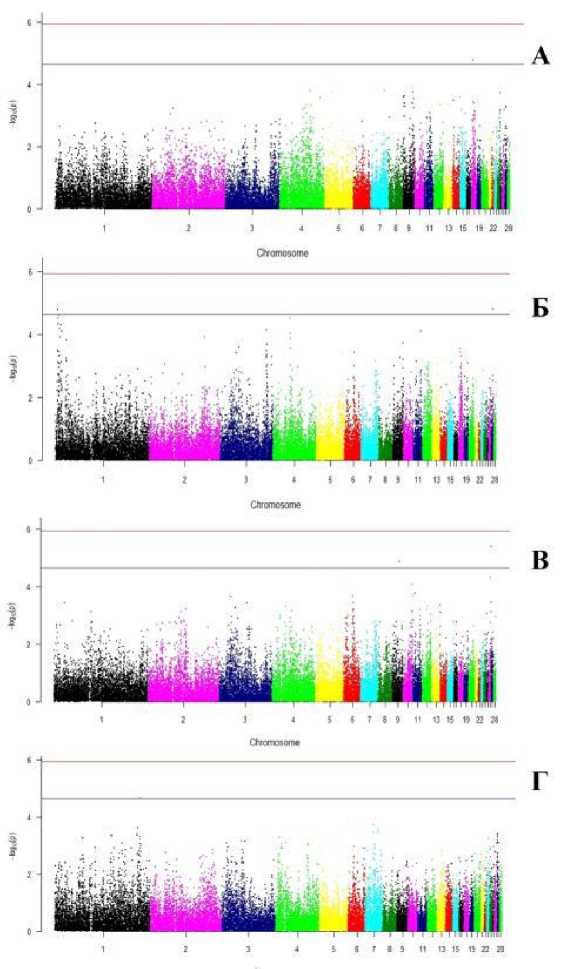
Рис. 2 . Графики Manhattan для обхвата груди (А), длины голени (Б), длины плюсны (В), угла груди (Г) царскосельской породы кур
[Manhattan plots for chest girth (A), shin length (Б), metatarsal length (В), chest angle (Г) of the Tsarskoye Selo chicken breed]
В пределах 0,3 Мб от целевого SNP расположен ген FOXK2 – регулятор транскрипции, который участвует в различных процессах, включая гликолиз, аутофагию и метаболизм глюкозы. В предыдущих исследованиях было отмечено его участие в сигнальном пути Wnt/β-catenin [Wang W. et al., 2015], который необходим для эмбрионального развития и регенерации гомеостаза костных тканей [Duan, Bonewald, 2016; Liu J. et al., 2022]. Эта информация позволяет объяснить наличие положительных корреляций ОГ с показателями развития костей, такими как ОП, ДП и ДБ (рис. 1). В другом исследовании обнаружено, что ген FOXK2 модулирует путь Wnt, который, как известно, связан с миогенезом, дифференцировкой типов мышечных волокон и рекрутированием сателлитных клеток после травмы [Petrie et al., 2016]. Все вышеперечисленное позволяет предположить, что сигнальный путь Wnt играет ключевую роль в эмбриональном развитии особи и, соответственно, обуславливает ее генетический потенциал роста, а ассоциация FOXK2 с ОГ обусловлена зависимостью данного показателя от количества и размеров мышечных волокон груди.
С показателем ДГ ассоциирован SNP rs13823757 (1,62E-05), локализованный в интронных частях сразу трёх РНК-кодирующих генов, а также SNP rs14707919 (1,56E-05), в пределах 0,1 Мб от которого рас- положены гены IGF2BP1, GIP, PHOSPHO1 и PHB1 (рис. 2 Б). Ген IGF2BP1 кодирует член семейства мРНК-связывающих белков инсулиноподобного фактора роста 2. Ранее этот ген был ассоциирован с массой и прочностью большеберцовой кости у уток породы Нонгхуа [Lu et al., 2024]. Ассоциация этого гена одновременно с ДГ и с показателями бедренной кости вполне логичны, т.к. для показателя ДГ обнаружены высокие положительные корреляции со всеми морфометрическими показателями задних конечностей – ДБ, ДП и ОП (рис. 1). В другом исследовании выявлено, что этот ген участвует в сигнальном пути Hedgehog и регулирует стабильность РНК нескольких генов-мишеней, связанных с ростом [Noubissi et al., 2018], и это также согласуется с положительной корреляцией ДГ с ЖМ и КДТ. Более того, в исследовании на козах, indel-мутации в гене IGF2BP1 также были ассоциированы с ростовыми показателями [Wang Z. et al., 2020]. Ген GIP – глюкозозависимый инсулинотропный полипептид – кодирует гормон инкретин и принадлежит к суперсемейству глюкагонов. Ранее установлено, что GIP играет роль в регуляции метаболизма костей, а именно подавляет процесс резорбции костей и активно стимулирует костеобразование [Gaudin-Audrain et al., 2013; Skov-Jeppesen et al., 2021; Gabe et al., 2022; Liu H. et al., 2024]. Ген PHOSPHO1 кодирует фосфатазу, которая предположительно участвует в минерализации и созревании костей. Экспрессия PHOSPHO1 значительно выше в минерализованных тканях и обнаружена у ряда видов, включая людей и мышей [Morcos et al., 2018]. Согласно имеющимся данным, PHOSPHO1 играет важную роль в восстановлении после переломов, в связи с чем может быть использован в качестве терапевтической мишени при их лечении [Dillon et al., 2019]. Мыши с дефицитом этого гена характеризуются аномальными пластинками эндохондрального роста и аномалиями скелета, включая остеомаляцию, сколиоз, деформацию длинных костей и спонтанные переломы [Yadav et al., 2011; Javaheri et al., 2015]. В исследованиях на птицах также выявлено, что подавление активности PHOSPHO1 приводит к нарушениям минерализации скелета во время развития конечностей цыпленка [Macrae et al, 2010]. PHB1 является эволюционно консервативным геном, предположительно участвующим в клеточном старении и подавлении опухолей. В исследовании Tabti с соавт. отмечено, что PHB1 вовлечен в этиологию диабета, ожирения и остеопороза [Tabti et al., 2021].
В исследовании ростовых показателей кур сразу три гена, IGF2BP1 , GIP и PHOSPHO1 , были предложены в качестве генов-кандидатов роста костей [Wang Y. et al., 2020], что согласуется с результатами, полученными в нашем исследовании. На основании полученных ассоциаций и корреляций можно выдвинуть предположение, что локус на 27 хромосоме, содержащий вышеперечисленные гены, играет важную роль в формировании размерно-ростовых показателей особей, в особенности конечностей.
Для показателя ДП было аннотировано 2 SNP – rs16204837 (4,01E-06) и rs315156385 (1,36E-05) на 26 и 9 хромосомах соответственно (рис. 2 В). SNP на 26 хромосоме был локализован в интронной части гена TAF8 , кодирующего один или несколько факторов, связанных с TATA-связывающим белком. TAF8 является белком развития, который вовлечен в процесс транскрипции и её регуляции. В исследовании Wong et al. (2022) для гена TAF8 описано 7 случаев мутаций, приводящих к нейродегенеративным заболеваниям у людей, которые сопровождаются задержкой роста, микроцефалией, прогрессирующей спастичностью, церебральной атрофией и развитием эпилепсии [Wong et al., 2022]. В пределах 0,5 Мб от целевого SNP на 26 хромосоме также расположены гены BTG2 , FMOD и PREPL . Ген BTG2 кодирует антипроли-феративный белок, участвующий в процессе транскрипции и ее регуляции. В исследовании Park et al. (2004) на мышах выявлено, что BTG2 усиливает транскрипционную активность передачи сигналов BMP (костный морфогенетический белок), а обнаруженные динамические паттерны экспрессии BTG2 в развивающихся сомитах доказывают его участие в формировании паттерна позвонков [Park et al., 2004]. Ген FMOD кодирует фибромодулин и предположительно играет основную роль в фибриллогенезе коллагена. FMOD детектируется в эмбриональных склеротомах уже на 10 день после оплодотворения, а также экспрессируется хондроцитами и остеобластами плода во время эндохондрального и внутримембранозного окостенения [Gori, Schipani, Demay, 2001; Tevlin et al., 2023]. Особое значение для формирования и прочности кости FMOD имеет благодаря его способности опосредованно облегчать сшивание коллагена [Hudson et al., 2017]. PREPL кодирует пропилэндопептидазу и представляет собой матричный белок, экспрессируемый в базальных мембранах, хрящах и костном матриксе [Rucci et al., 2013]. Он обладает мощным антирезорбтивным действием, ингибируя образование остеокластов, в результате чего был рекомендован в качестве нового агента для лечения заболеваний костей, вызванных повышенной активностью остеокластов [Rucci et al., 2013].
SNP на 9 хромосоме был локализован в интронной части гена DCUN1D1, который обеспечивает связывающую активность белков семейства куллинов. DCUN1D1 играет важную роль в убиктинировании и неддилировании белков – процессах пострансляционной модификации, которые регулируют стабильность и функцию целевых белков [Paccez et al., 2024]. В пределах 0,3 Мб от целевого SNP расположен ген FETUB – член семейства фетуинов, которые участвуют в остеогенезе и резорбции кости, регуляции рецепторов инсулина и фактора роста гепатоцитов, а также реакции на системное воспаление. Отмечено, что фетуины включаются в костную ткань через сыворотку крови при кальцификации, при этом пониженные концентрации фетуина в плазме крови характерны для больных болезнью Педжета, а высокие уровни – у больных с несовершенным остеогенезом [Kubota et al., 2012]. Вся группа генов, ассоциированных с ДП, задействована либо в остеогенезе, либо в костном гомеостазе, и наличие высоких корреляционных связей между показателями ДП, ДГ и ДБ подтверждает влияние выявленных локусов на скелет конечностей.
Для последнего изучаемого показателя – УГ – был идентифицирован SNP rs316245165 (2,27E-05) на 1 хромосоме, локализованный в интроне РНК-кодирующего гена с неустановленной функцией (рис. 2 Г). Для установления функциональной характеристики и влияния данного SNP на показатель УГ необходимы дополнительные исследования.
Заключение
В результате проведения настоящего исследования для царскосельской породы кур было получено 6 предположительно значимых SNP, ассоциированных с показателями экстерьерной оценки – обхватом груди (1 SNP), длиной голени (2 SNP), длиной плюсны (2 SNP) и углом груди (1 SNP). Ген FOXK2 , ассоциированный обхватом груди, включен в группу высоко консервативных сигнальных путей Wnt. Согласно существующим данным, пути Wnt задействованы в процессах эмбриогенеза и миогенеза, а также развития и регенерации костных тканей, что объясняет как полученную ассоциацию гена FOXK2 с обхватом груди, так и положительную корреляцию последнего с показателями развития конечностей (обхват плюсны, длины плюсны и голени). Гены IGF2BP1, GIP, PHOSPHO1 и PHB1 были ассоциированы с длиной голени. Известно, что все перечисленные гены вовлечены в процессы костеобразования, а ген IGF2BP1 ранее был ассоциирован с ростовыми показателями как представителей класса птиц, так и других сельскохозяйственных животных. Эти данные позволяют предположить, что локус на 27 хромосоме, содержащий перечисленные гены, играет важную роль в формировании размерно-ростовых показателей особей, в особенности конечностей. С показателем длина плюсны ассоциированы два региона на 26 и 9 хромосомах. На хромосоме 26 идентифицированы гены TAF8, BTG2, FMOD и PREPL . Согласно данным, мутации в TAF8 вызывают нейродегенеративные заболевания, сопровождающиеся задержкой роста, тогда как BTG2, FMOD и PREPL задействованы в процессах костеобразования и гомеостаза костной ткани. На 9 хромосоме расположены гены DCUN1D1 и FETUB. Влияние гена DCUN1D1 на длину плюсны может обуславливаться способностью первого участвовать в процессах посттрансляционной модификации белков. Ген FETUB же достоверно участвует в процессах остеогенеза и резорбции костей, и, более того, отклонения концентраций фетуинов от нормы наблюдаются у пациентов с костной болезнью Педжета и с несовершенным остеогенезом. Весь кластер генов, ассоциированных с длиной плюсны, задействован либо в остеогенезе, либо в костном гомеостазе, и наличие высоких положительных корреляционных связей между показателями длина плюсны, длина голени и длина бедра подтверждает влияние выявленных локусов на скелет конечностей. Также выявлена ассоциация между углом груди и РНК-кодирующим геном с неизвестной функцией, в связи с чем установление функциональных характеристик данного гена требует дополнительного изучения.
Проведенное исследование позволило выявить ряд локусов, ассоциированных с экстерьерными характеристиками царскосельской породы кур. Бо́льшая часть генов в идентифицированных локусах была вовлечена в процессы костеобразования и костного гомеостаза, которые косвенно регулируют биологический потенциал особи к росту. Выявленные гены-кандидаты могут быть рекомендованы к использованию в маркерной селекции для царскосельской породы кур. Для подтверждения фундаментальной роли выявленных генов в формировании генетического потенциала размерно-весовых характеристик необходимы исследования и на других породах птиц.


