Получение β-клеток поджелудочной железы новорожденных кроликов и межвидовых гибридных культур клеток - продуцентов инсулина
Автор: Шевцова Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Клеточные технологии
Статья в выпуске: 6 т.42, 2007 года.
Бесплатный доступ
Оценивали возможность гибридизации β-клеток поджелудочной железы новорожденных кроликов и мугантной культуры клеток почки овцы, дефектных по тимидинкиназе, с целью получения межвидовых гибридных культур клеток - продуцентов инсулина. Показано, что β-клетки поджелудочной железы новорожденных кроликов способны сливаться с эпите-лиоподобными клетками почки овцы. Полученная межвидовая гибридная культура имеет стабильную морфологию и кулътуральные свойства, продуцирует инсулин в культуральную среду, а также накапливает зерна инсулина в цитоплазме.
5-бром-2-дезоксиуридин (5-бду), гат - селективная среда, содержащая гипоксантин, аминоптерин, тимидин, крупный рогатый скот, мугантная культура клеток почки овцы (по тк-100), среда игла mem (минимальная среда игла), дмем (минимальная среда игла в модификации дюлъбеко), тк - тимидинкиназа
Короткий адрес: https://sciup.org/142133229
IDR: 142133229 | УДК: 57.085.23
Текст научной статьи Получение β-клеток поджелудочной железы новорожденных кроликов и межвидовых гибридных культур клеток - продуцентов инсулина
Число больных диабетом составляет 2-3 % населения планеты и, по прогнозам ученых, каждые 15 лет ожидается его 2-кратное увеличение.
Одно из разрабатываемых направлений эффективных методов лечения диабета — трансплантология, включающая аллогенную пересадку поджелудочной железы или ее фрагментов, пересадку островков поджелудочной железы, полученных от аллогенного или ксеногенного донора, конструирование и создание искусственной поджелудочной железы (1, 2).
Реальной альтернативой применения алло- или ксенотрансплантации культур или свежих островковых клеток, по нашему мнению, являются биотехнологические методы, позволяющие полностью компенсировать функцию естественных инсулинсекретирующих клеток, и в частности создание гибридных культур клеток, продуцирующих инсулин и обладающих гистосовместимостью с тканевыми антигенами различных видов животных и человека, что и послужило целью нашей работы.
Методика . В качестве партнеров по слиянию были взяты мутантная культура клеток почки овцы ПО ТК-100, хранившаяся в жидком азоте в криобанке Всероссийского НИИ экспериментальной ветеринарии им. Я.Р. Коваленко (получена А.С. Симоновой и др., 1998), и β -клетки поджелудочной железы 1-3-суточных кроликов. Гибридизацию β -клеток и клеток почки овцы, дефектных по тимидинкиназе, проводили согласно методическим рекомендациям по гибридизации соматических клеток сельскохозяйственных животных с использованием стандартных растворов (3); β -клетки поджелудочной железы кролика получали бесцентрифужным флотационным методом (4).
Применялись среды Игла МЕМ, Игла MEM с двойным набором аминокислот, ДМЕМ (минимальная среда Игла в модификации Дюльбеко), RPMI-1640, селективная среда ГAT, раствор версена (натриевая соль этилендиаминтетрауксусной кислоты), 0,25 % раствор трипсина на рабочем растворе Хенкса без Са2+ и Mg2+, сыворотка крови эмбрионов крупного рогатого скота (НПО «Биолот», Россия, «Sigma», США); в качестве необходимых добавок для роста мутантных клеток и гибридных культур — 0,05 % 2-меркаптоэтанол и 0,05 % пируват натрия; для предотвращения контаминации культур бактериями и грибами — этоний (из расчета 5-7 мкг/мл), энроксил и амфотерицин В (соответственно 0,05 и 0,01 %), пенициллин и стрептомицин (по 100 ЕД/мл), 5-бром-2-дезоксиуридин (5-БДУ) (500 мкг/20 мл). 5-БДУ использовали в концентрации от 4 до 150 мкг/мл для проверки на реверсию мутантных клеточных линий. Рабочие растворы стерилизовали фильтрацией (диаметр пор 0,22 мкм) («Millipore», США).
Культуры клеток поддерживали периодическим пассированием: пересев культуры осуществляли по мере формирования монослоя после обработки 0,02 % версеном и 0,25 % трипсином (в соотношении 7:1) бесцентрифужным методом с коэффициентом пересева 1:4-1:5 при титре посевного материала 105 кл/мл.
Для приготовления цитологических препаратов клетки выращивали на покровных стеклах в пенициллиновых флаконах (посевной титр — 1,5-2½105 кл/мл, объем суспензии — 1,5-2 мл), далее фиксировали в растворе Буэна или нейтральным формалином, обрабатывали метиловым спиртом и окрашивали гематоксилином с эозином или азур-эозином по Романовскому-Гимза. Препараты для кариологического анализа готовили по методу Мурхеда (1960), предусматривающему накопление в культуре клеток с метафазными пластинками под действием колхицина, обработку клеток гипотоническим раствором, фиксацию и окрашивание препаратов.
При иммуноцитохимическом и цитохимическом исследовании клеточных культур на продукцию инсулина выращивали монослой исследуемых клеток в пенициллиновых флаконах с покровными стеклами, как описано выше. Цитохимическое окрашивание клеток на инсулин проводили альдегидфуксином по Гомори. Для иммуноцитохимического окрашивания гибридных клеток на инсулин использовали моноклональные антитела к инсулину («Sigma», США), антивидовые (вторичные) антитела или антитела с флуоресцином (FITC), дающие зеленое свечение в ультрафиолетовом свете, а также антитела, конъюгированные с пероксидазой хрена. Иммуногистохимические методики описаны L. Andersen с соавт. (5).
Результаты. Полученные от слияния клеточные гибриды на первых пассажах содержали большое число ди- и поликарионов со смешанной морфологией (рис. 1). Кариотип в культуре был нестабильным, в монослое встречались крупные образования с гигантскими ядрами, представляющие собой слившиеся клетки, наблюдалась активная пролиферация.
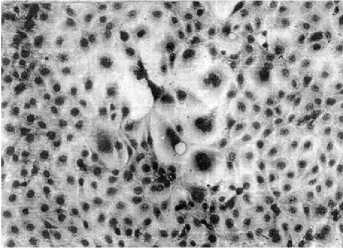
Рис. 1. Гибрид в -клеток кролика и мутантной культуры клеток почки овцы ПО ТК-100 (второй пассаж, окраска по Романовскому, ½200).
Клетки с высокой адгезивной способностью прикреплялись к субстрату, среди них встречались симпластные структуры, содержащие несколько ядер (слившиеся в результате гибридизации клетки, способные сохранять морфологию на протяжении нескольких пассажей). Крупные округлые лимфоцитоподобные клетки располагались на поверхности фибробластов одиночно или небольшими кластерами, иногда отрываясь и переходя в суспензию.
В процессе культивирования было проведено клонирование культур методом предельных разведений. Часть клонов выбраковывалась вследствие нестабильности, низкой адаптивности и других причин, влияющих на жизнеспособность культуры.
На начальных этапах продукцию инсулина гибридными клонами определяли радиоиммунным методом. Первоначальное тестирование провели на восьмом пассаже после перевода с селективной среды на обычную, когда наступила некоторая стабилизация генотипа вновь образующихся клеток и культура стала однородной.
Концентрация инсулина в культуральной жидкости к исходу 6 сут составила 156 нг/л. После этого провели клонирование культуры и отбор инсулинпродуцирующих клонов. Весь объем культуры (6,0 мл клеточной суспензии) ресуспендировали и высеяли в отдельные флаконы объемом 25 мл (по 103 клеток на флакон). Через 6 сут культивирования отобрали пробы культуральной жидкости и методом радиоиммунного анализа определили содержание инсулина в образцах. При концентрации инсулина в контроле 34,4 нг/л (культура клеток почки овцы ПО ТК-100) в 15 проанализированных гибридных клонах она составила от 120 (клоны 2Д и 2Ж) до 360 (клон 1Г) нг/л, то есть на 12-е сут все образцы гибридной культуры продуцировали инсулин в количестве, превышающем контрольный показатель в 3,5-11,5 раз.
Все 15 образцов были трижды реклонированы с криоконсервацией на каждой стадии получения клонов гибридных клеток. После третьего клонирования образцы высевали на планшеты (по 100 клеток на лунку) и на 6-е сут культивирования тестировали пробы культуральной жидкости иммунолюминесцентным методом. По результатам тестирования отобрали клоны, продуцирующие наибольшее количество инсулина.
Из 45 клонов 4 не продуцировали инсулин (клоны 17, 22, 1В и 4А), у остальных показатель варьировал от 1,7 (клон 16) до 42 пмоль/л. Для иммуноцитохимического и цитохимического определения содержания инсулина в клетках гибридных клонов суспензию клеток каждого клона максимально разводили питательной средой и высевали в многолуночные планшеты (1-10 клеток на лунку). В результате получили 24 жизнеспособные субпопуляции гибридной культуры, при этом клоны существенно различались между собой как по культуральным и морфологическим свойствам, так и по продукции инсулина, оцениваемой по содержанию зерен инсулина в клетках (рис. 2).
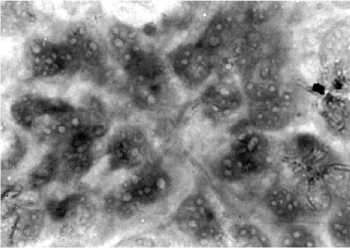
Рис. 2. Определение продукции инсулина межвидовой гибридной культурой ПО ТК-100 % в —клетки кролика. Окраска по Гомори, ^200.
Жизнеспособность клонов поддерживалась культивированием в термостате (СO 2 -инкубатор) при содержании СO 2 5 % и влажности воздуха 100 % (4-5 флаконов на клон) с пересевом каждые 5-7 сут. После 16-18 пассажей в результате селекции по культуральноморфологическим, кариологическим признакам и продукции инсулина были отобраны 10 наиболее перспективных клонов, из которых в результате выделили два наиболее перспективных — Г1 и Г2, которые одновременно реклонировали. К 18-му пассажу из клонов Г1 и Г2 жизнеспособными остались соответственно 10 и 16, но по продукции инсулина клоны Г2 были признаны неперспективными.
Из всех клонов поколения Г1 для дальнейшей работы выбрали клоны ГА2 и ГГ4. Однако у клеток клонов ГГ4 после реклонирования и 18 пассажей повышалась адгезивность, в связи с чем их трудно было отделять от подложки, и оказалась практически утраченной способность секретировать инсулин.
Клетки клона ГА2 сохранили как положительные культуральные характеристики, так и возможность продуцировать значительное количество инсулина в питательной среде.
Таким образом, β-клетки поджелудочной железы новорожденных кроликов способны сливаться с эпителиоподобными клетками почки овцы, дефектными по ферменту тимидинкиназе. Полученная межвидовая гибридная культура имеет стабильную морфологию, культуральные свойства и продуцирует инсулин в культуральную среду, а также накапливает зерна инсулина в цитоплазме, что подтверждается иммуноцитохимическим, гистологическим, иммунорадиологическим методом и методом флуоресцирующих антител. В результате выделены клоны с высоким уровнем продукции инсулина в культуральную среду.
Автор выражает благодарность профессору Н.Н. Скалецкому, сотрудникам Всероссийского НИИ экспериментальной ветеринарии им. Я.Р. Коваленко Т.В. Гальнбек, И.К. Абдрахманову, А.Н. Сафиной за помощь при проведении работы.
Л И Т Е Р А Т У Р А
-
1. Д е д о в И.И., Б а л а б о л к и н М.И., К л е б а н о в а Е.М. Современные аспекты трансплантации островков поджелудочной железы при сахарном диабете. М., 2001.
-
2. С к а л е ц к и й Н.Н., К и р с а н о в а Л.А., Б л ю м к и н В.Н. Проблемы трансплантологии и искусственных органов М., 1994: 73-80.
-
3. Д ь я к о н о в Л.П., К у щ А.К., Т у г и з о в Ш.М. др. Методические рекомендации по гибридизации соматических клеток сельскохозяйственных животных. М.,
-
4. С к а л е ц к и й Н.Н., К и р с а н о в а Л.А., Б а р а н о в а Н.В. и др. Получение культур островковых клеток для трансплантации: новые подходы и новое качество. Вестник трансплантологии и искусственных органов, 2002, 3: 86.
-
5. A n d e r s e n L., D i n e s e n В., J o r g e n s e n P.N. e.a. Enzime immunoassay for detekt human insulin in serum or plasma. Clin. Chem., 1993, 39(4): 578-582.
-
ГНУ Всероссийский НИИ животноводства Россельхозакадемии,


