Получение активированных лимфоцитов из мононуклеарных лейкоцитов периферической крови человека под воздействием альфа-фетопротеина
Автор: Черешнев В.А., Лебединская О.В., Ахматова Н.К., Родионов С.Ю., Лебединская Е.А., Гаврилова Т.В., Карамзин А.М., Киселевский М.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 (13), 2005 года.
Бесплатный доступ
Изучена возможность получения активированных цитотоксических лимфоцитов под воздействием альфа-фетопротеина для дальнейшего использования в адоптивной иммунотерапии онкологических и инфекционных заболеваний. Показано, что альфа-фетопротеин повышает функциональную (пролиферативную и цитотоксическую) активность мононуклеарных лейкоцитов (МЛ) периферической крови человека. Усиление цитотоксической активности МЛ под действием альфафетопротеина и данные изучения иммунофенотипа свидетельствуют о формировании в культурах субпопуляций цитотоксических лимфоцитов, NK- и NKT-клеток. Основываясь на полученных результатах, представляется возможным применение альфа-фетопротеина, наряду с ИЛ-2, для получения активированных лимфоцитов, которые могут быть использованы в иммунотерапии злокачественных новообразований и инфекционных заболеваний.
Короткий адрес: https://sciup.org/14054192
IDR: 14054192
Текст научной статьи Получение активированных лимфоцитов из мононуклеарных лейкоцитов периферической крови человека под воздействием альфа-фетопротеина
В.А. Черешнев1,0.В. Лебединская2, Н.К. Ахматова3, СЮ. Родионов4, Е.А.Лебединская2, Т.В. Гаврилова2, А.М. Карамзин5, М.В. Киселевский5
Институт иммунологии и физиологии УрО РАН', г. Екатеринбург
ГОУ ВПО «Пермская государственная медицинская академия» МЗ РФ2
ГУ НИИ вакцин и сывороток им. И.И. Мечникова РАМН3, г. Москва Пермский филиал Института иммунологии и физиологии УрО РАН4 Онкологический научный центр ии. Н.Н. Блохина РАМН5, г. Москва
Изучена возможность получения активированных цитотоксических лимфоцитов под воздействием альфа-фетопроте-ина для дальнейшего использования в адоптивной иммунотерапии онкологических и инфекционных заболеваний. Показано, что альфа-фетопротеин повышает функциональную (пролиферативную и цитотоксическую) активность мононукле-арных лейкоцитов (МЛ) периферической крови человека. Усиление цитотоксической активности МЛ под действием альфа-фетопротеина и данные изучения иммунофенотипа свидетельствуют о формировании в культурах субпопуляций цитотоксических лимфоцитов, NK- и NKT-клеток. Основываясь на полученных результатах, представляется возможным применение альфа-фетопротеина, наряду с ИЛ-2, для получения активированных лимфоцитов, которые могут быть использованы в иммунотерапии злокачественных новообразований и инфекционных заболеваний.
OBTAINING OF ACTIVATED LYMPHOCYTES FROM MONONUCLEAR LEUKOCYTES OF HUMAN PERIPHERAL BLOOD UNDER THE ACTION OF ALPHA-PHETOPROTEIN
-
V.A. Chereshnev', O.V. Lebedinskaya2, N.K. Akhmatova3, S.Yu. Rodionov4, E.A. Lebedinskaya2, T.V. Gavrilova2, A.M. Karamzin5, M.A. Kiselevskyi5
Institute of Immunology and Physiology', Yekaterinburg Perm State Medical Academy2, Health Ministry ofRF I.I. Mechnikov Research Institute of Vaccine and Serum3, RAMS, Moscov/
Perm Branch of Immunology and Physiology Institute4 N.N. Blokhin Cancer Research Center5, RAMS, Moscow
The feasibility of obtaining the activated cytotoxic lymphocytes under the action of alpha-phetoprotein for their use in adoptive immunotherapy of malignant and infectious diseases was studied. Alpha-phetoprotein was shown to increase the functional (proliferative and cytotoxic) activity of mononuclear leukocytes (ML) of human peripheral blood. The enhancement of cytotoxic activity of ML under the action of alpha-phetoprotein and data on immunophenotype study give the ividence of the formation of cytotoxic lymphocytes, NK and NKT-cells in subpopulation culture. The results of the study show that the use of alpha-phetoprotein seems to be feasible for obtaining the activated lymphocytes which can be used in immunotherapy of malignant and infectious diseases.
Субпопуляция натуральных киллеров (NK), ции (10—15 % от общего количества всех лимфоцитов). представленная большими гранулярными лим- Они лишены характерных для Т- и В-лимфоцитов фоцитами, постоянно присутствует в перифе- поверхностных маркеров. Маркерами NK-клеток рической крови в виде незначительной фрак- служат антигены CD16,
CD56. В адгезионных взаимодействиях с клетками-мишенями наиболее значимым является маркер NK-клеток CD56 [18, 20]. CD16 играет важную роль в антителозависимой цитотоксичности. По своей природе NK являются цитотоксическими лимфоцитами (ЦТЛ), которые способны уничтожать клетки, зараженные вирусами или внутриклеточными бактериями [14, 17], и опухолевые элементы [2, 15].
В настоящее время одним из путей, направленных на повышение эффективности противоопухолевого и противоинфекционного иммунитета, является экстракорпоральная генерация активированных цитотоксических лимфоцитов, которые используются для целей адоптивной иммунотерапии [2, 16]. Наибольшее применение в клинической практике нашли лимфокин-активированные киллеры (ЛАК) — клетки, генерируемые из мононуклеаров крови (МНК) при инкубации с интерлейкином-2 (ИЛ—2). ЛАК оказывают избирательное цитотоксическое действие на трансформированные и не влияют на нормальные клетки своего организма [2, б, 11, 12]. Однако известно, что киллерная активность лимфоцитов может быть существенно повышена при воздействии различных стимулирующих факторов, в том числе и нецитокиновой природы. Одним из таких агентов может служить альфа-фетопротеин (АФП), который является, как показано в предыдущих исследованиях [7, 9], стимулятором пролиферации и индуктором дифференцировки эмбриональных фибробластов.
В связи с этим целью работы явилось исследование возможности получения активированных цитотоксических лимфоцитов из мононук-леарных лейкоцитов периферической крови доноров под воздействием альфа-фетопротеи-на и изучение морфофункциональных особенностей генерированных клеток.
Материалы и методы
Выделение мононуклеарных лейкоцитов (NL1). МЛ выделяли из стабилизированной гепарином (25 Ед/мл) периферической крови 25 здоровых доноров на одноступенчатом градиенте фикол-ла (Pharmacia, США, плотностью 1,077 г/см3), центрифугированием при 400 g в течение 30 мин. Мононуклеарные лейкоциты, образовавшие интер фазное кольцо, собирали пипеткой и трехкратно отмывали в среде 199. После каждой отмывки в 10-кратном объеме среды клетки осаждали центрифугированием при 200 g.
Препараты. В работе использован препарат а-фетопротеина человеческого, лиофилизированного и стабилизированного декстраном производства ЗАО «Институт новых медицинских технологий» (г. Пермь, Россия). Исследуемые дозы - 0,001; 0,01; ОД; 1,0 и 10,0 мкг/мл.
Генерация ЛАК МЛ, выделенные из периферической крови, ресуспендировали в среде RPMI 1640 (ICN, США) с добавлением 10 % эмбриональной телячьей сыворотки (ЭТС), 2 мМ глютамина, стрептомицина с пенициллином по 5000 МЕ/мл в концентрации 1x106 в 1 мл среды. Затем добавляли ИЛ-2 в концентрации 10000 МЕ/мл. Клетки инкубировали при 4,5 % СО, и 37°С в течение 4 сут.
Цитотоксический тест. Цитотоксическую ак тивность мононуклеарных лейкоцитов периферической крови доноров под воздействием а-фетопротеина определяли на НК-чувствитель-ной линии опухолевых клеток К-562. Опухолевые клетки (1х104 в 1 мл) инкубировали в культуральной среде с МЛ, обработанными а-фетопротеином в дозах 0,001; 0,01; 0,1; 1,0 или 10,0 мкг/мл (в соотношениях клетки-мишени/ эффекторы, равных 1:5, 1:2, 1:1 и 1:0,5) в плоскодонных 96-луночных микропланшетах (Costar, Франция) 18 ч. Затем в лунки добавлялся витальный краситель МТТ (Sigma, США) и по оптической плотности, измеряемой на мультискане МСС-340 (Labsystem, Финляндия), рассчитывался процент лизиса опухолевых клеток (процент цитотоксичности).
Оценка пролиферативной активности МЛ. Оценку пролиферативной активности МЛ при действии а-фетопротеина проводили в колориметрическом тесте с использованием витального красителя AlamarBlue (Biosours, США) в стерильных условиях, используя ламинарный бокс с горизонтальным потоком воздуха (Juan VFS 906). Суспензию МЛ, обработанную а-фетопротеи-ном в дозах от 0,01 до 10,0 мкг/мл, в обогащен- ной среде РПМИ 1640 вносили в 96-луночные планшеты в количестве 10x103 клеток/лунку и инкубировали в течение 4 сут в стандартных условиях культивирования. По окончании инкубации в лунки вносили краситель AlamarBlue (10 %). Флюоресценцию измеряли после четырехчасовой инкубации при 37°С, 5 % СО2 на флюориметре VersaFluor VI3 (Vtocal) при длине волны возбуждения 530-560 нм, эмиссии 590 нм и выражали в условных единицах (у.е.) флюоресценции. Рассчитывали индекс стимуляции (ИС), представляющий собой отношение пролиферативной активности МЛ в отсутствие ос-фетопротеина к пролиферативной активности МЛ при стимуляции (Х-фетопротеином.
Математическая обработка данных пролифератив ной активности МЛ. Данные обрабатывали с помощью компьютера по специальной программе, реализующей метод градиентного спуска, и строили экспоненциальные кривые, которые соответствовали уравнению экспоненциальной регрессии с линейным членом [3, 5].
Анализ фенотипа МЛ. Фенотип генерированных клеток исследовали с использованием моноклональных антител (Caltag Laboratories, США) против соответствующих антигенов. Клетки отмывали холодным фосфатно-солевым буфером (ФСБ) и окрашивали FITC (флюорес-циинизотиоционат) и РЕ (фикоэритрин)-мече-ными антителами согласно инструкции производителя. Затем отмывали 2 раза холодным ФСБ. Результаты учитывали на проточном цитометре FacsCalibur (Becton Dickinson, США). На клетках, полученных из мононуклеаров периферической крови доноров, исследовали уровни экспрессии молекул CD3, CD4, CD8, CD16, CD25, CD38, CD56, CD57, CD58 и HLA-DR. Гейт (окно) популяции клеток устанавливали на основе комбинации прямого и бокового светорассеяния и размера клеток. При учете результатов подсчитывали 10000 клеток в гейте. Статистическая обработка материала проведена при помощи программного пакета WIN MDI 2.8.
Морфогистохимическое исследование. На 4-е сут инкубации МЛ периферической крови в присутствии альфа-фетопротеина из культуральной взвеси были сделаны мазки, которые окраши- вали на РНК по Браше с контрольной обработкой РНК-азой, эозин-азуром по Романовскому - Гимза, реактивом Шиффа по Шабада-шу с контролем амилазой на гликоген и гликозаминогликаны [4]. В окрашенных по Браше мазках подсчитывали процентное содержание выявляемых клеток. Статистическая обработка данных проводилась с использованием программы «ИПСО» (Россия).
Результаты исследования
Результаты исследования показали, что а-фетопротеин усиливает цитотоксическую активность МЛ периферической крови здоровых доноров по отношению к линии опухолевых клеток К562 (табл. 1). АФП повышает уровень цитотоксической активности МЛ в диапазоне концентраций от 0,01 мкг/мл до 10,0 мкг/мл. При этом не отмечается четкого дозозависимого эффекта, так как и высокие (1,0 и 10,0 мкг/мл), и низкие (0,01 мкг/мл) концентрации АФП почти в равной степени усиливают цитотоксическую активность мононуклеарных лейкоцитов (до 73,2-78,0 %). Однако самой действенной оказалась доза а-фетопротеина 0,1 мкг/мл, при которой цитотоксическая активность МЛ достигает 96,7 %. Лишь самая низкая из испытанных концентраций препарата (0,001 мкг/мл) не влияла на противоопухолевую активность мононук-леарных лейкоцитов периферической крови.
Таблица 1
Влияние СС-фетопротеина па цитотоксическую активность мононукдеаров периферической крови здоровых доноров к линии опухолевых клеток
_________________ К 562 (п=15) __________________
|
Концентр алия препарата, мкг/мл |
Уровень цитотоксичности, % |
|
|
а-фето проге ин |
МЛ |
|
|
100 |
78,0±4,6* |
24,4±357 |
|
10 |
73,2±4,1* |
|
|
1 |
96,7±4,l•♦ |
|
|
0,1 |
77,3±3,9* |
|
|
0,01 |
24,7±2,6 |
|
Примечание. достоверность различий между контрольной (МЛ) и экспериментальными группами: * - р <0,05; ** —/><0,01.
Показатели цитотоксической активности МЛ, активированных ИЛ-2 (ЛАК), были несколько ниже по сравнению с полученными в опытах с СС-фетопротеином.
Как следует из данных, представленных в табл. 2, АФП оказывает выраженное митогенное действие на МЛ здоровых доноров . Относительное количество бластных форм в культурах в зависимости от дозы препарата повышается в 3— 7 раз по сравнению с контрольной группой. Индекс стимуляции пролиферативной активности МЛ увеличивается соответственно от 3,2 (при концентрации 0,01 мкг/мл) до 6,9 (при концентрации 10,0 мкг/мл). В данных условиях 97-98 % МЛ сохраняли жизнеспособность.
Исследование иммунофенотипа клеток, генерированных из МЛ с помощью АФП, позволило установить, что они зкспрессируют на своей мембране активационные антигены (CD38 и HLADR). Мононуклеарные лейкоциты, активированные АФП, характеризовались также высоким уровнем экспрессии маркеров НК (CD56, CD16) и увеличенным процентным содержанием CD8+ клеток по сравнению с интактными МЛ. Результаты экспериментов показали также умеренное повышение (по сравнению с контрольной серией) количества CD3+ и CD4+ Т-клеток в популяции а-фетопротеинактивиро-ванных мононуклеарных лейкоцитов периферической крови (рис. 1).
Таблица 2
Влияние Ct-фетопротеина на пролиферативную активность и митогенез мононуклеарных лейкоцитов здоровых доноров (п=15)
|
Условия культивирования |
Бластные формы, у.е М±т |
Индекс стимуляции, М±т |
Жизнеспособные клетки. % М4:Щ |
|
|
Контроль |
— |
0,09540,02 |
— |
98,0403 |
|
а-фето-протеин мкг/мл |
100 |
0,65540,05** |
65 |
96,940,6 |
|
10 |
031740,04*» |
5,4 |
97,540,8 |
|
|
1 |
0,51040,07*» |
5,4 |
98,0423 |
|
|
0,1 |
03 0940,03* |
33 |
98,042,4 |
|
Примечание, достоверность различий между контрольной (МЛ) и экспериментальными группами - * р <0,05; •• /><0,01
Морфогистохимические исследования показали, что МЛ, активированные а-фетопротеи-ном, представляют собой крупные клетки лимфоидного ряда типа иммунобластов и пролимфоцитов с базофильно окрашенной и содержащей пиронинофильный компонент цитоплазмой (рис. 2А). Сохранение яркой пиронинофи-лии в цитоплазме и ядрышках клеток после обработки препаратов РНК-зой свидетельствует о наличии в них повышенного количества РНК. При фазовоконтрастной микроскопии в культурах определяются многочисленные колонии крупных клеток округлой формы с круглым ядром и широким ободком цитоплазмы (рис. 2Б).
Обсуждение
Таким образом, в результате наших исследований выявлено, что а-фетопротеин в значительной степени повышает функциональную активность мононуклеарных лейкоцитов периферической крови человека. Довольно высокий уровень цитотоксической активности МЛ, возникающий при инкубации их с ОС-фетопротеи-ном, обусловлен, очевидно, одновременной индукцией под его воздействием и ЦТЛ (CD8+), и NK-клеток (CD56+ и CD16+). Активация МЛ под действием АФП подтверждается также усилением экспрессии дифференцировочных, ко-стимулирующих и адгезивных молекул (CD38, CD56, CD58, HLA-DR) на их поверхности.
В настоящее время имеются данные о существовании в популяции активированных лимфоцитов также NKT-клеток [10, 11,15], экспрессирующих не только маркеры НК (CD16+, CD56+), но и Т-клеточные дифференцировочные антигены (CD3, CD4, CD 8) [8]. Эта субпопуляция лимфоцитов обнаруживается в основном в пораженных опухолевым или инфекционным процессом органах — печени и легких — и практически отсутствует в периферической крови. По своей спонтанной киллерной активности NKT значительно превышают МЛ. Весьма вероятно, что активированные ос-фетопротеином клетки, экспрессирующие одновременно маркеры ЦТЛ и NK, представляют собой NKT-клетки. При
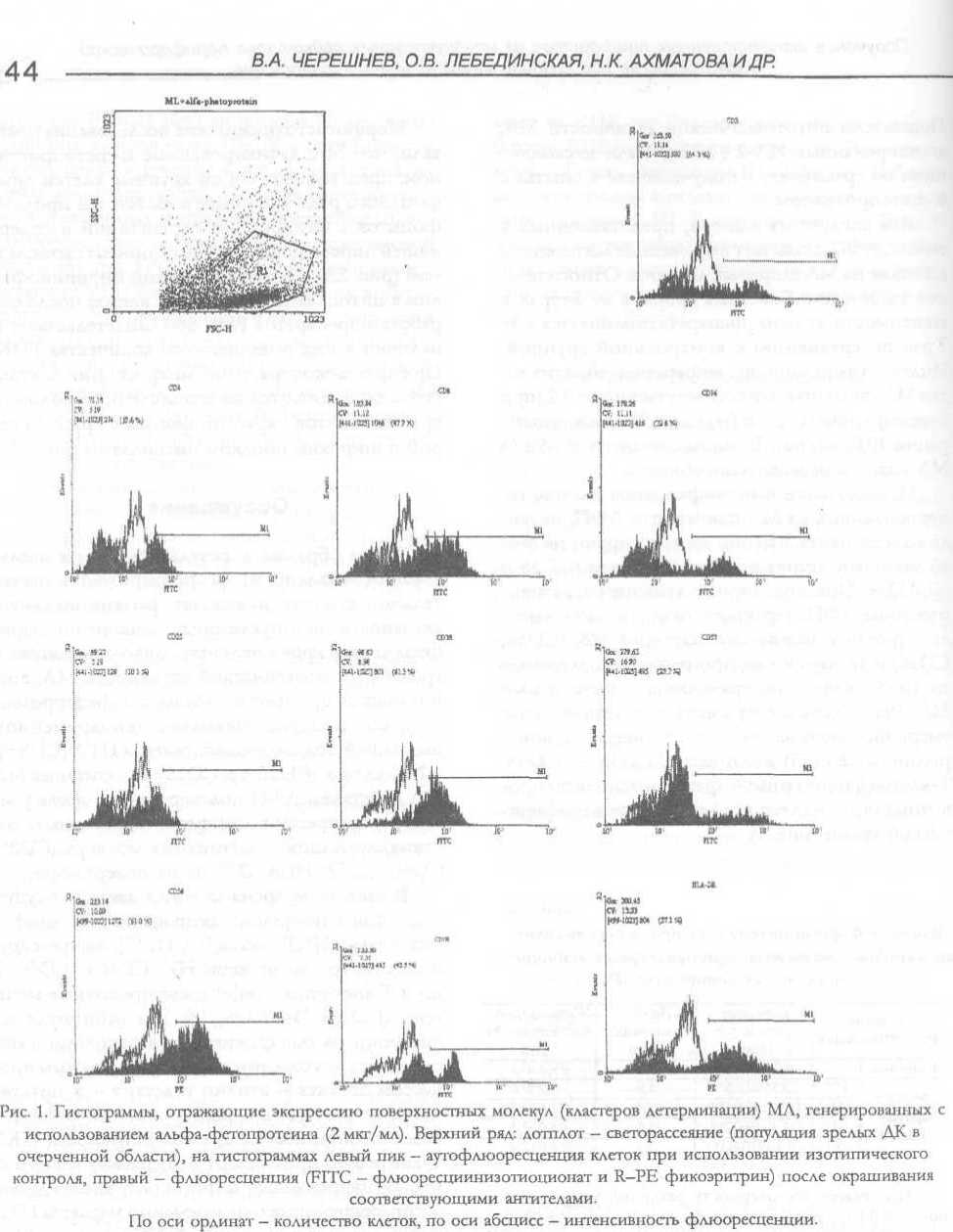
Обозначения: CD - дифференцировочные антигены; HLA-DK - молекулы главного комплекса гистосовместимости
II класса
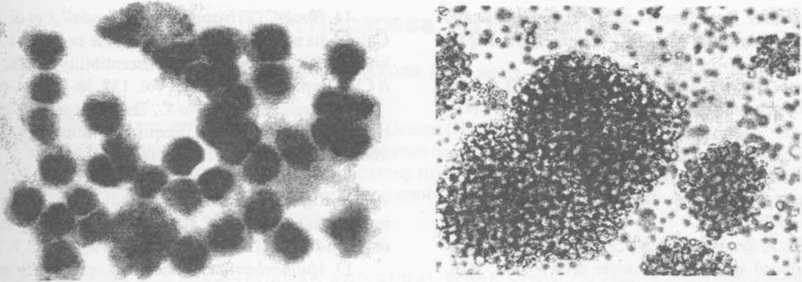
А Б
Рис. 2. Мононуклеарные лейкоциты в культуре периферической крови человека, инкубированной с альфа-фетопротеином (2 мкг/мл):
А Микрофотография АФПАК-клеток в мазке культуральной взвеси МЛ (4 сут культивирования). Окраска эозин-азуром по Романовскому-Гимза Ок. 10, об. 100;
Б. Микрофотография колоний АФПАК-клеток в культуральной взвеси МЛ (4 сут культивирования). Фазово-контрастная микроскопия. Ок. 10, об. 20
этом содержание CD8 + , CD16 + , CD38 + , CD56+, HLA-DR+ клеток при инкубации МЛ с ОС-фетопротеином повышается в 2—6 раз по сравнению с контролем.
Нарастание соотношения количества клеток CD4+/CD8+, являющегося одним из ключевых параметров иммунограммы, в эксперименте с АФП с 0,3 до 1,3 также свидетельствует об интенсивности активации иммунного процесса [1,13,19].
Проведенные исследования показали, что появление в культурах, активированных СС-фе-топротеином, большого числа клеток, характеризующихся функционально и иммунофенотипически как NK-клетки и цитотоксические лимфоциты, сопровождается усилением пролиферативного потенциала МЛ, что подтверждается данными морфогистохимических исследований. В культуральной взвеси МЛ, активированных а-фетопротеином, при фазовоконтрастной микроскопии выявляются колонии типичных бластных форм, а в мазках — клетки типа иммунобластов, пролимфоцитов и активированных лимфоцитов с повышенным содержанием РНК в цитоплазме и ядрышках.
Таким образом, в результате проведенных экспериментов установлено, что а-фетопроте-ин обладает способностью активировать МЛ крови человека с образованием клеток, характеризующихся высокой противоопухолевой цитотоксической и пролиферативной активностью. Эти данные свидетельствуют о целесообразности использования ОС-фетопротеина для экстракорпоральной генерации активированных лимфоцитов, которые могут быть использованы в иммунотерапии злокачественных новообразований и инфекционных заболеваний.


