Получение DH-растений в культуре микроспор моркови
Автор: Вюртц Т.С., Домблидес Е.А., Шмыкова Н.А., Федорова М.И., Кан Л.Ю., Домблидес А.С.
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 5 (38), 2017 года.
Бесплатный доступ
Целью данного исследования было изучить факторы, влияющие на процесс эмбриогенеза в культуре изолированных микроспор in vitro, оптимизировать существующие протоколы и получить удвоенные гаплоиды моркови (DH-растения). Из 10 изученных в 2017 году сортообразцов нам удалось получить эмбриоиды у 8 сортообразцов с использованием 5 различных вариантов питательных сред. Наибольший выход эмбриоидов наблюдался у селекционного образца 7кт (84 эмбриоида на чашку Петри). Было отмечено, что оптимальными для введения в культуру являются бутоны, содержащие преимущественно микроспоры на поздней вакуолизированной стадии развития. Первые деления в культуре микроспор моркови под микроскопом были обнаружены уже через 3 дня после начала культивирования. На 40 сутки эмбриоиды были хорошо сформированы и видны невооруженным глазом. Было отмечено, что если продолжать культивировать эмбриоиды на питательной среде с 13% сахарозой более 60 суток, то активно начинается процесс образования вторичных эмбриоидов. В связи с этим мы рекомендуем эмбриоиды на сердцевидной стадии развития сразу же переносить в отдельные пробирки на регенерационную среду с 2% сахарозой, чтобы вести правильный учет образовавшихся эмбриоидов. Мы провели изучение влияния факторов генотипа и питательной среды, а также их совместного действия на образование эмбриоидов у 8 генотипов моркови на 5 различных питательных средах. Проведенный двухфакторный дисперсионный анализ показал, что генотип является главным фактором определяющим образование эмбриоидов из микроспор, а совместное действие обоих факторов также определяет количество образовавшихся эмбриоидов. Прямым подсчетом числа хромосом в меристематических клетках и с использованием метода подсчета хлоропластов в замыкающих устьичных клетках было установлено, что почти все полу-ченые растения были удвоенными гаплоидами.
Dh-технологии, андрогенез, культура изолированных микроспор, регенерация растений
Короткий адрес: https://sciup.org/140223717
IDR: 140223717 | УДК: 635.132:573.6 | DOI: 10.18619/2072-9146-2017-5-25-30
Текст научной статьи Получение DH-растений в культуре микроспор моркови
Морковь — одна из важных сельскохозяйственных культур. По данным Министерства сельского хозяйства России площадь под промышленным производством моркови столовой в стране достигает ежегодно 23600 га, а потребность в семенах составляет около 40 т. В 2017 году в «Государственном реестре селекцион- ных достижений, допущенных к использованию», представлено 148 сортов и 143 гибрида F1 моркови столовой.
Корнеплоды моркови широко используются для продовольственных и кормовых целей, в детском и диетическом питании, а также в медицине. В сердцевине моркови обнаружен пигмент апигенин, снимающий усталость сердечной мышцы (Бунин и др., 2004; Тюкавин, 2007). Из семян моркови производят Даукарин – препарат, который применяется при коронарной недостаточности и стенокардии, и Уролесан, применяемый при мочекаменной и желчекаменной болезни.
Одним из путей повышения урожайности и качества продукции моркови
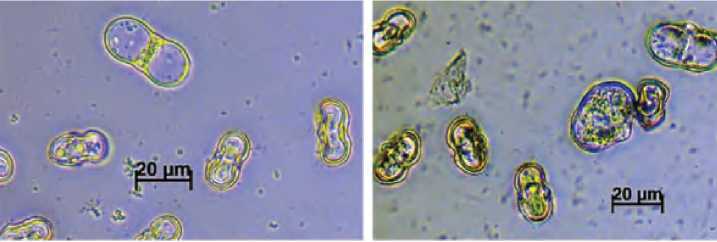
А. Равное деление – 3 суток культивирования Б. Деления в микроспорах элипсоидной и сфе-
рической формы – 3 суток культивирования
В. Многоклеточные эмбриоидные структуры – 10 суток культивирования
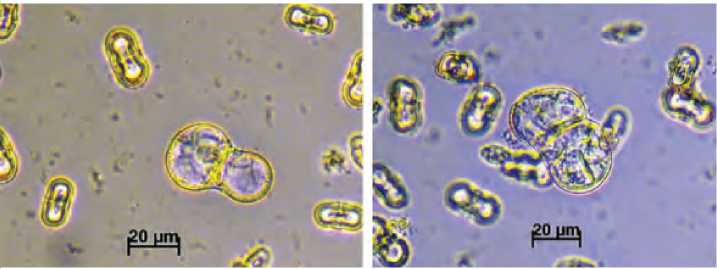
Г. Глобулярный эмбриоид – 18 суток культивирования
Д. Торпедовидный эмбриоид – 24 сутки культивирования
столовой является создание гетерозисных гибридов F1, отличающихся улучшенными показателями хозяйственно ценных признаков.
Для получения F1 гибридов моркови необходимы генетически выровненные линии, для создания которых методами классической селекции требуется 12-14 лет. Кроме того, не удается достичь полной степени гомозиготности по желаемым признакам. Это трудоемкий и длительный процесс, который можно большое разнообразие исходного материала для селекции.
Несмотря на многочисленные попытки получить удвоенные гаплоиды в культуре пыльников моркови (Andersen, 1985; Тюкавин и др., 1999; Домблидес 2001; Gуrecka et al., 2005; Шмыкова, 2006; Чистова А.В., 2015), успехи в использовании метода культуры микроспор у этой культуры были достигнуты лишь в последние годы. Matsubara S. et al. (1995) впервые сообщили об образо- вании многоядерных структур и каллуса в культуре изолированных микроспор. Gócrecka К. et al. (2010) и Li J.-R. et al. (2013) впервые получили DH-растения моркови и представили разработанный ими протокол. Однако выход удвоенных гаплоидов у этой культуры остается достаточно низким, и новые генотипы нуждаются в оптимизации данной технологии.
Лаборатория столовых корнеплодов и лаборатория генетики ФГБНУ ФНЦО обладают большой коллекцией перспективных форм моркови столовой для создания гетерозисных гибридов F1. Целью данного исследования было изучить факторы, влияющие на процесс эмбриогенеза в культуре изолированных микроспор in vitro , оптимизировать существующие протоколы и получить удвоенные гаплоиды моркови.
Материалы и методы
В работе использовали образцы моркови столовой из коллекции лаборатории столовых корнеплодов и лаборатории генетики и цитологии ФГБНУ ФНЦО, относящиеся к разным сортоти-пам (табл. 1). Донорные растения выращивали в условиях открытого грунта с соблюдением агротехнических мероприятий для получения семенников. Корнеплоды, полученные в условиях открытого грунта, после яровизации в холодильной камере при температуре +4-6°С в течение 3 месяцев высаживали в климатической камере при режиме 19°С круглосуточно, 16 ч день/8 ч ночь, освещение 9000 люкс или отапливаемой теплице.
При отборе бутонов проводили цитологическое исследование стадий развития микроспор. Для визуализации микроспор и пыльцы использовали методику дифференциального окрашивания (Alexander, 1969) и микроскоп Axio Imager А2 (Zeiss, Германия), с помощью которого определяли стадию развития микроспор.
Культура микроспор
Бутоны собирали с растений, находящихся на начальной стадии цветения, и стерилизовали 30 с в 96% этаноле, затем в течение 5 мин. в 50% водном растворе коммерческого препарата сократить с использованием современных биотехнологических методов получения удвоенных гаплоидов in vitro (культура пыльников, изолированных микроспор и неоплодотворенных семяпочек).
Культура микроспор in vitro (андроге-нез) занимает ведущее место в селекционных программах по созданию удвоенных гаплоидных растений (DH-растения). С помощью этого метода можно получить полностью гомозиготные линии за 1 год. Отсутствие соматических тканей в культуре микроспор, позволяет не ставить под сомнение происхождение полученных растений, а реализация гаметоклональной изменчивости в индивидуальных растениях предоставляет возможность получить
Таблица 1. Образцы моркови столовой Daucus carota L.
|
Селекционный№ |
Название |
Происхождение |
Сортотип |
|
4 |
Нантская 4 |
Россия |
Нантская |
|
7 |
Cubic sperlings |
Германия |
Флакке |
|
7kt |
Селекц. линия |
Россия |
Флакке |
|
8 |
Шантенэ |
Россия |
Шантене |
|
9 |
De Luc |
Франция |
Шантене |
|
10 |
Purple Dragon |
США |
Император |
|
19 |
Nutri-RED |
Чехия |
Император |
|
22 |
Rubra Vitamina |
Германия |
Флакке |
|
23 |
Saint Valery |
Нидерланды |
Флакке |
|
26 |
Maestro F 1 |
Франция |
Нантская |
«Белизна» с добавлением Твина-20 (1 капля на 100 мл), с последующим трехкратным промыванием в стерильной дистиллированной воде.
Выделение и культивирование микроспор проводили по оптимизированной методике, разработанной для рапса (Lichter, 1982) на среде % NLN, ph 5.8 с концентрацией сахарозы 13% и добавлением цефотаксима 200 мг/л. Для индукции эмбриоидов было разработано 4 дополнительных варианта среды на основе NLN и МС (Murashige and Skoog, 1962) с различными добавками.
Культивирование проводили в чашках Петри диаметром 6 см на питательной среде (5 мл), в которой они инкубировались при 32°С в темноте в течение двух суток, далее инкубация проходила при 25°С в темноте до образования эмбриоидов.
Получение растений-регенерантов
Эмбриоиды на торпедо – и сердцевидной стадии развития помещали в стеклянные пробирки с мостиками из фильтровальной бумаги на питательную среду МСм (Masuda et al., 1981) с 2% сахарозой и добавлением 0,1 мг/л кинетина. Культивирование проводили на стеллажах с люминесцентными лампами при 25°С и фотопериоде 14 часов, освещенности 2,5 тыс. люкс.
Выращиваниерастений-регенерантов
Растения с нормально развитыми листьями и корневой системой переносили в вегетационные сосуды, заполненные смесью торфа и перлита (7:3), накрывали перфорированными пластиковыми стаканчиками для адаптации растений к условиям in vivo. Выращивали растения-регенеранты в тех же условиях, что и донорные растения.
Определение плоидности растений подсчетом хлоропластов в замыкающих устьичных клетках
Определение плоидности у растений регенерантов проводили путем подсчета хлоропластов в замыкающих устьичных клетках. Эпидермальный слой клеток снимали с нижней стороны листьев, промывали в дистиллированной воде и помещали на предметное стекло в каплю воды, накрывали сверху покровным стеклом и просматривали под микроскопом Axio Imager А2 с флуоресценцией (набор фильтров BR 490 и 515). Не менее 10 пар устьичных клеток каждого растения были сфотографированы и проведен подсчет хлоропластов.
Подсчет числа хромосом с использованием пропионо-лакмоидного метода
Цитологическое исследование проводили пропионо-лакмоидным методом (Соловьева, 1982) путем приготовления давленых препаратов меристемы стебля и кончиков корней растений, корешков проростков.
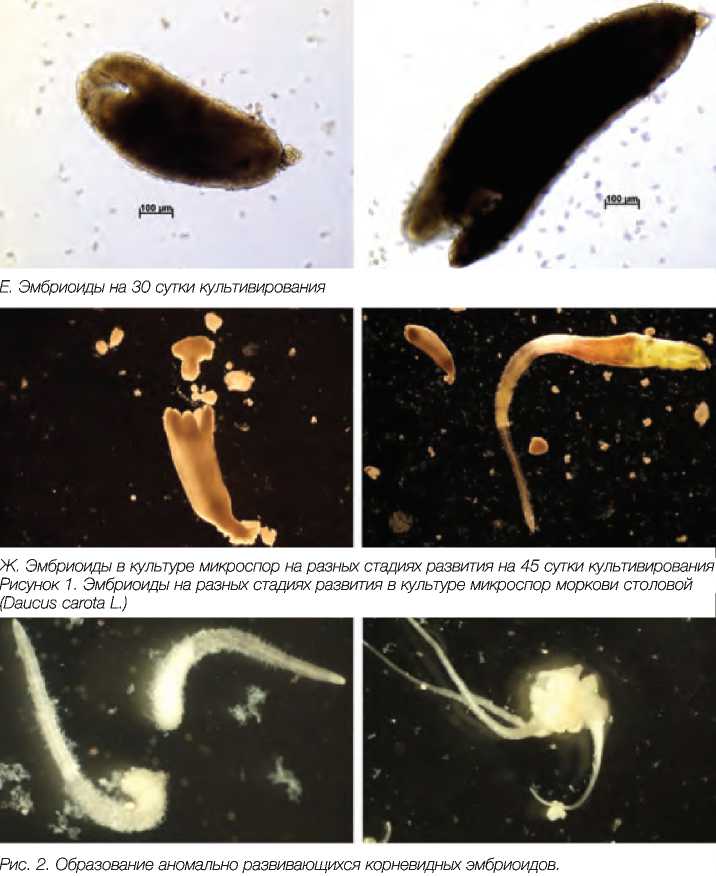
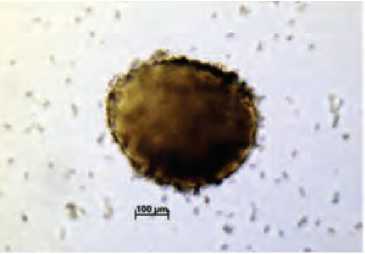
Эмбриоиды на 30 сутки культивирования
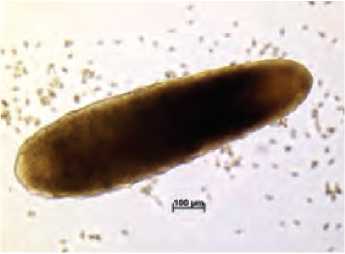
2. Образование аномально развивающихся корневидных эмбриоидов.
Ж. Эмбриоиды в культуре микроспор на разных стадиях развития на 45 сутки культивирования Рисунок 1. Эмбриоиды на разных стадиях развития в культуре микроспор моркови столовой (Daucus carota L.)
Препараты просматривали с помощью микроскопа Zeiss Scope.A1, оснащенного камерой Digital Camera Power Shot G10 Canon. Обработку изображений проводили с помощью программы Axio Vision, версия 4.8 (Carl Zeiss MicroImaging, Jena, Germany).
Статистический анализ
Обработку экспериментальных данных проводили с использованием общепринятых математико-статистических методов с использованием пакета прикладных программ Microsoft Exel и Statistika 6.0
Таблица 2. Влияние стадий развития микроспор на образование эмбриоидов*
|
№ опыта |
Стадия развития микроспор и пыльцы в бутонах |
Количество чашек, шт |
Количество эмбриоидов, шт/ч |
|
1 |
Тетрады и ранние микроспоры |
4 |
0 |
|
2 |
Одноядерные и преимущественно поздние вакуолизированныее микроспоры |
4 |
5±1,4 |
|
3 |
Поздние вакуолизированные микроспоры и двухклеточная пыльца |
4 |
1,25±0,6 |
|
4 |
Двухклеточная и зрелая пыльца |
4 |
0 |
Примечание:* в эксперименте использовалась среда 1 - Ѕ NLN -13, ph 5.8
Результаты
Одним из важных факторов, влияющих на образование эмбриоидов, является стадия развития микроспор. Ранее было определено, что индукция андрогенеза может наблюдаться как на стадии тетрад, так и на стадии вакуолизированных микроспор, но оптимальной для моркови является стадия, когда большая часть микроспор в пыльниках находится на поздней одноядерной стадии (Тюкавин и др., 1999; Домблидес A., 2001; Gorecka К. et al. 2010).
На донорных растениях сорта Шантенэ была проведена серия опытов
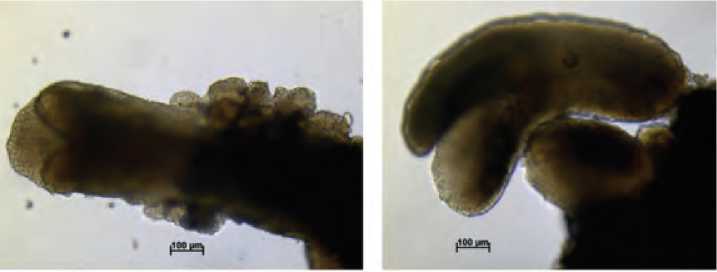
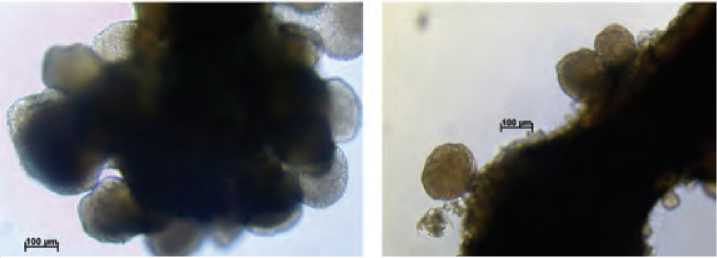
Рис. 3. Образование многочисленных вторичных эмбриоидов на первичных эмбриоидах при длительном культивировании на среде с 13% сахарозой – 70 суток культивирования.
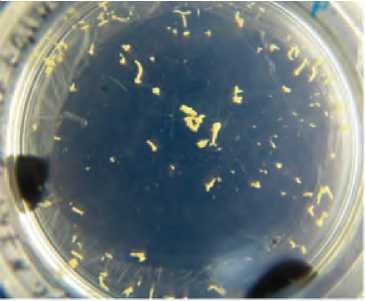
Рис. 4. Эмбриоиды в культуре микроспор на 40сутки культивирования.
Нами были цитологически изучены этапы образования эмбриоидов в культуре микроспор моркови (рис 1-4). Первые деления в культуре микроспор моркови под микроскопом были обнаружены уже через 3 дня после начала культивирования, а на 30-45 сутки эмбриоиды были хорошо видны невооруженным глазом. Было отмечено, что если продолжать культивировать эмбриоиды на питательной среде с 13% сахарозой более 60 суток, то активно начинается процесс образования вторичных эмбриоидов (рис. 3) и в последующем это может привести к ложным результатам по увеличенному количеству образовавшихся эмбриоидов за счет вторичного эмбриогенеза. Большая часть эмбриоидов при этом будет генетически идентична. В связи с этим, мы рекомендуем эмбриоиды на сердцевидной стадии развития сразу же переносить в отдельные пробирки на регенерационную среду с 2% сахарозой (рис.5-6), чтобы вести правильный учет образовавшихся эмбриоидов. Поскольку эмбриоиды образуются в культуре микроспор моркови не одновременно и часто находятся на разных стадиях развития, то перенос эмбриоидов на регенерационную среду необходимо проводить несколько раз. Одной из проблем, с которой можно столкнуться при регенерации растений моркови из эмбриоидов, полученных в культуре микроспор in vitro – это образование альбиносных или частично альби-носных растений (рис.7). Обычно эта проблема носит генотип-специфиче-ский характер. В нашем эксперименте такие растения появлялись в культуре микроспор у сортообразца Шантенэ, где процент альбиносных и частично альбиносных растений составлял около 50%.
по определению оптимальной стадии развития микроспор и пыльцы для индукции эмбриогенеза в культуре изолированных микроспор моркови. Донорные растения выращивали в защищенном грунте, бутоны срывали с соцветий первого порядка, с зонтичков краевых цветков 1-2 ряда. Закладку опыта проводили каждые 3 дня. Перед введением в культуру in vitro для определения стадии развития микроспор препараты окрашивали дифференциальным красителем. В результате этого эксперимента было подтверждено, что наибольший выход эмбриоидов наблюдается у растений моркови, находящихся в начале цветения, из бутонов в которых наибольшая часть микроспор находится на поздней одноядерной стадии развития (табл. 2). Из бутонов, содержащих тетрады и микроспоры на ранней одноядерной стадии развития, а также из бутонов с двухклеточной и зрелой пыльцой эмбриоидов получено не было. Последующие эксперименты на всех образцах проводили, отбирая бутоны только с микроспорами на поздней одноядерной стадии развития.
Таблица 3. Количество образовавшихся эмбриоидов* на различных вариантах питательной среды**
|
Сортообразец |
кол-во чашек |
среда 1 |
среда2 |
среда3 |
среда4 |
среда5 |
|
Cubic sperlings |
6 |
0 |
13±1,8 |
10± 2,7 |
13±1,1 |
2±0,4 |
|
7 кт |
6 |
0 |
0 |
0 |
72 ± 5,4 |
0 |
|
De Luc |
6 |
0 |
2,4±0,7 |
0 |
0 |
0 |
|
Nutri-Red |
6 |
0 |
4,4±0,7 |
0 |
0 |
0 |
|
Rubra Vitamina |
6 |
0 |
5,5±0,3 |
0 |
0 |
0 |
|
Saint Valery |
6 |
4±0,8 |
0 |
0 |
0 |
0 |
|
Нантская 4 |
6 |
0 |
2,2±0,7 |
0 |
0 |
0 |
|
Шантене |
6 |
5,4±0,5 |
3,5±0,6 |
0 |
0 |
19±0,9 |
|
НСР 05 |
1,3 |
3,2 |
7,2 |
1,3 |
Примечание: * - среднее количество образовавшихся эмбриоидов в одной чашке Петри на 45 сутки культивирования; **состав питательных сред: среда 1 - Ѕ NLN -13, ph 5.8; среда 2, 3, 4 – на основе среды NLN -13 с различными добавками, ph 5.8, среда 5 – на основе среды – МС с 13% сахарозой, ph 5.8

Рис. 5. Прямое развитие растения R 0 из эмбриоида на мостике из фильтровальной бумаги в прбирке на жидкой среде Мсм с 0,1 кинетина.
используя профилактические обработки коммерческим препаратом «Квадрис 250 SC, K.C.», сразу после пересадки и через 2-е суток, затем по мере необходимости. В наших опытах процент гибели растений на этапе адаптации не превышал 20-30% в зависимости от образца.
Полученные растения-регенеранты, успешно прошедшие адаптацию, практически все были удвоенными гаплоидами. Это было подтверждено прямым подсчетом числа хромосом в меристематических клетках (рис.8) и с использованием косвенного метода определения плоидности путем подсчета количества хлоропластов в замыкающих устьичных клетках (рис. 9). Часть растений – регенерантов R0 зацветала без прохождения стадии яровизации корнеплодов (рис. 10), основная же часть нуждалась в 2-3 месячной яровизации для успешного получения семян (рис.11).
Известно, что одними из важнейших факторов, влияющих на эффективность эмбриогенеза, является генотип и питательная среда (Тюкавин и др., 1999; Gorecka К. et al. 2010; Чистова А.В., 2015). Из 10 изученных в 2017 году сортообразцов на 5 различных питательных средах нам удалось получить эмбриоиды у 8 сор-тообразцов (табл. 3). Наибольший

Рис. 6. Регенерация растений R 0 .

Рис. 7. Альбиносные и частично альбиносные растения моркови сорта Шантенэ.
Для моркови критическим этапом является адаптация растений-регенерантов, полученных в условиях in vitro к условиям выращивания их in vivo. При переносе растений регенерантов в условия с влажностью, которая меньше чем в культуральном сосуде, растения быстро увядают. Предположительно это связано с ненормальным функционированием замыкающих клеток устьиц, либо их деформации, а также комплексом метаболических процессов, связанных с водным режимом. При дальнейшем культивировании в условиях in vivo у растений-регенерантов формируются новые листья с устьицами, которые нормально развиты (Huguette et al., 1993). Минимизировать эти потери можно,
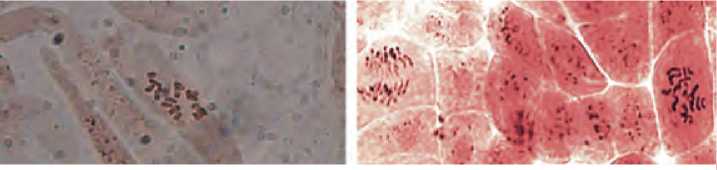
Рис. 8. Хромосомы в меристемных клетках окрашенные с использованием пропион-лакмоидно го метода (увеличение х100). А – растение – регенерант R 0 , Б – контрольное диплоидное растение
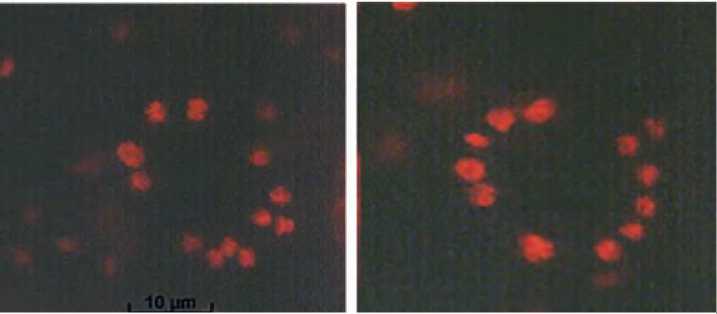
Рис. 9. Хлоропласты в замыкающих клетках устьиц (увеличение х100; флюоресценция хлоро пластов с использованием набора фильтров BR 490 и 515)
А – растение- регенерант R0, Б – контрольное диплоидное растение стемных клетках окрашенные с использованием пропион-лакмоидного метода (увеличение х100). А – растение – регенерант R0, Б – контрольное диплоидное растение

Рис. 11. Самоопыление растений-регенерантов R 0 в теплице
Рис. 10.
Растения-регенеранты R 0
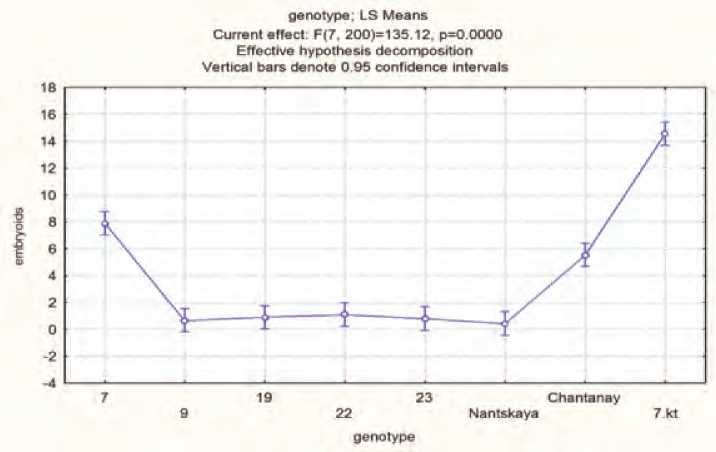
НСР 05 =1,7
Рис. 12. Образование эмбриоидов у различных генотипов моркови.
Таблица 4. Результаты двухфакторного дисперсионного анализа по влиянию генотипа и состава питательной среды на эффективность образования эмбриоидов в культуре изолированных микроспор in vitro
|
Источник вариации |
SS |
Degr. of |
MS |
F |
p |
|
межгрупповая |
3816.04 |
1 |
3816.038 |
663.5625 |
0.00 |
|
генотип |
5439.20 |
7 |
777.028 |
135.1157 |
0.00 |
|
среда |
3008.11 |
4 |
752.027 |
130.7684 |
0.00 |
|
Взаимодействие генотип*среда |
24579.49 |
28 |
877.839 |
152.6455 |
0.00 |
|
случайная |
1150.17 |
200 |
5.751 |
выход эмбриоидов наблюдали у селекционного образца 7кт (84 эмбриоида на чашку Петри). В своей работе мы провели изучение влияния этих двух факторов и их совместного действия на образование эмбриоидов у 8 генотипов моркови на 5 различных питательных средах.
Проведенный двухфакторый дисперсионный анализ (рис.12, табл.4), где генотип и среда являются определяющими факторами, показал, что генотип является главным фактором, определяющим образование эмбриоидов из микроспор. В тоже время, совместное действие обоих факторов также определяет количество образовавшихся эмбриоидов.
В результате проведенной работы нами были изучены этапы эмбриогенеза в культуре изолированных микроспор in vitro , изучены факторы, влияющие на эмбриогенез, и получены удвоенные гаплоиды (DH-растения) из 8 сортообразцов моркови столовой. Анализируя отечественный и зарубежный опыт, прослеживается перспективность разработок DH-технологий получения удвоенных гаплоидов у растений моркови столовой через культуру изолированных микроспор in vitro . Внедрение этой технологии позволит ускорить процесс создания конкурентно способных гибридов моркови.
к. с.-х.н., М., 2015. 18 с
-
• References
-
1. Bunin M.S., Litvinova M.K., Meshkov A.V. Morkov' - Daucus carota L. (Biologicheskie osobennosti, selekciya i semenovodstvo, agrotekhnika vozdelyvaniya). - M.: FGNU «Rosinformagrotekh», 2004. – 164 s.
-
2. Domblides, A.S. Razrabotka laboratornoj tekhnologii polucheniya ginogennyh raste-nij morkovi in vitro: avtoreferat dis. k. s.-h.n.M., 2001. 23 s.
-
3. Tyukavin G.B., SHmykova N.A., Monahova M.A. Citologiya ehmbriogeneza v kul'ture pyl'nikov morkovi // Fiziologiya rastenij. 1999. T. 46. № 6. S. 876-883.
-
4. Tyukavin, G.B. Biotekhnologicheskie osnovy selekcionnoj tekhnologii morkovi. M., 2007.539 s.
-
5. CHistova A.V. Sovershenstvovanie in vitro tekhnologii polucheniya udvoennyh gaploidov
-
-
6. SHmykova, N.A. Razrabotka sistemy biotekhnologicheskih metodov, napravlennyh na uskorenie selekcionnogo processa ovoshchnyh kul'tur: dis. … d-ra s-h. Nauk: 06.01.05, 03.00.23. - M., 2006.365 s.
-
7. Solov'yova L.V. Praktikum po citologii plodovyh rastenij – M.: Izd-vo MGU,1982. – 54 s.
dlya selekcii F1 gibridov morkovi na osnove samonesovmestimosti: avtoreferat dis.
k. s.-h.n., M., 2015. 18 s
Список литературы Получение DH-растений в культуре микроспор моркови
- Бунин М.С., Литвинова М.К., Мешков А.В. Морковь -Daucus carota L. (Биологические особенности, селекция и семеноводство, агротехника возделывания). -М.: ФГНУ «Росинформагротех», 2004. -164 с.
- Домблидес, А.С. Разработка лабораторной технологии получения гиногенных растений моркови in vitro: автореферат дис. к. с.-х.н.М., 2001. 23 с.
- Тюкавин Г.Б., Шмыкова Н.А., Монахова М.А. Цитология эмбриогенеза в культуре пыльников моркови//Физиология растений. 1999. Т. 46. № 6. С. 876-883.
- Тюкавин, Г.Б. Биотехнологические основы селекционной технологии моркови. М., 2007.539 с.
- Чистова А.В. Совершенствование in vitro технологии получения удвоенных гаплоидов для селекции F1 гибридов моркови на основе самонесовместимости: автореферат дис. к. с.-х.н., М., 2015. 18 с
- Шмыкова, Н.А. Разработка системы биотехнологических методов, направленных на ускорение селекционного процесса овощных культур: дис.. д-ра с-х. Наук: 06.01.05, 03.00.23. -М., 2006.365 с.
- Соловьёва Л.В. Практикум по цитологии плодовых растений -М.: Изд-во МГУ,1982. -54 с.
- Alexander M.P. Differential staining of aborted and non$aborted pollen.//Stain technol. 1969. V.44. №3. P.117-122
- Andersen S.B. Anther Culture in Carrot//Hereditas Suppl. 1985. -V.3, N 12.-P. 132.
- Gуrecka K, Krzyzanowska D, Gуrecki R (2005) The influence of several factors on the efficiency of androgenesis in carrot. J of Appl Genet 46(3):265-269.
- Gуrecka, K., U. Kowalska., D. Krzyzanowska. W. Kiszezak. Obtaining carrot (Daucus carota L.) plants in isolated microspore cultures//J Appl Genet, 2010. V. 51.P. 141-147.
- Huguette S., Maryse Т., Alain C. The ultrastructure of micropropagated and greenhouse rose plant stomata//Plant Cell, Tiss. Org. Cult. 1993. -V.32, N 2. -P. 227-233.
- Li J.-R., Zhuang F.Y., Ou Ch.-G., Hu H., Zhao Z.-W., Mao J.-H. Microspore embryogenesis and production of haploid and doubled haploid plants in carrot (Daucus carota L.).//Plant Cell Tiss. Organ Cult. 2013. V. 112 P. 275-287.
- Lichter R. Induction of haploid plants from isolated pollen of Brassica napus. Z. Pflanzenphysiol., 1982, 105: 427-434.
- Masuda K., Kikuta Y., Okazava Y. A Revision of the Medium for Somatic Embryogenesis in Carrot Suspension Culture//J. Fac. Agr. Hokkaido Univ. 1981. -Vol. 60. -P.-183-193.
- Murashige T., Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum, 1962, 15: 473-497 ( 3054.1962.tb08052.x) DOI: 10.1111/j.1399-
- Matsubara S., Dohya N, Murakami K, Nishio T, Dore C Callus formation and regeneration of adventitious embryos from carrot, fennel and mitsuba microspores by anther and isolated microspore cultures//Acta Hortic, 1995.V. 392. P. 129-137.


