Получение формальдегида на новой каталитической системе
Автор: Шумкова И.Н., Линькова Т.С., Земский Д.Н., Хабибрахманова О.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 2 (76), 2018 года.
Бесплатный доступ
Формальдегид находит широкое применение во многих областях промышленности. Увеличение потребности в формальдегиде привели к росту научных исследований, цель которых – получить наибольший выход продукта (формальдегида) при минимальных затратах на сырье, катализатор и его регенерацию, энергоносители и т.д. На промышленных установках по получению формальдегида окислительным дегидрированием метанола на катализаторе «серебро на пемзе» температура процесса поддерживается на уровне 600 ?С. В работе исследован процесс получения формальдегида окислением метанола кислородом воздуха с при совмещении катализаторов «серебро» и «серебро на пемзе» в интервале температур 250–450 ?С. Результаты показали возможность практического применения совмещенного катализатора Химико-технологически показатели процесса с использованием опытного катализатора немного ниже производственных показателей, однако, температура опытного процесса в 2 раза ниже – это позволит не только сократить энергетические затраты, но и увеличить срок службы катализатора и затраты на его регенерацию
Формальдегид, окисление, дегидрирование, серебро на пемзе, катализатор дегидрирования, катализатор окисления
Короткий адрес: https://sciup.org/140238577
IDR: 140238577 | DOI: 10.20914/2310-1202-2018-2-275-282
Текст научной статьи Получение формальдегида на новой каталитической системе
Формальдегид, как продукт окисления спиртов, находит широкое применение во многих областях промышленности и хозяйства. Основная часть формальдегида идёт на изготовление полимеров – реактопластов (фенолформальдегидные, карбамидформальдегидные и меламинофор-мальдегидные смолы), которые применяют для получения пластических масс, синтетических клеев, лаков, герметиков, пресс-композиций с различными наполнителями, древесно-волокнистых и древесно-стружечных плит, пропиточных и заливочных композиций. Формальдегид также широко используется в промышленном органическом синтезе (пентаэритрит, триметилолпропан), в медицине, фармакологии, строительстве, деревообрабатывающей промышленности, текстиле, бытовой химии [1–5].
Формальдегид – это яд, который является чрезвычайно опасным веществом. Обладает токсичностью, негативно воздействует на генетический материал, репродуктивные органы, дыхательные пути, глаза, кожные покровы. Оказывает сильное действие на центральную нервную систему. Смертельная доза 40% водного раствора формальдегида составляет 10-50 г. Приём внутрь 60–90 мл является смертельным. Симптомы отравления: бледность, упадок сил, бессознательное состояние, депрессия, затруднённое дыхание, головная боль, нередко судороги по ночам [6–10].
Промышленно освоенные способы получения формальдегида:
-
1) Окислительное дегидрирование метанола на серебряном катализаторе;
-
2) Окислительное дегидрирование метанола на оксидных катализаторах;
-
3) Окисление метанола в формальдегид;
-
4) Дегидрирование метанола в формальдегид;
-
5) Окисление природного газа и низших парафинов.
Процесс окислительной конверсии метанола в формальдегид известен уже несколько десятков лет и до сегодняшнего дня успешно используется в промышленности [2].
На промышленных установках по получению формальдегида из метанола чаше всего используют трегерные (нанесенные) серебряные катализаторы [11].
Наиболее широкое применение в качестве носителя получила пемза [2]. Пемза – механически нестойкое вещество и в процессе длительной эксплуатации (4 месяца) может подвергаться частичному разрушению. В результате чего массовая доля потерь катализатора «серебро, нанесенное на пемзу» составляет 8 – 10% и, таким образом, автоматически исключается из дальнейшего использования, так как подлежит переработке с целью утилизации серебра. Всего пемзосереб-ряный катализатор выдерживает 3–4 цикла регенерации, после чего его из-за низкой активности и селективности заменяют на новый свежий катализатор [12]. В связи с этим необходим новый способ применения серебра в качестве катализатора, дающий минимальные потери драгоценного металла и выдерживающий большее число регенерации с сохранением высоких показателей процесса
Существует достаточно большое количество предложенных катализаторов, которые могли бы быть использованы для получения формальдегида. Исследования по получению формальдегида широко велись еще с прошлого века, однако, во многих из них имеются недостатки, такие как: небольшой срок службы катализатора, который работает в области низких степеней превращения с низкой производительностью; невысокий выход формальдегида; невысокие химико-технологические параметры процесса [13–15].
В ода обр.
Т-2 Бода пр .
Вода обр.
Р-1 --------
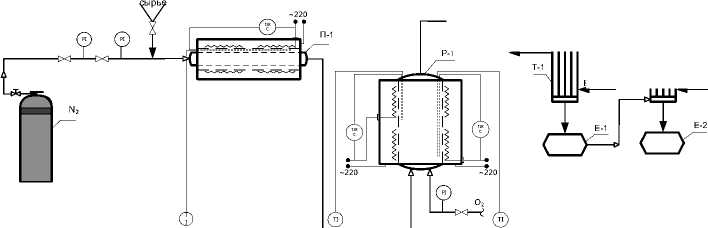
Рисунок 1. Схема получения формальдегида окислительной конверсией метилового спирта, П-1 – испаритель; Р-1 – реактор окисления; Т-1, Т-2 – прямые холодильники; Е-1, Е-2 – приемники; А-1, А-2 – абсорберы
Figure 1. Scheme of formaldehyde production by oxidative conversion of methyl alcohol, P-1-evaporator; P-1-oxidation reactor; T-1, T-2-direct refrigerators; E-1, E-2 – receivers; A-1, A-2 – absorbers
Вода пр.
Увеличение потребности в формальдегиде привели к росту научных исследований, цель которых – получить наибольший выход продукта (формальдегида) при минимальными затратах на сырье, катализатор и его регенерацию, энергоносители и т. д. Одним из примеров является способ превращения метанола в формальдегид на серебряных композициях за счет использования циклической подачи кислорода в реакционное пространство, с одной стороны, и организации посткаталитического пространства, с другой, в котором реализуются цепные превращения [16].
Изучив современные методы регенерации серебряного катализатора, можно сделать вывод, что все большую популярность приобретают способы использования новых катализаторов на основе старых, в результате которых показатели процесса увеличиваются или остаются неизменными, а затраты на регенерацию катализатора уменьшаются.
Возможно, при одновременном использовании в качестве катализатора «серебро на пемзе» и «чистое серебро» показатели процесса увеличатся, а потери драгоценного металла при утилизации «серебра на пемзе» уменьшатся.
На промышленных установках по получению формальдегида окислительным дегидрированием метанола на катализаторе «серебро на пемзе» температура процесса поддерживается на уровне 600 ºС, при этом конверсия метанола составляет около 70%, селективность образования формальдегида – около 87%.
В настоящей работе поставлена задача практическим путем определить принципиальную возможность использования совмещенного катализатора «серебро на пемзе» и «чистое серебро» при более низких температурах.
Материалы и методы
Для проведения реакции использовали технический метанол марки ОКП 24 2111 (ГОСТ 2222-95) [17], кислород воздуха и воду [18] (для уменьшения выхода побочных продуктов), а в качестве инертного растворителя – азот (ГОСТ 9293-74) [19].
Схема установки окисления представлена на рисунке 1.
Установка состоит из испарителя П-1, реактора Р-1, холодильников Т-1, Т-2, емкостей Е-1, Е-2, абсорберов А-1, А-2. В качестве инертного разбавителя используется азот, который в систему подается из баллона через расходомер, регулируемый зажимом. После смешения сырья с инертным газом масса направляется в кварцевый испаритель П-1, который состоит из двух частей: внутренней трубки для испарения и внешней рубашки. В средней части испарителя расположена обмотка, соединенная с латером для подачи и регулирования тепла. В зазоре между трубкой и рубашкой помещается термопара, соединенная с прибором, который показывает температуру в испарителе. Для устранения тепловых потерь испаритель обматывают асбестовой нитью и стеклотканью. Азот и пары сырья поступают из испарителя П-1 в нижнюю часть реактора окисления Р-1, где имеется боковой отвод для подачи кислорода воздуха посредством компрессора и пузырькового расходомера.
Кварцевый реактор Р-1 состоит из двух зон: нижней, предназначенной для смешения и подогрева реакционной массы до заданной температуры, и верхней, где располагается слой катализатора, насадки и проходит реакция окисления. В качестве катализатора используется серебро, нанесенное на пемзу, чистое серебро, медь, в качестве насадки – измельченное кварцевое стекло. Имеется две термопары: одна из них измеряет температуру верха реактора, а вторая – низа реактора. Для устранения тепловых потерь реактор обмотан асбестовой нитью и стеклотканью.
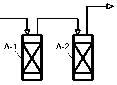
Реактор Р-1 соединяется с холодильником Т-1 через угловой переходник. Внутренняя трубка холодильника Т-1 загружается цилиндрической стеклянной насадкой. Пары продукта после конденсации стекают в приемник Е-1. После холодильника Т-1 расположен холодильник Т-2 для дополнительной конденсации паров в приемник Е-2. Далее уносимые пары поступают последовательно в абсорберы А-1 и А-2, наполненные водой и щелочью для лучшего улавливания газообразных продуктов. В течение процесса приемники и абсорберы охлаждают льдом для снижения потерь продукта.
Активными центрами катализатора дегидрирования являются поверхностные оксиды серебра, на которых сорбируются метанол и кислород. В процессе хемосорбции кислорода осуществляется перенос заряда с атомов серебра на адсорбированный кислород, и поверхность заряжается отрицательно [2].
В качестве катализатора используется серебро, нанесенное на пемзу(далее по тексту – промышленный катализатор); серебро на пемзе и чистое серебро (5:1 об. доли) (далее по тексту – опытный катализатор), в качестве насадки – измельченное кварцевое стекло.
В промышленности окислительную конверсию метанола в формальдегид на металлических катализаторах проводят в интервале температур 500–700 ºС, мольное соотношение кислорода поддерживают на уровне 0,30–0,33 моль.В настоящей работе проведены реакции при пяти температурах от 250 до 450 ºСс шагом в 50 ºС при соотношении О 2 :СН 3 ОН = 0,35 :1 и при мольных соотношениях О 2 :СН 3 ОН = = (0,15; 0,25; 0,35; 0,45) :1 с температурой 300 ºС.
Определение количественного содержания формальдегида в смеси продуктов окисления метанола провели по методу титрования; хроматографическим методом определили концентрацию веществ в анализируемой смеси (на основании которых были определены конверсия и селективность окисления метанола).
Результаты и обсуждение
Окислительное дегидрирование метанола заключается в совмещении процесса окисления и дегидрирования метанола:
СН 3 OH + 0,5О 2 → СН 2 O + Н 2 O,∆Н = 147,4 кДж/моль;
СН 3 OH→ СН 2 O + Н 2 ,∆Н =-93,4 кДж/моль [20].
Кроме превращения в целевой продукт возможно образование множества побочных веществ, таких как муравьиная кислота, метилаль, метан, углекислый газ, угарный газ, вода, водород.
СН 3 ОН + 1,5 О 2 →СО 2 + 2 Н 2 О +
682,5 кДж/моль;
СН 3 ОН + Н 2 →СН 4 + Н 2 О – 163 кДж/моль;
СН 3 ОН + О 2 →НСООН + Н 2 О +
406,1 кДж/моль;
СН 3 ОН + О 2 → СО + 2 Н 2 О + 393,6 кДж/моль;
СН 3 ОН + 0,5 О 2 →СО 2 + 2 Н 2 +
439,6 кДж/моль;
СН 3 ОН → СО + 2 Н 2 – 92,1 кДж/моль;
2 СН 3 ОН + СН 2 О → СН 2 (ОСН 3 ) 2 (метилаль) + Н 2 О + 131 кДж/моль;
СН 2 О → СО 2 + Н 2 – 5,5 кДж;
СН 2 О + 0,5 О 2 → НСООН + 260,6 кДж/моль;
СН 2 О + О 2 →СО 2 + Н 2 О + 519,2 кДж/моль;
СН 2 О + 0,5 О 2 →СО + Н 2 О + 230,3 кДж/моль;
2СН 2 О + Н 2 О→СН 3 ОН + НСООН +
122,0 кДж/моль;
СО + ½ О 2 →СО 2 + 283 кДж;
СО 2 + Н 2 → СО + Н 2 О;
Н 2 + ½ О 2 →Н 2 О + 241,8 кДж/моль;
Вследствие побочных реакций суммарный тепловой эффект процесса значительно выше, чем тепловой эффект окисления метилового спирта по первой реакции.
Хроматографический метод позволяет определить концентрацию веществ в анализируемой смеси, на основании этого мы определим конверсию и, впоследствии, селективностьсмеси продуктов окисления метанола.
С помощью газового хроматографа «Кристалл люкс 4000 М» были сняты хроматограммы исходных веществ, целевого продукта, продуктовой смеси каждого эксперимента. Однако стоит иметь ввиду тот факт, что хроматограф имеет пламенно-ионизационный детектор, который не определяет содержание таких веществ как кислород, азот, вода, оксид углерода, водород, которые также содержатся в продукте реакции, поэтому значения конверсии и селективности определяются приближенно.
Для начала необходимо определить принадлежность веществ к соответствующим пикам на хроматограмме продукта окисления метанола. Хроматограмма исходного метанола (рисунок 2) имеет своеобразный двухгорбный пик:
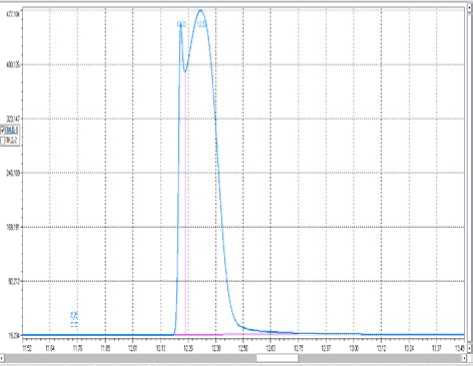
Время, мин Площадь, мв×мин Площадь,%
Time, min. Area,mv×min Area, %
12,22 12,80 15,79
12,32 68,70 84,20
Рисунок 2. Хроматограмма метанола Figure 2. Chromatogram of methanol
Была снята хроматограмма формалина (рисунок 3) , на ней вышло 3 пика, предполагаем, что средний пик отвечает формальдегиду, так как площадь этого пика, следовательно, и содержание, максимально, остальные – полимерам формальдегида.
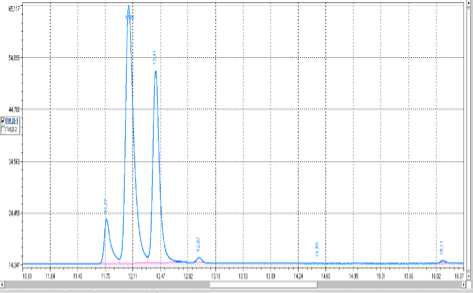
Время, мин Площадь, мв×мин Площадь,%
Time, min. Area,mv×min Area,%
11,77 0,84 7,74
12,06 6,14 56,73
12,41 3,69 34,05
Рисунок 3. Хроматограмма формалина
-
Figure 3. Chromatogram of formalin
На хроматограмме процесса окисления (рисунок 4) первый пик отвечает формальдегиду, второй – непревращенному сырью, третий и четвертый – побочным продуктам, предположительно муравьиной кислоте и диметилфор-малю (метилалю).
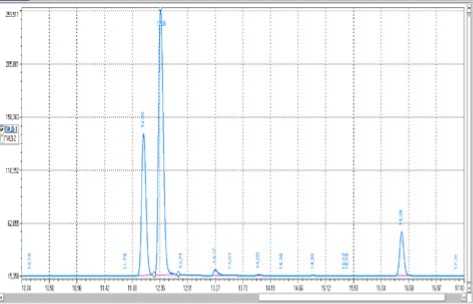
Рисунок 4. Хроматограмма окисления метанола на катализаторе «серебро на пемзе
-
Figure 4. Chromatogram of methanol oxidation on the catalyst «silver on pumice»
Изучив хроматограммы всех опытов, были рассчитаны конверсии и селективности процесса.
Исследование процесса синтеза формальдегида на промышленном и опытном катализаторах показало, что выход формальдегида с использованием промышленного катализатора плавно растет с повышением температуры (рисунок 5) . При использовании опытного катализатора выход целевого продукта растет до 300 ºС и достигает максимального значения, а затем резко снижается. Предположительно, выход целевого продукта на опытном катализаторе снижается с очень высокой скоростью из-за значительного развития образования побочных веществ.
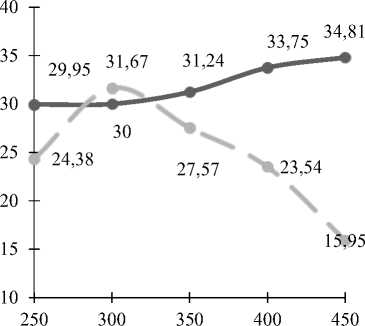
Температура, ºС | Temperature, ° C
Рисунок 5. Зависимость выхода формальдегида от температуры; – – катализатор промышленный, –– катализатор опытный
Figure 5. The dependence of the yield of formaldehyde from the temperature; – – catalyst-industrial; –– catalyst-experienced
Конверсия сырья с повышением температуры возрастает. На промышленном катализаторе конверсия метанола плавно растет с увеличением температуры (рисунок 6) .В случае с опытным катализатором конверсия растет до температуры 400 ºС, а затем резко снижается. Возможно, это происходит из–за зауглерожива-ния серебряного катализатора.
Высокие показатели опытного катализатора свидетельствуют о том, что он обладает наибольшей способностью к окислительному дегидрированию.
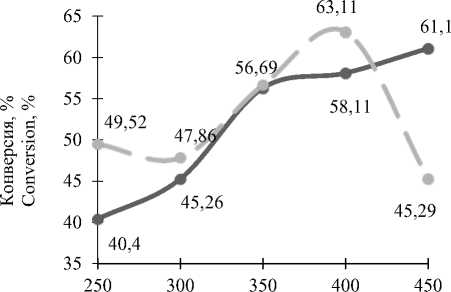
Температура, ºС | Temperature, ° C
Рисунок 6. Зависимость конверсии метанола от температуры процесса; – – катализатор промышленный, –– катализатор опытный
Figure 6. Dependence of methanol conversion on process temperature; – – catalyst-industrial; –– catalyst-experienced
Селективность процесса снижается с повышением температуры (рисунок 7) . Наибольшее значение селективностиопытного катализатора зафиксировано при температуре300 ºС. Скорее всего, с ростом температуры на опытном катализаторе значительно увеличивается доля протекания побочных реакций.
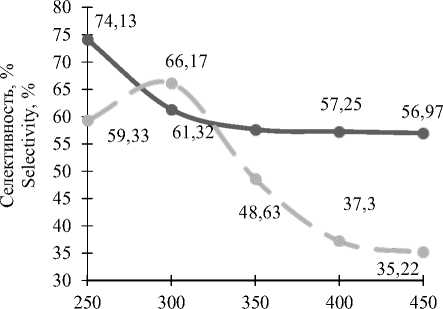
Температура, ºС | Temperature, ° C
Рисунок 7. Зависимости селективности образования формальдегида от температуры процесса; – – катализатор промышленный, –– катализатор опытный
Figure 7. Based on the selectivity of the formation of formaldehyde from the process temperature; – – catalyst-industrial; –– catalyst-experienced
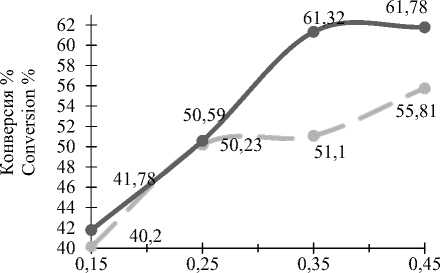
Соотношение метанола и кислорода, (1:n) Methanol-oxygen correlation, (1 :n)
Рисунок 8.Зависимость конверсии метанола от мольного соотношения подачи исходного сырья при t = 300 ºС; – – катализатор промышленный, –– катализатор опытный
Figure 8. The dependence of the methanol conversion from the molar ratio of the supply of raw materials at300; – – catalyst-industrial; –– catalyst-experienced
При использовании опытного катализатора наилучшие значения принимает селективность, а при использовании промышленного – конверсия метанола.
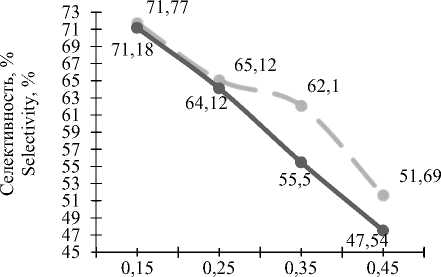
Соотношение метанола и кислорода, (1:n) Methanol-oxygen correlation, (1 :n)
Рисунок 9. Зависимость селективности от мольного соотношения подачи исходного сырья при t = 300; – – катализатор промышленный, –– катализатор опытный
Figure 9. Dependence of selectivity on the molar feed ratio at300° C; – – catalyst-industrial; –– catalyst-experienced
С увеличением количества подаваемого кислорода конверсия метанола возрастает (рисунок 8) , а селективность снижается (рисунок 9) при использовании примышленного и опытного катализаторов. Это говорит об увеличении роста числа побочных реакций на обоих катализаторах.
Заключение
В работе исследован процесс получения формальдегида окислением метанола кислородом
Список литературы Получение формальдегида на новой каталитической системе
- Перспективы//The Chemical Journal. 2016. № 24.
- Огородников С.К. Формальдегид. Л.: Химия, 1984. 280 с.
- Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. М.: Медицина, 1985. 190 с.
- Грушова Е.И., Юсевич А.И., Куис О.В. Химия и технология основного органического и нефтехимического синтеза. Лабораторный практикум: учеб. пособие для студентов по специальности «Химическая технология органических веществ, материалов и изделий». Минск: БГТУ, 2011. 141 с.
- Фенолоальдегидные смолы. Российский энциклопедический словарь. М.: «Большая российская энциклопедия», 2000. С. 1963.
- ГОСТ 4598-86 Плиты древесноволокнистые. Технические условия.
- Корольченко А.Я., Корольченко Д.А. Пожаровзрывоопасность веществ и материалов и средства их тушения. М.: Асс. "Пожнаука", 2004. 713 с.
- Гигиенические нормативы ГН 2.1.5.1315 -03. «Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования».
- Гигиенические нормативы ГН 2.1.6.1338 -03. «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест».
- Гигиенические нормативы ГН 2.2.5.1313 -03. «Предельно допустимые концентрации (ПДК) вредных веществ воздухе рабочей зоны»
- Платэ Н.А., Сливинский Е.В. Основы химии и технологии мономеров. М.: Наука: МАИК "Наука/Интерпериодика", 2002. 696 с.
- Бутенко А.Н., Отводенко С.Э., Русинов А.И., Савенков А.С. Исследование серебряных катализаторов получения формальдегида, нанесенных на алюмосиликатный носитель//Научные журналы НТУ "ХПИ": Интегрированные технологии и энергосбережение. 2004. № 4.
- Ruterana P., Buffat P.A., Prairie М., Renken A. The structure of the Na2MoO4 catalyst for water free dehydrogenation of methanol to formaldehyde//Helvetica PhysicaActa. 1989. №62. Р. 227-230.
- ПатентРФ№ 3719055 Способ получения формальдегида, 1988.
- Meyer A., Renken A. New catalysts for the dehydrogenation of methanol to water-free formaldehyde//Proc. 9th Int. Congr. Catal. 1988. V.4. P.1898-1905
- Усачев Н.Я., Круковский И.М., Канаев С.А. Неокислительное дегидрирование метанола в формальдегид//Нефтехимия. 2004. Т.44. С. 411
- ГОСТ 6709-72 Вода дистиллированная. Технические условия. М.: ФГУП Стандартинформ, 2010.
- ГОСТ 2222-95 Метанол технический. Технические условия. М.: ИПК Издательство стандартов, 2000.
- ГОСТ 9293-74 (ИСО 2435-73) Азот газообразный и жидкий. Технические условия. М.: Стандартинформ, 2007.
- Лебедев Н.Н., Монаков М.Н., Швец В.Ф. Теория технологических процессов основного органического и нефтехимического синтезов. М.: Химия, 1984.
- Мухленов И.П. и др. Общая химическая технология (часть 2, Важнейшие химические производства). М.: «Высшая школа», 1984
- Юкельсон И.И. Технология основного органического синтеза. М.: Химия, 1968.
- Usachev N. Ya., Belanova E.P., Kazakov А.V. et al.//Stud. Surf. Sci. Catal. (Zeolites and Mesoporous materials at the dawn of the 21st century). 2001. V.135. P.206.
- Methanol (CAS Reg. No. 67-56-1), Interim Acute Exposure Guideline Levels (AEGLs)//EPA, 2005: "Odor: Alcoholic odor; pungent odor when crude; pungent.
- Vale A. «Methanol». Medicine. 2007. № 35 (12). Р. 633-4 DOI: 10.1016/j.mpmed.2007.09.014


