Получение и исследование фенольных соединений из смолы узгенских углей
Автор: Осекова Гулбара Арыновна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Химические науки
Статья в выпуске: 8 т.6, 2020 года.
Бесплатный доступ
При постоянном температурном режиме экспериментально получены и исследованы фенолит натрия и пикриновая кислота. Исследована и получена фенолформальдегидная смола конденсационным полимеризационным методом. Образование параизомеры при сульфировании фенола 98%-ной серной кислотой при 1000 °C указывает на то, что скорость обратной реакции в этих условиях мала. Контроль сульфирования фенола становится доминирующим продуктом этой реакции.
Фенол, фенолит натрий, гидроксид натрия, азотная кислота, пикриновая кислота, формальдегид, смола, полимеризация
Короткий адрес: https://sciup.org/14117863
IDR: 14117863 | УДК: 662.66:547.022 | DOI: 10.33619/2414-2948/57/04
Текст научной статьи Получение и исследование фенольных соединений из смолы узгенских углей
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №8. 2020
УДК 662.66:547.022
Спирты — гидроксильные производные углеводородов различных типов. Для гидроксильных производных бензола и его гомологов, содержащих ОН-группу непосредственно у бензельного ядра, употребляют название фенолы, аналогичные производные нафталина называются нафтолами. Таким образом, спирты, фенолы и нафтолы имеют одну и ту же функциональную группу, соединенную с различными углеводородными радикалами. Наличие общей функциональной группы обусловливает далеко идущее сходство всех гидроксильных производных, но в то же время спирты явно отличаются от фенолов по некоторым свойствам. В этом проявляется влияние углеводородного радикала на гидроксильную функцию. Общий характер гидроксильных соединений можно предвидеть, анализирую природу имеющиеся в них атомов и связей [1].
Гидроксид относится к числу насыщенных функциональных групп, имеющих подвижный атом водорода и создающих частичный положительный заряд на ближайшем к функциональной группе углеродом атоме. Одним из общих свойств гидроксильных соединении является способность подвижного водорода ОН-группы замещаться на металл. В этом проявляются кислотные свойства гидроксила [2].
s
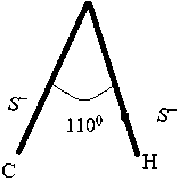
|
Энергия (кДж/моль) |
Полярность (Д) |
Поляризуемость |
|
|
С-О |
344 |
0,7 |
1,5 |
|
О-Н |
466 |
1,51 |
1,7 |
Исследованы процессы водно-щелочного экстрагирования смолы из каменного угля и получение фенола при температурном режиме 200 °C. Показано, что при экстрагирования фенола из каменноугольной смолы очень хороший результат дает буферный раствор рН=12,45 с применением бутил ацетат с раствором гашенной извести. Извлечение фенола достигает 94% [3].
Смолы низкотемпературной термохимической переработка углей содержат до 30 мас.% фенолов, структура которых, особенно компонентов, выкипающих выше 300 °C, до настоящего времени изучена крайне недостаточно. Если же учесть, что количество последних составляет около 60 мас.% (от суммарных фенолов), то становится вполне понятен тот интерес, который существуют к ним, и особенно он усилился в последние годы.
Целью настоящей работы является подробное комплексное изучение особенностей химического состава фенолов смолы узгенских углей, установление структуры отделенных фрагментов, типа их конденсации, ароматичности, замещенности различными алкильными цепями и функциональными группами, установление динамики распределения кислорода в отдельных структурах фенолов, генетической связи с исходными биологическим материалом, взаимосвязи химического состава последних с их поведением при высокотемпературном пиролизе, определение выхода фенолов в формирование группового структурно группового и компонентного состава образующихся при этом продуктов а также отдельных кинетических характеристик процесса и основаны областей применения продуктов пиролиза фенолов [4].
Коксование угля является одним из основных промышленных способов получения фенола. Каменноугольная смола, образующаяся в процессе коксования при температуре около 1000 °C без доступа воздуха, содержит фенол и другие вещества. Кумольный метод — основной промышленный способ в мировом производства фенола, был разработан и внедрен в СССР еще в 1949 г. При каталитическом окислении изопропилбензол (кумола) кислородом воздуха и последующим разложении промежуточных продуктов серной кислотой образуется фенол и ацетон [5].
Смолы скоростного пиролиза каменного угля характеризуются низким содержанием карбамидов и высоким содержанием легких фракции и суммарных фенолов, из которых до 17% — приходится на смолу низкокипящих, наиболее ценных для использования в качестве сырья для синтеза пластмасс неионогенных поверхностно-активных веществ, пластификаторов и других продуктов [6].
Фенолы труднее вступают в реакции нуклеофильного замещения гидроксильной группы, и в частности, с трудом превращаются в галоген образование. В отличие от спиртов, для фенолов — это реакция практического значения не имеет. Замещение спиртового гидроксила на аминогруппу требует довольно жестких условий. Реакция идет при пропускании смеси паров спирта с аммиаком при 300 °C над оксидом алюминия.
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №8. 2020
Фенольные гидроксилы в некоторых соединениях (нафтолах, многоатомных фенолах) могут сравнительно легко заменяться на аминогруппу при действии сульфита аммония (при Т 15 °C и под давлением около 15 атм.). Это, так называемая реакция Бухерера, применяется в технике, главным образом, для превращения В-нафтола в В-нафтиламин.
У фенолов окислители действует одновременно на функциональную группу и бензельное ядро, приводя к глубоким изменениям молекул. Один из важных моментов реакции этого типа — обратимое превращение двухатомного фенола гидрохинона в хинон [7].
В мире производится свыше 7,7 млн т фенола и свыше 4,5 млн т ацетона. В ближайшие 3–4 года количество производимого фенола возрастет приблизительно на 1,5 млн т и на 0,9 млн т — ацетона, т. е. вырастает примерно на 20%. Подавляющая часть фенола и ацетона производится с использованием кумольной технологии (97%). С учетом того что, значительная часть производного фенола и ацетона расходуется на производство карбонатных пластиков, где на 2 моль потребляемого фенола требуется только 1 моль ацетона, а другие направления не в состоянии потребить в полном объеме производимые излишки ацетона, проблема указанного дисбаланса стоит в мире достаточно остро и составляет 20–30%.
Не менее важны проблемы — снижение капитальных затрат при строительстве новых фенольных производств, снижение себестоимости производства рассматриваемых продуктов и разумеется вопросы экологии [8].
Экспериментальная часть
В процессе водно-щелочного экстрагирования смолы из узгенского каменного угля при температурном режиме — 200 °C, pH — 12,45, с применением бутил ацетат с раствором гашенной извести, извлечение фенола достигало до 94% [3].
Полученный раствор фенола помещали в сушильный шкаф — при температуре 110 °C [3]. Брали 5 г сухого фенола, 50 мл раствора дистиллированной воды и добавляли 10% раствор гидроксида натрия. В результате этой реакции образуется фенолит натрий.
C 6 H 5 OH+NaOH C 6 H 5 ONa+H2O
Фенол фенолит натрий
Происходит процесс нейтрализации и образуется соль (фенолит натрия) и вода. Здесь фенол играет роль кислоты. Полученный раствор сначала выпариваем и после этого — сушим до кристаллического состояния. При взвешивании получается 6,2 г фенолита натрия.
Из полученного фенола берем 1,5 г, насыпаем в термостойкий стакан и нагреваем при Т 43 °C, при этом — порошковый фенол переходит на жидкую фазу [3].
В конусную колбу наливаем 15 мл HNO 3 и капельно добавляем 1,5 г жидкого фенола. Хорошо перемешиваем и медленно нагреваем, в процесс этого — образуется кристаллическое вещество.
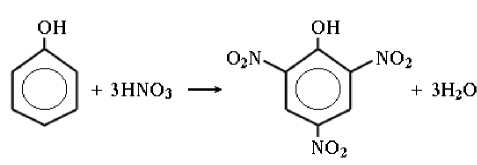
Фенол пикриновая кислота
Химическая реакция проводилась в вытяжном шкафу. Полученный осадок сушили при температуре 60 °C. Взвесили технических весах, масса пикриновая кислота составляют 1,3 г.
Из полученного фенола [3] для эксперимента технических весах взвесили 10 г фенола и нагревали при температуре 43 °C получили жидкий раствор формальдегида постепенно образуется фенолформальдегидная смола. На этом процессе происходить реакция конденсация т. е. взаимодействие двух органических соединений (фенол, формальдегид) с начала образуется орта и пара –окси метил фенол, дальнейшей реакции образуется формальдегидная смола полимер.
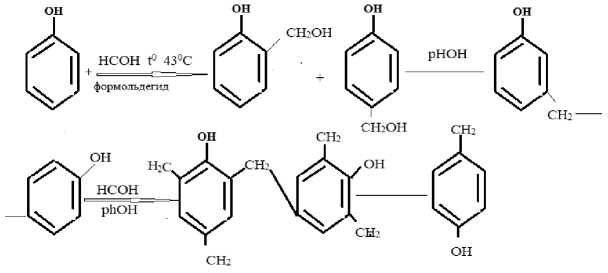
фенолформальдегидная смола [9]
Фенолформальдегидная смола постепенного переходит в твердое вещество, весом 16,4 г. Полученный фенол, формальдегидную смолу, легко определить качественной реакцией.
Для этого в термостойкую колбу наливаем 290 мл дистиллированной воды и добавляем 5 г фенолформальдегидной смолы, затем 20–30 мин кипятим, охлаждаем и фильтруем. Полученный раствор по 5 мл разливаем в 2 пробирки.
В первую пробирку добавляем 1 мл бромной воды, в пробирке образуется, осаждается белый осадок, — трибромфенол.
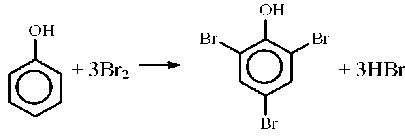
Во вторую пробирку добавляем раствор FeCL 3 , образуется фиолетовый раствор, окраска исчезает после добавления концентрированной серной кислоты. Выделяется запах фенола.
В чистую пробирку засыпаем 2 г полученного фенола и добавляем 2 мл концентрированной серной кислоты, загружаем в водяную баню при температуре 130 °C, и постепенно пипеткой добавляем 10 капель раствора фенола. Реакция происходит ступенчато, образуется дифенолэфир.
C 6 H 5 OH+HOSO 2 OH 130 °C C 6 H 5 OSO 2 OH+H 2 O фенол серная кислота
C 6 H 5 OSO 2 OH + C 6 H 5 OH 130 °C +H 2 SO 4 +C 6 H–O–C 6 H5----► дифенилэфир.
Бюллетень науки и практики / Bulletin of Science and Practice Т. 6. №8. 2020
Выводы
-
1. Исследовано и экспериментально получено: 6,2 г белого порошка фенолит натрия; при постоянном 43 °C температурном режиме — 1,3 г пикриновой кислоты.
-
2. В процессе конденсировано-полимеризационным методом — 16,4 г
-
3. Образование параизомеров при сульфировании фенола 98%-ной серной кислотой при Т 1000 °C указывают на то, что скорость обратной реакции в этих условиях мала.
-
4. Контроль сульфирования фенола становится доминирующим продуктом этой реакции.
фенолформальдегидной смолы.
Список литературы Получение и исследование фенольных соединений из смолы узгенских углей
- Потапов В. М. Органическая химия. М.: Просвещение, 1976. 367 с.
- Степаненко Б. Н. Курс органической химии. М: Высшая школа. 1981. 449 с.
- Осекова Г. А., Ташполотов Ы. Т. Исследование процесса получения фенола методом экстракции из пиролизной смолы узгенских углей водными щелочными растворами // Бюллетень науки и практики. 2019. Т. 5. №6. С. 29-32. DOI: 10.33619/2414-2948/43/04
- Афонсо М. Химический состав фенолов смолы полукоксования бурого угля Подмосковного бассейна и их термохимические превращения: автореф. дисс.. канд. хим. наук. Санкт-Петербург, 1999. 20 с.
- Кружалов Б. Д., Голованенко Б. Н. Совместное получение фенола и ацетона. М.: Госхимиздат, 1963. 200 с.
- Аманалиева С. Т. Фенолы скоростного пиролиза каменных углей. Фрунзе, 1983. С. 32-37.
- Осекова Г. А., Ташполотов Ы., Ысманов Э. М. Исследование бурых углей Алайского бассейна с применением пиролиза (без доступа воздуха) // Известия Ошского технологического университета. 2018. №1. С. 174-176.
- Закошанский В. М. Альтернативные технологии получения фенола // Российский химический журнал. 2008. №4. С. 53-71.


