Получение и комплексная оценка диагностических сывороток к антигену Yersinia pseudotuberculosis, выделенному с применением диметилсульфоксида
Автор: Иващенко Сергей Владимирович, Маниесон Виктор Эммануэль, Петченко Ксения Александровна, Спиряхина Татьяна Владиславовна, Ларионова Ольга Сергеевна
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 1, 2023 года.
Бесплатный доступ
Цель исследования - получение гипериммунных сывороток крови морской свинки и кролика с использованием антигена, выделенного при помощи диметилсульфоксида из клеток Yersinia pseudotuberculosis, а также изучение возможности комплексного использования полученных специфических антител в непрямом иммуноферментном анализе (ИФА) для обнаружения иерсиний. Для получения гипериммунных сывороток использовали смесь антигена и адъюванта в соотношении 1:1. В составе антигена преобладали белки. Его вводили животным в количестве 0,6 мг на морскую свинку и 2 мг на кролика. В качестве адъюванта применяли 1 %-й полиазолидинаммоний, модифицированный гидрат-ионами йода. Иммунизировали животных подкожно пятикратно с интервалом в 2 недели. Полученные сыворотки проявили в ИФА родовую специфичность по отношению к Yersinia enterocolitica и Yersinia pseudotuberculosis (1:6400-1:25600). Взаимодействие их с Escherichia coli, Salmonella typhimurium, Proteus vulgaris, Enterobacter aerogenes, Brucella abortus было незначительным (1:100-1:400). Комплексное использование специфичных гипериммунных сывороток крови от двух видов животных позволило провести непрямой ИФА для обнаружения антигена. Для этого адсорбировали антитела морской свинки на поверхности лунок микропланшета. Затем с помощью кроличьей сыворотки осуществили индикацию антигена, прикрепившегося к адсорбированным на микропланшете антителам морской свинки. Антитела кролика выявляли пероксидазным антивидовым конъюгатом. Комплексное использование экспериментальных сывороток позволило обнаружить энтеропатогенные иерсинии в среде накопления даже в условиях значительного фекального загрязнения исследуемого материала уже на 3-й день «холодового обогащения» при условии внесении в 1 мл среды накопления не менее 50 иерсиниозных клеток.
Гипериммунная сыворотка, антиген, диметилсульфоксид, иммуноферментный анализ
Короткий адрес: https://sciup.org/140297202
IDR: 140297202 | УДК: 579.842.23:616-097:547.279.52 | DOI: 10.36718/1819-4036-2023-1-125-130
Текст научной статьи Получение и комплексная оценка диагностических сывороток к антигену Yersinia pseudotuberculosis, выделенному с применением диметилсульфоксида
Введение. Энтеропатогенные иерсинии ( Yersinia enterocolitica и Yersinia pseudotuberculosis ) повсеместно вызывают расстройства функции желудочно-кишечного тракта у молодняка сельскохозяйственных животных. Эти расстройства известны как кишечный иерсиниоз и псевдотуберкулез.
Основным методом диагностики иерсиниозов является бактериологический, в котором ключевое значение имеет «холодовое обогащение» возбудителя на бедных питательных средах накопления [1].
Эффективность бактериологической диагностики псевдотуберкулеза и кишечного иерси-ниоза можно повысить предварительной индикацией иерсиний в средах накопления при помощи иммуноферментной тест-системы. Обязательной составной частью тест-системы являются гипериммунные сыворотки, содержащие специфические антитела. Для непрямого варианта ИФА необходимо наличие иерсиниозных сывороток, полученных от двух видов лабораторных животных [2]. Нами ранее была получена иерсиниозная гипериммунная сыворотка от кроликов [3]. В настоящей работе предпринята попытка использования морских свинок для получения антител.
Для иммунизации животных нами использовался антиген (ДА), полученный в результате обработки клеток Y. pseudotuberculosis диметилсульфоксидом. Основной химический состав ДА представлен белками [4].
Получение иммунных сывороток с высоким титром антител возможно только при использовании адъювантов, усиливающих действие антигена. Синтетические полиэлектролиты являются перспективной группой адъювантных препаратов [5]. Представителем данной группы химических соединений является полиазолидинаммоний, модифицированный гидрат-ионами йода (ПААГ).
Возможности совместного применения ПААГ и ДА Y. pseudotuberculosis для получения гипериммунных сывороток крови впервые изучались нами при иммунизации кроликов [3]. Данный эксперимент показал перспективность таких гипериммунизаций, что определило использование комплекса ПААГ + ДА Y. pseudotuberculosis при иммунизации морских свинок.
Цель исследования – получение гипериммунной сыворотки крови морской свинки путем иммунизации животного ДА Y. Pseudotuberculosis в комплексе с ПААГ, а также изучение возможности комплексного использования полученных антител с аналогичными кроличьими антителами в непрямом ИФА.
Задачи: получение гипериммунной сыворотки крови морской свинки в результате иммунизации животного ДА Y. pseudotuberculosis и ПААГ в качестве адъюванта; изучение специфичности полученной гипериммунной сыворотки крови морской свинки; совместное использование полученных антител с аналогичными кроличьими антителами в непрямом ИФА для индикации иер-синий в среде накопления с фекалиями свиней.
Объекты и методы. ДА получали из микробной культуры Y. pseudotuberculosis III О:3 серова-риантa. Специфичность гипериммунных сывороток крови морских свинок определяли при помощи формалинизированных клеток Y. Pseudotuberculosis О:1, О:3, О:4, О:5 серовариантов, Y. enterocolitica О:3, О:9 серовариантов и других видов бактерий кишечной группы, а также единого бруцеллезного антигена производства ОАО «Покровский завод биопрепаратов». Все исполь- зованные в работе штаммы бактерий были получены из музейной коллекции патогенных микроорганизмов ФКУН РосНИПЧИ «Микроб».
Методика получения ДА Y. Pseudotuberculosis заключалась в обработке сухой ацетоновой микробной массы бактерий диметилсульфоксидом. «Ацетоновый порошок» заливали диметилсульфоксидом в соотношении 1:6, инкубировали на шейкере при 37 °С 40 мин, осаждали центрифугированием при 5 тыс. об/мин и удаляли осадок. Надосадочную жидкость, содержащую ДА, диализировали против 0,01 М кар-бонатно-бикарбонатного буферного раствора (КББ) для освобождения от диметилсульфоксида. Диализ проводили 10 ч при комнатной температуре, с перемешиванием и сменой КББ. Полученный ДА лиофильно высушивали [4].
Иммунизацию морских свинок массой 400– 500 г проводили подкожно четырехкратно вдоль спины в 3–4 точки в объеме 1 мл смеси ДА и ПААГ. Соотношение адъюванта к раствору антигена составляло 1:1. ПААГ использовали в 1 %-й концентрации. ДА вводили из расчета 0,6 мг препарата на животное. Иммунизирующая доза для морской свинки была рассчитана из дозы, использованной нами ранее для иммунизации кролика, с учетом коэффициента межвидового переноса доз [6]. Было проведено 5 иммунизаций с интервалом в 2 недели. Кровь для получения сыворотки брали из сердца в процессе тотального обескровливания животного через 14 сут после последней иммунизации.
Гипериммунная сыворотка крови кролика была получена нами ранее аналогичным способом при введении 2 мг ДА на животное [3].
Полученные гипериммунные сыворотки крови морских свинок исследовали методом твердофазного непрямого ИФА [7].
-
10 %-ю взвесь свиных фекалий, отобранных в момент дефекации, обсеменяли суточными агаровыми культурами Y. enterocolitica или Y. pseudotuberculosis , а затем вносили в среду накопления (фосфатно-солевой буфер (ФСБ) pH = 7,6–7,8) таким образом, чтобы концентрации иерсиний в средах накопления составляли 5·105; 5·103; 50; 5 клеток/мл. Среды накопления с посевами инкубировали при 4 °С в течение 6 сут. Исследование сред в ИФА проводили на 3-и и 6-е сут «холодового обогащения» посевов. Для индикации иерсиний часть содержимого
пробирки после перемешивания среды вносили в лунку планшета и обрабатывали 1 %-м формалином в течение 4 ч.
Результаты и их обсуждение. Результаты оценки специфичности гипериммунных сывороток представлены в таблице 1. Полученная гипериммунная сыворотка морской свинки показала родовую иерсиниозную специфичность в
ИФА с цельными клетками бактерий. Взаимодействие с бактериями из других родов кишечной микрофлоры и бруцеллами было незначительным. Гипериммунная сыворотка крови морской свинки проявила несколько меньшую анти-тельную активность и сходную специфичность при сравнении с аналогичной кроличьей сывороткой (табл. 1).
Таблица 1
Результат определения специфичности полученных гипериммунных сывороток крови
|
Бактериальные клетки в разведении 109 на 1 мл |
Титры антител полученных сывороток в ИФА с клетками бактерий |
|
|
Сыворотка морской свинки |
Сыворотка кролика |
|
|
Yersinia pseudotuberculosis О:1 |
1:12800 |
1:25600 |
|
Yersinia pseudotuberculosis О:3 |
1:12800 |
1:25600 |
|
Yersinia pseudotuberculosis О:4 |
1:6400 |
1:12800 |
|
Yersinia pseudotuberculosis О:5 |
1:12800 |
1:12800 |
|
Yersinia enterocolitica О:3 |
1:12800 |
1:25600 |
|
Yersinia enterocolitica О:9 |
1:6400 |
1:12800 |
|
Escherichia coli |
1:200 |
1:400 |
|
Salmonella typhimurium |
1:100 |
1:100 |
|
Proteus vulgaris |
1:100 |
1:200 |
|
Enterobacter aerogenes |
1:200 |
1:200 |
|
Brucella abortus |
1:100 |
1:200 |
Для определения антигенов в исследуемом материале могут быть использованы прямой и непрямой варианты ИФА. Для проведения прямого ИФА диагностическую сыворотку необходимо конъюгировать с ферментом, что может привести к снижению чувствительности и специфичности создаваемой тест-системы. В непрямом варианте ИФА конъюгировать специфическую сыворотку не надо, поэтому непрямой вариант ИФА был признан более перспективным. Для его осуществления мы имели две специфические гипериммунные сыворотки: морской свинки и кролика. Антитела морской свинки было решено использовать для адсорбции на поверхности лунок планшета в разведении 1:200, а с помощью кроличьих антител мы осуществляли индикацию антигена в исследуемом материале, также используя разведения 1:200. Последовательность этапов проведения непрямого ИФА приведена на рисунке.
Исследуемым материалом для индикации являлась среда накопления – ФСБ, предварительно обсемененная энтеропатогенными иер-синиями и фекалиями свиней, а также подвергнутая «холодовому обогащению». Проведенная подготовка исследуемого материала позволила максимально приблизить процесс индикации к реальной ситуации, при которой наблюдается присутствие значительного количества посторонней микрофлоры и накопление корпускулярных и растворимых иерсиниозных антигенов. Результаты исследования указывают на возможность индикации энтеропатогенных иерси-ний при помощи экспериментальных сывороток на 3-й день «холодового обогащения» при условии внесении в 1 мл среды накопления не менее 50 иерсиниозных клеток, а при инокуляции 5 клеток – на 6-й день (табл. 2).
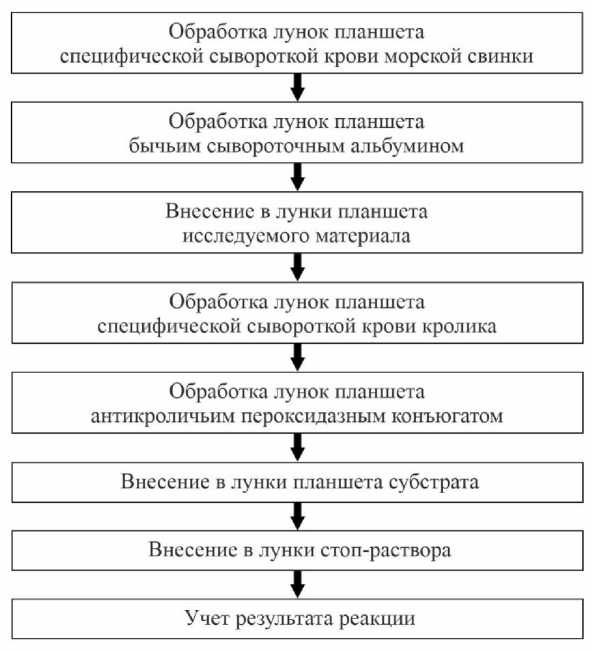
Схема проведения непрямого варианта ИФА для индикации энтеропатогенных иерсиний в средах накопления
Диагностические возможности совместного использования экспериментальных сывороток
Таблица 2
|
Кол-во бактерий, внесенных в среды накопления |
Время обогащения, сут |
|||
|
3 |
6 |
|||
|
Разведения среды, показавшие положительный результат с экспериментальными сыворотками |
||||
|
Y. pseudotuberculosis |
5·105 |
1:8 |
1:32 |
|
|
5·103 |
1:4 |
1:16 |
||
|
50 |
1:2 |
1:8 |
||
|
5 |
– |
1:4 |
||
|
Y. enteroсolitica |
5·105 |
1:4 |
1:16 |
|
|
5·103 |
1:2 |
1:8 |
||
|
50 |
Цельная |
1:4 |
||
|
5 |
– |
Цельная |
||
|
о I— о |
без фекалий |
с Y. pseudotuberculosis |
1:4 |
1:16 |
|
с Y. enteroсolitica |
1:4 |
1:16 |
||
|
с фекалиями |
Без иерсиний |
– |
– |
|
Список литературы Получение и комплексная оценка диагностических сывороток к антигену Yersinia pseudotuberculosis, выделенному с применением диметилсульфоксида
- Зыкин Л.Ф., Щербаков А.А., Хапцев З.Ю. Иерсиниоз и псевдотуберкулез сельскохозяйственных животных. Саратов, 2002. 67 с.
- Теория и практика иммуноферментного анализа / А.М. Егоров [и др.]. М.: Высш. шк., 1991. 288 с.
- Manieson V.E., Ivaschenko S.V. The use of polyazolidineammonium and dimethyl-sulfoxide antigen Yersinia pseudotuberculosis to obtain hyperimmune serum // E3S Web of Conf. 2020. 175. 03011. DOI: 10.1051/е3sconf/202017503011.
- Свойства диметилсульфоксид-фракции Yersinia enterocolitica / А. Хаджу [и др.] // Научная жизнь. 2014. № 6. С. 149-155.
- Петров Р.В., Хаитов Р.М. Иммуногены и вакцины нового поколения. М.: ГЭОТАР-Медиа, 2011. 608 с.
- Выбор дозы препарата для доклинического исследования: межвидовой перенос доз / Е.В. Шекунова [и др.] // Ведомости Научного центра экспертизы средств медицинского применения. 2020. № 1 (10). С. 19-28.
- Hornbeck P., Winston S.E., Fuller S.A. Enzyme-linked immunosorbent assays // Current Protocols in Molecular Biology. 2001. № 15. P. 15.


