Получение и оценка селекционного материала для создания F1 гибридов капусты пекинской (B.rapa ssp. pekinensis) c устойчивостью к стрессовым факторам
Автор: Заставнюк А.Д., Монахос Г.Ф., Монахос С.Г.
Журнал: Овощи России @vegetables
Рубрика: Селекция, семеноводство и биотехнология растений
Статья в выпуске: 4 (72), 2023 года.
Бесплатный доступ
Актуальность и цель исследования. Капуста пекинская - овощная культура с высоким содержанием витаминов и низкой калорийностью, ценится за возможность получать несколько урожаев в год и высокую продуктивность. В последнее время поставки овоща в Россию сократились. В Госреестре менее 70 сортов и гибридов культуры, многие восприимчивы к важнейшим заболеваниям. Необходимо удовлетворить потребительский спрос и пополнить Госреестр новыми продуктивными коммерческими гибридами с устойчивостью к стрессорам. Цель исследования состояла в оценке и создании генотипов с набором ценных хозяйственных признаков, включая устойчивость к киле, мучнистой росе, раннему стеблеванию. Материалы и методы. В качестве растительного материала были использованы линии капусты пекинской различной степени инбредности и DH, а также гибридные комбинации от скрещивания этих линий. Линии получены в 2019-2020 годах, селекционный материал для них отбирали на провокационных фонах по устойчивости к киле и толерантности к внутреннему ожогу кочанов. Использовали следующие методы: выращивание растений; выделение ДНК (метод СТАВ); ПЦР-анализ; электрофорез и визуализация результатов; оценка продуктивности и дисперсионный анализ; создании удвоенных гаплоидов в культуре изолированных микроспор in vitro; оценка устойчивости / восприимчивости к мучнистой росе. Результаты. Рекомендованы 2 генотипа с высокой продуктивностью и выровненностью в обороте лето-осень 2022 года, выявлен генотип, превысивший 3 стандарта по массе кочана в обороте весна-лето 2022 года; в результате молекулярного генотипирования проведена дифференциация 41 линии по гену устойчивости к киле CRb; получены DH растения для 4 генотипов с устойчивостью к стеблеванию, изучена их отзывчивость к эмбриогенезу; проведена оценка 18 линий на устойчивость к мучнистой росе, выделены 7 генотипов с устойчивостью к заболеванию.
Капуста пекинская, brassica rapa ssp. pekinensis, кила, p.brassicae, мучнистая роса, устойчивость, молекулярно-генетический анализ, удвоенные гаплоиды
Короткий адрес: https://sciup.org/140301890
IDR: 140301890 | УДК: 635.345:631.524.85 | DOI: 10.18619/2072-9146-2023-4-13-22
Текст научной статьи Получение и оценка селекционного материала для создания F1 гибридов капусты пекинской (B.rapa ssp. pekinensis) c устойчивостью к стрессовым факторам
Оригинальные статьи / Originalarticles УДК 635.345:631.524.85
Капуста пекинская – важный и ценный для рациона питания человека овощ, неизменный ингредиент многих диет из-за низкой калорийности и хорошего биохимического состава. Например, в ней много витамина C, В5, B2, витамина РР, противоязвенного витамина U, β-каротина, белков и клетчатки. Она содер- жит также незаменимую аминокислоту лизин, которая способствует активному очищению крови [1].
Культуру возделывают как однолетнее растение, хотя по своей природе это двулетник. Овощ любят и широко выращивают во всем мире: это Северный и Северо-Восточный Китай, Япония, Америка, Австралия, Юго-Восточная Азия [2]. Ежегодная посевная площадь пекинской капусты в Китае достигает 2,67 млн. гектаров, что составляет 15% от общей посевной площади овощей, с выходной стоимостью почти 60 млрд. юаней [2].
В странах Европы также возделывают и потребляют культуру. Так, в Польше площадь её производства ежегодно составляет 5-7 тыс. га и зависит от гибридов F1, поставляемых иностранными семеноводческими компаниями [3]. А в Австрии по данным компании Statista (2022), в 2020/21 году годовой объем потребления пекинской капусты составил около 32,6 тыс. тонн1.
Привлекательность производства культуры заключается в высокой оптовой цене реализации и спросе, высокой урожайности (до 60 т с 1 га), а также в возможности получать два урожая в год [4]. Популярность капусты пекинской в России продолжает развиваться и в промышленном, и в частном овощеводстве. В данный период в стране посевные площади увеличиваются под культуры азиатских подвидов Brassica, и снижаются под корнеплодной репой [5]. Однако значительная доля потребляемой пекинской капусты импортируется в Россию из других стран. По материалам исследований АБ-Центра (2022), импорт культуры за пять лет был сокращен примерно на 58% [4] (рисунок 1).
Поэтому необходимо иметь отечественный сортимент гибридов пекинской капусты, чтобы обеспечить импортозамещение.
По состоянию на ноябрь 2022 года в Госреестр включено 16 отечественных сортов и 52 гибрида F 1 пекинской капусты, 48% из которых зарубежные [4].
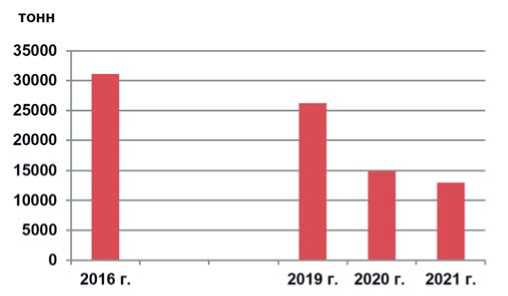
Рис.1. Объём импорта пекинской капусты в Россию
Fig.1. Importvolume ofChinese cabbage to Russia
Для сравнения, в Японии зарегистрировано более 300 гибридов. На урожайность капустных культур негативно влияют различные патогены, в том числе бактериальные, вирусные и грибковые инфекции [5]. Многие сорта и гибриды Госреестра восприимчивы к наиболее опасным патогенам. Такие заболевания, как кила (возбудитель Plasmodiophora brassicae ), верхушечный ожог (некроз капусты), альтернариоз (возбудители Alternaria brassicae , А. brassicicola ) и мучнистая роса (возбудитель Erysiphe communis f . sp. brassicae Hammarl.), хотя и не входят в перечень карантинных объектов на территории России и Евразийского экономического союза, обычно поражают значительную часть посевных площадей и приводят к ощутимой потере и снижению товарной продукции. Создание устойчивых к этим патогенам сортов является важным направлением в селекции. По состоянию на ноябрь 2022 г. устойчивость к киле имеют всего 29% гибридов капусты пекинской Госреестра, только 13% из которых отечественной селекции, менее 3% гибридов устойчивы к краевому некрозу, нет гибридов с толерантностью к альтерна-риозу.
Устойчивость к раннему стеблеванию, очень важную ввиду биологической особенности культуры, имеют всего 13% сортов Госреестра и только половина рекомендованных для выращивания растений имеют закрытую вершину кочана. Много сортов и гибридов пекинской капусты Госреестра представлены кочанными формами типа Аити (часто недостаточно устойчивыми к стеблеванию) и Чифу (с остроконечным кочаном типа «пуля»), а также гибридами этих сортотипов с сортами с полуоткрытым кочаном типа Касин (с устойчивостью к стеблеванию, но часто недостаточно устойчивыми к альтернариозу и вирусу мозаики турнепса) [1].
Для перехода на зеленое сельское хозяйство и производство органической продукции необходимы сорта и гибриды, сочетающие высокую продуктивность и товарность с комплексной устойчивостью к биотическим и абиотическим стрессовым факторам [6]. Для этого нужен селекционный материал, устойчивый к раннему стеблеванию, с высокой продуктивностью, а также с устойчивостью к заболеваниям, таким как кила, внутренний некроз, мучнистая роса.
По своей природе капуста пекинская высоко восприимчива к киле, от которой гибнет до 60% урожая [7]. Возбудитель заболевания P. brassicae – эндемичный организм, внутриклеточный паразит, который приводит к гипертрофии и гиперплазии клеток [8]. В результате разрастания паренхимной ткани корней, на корнях образуются клубневые наросты и в результате из-за блокировки проводящей системы растение не получает питание и гибнет.Покоящиеся споры возбудителя килы сохраняют патогенность до 20 лет [9]. Признано, что единственный эффективный способ справиться с заболеванием – выращивание растений с генетической устойчивостью к патогену [9]. Такие растения растут практически без применения пестицидов, к тому же происходит очищение почвы от спящих спор килы, которые прорастают, но не развиваются на корнях устойчивых растений и погибают [4]. При выращивании устойчивых растений дополнительно сохраняется до 40% урожая и это экономически целесообразно.
Лишь в конце XX века удалось получить первые устойчивые к киле (CR) гибриды культуры, когда удалось передать гены резистентности из европейского кормового турнепса ( B. rapa ssp. rapifera ) [10]. У B.rapa ssp. pekinensis и B. rapa ssp. rapifera одинаковое число хромосом ( B.rapa , 2n = 20, AA), поэтому интродукция любого признака между ними не вызывает сложности [11]. Для создания килоустойчивых гибридов и сортов различного назначения необходимо одновременно проводить отбор по CR и другим ценным хозяйственным признакам. Устойчивость, контролируемая одним доминантным геном CR, со временем может быть преодолена с высокой степенью вероятности [12]. Для придания высокой степени устойчивости к широкому спектру рас P. brassicae необходимо «пирамидиро-вать» в одном генотипе несколько доминантных генов CR или QTL [13; 14]. Всего у B. rapa удалось обнаружить не менее 19 генов / QTL резистентности к Plasmodiophora brassicae Wor., которые локализованы на шести группах сцепления [9; 14]. К ключевым генам «главного действия» относят гены CRa [15], CRb [16], Crr1 [17], и СRA05 [18].
При создании F 1 -гибридов растений Brassica в большинстве развитых стран традиционные методы классической селекции комбинируют с технологиями ускорения селекционного процесса, такими, как методы молекулярного маркирования (для отбора и «пирамидирования» генов), а также создания удвоенных гаплоидов (DH). Их применение позволяет создавать чистые линии с определёнными признаками (например, устойчивостью к киле или раннему стеблеванию) – исходный материал для скрещиваний – за 1-2 года вместо 5-6 лет традиционной селекции [19] . Наиболее эффективным и технологичным способом создания DH-линий является использование метода культуры изолированных микроспор [20]. Гаплоидные растения регенерируют in vitro из микроспор, изолированных из пыльников. Технология не универсальна, очень чувствительна к множеству факторов, тем не менее, её широко применяют для различных растений Brassica, в том числе для капусты пекинской и китайской [21]. В значительной степени на отзывчивость к микроспорогенному эмбриогенезу влияет генотип культуры. Однако основным преимуществом технологии является высокий выход эмбриоидов и, как следствие, - высокое количество удвоенных гаплоидов [22].
Цель исследования состояла в оценке и создании генотипов с набором ценных хозяйственных признаков, включая продуктивность, устойчивость к киле, мучнистой росе, раннему стеблеванию.
Материалы и методы
Растительный материал. Линии капусты пекинской произведены в 2019–2020 годах из образцов, отобранных на провокационных фонах по устойчивости к киле и толерантности к внутреннему некрозу кочанов. Изучали среднюю массу кочана 36 гибридов от скрещивания этих линий в весенне-летнем обороте и 22 гибрида в летне-осеннем обороте в 2022 г. Выделение перспективных гибридных комбинаций проводили в сравнении с лучшими стандартами: зарубежным гибридом F 1 Bilko и отечественными гибридами F 1 Ника и
F 1 Гидра. Для изоляции микроспор использовали 4 линии различной степени инбридинга: ОКС_2; ЕС 2-3 ×Е 2 ки б112; К 43-15 и К 43-12 , устойчивые к раннему стеблеванию.
Выращивание растений и оценка продуктивности. Растения гибридных комбинаций выращивали рассадным способом с использованием кассетной технологии. В весенне-летнем обороте посев семян в кассеты с торфяным субстратом произвели 20 апреля 2022 г., в открытый грунт в многолетний инфекционный фон по киле растения высаживали по схеме 45×35 см2 16 мая 2022 г. с одновременным поливом. Для летне-осеннего оборота посев семян произведен 30 июня 2022 г., в открытый грунт растения высаживали 21 июля 2022 г. по той же схеме. Полевые испытания генотипов были проведены при размещении опытных делянок методом рандомизированных повторений по 8 растений в каждой с двухкратной повторностью. Оценку продуктивности проводили в технической зрелости кочана при взвешивании по 4 растения, вычисляя среднюю массу для каждого генотипа. Растения выращивали традиционным способом.
Используемые для введения в культуру микроспор линии посажены в сентябре 2022 г в зимнюю теплицу. Яровизацию проводили в защищенном грунте в зимний период при температуре 4-6oC.
Статистический анализ. Существенность различий в проявлении признака оценивали с помощью дисперсионного анализа на 5%-ном уровне значимости.
Оценка устойчивости к мучнистой росе. Проводили в сложившихся благоприятных для развития заболевания естественных условиях в теплице для растений, посеянных в сентябре 2022 г. Оценку растений проводили по универсальной шкале для листовых пятнистостей [23]: 0 – устойчивое (отсутствие поражения); 1 – толерантное (поражение в виде отдельных белых пятен, до 10% площади листа); 2 – слабовосприимчивое (поражено от 11% до 25% поверхности; поражение в виде отдельных белых пятен, спороношение слабое); 3 – высоковосприимчивое (поражено от 25 до 50% площади листа, поражение в виде крупных пятен, спороно-шение сильное); 4 – высоковосприимчивое (поражено свыше 50% площади листа, сплошной белый налет). Оценку площади поражения проводили по эскизам листьев [24].
Изоляция и культивирование микроспор. Для изоляции микроспор при помощи штангенциркуля отбирали бутоны длиной 2,5-2,7 мм, содержащие микроспоры поздней одноядерной стадии развития. Изоляцию микроспор проводили по [25; 26]. Стерилизацию бутонов проводили в 2% гипохлорите натрия с добавлением 1-2 капель Твин-20 в течение 10 минут и промывали 3 раза в стерильной воде. Изоляцию микроспор проводили в питательной среде B5, содержащей 13% сахарозы. Простерилизованные ситечки с бутонами последовательно споласкивали в стерильной воде в течение 1, 5 и 10 минут. Бутоны помещали в одноразовые бюксы с добавлением 2 мл стерильной среды В5-13, измельчали плунжерами до суспензии и фильтровали в стерильную пробирку объемом 15 мл. Центрифугировали микроспоры 4 минуты при 800 оборотах в минуту 3 раза. Далее ресуспендировали микроспоры в 2 мл охлажденной среды NLN-13.
Определяли плотность микроспор, используя камеру Фукса-Розенталя, после чего средой для культивирования доводили до 4×104 микроспор/мл. Суспензию микроспор разливали в чашки Петри и культивировали при 33оC в течение 48 часов в полной темноте и затем переносили снова в темноту. При появлении эмбриоидов чашки Петри помещали на шейкер и инкубировали при 25оC (при 60 оборотах в минуту).
Регенерация/проращивание эмбриоидов.
Эмбриоиды в семядольной стадии развития помещали в автоклавируемые контейнеры, заполненные на 0,5–0,6 см агаризованной (1,1%) средой В5. Кислотность среды перед стерилизацией доводили до pH 5,8. Плотность размещения эмбриоидов составляла 9–12 шт. на один контейнер. Эмбриоиды культивировали при 24°C и фотопериоде 16 ч – день, 8 ч – ночь. Один раз в месяц при отсутствии развитых растений пересаживали на свежую питательную среду того же состава. При образовании из эмбриоида проростка с нормально развитыми листьями и корневой системой их пересаживали в кассеты с торфяным субстратом для адаптации.
Выделение ДНК. Проводили из молодых тканей листьев растений капусты пекинской по методике ЦТАБ согласно протоколу [27].
Полимеразная цепная реакция (ПЦР). Амплификацию геномной ДНК проводили в 15 мкл реакционной смеси, содержащей: 1×ПЦР-буфер; 0,2 мМ dNTPs; по 5–10 пМ каждого праймера; 0,25 ед.а. Taq-полимеразы и 20 нг геномной ДНК.Амплификацию проводили в амплификаторе DNA Engine® Peltier Therma Cyclers (BIO-Rad). ПЦР былавыполнена при следующих условиях: начальная денатурация при 94°С 3 мин; 35 циклов – денатурация при 94°С 30 с; отжиг при 60°С 30 с, элонгация при 72°С 1 мин; завершающая элонгация при 72°С 5 мин. Хранение – при температуре 10°C [4].
Генотипирование устойчивости к киле проводили с использованием маркера B0902 гена CRb
(F: AGCCTTGCGTAAAAGCAACTAC,
R: GTTTGGAATCCGACAAATACATCCAT) [28].
Электрофорез, визуализация и документация.
Продукты амплификации окрашивали флуоресцентным красителем GelRed (Biotium, США)и разделяли в 1%-ном агарозном геле в однократном Трис-боратном-ЭДТА-буфере при напряженности 4 Вт/см в течение 60 мин. Визуализацию и документацию электрофореграмм проводили с использованием гель-документи-рующей системы GelDoc Go (Bio-Rad) [4].
Результаты и их обсуждение
Выделение продуктивных гибридов капусты пекинской
Проведён учёт массы кочанов гибридных комбинаций, устойчивых к киле: в весенне-летнем обороте 2022 года изучали 36 гибридов, в летне-осеннем обороте 2022 года – 22 гибрида. Изучаемый материал сравнивали с лучшими коммерческими CR-гибридами отечественной и зарубежной селекции: F 1 Ника, F 1 Гидра и F 1 Bilko.
Размах вариации средних значений массы кочана оцениваемых 36 генотипов, выращиваемых в весеннелетнем обороте, составил 970,5 г. Минимальное значение средней массы кочана было у генотипа Кви дг7-
3×Кви10, максимальное – у генотипа Чи 1 мс×П 1 дг7 (табл. 1). По результатам оценки в сравнении со стандартами, выявлена лучшая гибридная комбинация Чи 1 мс×П 1 дг7 (mср=1458,25 г.), среднее значение массы которой для 5% уровня значимости превысило 3 стандарта. Три генотипа: Чи 1 мс×Квидг7, Квидг19×П 1 дг9 и К 43-12 ×Чи 1 существенно превысили по продуктивности гибрид F 1 Ника. Выделенные генотипы были с максимальным проявлением признака свыше 1000 г (табл.1).
Из таблицы 1 следует, что масса кочана слабо варьирует (CV ≤ 10%) только у четырех генотипов, не превышающих стандарты: Квидг(10)×Квидг7-2, Квидг8-2×8-1, Кви 19 ×П 1 дг2 и К 43-15 ×Квидг(10). Среднюю степень варьирования признаков (11-20%) имеют 11 генотипов (30% от общего числа): Чи 1 мс×Квидг7, Чи 1 мс×П 2 дг(13)2, Чи 1 мс×П 1 дг2-1, Чи 1 мс×К43-15, Чи 1 мс×Ес2, Квидг7-2×Квидг(10)1, Квидг19×П1дг9, Чи 1 мс×Т 52 , Кви 7 ×П 1 дг4, Кви 19 ×П 1 дг18 и Кви 8 ×П 1 дг9. Сильную вариацию признака > 20% наблюдали у остальных 21 гибридных комбинаций, что составило 58% от общего числа линий. Выделенные 4 гибридные комбинации с высокой массой кочана имели высокую и среднюю степень варьирования, при этом средние значения диаметра и высоты кочана у данных генотипов слабо варьировали (CV≤10%), что может свидетельствовать о разной плотности кочана.
Для 22 генотипов, оцениваемых в летне-осеннем обороте (июль-сентябрь 2022 года), размах вариации составил 805,16 г. Минимальное значение массы кочана было у генотипа Би 5 дг2-1xП1дг5-11, максимальное – у генотипа Би 5 дг2-1 х П1дг4-1 (табл.2). Примечательно, что у этих двух генотипов одна и та же материнская линия Би 5 дг2-1, а в генотипе с максимальной массой отцовская линия П1дг4-1 имела высокий эффект ОКС в исследовании [4] и была рекомендована к использованию для поиска «удачных» гибридных комбинаций. Можно предположить, что именно скрещивание с линией П1дг4-1 привело к «удачной комбинации», так как эффект ОКС частично определяется доминированием [29]. По результатам оценки в сравнении с двумя стандартами выявлены 10 гибридных комбинаций, значимо превысивших по массе кочана стандарт F 1 Bilko. Ни один генотип не превзошел по продуктивности F 1 Гидра, но 7 гибридных комбинаций (выделены зеленым цветом в табл.2) значимо не отличаются от него по массе для НСР 05 = 279,7 г. Лучший по массе генотип Би 5 дг2-1 х П 1 дг4-1 (m ср = 1404,56 г) (табл. 2).
Одна из 7 гибридных комбинаций с высокой массой (Кви 19 х П 1 дг9) была выделена ранее при полевых испытаниях в 2021 году и вошла в число 14 перспективных по продуктивности [4]. У данного генотипа было отмечено удачное сочетание высоких эффектов ОКС родительских линий и СКС гибридной комбинации, что подтверждает решающий вклад в генетический контроль массы кочана эффекта специфической комбинационной способности.
В 2021 году испытание данного генотипа проводили также в летне-осенний период.Примечательно, что средняя масса гибридных комбинаций, выращенных в летне-осеннем обороте (m ср = 1019,57 г), выше средней массы генотипов, выращенных в весенне-летнем обороте (m ср = 838,71 г.). Так, доля гибридов с массой свыше 1000 г во втором обороте составила 45%, а в первом – всего 8%. Это может свидетельствовать о
Таблица 1. Среднее значение и степень изменчивости массы кочана гибридных комбинаций капусты пекинской (весна-лето, 2022) Table 1. The average value and degree of variability of the head weight of hybrid combinations of Chinese cabbage (spring-summer, 2022)
|
№ |
Генотипы |
Средняя масса, г |
Коэффициент вариации, % |
№ |
Генотипы |
Средняя масса, г |
Коэффициент вариации, % |
|
1. |
Чи 1 мс×Квидг7 |
1151,00 |
17,3% |
19. |
К 43-15 ×Чи 1 |
961,50 |
21,7% |
|
2. |
Чи 1 мс×Квидг8 |
816,31 |
31,1% |
20. |
Квидг7-3×7-1 |
782,00 |
30,6% |
|
3. |
Чи 1 мс×П2дг(13)2 |
720,50 |
18,1% |
21. |
Квидг7-3×8-1 |
724,75 |
29,7% |
|
4. |
Чи 1 мс×П 1 дг2-1 |
786,00 |
18,9% |
22. |
Квидг19×П 1 дг9 |
1086,00 |
14,5% |
|
5. |
Квидг(10)×Квидг7-2 |
663,50 |
6,5% |
23. |
К 43-12 ×Чи 1 |
1157,13 |
26,7% |
|
6. |
Кви дг8-1×8-2 |
626,75 |
34,4% |
24. |
Чи 1 мс×П2дг13 |
593,75 |
36,4% |
|
7. |
Чи 1 мс×К 43-15 |
513,25 |
16,3% |
25. |
Кви дг7-2×Чи 1 |
708,50 |
24,2% |
|
8. |
Чи 1 мс×П 6 дг2 |
773,13 |
39,2% |
26. |
Чи 1 мс×Т52 |
880,75 |
15,3% |
|
9. |
Кви дг7-3× Кви 10 |
487,75 |
21,9% |
27. |
Чи 1 мс×П 1 дг7 |
1458,25 |
28,9% |
|
10. |
Кви дг7-4× Квидг10 |
857,75 |
26,0% |
28. |
Кви 7 ×П 1 дг4 |
765,63 |
16,4% |
|
11. |
Кви 10 ×П 1 дг2 |
956,63 |
33,0% |
29. |
Кви 5 ×П 1 дг8 |
748,50 |
23,9% |
|
12. |
Кви3×П 1 дг1 |
864,50 |
22,1% |
30. |
Кви 19 ×П 1 дг2 |
783,00 |
9,8% |
|
13. |
К 43-12 ×Квидг7-2 |
857,75 |
27,6% |
31. |
Кви 19 ×П 1 дг18 |
772,75 |
12,4% |
|
14. |
Кви дг8-2×8-1 |
963,75 |
9,4% |
32. |
Кви 8 ×П 1 дг9 |
679,75 |
10,4% |
|
15. |
Чи 1 мс×Ес2 |
849,75 |
16,4% |
33. |
Кви 10 ×П 1 дг5 |
921,50 |
20,1% |
|
16. |
Чи 1 мс×П 1 дг4 |
865,00 |
22,7% |
34. |
Чи 1 мс×Кви 7 |
938,63 |
30,3% |
|
17. |
Кви8×П1дг8 |
743,38 |
26,2% |
35. |
К43-12×Квидг(10) |
575,50 |
23,1% |
|
18. |
Квидг7-2× Квидг(10)1 |
933,00 |
13,8% |
36. |
К 43-15 ×Квидг(10) |
763,25 |
4,6% |
Примечание. НСР 05 масса кочана = 256,25 г. Средняя масса кочана 3 стандартов: Ника F 1 (816,5 г), Гидра F 1 (996,75 г), Bilko F 1 (1168,25 г). Зеленым цветом выделена гибридная комбинация, превышающая 3 стандарта, синим выделены генотипы, превзошедшие Ника F 1 .
Note. LSD 05 the cabbage head weight = 256.25 g. The average weights of the cabbage head of 3 hybrid standards are: F 1 Nika (816.5 g), F 1 Hydra (996.75 g), F 1 Bilko (1168.25 g). The hybrid combination that surpassed 3 standards is highlighted in green, the genotypes that surpassed the F 1 Nika are highlighted in blue.
Таблица 2. Среднее значение и степень изменчивости массы кочана гибридных комбинаций капусты пекинской (лето-осень, 2022 год) Table 2. The average value and degree of variability of the head weight of hybrid combinations of Chinese cabbage (summer- autumn, 2022)
|
№ |
Генотипы |
Средняя масса, г |
Коэффициент вариации% |
№ |
Генотипы |
Средняя масса, г |
Коэффициент вариации % |
|
1. |
К 43-15 x Чи 1 |
894,50 |
14,2% |
12. |
Би 5 дг2-1 х П 1 дг4-1 |
1404,56 |
9,7% |
|
2. |
Би 5 дг2-1 x П 1 дг5-11 |
599,40 |
9,5% |
13. |
К 43-12 х Квидг(16) |
940,57 |
17,5% |
|
3. |
П 1 дг7-1 х Би 5 дг2-1 |
934,14 |
35,1% |
14. |
Ги 13 х Би 5 дг |
812,00 |
15,7% |
|
4. |
Би5дг2 х Т52 |
956,13 |
19,7% |
15. |
Би 5 дг7-1 х Квидг8-2 |
977,00 |
38,9% |
|
5. |
П1дг4-11 х Би5дг2-1 |
780,71 |
30,1% |
16. |
Кви 5 дг2 х Квидг7-1 |
1156,63 |
41,4% |
|
6. |
Кви 19 х П 1 дг9 |
1227,25 |
35,4% |
17. |
Би 5 дг2 х П 1 дг2 |
1201,83 |
11,4% |
|
7. |
Би5дг2-1 х П1дг7-1 |
1052,64 |
30,0% |
18. |
Квид7 х Би5дг2-1 |
1260,75 |
37,9% |
|
8. |
Квидг(15)1 х Би 5 дг2 |
1142,00 |
26,1% |
19. |
Квидг8-2 х Би 5 дг2-1 |
1229,17 |
15,2% |
|
9. |
П2дг2-11 х Би5дг2 |
1369,33 |
24,1% |
20. |
Би 5 дг2-2 х Квидг(15) |
1010,25 |
15,7% |
|
10. |
П 1 дг8-1 х Би 5 дг2-1 |
919,45 |
33,3% |
21. |
Кви 3 х П 1 дг1 |
876,63 |
21,2% |
|
11. |
Би 5 дг2 х Квидг(16) |
789,08 |
27,0% |
22. |
Кви 10 х П 1 дг2 |
790,88 |
20,4% |
Примечание. НСР 05 масса кочана = 279,7 г. Средняя масса кочана стандартов: Гидра F 1 (1424,25 г), Bilko F 1 (720,63 г). Зеленым цветом выделены гибридные комбинации, превзошедшие Bilko F 1 и значимо не отличающиеся от Гидра F 1 , синим цветом выделены генотипы, превысившие по массе кочана 1 стандарт.
Note. LSD 05 the cabbage head weight = 279.7 g. The average weights of the cabbage head of standards of hybrids are: F 1 Hydra (1424.25 g), F 1 Bilko (720.63 g). The hybrid combinations that have surpassed F 1 Bilko and are not significantly different from F 1 Hydra are highlighted in green, the genotypes that have exceeded the F 1 Bilko by cabbage head weight are highlighted in blue.
сложившихся благоприятных условиях для выращивания генотипов во втором обороте, так как среднесуточные температуры находились в оптимальном для культуры диапазоне 15-23ºC.
Масса кочана слабо варьирует всего у двух генотипов: Би 5 дг2-1 x П 1 дг5-11 и у генотипа с максимальной массой Би 5 дг2-1хП 1 дг4-1. Семь генотипов, в том числе Би5дг2 х П 1 дг2 и Квидг8-2 х Би 5 дг2-1 с высокой массой, имели среднюю степень варьирования признаков, остальные 13 генотипов сильно варьировали по массе (CV более 20%).
В совокупности, по выровненности и продуктивности выделены 2 лучшие гибридные комбинации: Би5дг2-1 х П1дг4-1 (mср=1404,56 г) и Би 5 дг2 х П 1 дг2 (m ср = 1201,83 г).
Изучение устойчивости линий капусты пекинской к мучнистой росе
Мучнистая роса (возбудитель: Erysiphe cruciferarum Opiz ex L. Junell.) обычно поражает все капустные культуры при сложившихся благоприятных для заболевания условиях (жаркая погода и наличие влажной среды для прорастания конидий возбудителя, частые туманы).
Первые симптомы заболевания можно наблюдать в виде белых округлых пятен с белым мучнистым мицелием на верхней и нижней поверхности листа. По мере развития заболевания эти пятна сливаются, и вскоре вся поверхность листа покрывается порошкообразным налетом [7]. Поврежденная листовая поверхность становится более восприимчивой к другим патогенам.
Моногенная доминантная устойчивость к настоящей мучнистой росе встречается у капусты белокочанной. У капусты пекинской генов вертикальной устойчивости пока не обнаружено [7]. Важной селекционной работой является оценка устойчивости к заболеванию растительного материала.
Были оценены 18 линий капусты пекинской, посеянные в сентябре 2022 г в зимнюю теплицу (см. табл. 3). Оценка проявления симптомов заболевания была проведена в апреле 2023 г. Определяли степень болезнеустойчивости растений капусты пекинской на естественном инфекционном фоне по 4-балльной шкале (рис. 2). За устойчивые принимали растения с поражением 0-1 балла, за восприимчивые – с поражением 2-4 балла. Оценивали фактическое количество пораженных растений каждой линии (от 1 до 5) и процент распространённости болезни.
В результате оценки поражения (см. табл. 3) генотипы были разделены на группы по устойчивости к патогену:
-
• Устойчивые (К 43-12 , К 43-15 , Квидг12-2, ОКС2, Би 5 дг2-1, Чи 1 -0, Orient Q);
-
• Высоковосприимчивые (Чи1мс×Квидг7, Чи1мс×Квидг8, П 1 дг4-12, П 2 дг2-1);
-
• Слабовосприимчивые (Квидг7-2 цв, Квидг8-2, Квидг10-1, П 2 дг7-1, Чи 1 мс×ЧиI, Чи 1 -6 цв F, ЕС 2-3 ×Е 2 ки б112).
Таким образом, выявлено 7 устойчивых и толерантных к мучнистой росе генотипов, которые можно рекомендовать для проведения дальнейших испытаний и включения в селекционный процесс для создания гибридов с устойчивостью к стрессовым факторам.

A) 0 баллов

B) 1 балл

C) 2 балла

D) 3 балла
Рис.2.Поражение капусты пекинской мучнистой росой от 0 до 4 баллов

F) 4 балла
Таблица 3. Оценка поражения линий капусты пекинской мучнистой росой Table 3. Evaluation of the damage to Chinese cabbage lines from powdery mildew
|
№ |
Генотип |
Балл поражения растений |
Развитие болезни, % |
Устойчивость |
||||
|
1 |
2 |
3 |
4 |
5 |
||||
|
1. |
Чи 1 мс×Квидг7 |
4 |
4 |
– |
– |
– |
100% |
высоковосприимчивое |
|
2. |
Квидг7-2 цв |
2 |
2 |
– |
– |
– |
50,00% |
cлабовосприимчивое |
|
3. |
Квидг8-2 |
1 |
2 |
– |
– |
– |
37,50% |
cлабовосприимчивое |
|
4. |
Квидг12-2 |
1 |
1 |
– |
– |
– |
25,00% |
толерантное |
|
5. |
Квидг10-1 |
1 |
2 |
– |
– |
– |
37,50% |
cлабовосприимчивое |
|
6. |
Чи 1 мс×Квидг8 |
3 |
3 |
– |
– |
– |
75,00% |
высоковосприимчивое |
|
7. |
К 43-12 |
1 |
– |
– |
– |
– |
25,00% |
толерантное |
|
8. |
К 43-15 |
0 |
0 |
– |
– |
– |
0,00% |
устойчивое |
|
9. |
ОКС2 |
1 |
– |
– |
– |
– |
25,00% |
толерантное |
|
10. |
Би 5 дг2-1 |
1 |
1 |
0 |
– |
– |
25,00% |
толерантное |
|
11. |
П 1 дг4-12 |
3 |
3 |
3 |
2 |
2 |
65,00% |
высоковосприимчивое |
|
12. |
П 2 дг7-1 |
1 |
2 |
2 |
2 |
– |
43,75% |
cлабовосприимчивое |
|
13. |
П 2 дг2-1 |
4 |
4 |
3 |
– |
– |
91,66% |
высоковосприимчивое |
|
14. |
Чи 1 -0 |
0 |
– |
– |
– |
– |
0,00% |
устойчивое |
|
15. |
Orient Q |
1 |
1 |
1 |
– |
– |
25,00% |
толерантное |
|
16. |
Чи 1 мс×ЧиI |
2 |
2 |
2 |
2 |
2 |
50,00% |
cлабовосприимчивое |
|
17. |
Чи 1 -6 цв F |
1 |
2 |
2 |
– |
– |
41,66% |
cлабовосприимчивое |
|
18. |
ЕС 2-3 ×Е2 ки б112 |
2 |
2 |
– |
– |
– |
50,00% |
cлабовосприимчивое |
Создание удвоенных гаплоидов капусты пекинской в культуре изолированных микроспор in vitro и отзывчивость генотипов
Методы биотехнологии позволяют создавать линии с заданными свойствами, например, ценными хозяйственными признаками и генами устойчивости сразу к нескольким возбудителям заболеваний. Для создания DH-растений в культуре изолированных микроспор использовали 4 селекционных образца с важной для культуры устойчивостью к раннему стеблеванию: ОКС_2; ЕС 2-3 ×Е 2 ки б112; К 43-15 и К 43-12 . Все указанные генотипы были созданы с помощью инфекционных фонов по устойчивости к киле и толерантности к верхушечному ожогу кочана. Дополнительно генотипы К 43-12 , К 43-15 и ОКС_2 обладают устойчивостью к мучнистой росе, а линия ОКС_2 перспективна для получения высокоурожайных гибридов.
Использовали бутоны с размером 2,5-2,7 мм согласно литературным данным [25]. Происходило успешное развитие эмбриоидов (рис. 3A, 3B), которые в дальнейшем развивались в полноценные растения (рис. 3С).
Были изучены сортовые различия в эмбриогенезе данных генотипов пекинской капусты ( Brassica rapa L. ssp. pekinensis ). Как известно, эмбриогенная способность зависит от множества факторов, но одним из ключевых моментов при работе с культурой микроспор in vitro является генотип донорных растений [21].
Селекционные образцы были разделены на группы по отзывчивости к эмбриогенезу (табл. 4). Для оценки эмбриогенной способности B.rapa ssp.pekinensis в культуре изолированных микроспор нами предложена следующая шкала (число эмбриоидов в пересчете на 100 бутонов): 0 шт./100 бут. – неотзывчивый; 1 - 500 шт./100 бут. – низко отзывчивый; 501 - 2000 шт./100 бут. – средне отзывчивый; ≥ 2001 шт./100 бут. – высоко отзывчивый [31]. Согласно данной шкале к средне отзывчивым отнесли генотип ЕС2-3×Е2 ки б112, с частотой эмбриогенеза более 500 эмбриоидов на 100 бутонов. Генотипы K43-12, K43-15 и ОКС_2 оказались низко отзывчивыми к эмбриогенезу (до 500 эмбриоидов на 100 бутонов). Адаптировать удалось растения-регенеранты для всех 4 генотипов.
Всего было получено 498 эмбриоидов (~ 77% от общего числа из 649 бутонов), из них:
-
• 3 эмбриоида – получено из донорного генотипа ОКС_2;
-
• 180 эмбриоидов – получено из донорного генотипа K 43-12 ;
-
• 9 эмбриоидов – получено из донорного генотипа K 43-15 ;
-
• 306 эмбриоидов – получено из донорного генотипа Е С2 -3×Е 2 ки.
Молекулярное генотипирование коллекции образцов линий на устойчивость к киле
Для изучения генов устойчивости к киле линий капусты пекинской было проведено молекулярное генотипирование с ДНК маркером B0902 F/R на ген устойчивости CRb.

A) Эмбриоиды в жидкой среде NLN-13 Embryos in a NLN-13 liquid medium
B) Прорастающие эмбриоиды на среде B5 Shooting of embryos on medium B5

C) Укоренение и адаптация растений-регенерантов (К 43-12 ) Rooting and adaptation of regenerated DH-plants (К 43-12 )
Рис. 3.Развитие DH-растений капусты пекинской в культуре изолированных микроспор
Fig. 3. DevelopmentofChinese cabbage DH-plantembryoids in isolated microspore culture
Проведение отбора с помощью маркеров для ранних этапов селекционного материала способствует значительному сокращению трудоёмкости исследований. Фенотипическая оценка линий не проводилась, результат генотипирования основан на работе маркера гена CRb. Линии Кви 4 и Кви 9 использовали для проверки результатов маркирования в качестве контроля восприимчивости. Эти линии ранее в 2021 г. проверялись на искусственном инфекционном фоне к киле [4] и проявили восприимчивость с максимальным баллом поражения 3 балла по шкале [32]. В соответствии с рис.4 наблюдаются целевые фрагменты, ассоциированные с рецессивным аллелем восприимчивости размером 241 п.н. у пяти линий: Кит 1 -3Са 1 бут; Кви 4 , Кви 9 , Би 5 дг бут и ЕС 2-3 -2102 бут.
У остальных 33 линий (кроме Ха6-111-4; Чи 1 мс×Квидг8 и Квидг(16) 2 бут) наблюдаются целевые фрагменты,ассоциированные с аллелем устойчивости, размером 160 п.н. (рис.4). Присутствие двух аллелей гена CRb наблюдается у 8 генотипов: П 1 дг4-1, Чи 1 мс×П 1 дг9, Чи 1 мс×П 1 дг21, Чи 1 мс×Чи 1 , ЕС 2 -3×Ес ки б112, ЕС2×ЕС ки б212, Orient Queen и Чи 1 мс×Квидг7, что свидетельствует о разных проявлениях гена. Ген Crb относят к генам «главного действия», он был обнаружен в 2013 г. у капусты китайской CR Shinki, локализован в 3 хромосоме [15]. Линии Ха6-111-4; Чи 1 мс×Квидг8 и Квидг(16) 2 бут, у которых не было обнаружено фрагмента амплификации, могут содержать другой ген устойчивости к киле.
Таблица 4. Отзывчивость генотипов в культуре изолированных микроспор in vitro Table 4. Responsiveness of genotypes in culture of isolated microspores in vitro
|
Генотип |
Число эмбриоидов/100 бутонов |
Группа отзывчивости |
|
К 43-15 |
40,63±13,26 |
низко отзывчивый |
|
К 43-12 |
415,69±177,07 |
низко отзывчивый |
|
ОКС_2 |
8,82±4,16 |
низко отзывчивый |
|
ЕС 2-3 ×Е 2 ки б112 |
608,66±19,69 |
средне отзывчивый |

Рис.4.ПЦР-анализ образцов капусты пекинской маркером B0902 гена CRb;
M- DNA-size marker;НК - negative control;160 bp is the size ofthe expected amplicon ofthe resistance allele;
Выводы
В результате полевого испытания устойчивых к киле 36 гибридных комбинаций капусты пекинской в обороте весна-лето 2022 г. выделен генотип Чи1мс×П1дг7 (mср = 1458,25 г.), значимо превысивший 3 стандарта по массе кочана. Однако коэффициент вариации признака у генотипа был значительным (CV более 20%), что может свидетельствовать о разной плотности кочанов и низкой морфологической выровненности.Во втором обороте из 22 гибридных комбинаций в совокупности по выровненности и продуктивности выделены 2 перспективные с закрытой вершиной кочана гибридные комбинации: Би5дг2-1 х П1дг4-1 (mср = 1404,56 г) и Би5дг2 х П1дг2 (mср = 1201,83 г), которые рекомендованы для расширенного сортоиспытания генотипов с ценными хозяйственными признаками, включая устойчивость к киле.
В результате оценки симптомов поражения мучнистой росой на естественном инфекционном фоне из 18 линий капусты пекинской были выделены 7 устойчивых к патогену: К 43-12 ; К 43-15 ; Квидг12-2; ОКС_2; Би 5 дг2-1; Чи 1 -0; Orient Q, которые рекомендованы для включения в селекционные испытания для создания гибридов с устойчивостью к стрессорам.
В культуре изолированных микроспор на основе 4 селекционных образцов, ЕС 2-3 ×Е 2 ки б112; ОКС_2; К 43-15 и К 43-12 , устойчивых к раннему стеблеванию, создана коллекция DH-линий.Селекционный материал для всех линий получен на инфекционном фоне по устойчивости к киле и толерантности к верхушечному ожогу. Дополнительно генотипы К 43-12 , К 43-15 и ОКС_2 показали устойчивость к мучнистой росе. Это позволит получить гибриды с набором ценных хозяйственных признаков, включая устойчивость к раннему стеблеванию, резистентность сразу к нескольким возбудителям заболевания и высокую продуктивность (благодаря перспективной линии ОКС_2). Самую высокую отзывчивость к эмбриогенезу из 4 генотипов проявил генотип ЕС 2-3 ×Е 2 ки б112 (частота образования эмбриоидов 608,66±19,69 штук на 100 бутонов).
В результате молекулярного генотипирования была проведена дифференциация 41 линии капусты пекинской по гену «главного действия» устойчивости к киле CRb . Ген Crb обнаружен у подавляющего большинства линий (~ 80%). Требуется дифференцировать линии по другим CR-генам для пирамидирования различных генов в одном генотипе и создания гибридов с надежной устойчивостью к заболеванию.
Об авторах:
Анастасия Дмитриевна Заставнюк – аспирант кафедры ботаники селекции и семеноводства садовых растений, младший научный сотрудник, автор для переписки, , ; ResearcherID: ADP-6159–2022 Григорий Федорович Монахос – кандидат с.-х. наук, генеральный директор,
Сократ Григорьевич Монахос – доктор с.-х. наук, профессор, заведующий кафедрой ботаники, селекции и семеноводства садовых растений, , Researcher ID: L-5962-2013, Scopus Author ID: 56052882900
Aboutthe Authors:
Anastasia D. Zastavnyuk – PhD student, Department of Botany, Plant Breeding and Seed Technology; Junior Researcher, Correspondence Author, ; ; ResearcherID: ADP-6159–2022 Grigory F. Monakhos – Cand. Sci. (Agriculture), General Director,
Sokrat G. Monakhos – Dr. Sci. (Agriculture), Prof., Head of the Department Botany, Plant Breeding and Seed Technology, ,
Researcher ID: L-5962-2013, Scopus Author ID: 56052882900
Список литературы Получение и оценка селекционного материала для создания F1 гибридов капусты пекинской (B.rapa ssp. pekinensis) c устойчивостью к стрессовым факторам
- Артемьева А.М., Соловьева А.Е. Генетическое разнообразие и биохимическая ценность капустных овощных растений рода Brassica L. Вестник НГАУ. Биология. 2018;4(49):50-61. https://doi.org/10.31677/2072-6724-2018-49-4-50-61 [Artem'eva A.M., Soloveva A.E. Genetic diversity and biochemical value of cabbage vegetable plants of the genus Brassica L. Vestnik NGAU. Biologiya. 2018;4(49):50-61. https://doi.org/10.31677/2072-6724-2018-49-4-50-61 (In Russ.)]
- Yuan J., Shen C., Yuan R. et al. Identification of genes related to tipburn resistance in Chinese cabbage and preliminary exploration of its molecular mechanism. BMC Plant Biol. 2021;567(21):1-12. https://doi.org/10.1186/s12870-021-03303-z
- Kamiński P., Podwyszyńska, M., Starzycki M. et al. Interspecific hybridisation of cytoplasmic male-sterile rapeseed with Ogura cytoplasm and Brassica rapa var. pekinensis as a method to obtain male-sterile Chinese cabbage inbred lines. Euphytica. 2016;(208):519-534. https://doi.org/10.1007/s10681-015-1595-9
- Заставнюк А.Д., Монахос Г.Ф., Вишнякова А.В., Миронов А.А., Монахос С.Г. Генотипирование устойчивости к киле и оценка комбинационной способности капусты пекинской. Известия Тимирязевской сельскохозяйственной академии. 2022;(5):77- 91. https://doi.org/10.26897/0021-342X-2022-5-77-91. EDN WDBKXQ.[Zastavnyuk A.D., Monakhos G.F., Vishnyakova A.V., Mironov A.A., Monakhos S.G. Chinese cabbage clubroot resistance genotyping and evaluation of combining ability. Izvestiya of Timiryazev Agricultural Academy. 2022;(5):77-91. (In Russ.)] EDN WDBKXQ.
- Беренсен Ф.А., Антонова О.Ю., Артемьева А.М. Достижения и перспективы молекулярно-генетического маркирования устойчивости к некоторым патогенам у видов рода Brassica L. Вавиловский журнал генетики и селекции. 2019;23(6):656-666. https://doi.org/10.18699/VJ19.538. [Berensen F.A., Antonova O.Yu., Artemeva A.M. Achievements and prospects of molecular genetic marking of resistance to certain pathogens in species of the genus Brassica L. Vavilov Journal of Genetics and Breeding. 2019;23(6):656-666. https://doi.org/10.18699/VJ19.538 (In Russ.)]
- Монахос С.Г., Воронина А.В., Байдина А.В., Зубко О.Н. Селекция растений на устойчивость-основа защиты от болезней в органическом земледелии. Картофель и овощи. 2019;(6):38-40. https://doi.org/10.25630/PAV.2019.92.83.009 [Monahos S.G., Voronina A.V., Bajdina A.V., Zubko O.N. Plant breeding for sustainability is the basis of protection against diseases in organic farming. Potato and vegetables. 2019;6:38-40 (In Russ.). https://doi.org/10.25630/PAV.2019.92.83.009 (In Russ.)]
- Монахос Г.Ф., Монахос С.Г. Капуста пекинская. Биологические особенности, генетика, селекция и семеноводство. Монография. Москва: Издательство РГАУ-МСХА имени КА Тимирязева; 2009. [Monakhos G.F., Monakhos S.G. Chinese cabbage Brassica rapa L.Em. Metzg. ssp. pekinensis (Lour.) Hanelt. Biological characteristics, genetics, breeding and seed production. Monograph]. M.: Izd-vo RGAU-MSKhA imeni K.A. Timiryazeva. 2009. 182 р. (In Russ.)]
- Malinowski R., Truman W., Blicharz S. Genius architect or clever thief-How Plasmodiophora brassicae reprograms host development to establish a pathogen oriented physiological sink. Molecular Plant-Microbe Interactions. 2019;32(10):1259-1266. https://doi.org/10.1094/MPMI-03-19-0069-CR
- Wenjing R., Zhiyuan L., Fengqing H. et al. Utilization of Ogura CMS germplasm with the clubroot resistance Y. gene by fertility restoration and cytoplasm replacement in Brassica oleracea L. Horticulture research. 2020;(7):61. https://doi.org/10.1038/s41438-020-0282-8
- Yoshikawa H. Studies on breeding of clubroot resistance in cole [Cruciferae] crops. Bulletin of the National Research Institute of Vegetables, Ornamental Plants and Tea. Series A.(Japan). 1993;(7):1-165. ISSN: 0916-684X.
- Matsumoto E., Yasui С., Ohi M., Tsukada M. Linkage analysis of RFLP markers for clubroot resistance and pigmentation in Chinese cabbage (Brassica rapa ssp. pekinensis. Euphytica. 1998;104:79:86. https://doi.org/10.1023/A:1018370418201
- Kuginuki Y., Yoshikawa H., Hirai M. Variation in virulence of Plasmodiophora brassicae in Japan tested with clubroot-resistant cultivars of Chinese cabbage (Brassica rapa L. ssp. pekinensis). European Journal of Plant Pathology. 1999;(105):327-332. https://doi.org/10.1023/A:1008705413127
- Hirai M. Genetic analysis of clubroot resistance in Brassica rapa. Breeding science. 2006;(56):223-229. https://doi.org/10.1270/jsbbs.56.223
- Monakhos S.G., Li N.M. Breeding value of clubroot resistance genes of Brassica rapa L. lines and effectiveness of molecular markers of mapped loci. Izvestiya of Timiryazev Agricultural Academy (TAA). 2013;(6):68-81. (In Russ.)]
- Ueno H.. et al. Molecular characterization of the CRa gene conferring clubroot resistance in Brassica rapa. Plant molecular biology. 2012;80:621-629. https://doi.org/10.1007/s11103-012-9971-5.
- Kato T., Hatakeyama K., Fukino N. et al. Fine mapping of the clubroot resistance gene CRb and development of a useful selectable marker in Brassica rapa. Breeding science. 2013;63(1):116- 124. https://doi.org/10.1270/jsbbs.73-1cover
- Suwabe K., Tsukazaki H., Iketani H., Hatakeyama K., Fujimura M., Nunome T., Fukuoka H., Matsumoto S., Hirai M. Identification of two loci for resistance to clubroot (Plasmodiophora brassicae Woronin) in Brassica rapa L. Theoretical Application Genetic. 2003.107:997-1002. https://doi.org/10.1007/s00122-003-1309-x
- Nguen M.L., Monakhos G.F., Komahin R.A., Monakhos S.G. The new clubroot resistance locus is located on chromosome A05 in Chinese Cabbage (Brassica rapa L.). Genetika. 2018;54:296-304 (In Russ.) https://doi.org/10.7868/S0016675818030037.
- Monakhos S.G., Li N.M. Breeding of Chinese cabbage using biotechnological methods. Potato and vegetables. 2014;9:34-35. (In Russ.).
- Dong Y.Q. Influencing factors and physiochemical changes of embryogenesis through in vitro isolated microspore culture in Brassica species. Biologia. 2021;(76):2629-2654. https://doi.org/10.1007/s11756-021-00721-0
- Шмыкова Н.А., Шумилина Д.В., Супрунова Т.П. Получение удвоенных гаплоидов у видов рода Brassica L. Вавиловский журнал генетики и селекции. 2015;19(1):111-120. https://doi.org/10.18699/VJ15.014. [Shmykova N. A., Shumilina D.V., Suprunova T.P. Obtaining doubled haploids in species of the genus Brassica L. Vavilov Journal of Genetics and Breeding. 2015;19(1):111-120. https://doi.org/10.18699/VJ15.014 (In Russ.)]
- Monakhos S., Uwiragiye A., Zhao J., Zhang N., Bonnema G. Generation of doubled haploids through microspore culture from vegetable and oilseed Brassica rapa crops. Izvestiya of Timiryazev Agricultural Academy (TAA). 2010;7:128-135 (In Russ.).
- Krishnia S.K., Saharan G.S.; Singh D. Genetics of Alternaria blight resistance in inter and intraspecific crosses of Brassica juncea and Brassica carinata. Annals of Biology. 2000;16(2):211- 216. ISSN: 0970-0153.
- Conn K.L., Tewari J.P., Awasthi R.P. A disease assessment key for Alternaria blackspot in rapeseed and mustard. Disease des plantes Survey'au Canada. 1990;70(1):19-22. ISSN: 0008-476X
- Monakhos S.G. Creation of pure lines-doubled cabbage haploids in the culture of isolated microspores and selection of F1 hybrids based on modern biotechnology methods: methodological recommendations]. M.. 2014. 44 р. (In Russ.)
- Custers J.B.M. Microspore culture in rapeseed (Brassica napus L.). Doubledhaploid production in crop plants. Academic Publisher. 2003. Р.185-194. https://doi.org/10.1007/978-94-017-1293-4_29
- Murray M.G. and Thompson W.F. Rapid isolation of high molecular weight plant DNA. Nucleic acids research. 1980;8(19):4321- 4326. https://doi.org/10.1093/nar/8.19.4321
- Kato T., Hatakeyama K., Fukino N. & Matsumoto S. Identificaiton of a clubroot resistance locus conferring resistance to a Plasmodiophora brassicae classified into pathotype group 3 in Chinese cabbage (Brassica rapa L.). Breeding science. 2012;62(3):282-287. https://doi.org/10.1270/jsbbs.62.282
- Griffing B.А. Concept of general and specific combining ability in relation to diallel crossing systems. Australian journal of biological sciences. 1956;9(4):463-493. https://doi.org/10.1071/BI9560463
- Pechan P.M., Keller W.A. Identification of potentially embryogenic microspores in Brassica napus. Physiologia Plantarum. 1988;74(2):377-384. https://doi.org/10.1111/j.1399-3054.1988.tb00646.x
- Monakhos S.G. Integration of modern biotechnological and classical methods in vegetable crop breeding. Moscow, Russian State Agrarian University - Moscow Timiryazev Agricultural Academy. 2016. 335 р. (In Russ.).
- Buczacki S., Toxopeus H., Mattusch P., Johnston T., Dixon G. & Hobolth L. Study of physiologic specialization in Plasmodiophora brassicae: proposals for attempted rationalization through an international approach. Transactions of the British Mycological Society. 1975;65(2):295-303. https://doi.org/10.1016/S0007-1536(75)80013-1


