Получение кобальтсодержащих (металлических, оксидных) наночастиц методом сольвотермолиза
Автор: Сайкова С.В., Пашков Г.Л., Пантелеева М.В., Линок Е.В., Королькова И.В.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Статья в выпуске: 5 т.5, 2012 года.
Бесплатный доступ
Изучен процесс синтеза сольвотермического разложения Со(ОН) 2 в различных органических средах: октаноле и минеральных маслах. Показано, что состав продуктов термодеструкции сильно зависит от природы среды сольвотермолиза и условий получения прекурсора. В ходе проведенного исследования был разработан новый способ получения наночастиц металлического кобальта (120-125 нм), стабилизированных тонкой пленкой углерода, а также его оксидов. Полученные продукты изучены методами ИК–спектроскопии, растровой электронной микроскопии, РФЭС, рентгенофазового, химического и термического анализа.
Кобальт, гидроксид кобальта (ii), сольвотермолиз, наночастицы
Короткий адрес: https://sciup.org/146114681
IDR: 146114681 | УДК: 621.762
Текст научной статьи Получение кобальтсодержащих (металлических, оксидных) наночастиц методом сольвотермолиза
В XXI веке материалы, содержащие частицы диаметром менее 100 нм, привлекают большое внимание ученых. Известно, что наночастицы обладают уникальными физическими, электрохимическими и каталитическими свойствами, что открывает широкие возможности для их применения. В частности, наночастицы кобальта используются для создания катализаторов, магнитных устройств записи, композитов, носителей биопрепаратов [1].
В настоящее время одним из новых подходов к синтезу наночастиц является использование твердофазных нанореакторов на основе слоистых гидроксидов переходных металлов, в качестве которых мы выбрали α-модификацию гидроксида кобальта (П). α-модификацию гидроксида кобальта (II) очень трудно получить традиционным способом – обменной реакцией солей кобальта с аммиаком или щелочью – при небольшом избытке осадителя образуются основные соли. Ранее [2, 3] нами был разработан способ получения α-модификации гидроксида кобальта (II), в котором в качестве реагента-осадителя используется анионит АВ-17-8 в ОН-форме. α-модификация гидроксида кобальта представляет собой слоистый материал, состоящий из положительно заряженных гидроксидных слоев, анионов и молекул воды, на
-
* Corresponding author E-mail address: ssai@mail.ru
ходящихся в межслоевом пространстве, которые могут легко обмениваться на другие анионы и молекулы. Введением частиц «гостей» в слои исходного вещества можно получить новый материал с заданными физическими и химическими свойствами, при этом реакционная зона ограничена гидроксидными слоями, что создает условия для синтеза нанофазы, сходные с условиями синтеза в двухмерном нанореакторе. Этот процесс называется интеркаляцией. Интеркаляция больших молекул, например додецилсульфата натрия, в межслоевое пространство слоистого материала увеличивает его, тем самым облегчая внедрение молекул органического растворителя [4].
Молекулы растворителя встраиваются между слоями, снижая силы взаимодействия слоев, что в конечном итоге приводит к расщеплению слоев исходного гидроксида (деламинация). Это облегчает дальнейший процесс образования наночастиц. Мы объединили стадии расщепления слоев и температурного разложения гидроксидных материалов, используя органические среды, имеющие высокую температуру кипения.
Экспериментальная часть
В работе использовали гелевый сильноосновный анионит АВ-17-8 в ОН-форме, имеющий высокий доннановский потенциал, препятствующий проникновению катионов в фазу сорбента. Методика перевода анионита в ОН-форму подробно описана в [5].
В типичной методике синтеза интеркалированного додецилсульфатом натрия а-Со(ОН)2 массу анионита рассчитывали по формуле
m
а - та
CCoAn ⋅ VCoAn ⋅2 COE
где C СоАn – концентрация исходного раствора кобальта, V СoAn – объем раствора кобальта. Далее навеску анионита в ОН-форме приводили в контакт с раствором 0,25 М раствором соли Со (II) (25 мл) и интеркалянта (25 мл 0,25 М) при комнатной температуре на сутки (первые три часа реакционная смесь перемешивается на шейкере). Анионит отделяли с помощью сита (диаметр отверстий 0,25 мм), осадок центрифугировали, промывали водой и высушивали при 80 °С.
Сольвотермическое разложение интеркалированного додецилсульфатом натрия Со(ОН)2 в масле проводили следующим образом. Навеску полученного по вышеуказанной методике интеркалированного а-Со(ОН)2, помещенную в термостойкую колбу, заливали маслом из расчета 15 мл масла1 на 0,5 г прекурсора. Содержимое колбы нагревали при Т = 400 °С с обратным холодильником в течение 15 ч. Далее смесь охлаждали до комнатной температуры, осадок отделяли от масла методом декантации, промывали (с последующим центрифугированием) небольшими порциями гексана (не менее 10-15 раз) и высушивали при температуре 80 °С.
Фазовый состав образцов идентифицировали, используя рентгенографический анализ (дифрактометр рентгеновский X'Pert PRO PIXcel фирмы PANalytical, излучение СuKα, длина волны 1,5405980 А), вращение образца вокруг нормали к его плоскости. Дифракционные измерения регистрировали с углом 2Θ. _
-
1 В работе использовали: масло вакуумное марки ВМ-6 (ТУ 38.401-58-3-90), индустриальное И-40 (ГОСТ 20799-88) и трансформаторное ГК (ТУ 38.1011025-85).
Исследование образцов методом ИК-спектроскопии проводили с помощью ИК-Фурье-спектрометра Vector 22 фирмы Bruker, погрешность по частоте ±1см-1 с разрешением 2 см-1, а электронной микроскопии - с помощью Hitachi S5500.
Обсуждение результатов
Расщепление интеркалированных слоистых гидроксидов нужно проводить в органических растворителях вследствие высокой плотности заряда слоев гидроксида. Молекула растворителя встраивается между слоями, увеличивая межслоевое расстояние, снижая силы взаимодействия слоев. Для проведения процесса сольвотермолиза в качестве слоистого материала выбрали а-Со(ОН)2, интеркалированный додецилсульфатом натрия. Основываясь на литературных данных, в качестве растворителя выбрали октанол (ТКИП = 194,5 °С), но мы экспериментально установили, что в октаноле не происходит полного термического разложения интеркалированного а-Со(ОН)2. Для увеличения температуры сольвотермолиза в качестве органического растворителя применяли углеводородные масла различных марок. Масла представляют собой в основном насыщенные углеводороды и содержат очень незначительное количество непредельных.
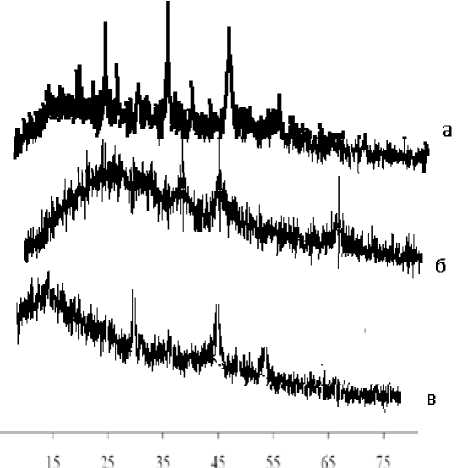
По данным РФА, в образцах, полученных в индустриальном и вакуумном маслах, присутствует фаза металлического Со, продукт сольвотермолиза в трансформаторном масле представляет собой СоО (рис. 1). Аморфная фаза, имеющаяся во всех образцах, вероятно, является неразложившимся гидроксидом кобальта.
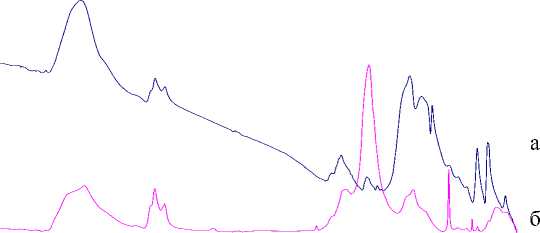
На ИК-спектрах (рис. 2) образцов, полученных в маслах И-40 и ВМ-6, наблюдается пик при 3433 см-1, относящийся к валентным колебаниям ОН-групп гидроксида. Полосы поглощения
2 Θ
Рис. 1. Рентгенограммы продуктов сольвотермолиза интеркалированного гидроксида кобальта (II) в вакуумном (а), индустриальном (б) и трансформаторном (в) маслах
4000 3500 3000 2500 2000 1500 1000 500
Волновое число, см-1
Рис. 2. ИК-спектры образцов, полученных в маслах ВМ-6 (а) и И-40 (б)

Рис. 3. Микрофотографии продуктов сольвотермолиза, полученных в вакуумном (а) и индустриальном (б) маслах при 600 см-1 (рис. 2а) относятся к колебаниям связи Co-О [6]. Остальные полосы поглощения относятся к различным колебаниям связей в алканах, что позволяет говорить о присутствии органической фазы в исследуемых образцах.
По данным электронно-микроскопического исследования (рис. 3) частицы образцов, полученных с помощью масел И-40 и ВМ-6, существенно отличаются по морфологии. В частности, в вакуумном масле частицы получаются сферическими, практически одинакового размера 120-125 нм. В индустриальном масле частицы представляют собой глобулы, состоящие из тонких сросшихся пластинок и иголочек. Вероятно, частицы покрыты оболочкой углерода, что и помогает избежать окисления металлического кобальта.
Как сказано выше, масла – это смесь насыщенных углеводородов, поэтому они стабильны до температуры 350 °С, выше которой как в присутствии, так и в отсутствие кислорода начина-– 582 – ется цепной радикальный процесс [7], в ходе которого высвобождается водород, являющийся восстановителем гидроксида кобальта:
Со(ОН ) 2 + Н2 = Со0 + 2H 2 О.
Известно, что наночастицы кобальта пирофорны и самопроизвольно возгораются на воздухе при комнатной температуре. Образование защитной оболочки на каждой наночастице (капсулирование) является распространённым методом защиты и стабилизации наночастиц. Чаще всего в качестве защитного покрытия используют углерод [8, 9]. Покрытые углеродом магнитные наночастицы находят применение в качестве сред для записи информации, как магнитные тонеры в ксерографии, магнитные чернила, контрастные агенты для магниторезонансных изображений и т.п. Если после компактирования таких порошков сохраняются нано-размерные магнитные частицы, то такие материалы могут служить прекрасными исходными компонентами для приготовления высокоэнергетических постоянных магнитов [10].
Итак, были получены кобальтсодержащие наночастицы, стабилизированные углеродной пленкой, в минеральных маслах путем сольвотермического разложения интеркалированного гидроксида кобальта (II).
Работа выполнена при поддержке Государственного контракта Минобрнауки 02.740.11.0269.


