Получение наночастиц селена с использованием силимарина и изучение их цитотоксичности по отношению к опухолевым клеткам
Автор: Староверов С.А., Дыкман Л.А., Меженный П.В., Фомин А.С., Козлов С.В., Волков А.А., Рыбин А.О., Голова А.Б., Ханадеев В.А., Курилова А.А., Щеголев С.Ю.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Эффекты биологически активных веществ
Статья в выпуске: 6 т.52, 2017 года.
Бесплатный доступ
В последние годы наблюдается существенный прогресс в ветеринарной онкологии: разрабатываются новые методы диагностики и лечения онкологических заболеваний у животных, расширяется спектр возможных терапевтических мероприятий. Представляют интерес, в частности, перспективы создания ветеринарных лекарственных препаратов с использованием разнообразных наночастиц (в том числе, коллоидного селена), на поверхности которых иммобилизованы биологически активные вещества, обладающие противоопухолевым действием. Наночастицы селена проявляют цитотоксическое воздействие на опухолевые клетки и рассматриваются также в качестве эффективных носителей для адресной доставки in vivo лекарств, генетических материалов, белков и т.п. Хорошо «настраиваемые» поливалентные структуры поверхности селеновых наночастиц обеспечивают удобную платформу для интеграции нескольких терапевтических препаратов или биомакромолекул с ковалентным или нековалентным конъюгированием. Нами был синтезирован комплекс наночастиц селена с силимарином - гепатопротектором флавоноидного типа, выделяемым из плодов расторопши пятнистой Silybum marianum (L.) Gaertn., и оценена цитотоксичность полученного препарата для линий опухолевых клеток, различающихся происхождением и онкологическими свойствами. Методами электронной микроскопии и динамического рассеяния света установлено, что разработанная методика обеспечивает получение стабильных взвесей конъюгатов селеновых наночастиц с силимарином в диапазоне размеров порядка 20-40 нм. Показано, что полученный конъюгат проявляет ярко выраженный цитотоксический эффект в отношении линии опухолевых клеток Hep-2 с уменьшением количества жизнеспособных клеток примерно в 6,5 раза по сравнению с контролем, против уменьшения примерно 2,3 раза в отношении линии клеток SPEV-2. При этом препарат исходного коллоидного селена оказывал значительно более слабое воздействие на культуры клеток обоих типов, а чистый силимарин не проявлял статистически значимого влияния на клетки SPEV-2 (в отличие от Hep-2). Предполагается, что полученный препарат может быть использован в дальнейшем для разработки противораковых методик нового поколения и представляет интерес также с точки зрения реализации подходов на основе принципов «зеленой химии».
Расторопша пятнистая, флаволигнаны, силимарин, наночастицы селена, конъюгация, цитотоксические эффекты
Короткий адрес: https://sciup.org/142214169
IDR: 142214169 | УДК: 615.32: | DOI: 10.15389/agrobiology.2017.6.1206rus
Текст научной статьи Получение наночастиц селена с использованием силимарина и изучение их цитотоксичности по отношению к опухолевым клеткам
Несмотря на то, что успехи современной ветеринарной медицины позволили снизить смертность животных, вызванную онкологическими заболеваниями, рак нередко продолжают рассматривать как одно из наиболее серьезных заболеваний нашего времени. По имеющимся данным, гибель более 50 % всех собак и кошек старше 10 лет обусловлена раком, а онкологические заболевания домашних животных остаются одной из наиболее распространенных причин обращения за ветеринарной помощью (1).
В последние годы наблюдается существенный прогресс в ветеринарной онкологии: разрабатываются новые методы диагностики и лечения онкологических заболеваний у животных, расширяется спектр возможных терапевтических мероприятий (2). Однако стоит отметить, что в арсенале ветеринарного врача практически отсутствуют специализированные лекарственные препараты, предназначенные для лечения онкологических заболеваний животных. Представляют интерес, в частности, перспективы со-
∗ В работе использовано оборудование ЦКП «Симбиоз» ИБФРМ РАН. Работа выполнена в рамках программы ФНИ (государственное задание ¹ 0755-2015-0002) и частично поддержана грантом Российского научного фонда ¹ 15-14-00002.
здания ветеринарных лекарственных средств с использованием разнообразных наночастиц (в том числе коллоидного селена), на поверхности которых иммобилизованы биологически активные вещества с противоопухолевым действием.
Селен (Se) — микроэлемент, имеющий важное значение для здоровья человека и животных (3, 4). Физиологическая роль селена в основном связана с его присутствием в селенометионине и селеноцистеине — аминокислотах, которые входят в относительно небольшой набор (около 25) селенопротеинов, обладающих, в том числе, окислительно-восстановительными и иммуномодулирующими свойствами (5).
Большой интерес представляет способность соединений селена оказывать цитотоксический эффект на опухолевые клетки, что связано с потенциальной способностью селенолата и селенида водорода эффективно реагировать с кислородом и тиолами, приводящей к нестехиометрическому потреблению тиолов и NADPH, окислительному стрессу и, в конечном итоге, гибели клеток вследствие апоптоза, некроза или некроптоза (6, 7). Онкоингибирующий эффект наночастиц селена был продемонстрирован, в частности, в ряде работ (8, 9).
Наночастицы селена рассматриваются также в качестве эффективных носителей для адресной доставки in vivo лекарств, генетических материалов, белков и т.п. Хорошо «настраиваемые» поливалентные структуры поверхности селеновых наночастиц обеспечивают удобную платформу для интеграции нескольких терапевтических препаратов или биомакромолекул с ковалентным или нековалентным конъюгированием (10). При «биосинтетическом» («зеленом») получении селеновых наночастиц используются аминокислоты (11, 12), грибные полисахариды (13), растительный экстракт из листьев Terminalia arjuna (14), фолиевая кислота (15), культуры клеток Saccharomyces cerevisiae (16) и др. При изучении механизмов действия модифицированных селеновых наночастиц ряд исследователей отмечают их тенденцию активировать митохондриальный апоптоз в клеточной линии MCF-7, вызывая окислительный стресс и в дальнейшем дисфункцию митохондрий, останавливая тем самым рост раковых клеток (15). Также отмечается снижение мембранного потенциала митохондрий и перепроизводство активных форм кислорода в клетках Hep-2 под действием селеновых наночастиц (17).
В последние годы описано около 30 классов химических веществ с раково-профилактическим эффектом, которые могут иметь практическое значение в снижении заболеваемости раком у человека (18). Среди них большое внимание уделяется полифенольным антиоксидантам естественного происхождения (19). Флаволигнаны, выделяемые из лекарственного растения расторопши пятнистой Silybum marianum (L.) Gaerth., являясь сильными антиоксидантами, способны инактивировать как свободные радикалы, так и активные формы кислорода в клетке. Также они блокируют рецепторы и транспортные системы на клеточной мембране, которые обеспечивают перенос токсических веществ в клетку, уменьшают активность макрофагальных клеток, участвующих в презентации антигенов, снижают продукцию γ -глобулинов, блокируют липооксигеназы и циклооксигеназы, оказывая тем самым противовоспалительное, иммуномодулирующее и антиканцерогенное действие (20).
В частности, было показано, что силибинин — один из флаволиг-нанов расторопши пятнистой, на долю которого приходится до 70 % от общего количества флаволигнанов (21), увеличивает ацетилирование гистонов Н3 и Н4 in vitro и in vivo в клетках линии Huh-7 ксенотрансплан- татов у голых мышей (22, 23). В клетках немелкоклеточного рака легкого силибинин ингибирует активность деацетилаз гистонов (HDAC) и снижение их внутриклеточного содержания (24). Силимарин — аналог силиби-нина, также относящийся к категории гепатопротекторов растительного происхождения флавоноидного типа, который выделяют из плодов расто-ропши пятнистой.
Нами впервые предложена методика получения стабилизированного конъюгата наночастиц селена из исходно неустойчивых суспензий с использованием силимарина и изучена цитотоксичность такого конъюгата для иммортализованных клеток почки эмбриона свиньи (линия SPEV-2) и клеток гепатоцеллюлярной карциномы человека (линия Hep-2).
Цель исследования заключалась в разработке способа стабилизации взвеси наночастиц селена при образовании комплекса с силимарином и оценке цитотоксических свойств полученного препарата по отношению к опухолевым клеткам.
Методика. Взвесь наночастиц селена получали, добавляя к 67 мл раствора селенистой кислоты 40 мл раствора L-цистеина. Для приготовления первого раствора к 0,128 г селенистой кислоты (АО «УЗПХ», Россия) добавляли 100 мл дистиллированной воды, для приготовления второго — к 0,726 г сухого L-цистеина (ООО «Неолаб», Россия) приливали 100 мл дистиллированной воды; рН растворов доводили до 8,5, используя 0,1 М NaOH. Полученная взвесь (исходный препарат наноселена) приобретала красно-коричневую окраску.
Диаметр (d) синтезированных наночастиц измеряли с использованием трансмиссионного электронного микроскопа Libra 120 («Carl Zeiss,» Германия) и методом динамического рассеяния света (ДРС) на анализаторе Zetasizer Nano-ZS («Malvern», Великобритания), как описано (25).
Для получения конъюгатов наночастиц селена использовали коммерческий силимарин («TEVA Czech Industries s.r.o.», Чехия). Концентрацию силимарина в конечном препарате определяли методом высокоэффективной жидкостной хроматографии. Анализ выполняли на жидкостном хроматографе Стайер (ЗАО «Аквилон», Россия) со спектрофотометрическим детектором А288 согласно прилагаемой инструкции. Для разделения компонентов использовали колонку Onix Monolithic C 18 (производство ЗАО «Аквилон» по лицензии фирмы «Merck KGaA», Германия).
Цитотоксические исследования проводили на клеточных линиях SPEV-2 (иммортализованные клетки почки эмбриона свиньи) и Hep-2 (опухолевые клетки гепатоцеллюлярной карциномы человека). Клетки выращивали в пластиковых матрасах на среде Игла в модификации по способу Дульбекко (DMEM) («Biological Industries», Израиль), содержащей L-глутамин, 15 мМ HEPES, 10 % фетальной коровьей сыворотки и антибиотики (20 мкг пенициллина с активностью 1000000 ЕД и 25 мкл гентамицина с активностью 1000 ЕД на 100 мл среды). Культивирование проводили в СО 2 -инкубаторе при температуре 37 ° С в атмосфере, содержащей 5 % СО 2 . Клетки отделяли от пластика обработкой раствором трипсина с версеном при температуре 37 ° С в течение 10-15 мин, затем осаждали центрифугированием при 900 g в течение 20 мин. Осадок ресуспендировали в фосфатносолевом буфере при рН 7,2-7,4 и повторно центрифугировали в указанном выше режиме. После ресуспендирования клеток в полной DMEM их помещали в лунки культурального планшета (1½105 клеток на лунку).
Для изучения цитотоксического действия синтезированных наночастиц клетки предварительно культивировали в течение 18-24 ч до формирования слоя, занимающего 80 % поверхности лунки. Препарат наноча-1208
стиц селена, конъюгированных с силимарином, лиофильно высушивали, перерастворяли в среде для инкубации (рН 7,2-7,4) и вносили в лунки планшета с культурами перевиваемых клеток (в 8 повторах в дозе 8 мкг си-лимарина на лунку). Для сравнения использовали раствор силимарина той же концентрации в культуральной среде. Контролем служили лунки, в которые препараты не добавляли. Жизнеспособность культивируемых клеток оценивали по их способности восстанавливать нитротетразолевый синий (MTT) до формазана (MTT-тест, MTT tetrazolium assay technology) (26) с определением концентрации формазана.
Статистическую обработку полученных результатов проводили по стандартным методикам с использованием t -критерия Стьюдента для оценки достоверности различий между выборками в опытных и контрольных экспериментах. По результатам вычисления среднеарифметического ( M ) и стандартного отклонения (±SD) для выборки определяли стандартную ошибку среднеарифметического (±SEM) и границы его доверительного интервала с учетом коэффициента Стьюдента t при уровне значимости 95 % (p = 0,05) и числе измерений n = 8.
Результаты. Согласно данным, полученным методом ДРС (рис. 1), размер частиц исходного препарата селена составил d ≈ 43-110 нм. Однако коллоидный раствор неконъюгированных наночастиц имел довольно низкую стабильность, и в течение 10-15 мин в нем выпадал осадок (предположительно аморфного селена) кирпично-красного цвета. В связи с поставленной целью нами была разработана следующая оригинальная методика получения конъюгата силимарина с наночастицами селена. Силима-рин в количестве 1,38 г растворяли в 100 мл 0,1 М раствора NaOH. Далее к 100 мл раствора силимарина добавляли 67 мл раствора селенистой кислоты, затем 40 мл раствора L-цистеина. Значение pH системы доводили до 8,5 добавлением 0,1 М раствора HCl (для нейтрализации избытка щелочи). По результатам метода ДРС (рис. 1), размер 97 % всех наночастиц в препарате селена с силимарином находится в пределах d ≈ 16-44 нм.
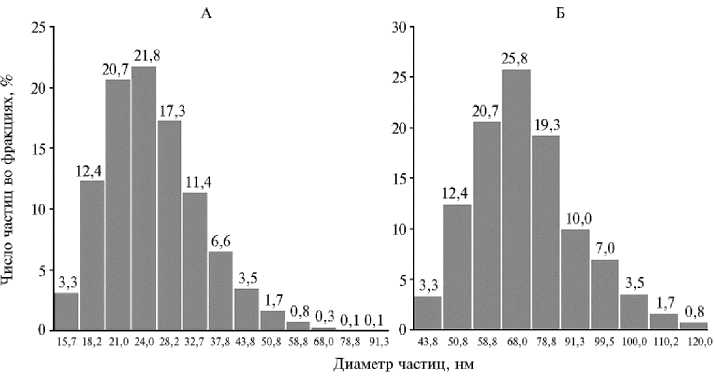
Рис. 1. Распределение наночастиц по размерам в препаратах селена, конъюгированного с сили-марином (А), и без силимарина (Б) по данным метода динамического рассеяния света (анализатор Zetasizer Nano-ZS, «Malvern», Великобритания).
В отличие от исходного препарата наноселена, полученная взвесь конъюгата селеновых наночастиц с силимарином, приобретая красно-коричневую окраску и становясь прозрачной с отсутствием видимой опалесценции, в течение длительного времени сохраняла стабильность. Таким образом, достигнутая стабилизация коллоидной взвеси селена силимари-ном сопровождалась увеличением ее дисперсности (уменьшением значений d), характерным для коллоидных систем подобного типа, что также подтвердила электронная микроскопия (рис. 2).
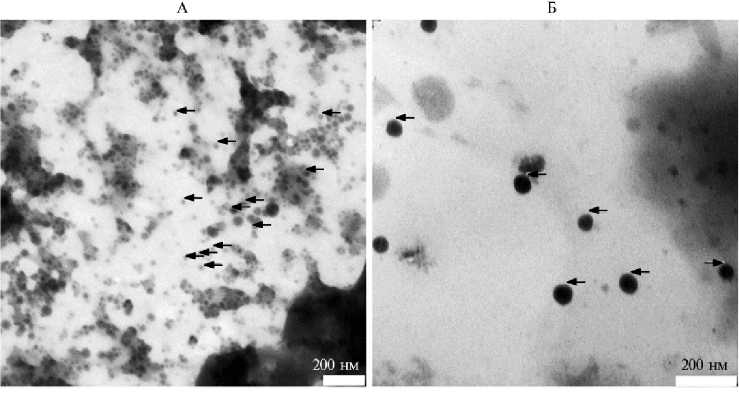
Рис. 2. Электронно-микроскопическое изображение наночастиц (отмечены стрелками) в конъюгате селена с силимарином (А) и исходных наночастиц селена (Б) (наночастицы отмечены стрелками).
Было установлено, что добавление сухого порошка селена, конъюгированного с силимарином, в среду для инкубации клеток не приводило к изменению ее рН.
Оценка цитотоксичности двух полученных препаратов селена и нативного силимарина, проведенные с использованием клеточных культур SPEV-2 и Hep-2, показала, что чистый силимарин не вызывал статистически значимого уменьшения жизнеспособности клеток SPEV-2 (рис. 3, А). Однако его добавление к культурам клеток Hep-2 приводило к уменьшению концентрации формазана на 10,3 % (см. рис. 3 Б), о достоверности которого свидетельствуют установленные неравенства t ф акт. = 2,45 > t теор. = 2,14; p ф акт. = 0,028 < 0,05. Внесение в лунки взвеси исходного наноселена вызывало достоверное угнетение жизнеспособности культуры SPEV-2 в ММТ-тесте (на 7,3 %), тогда как конъюгат селена с силимарином приводил к уменьшению концентрации формазана на 55,6 % (см. рис. 3, А).
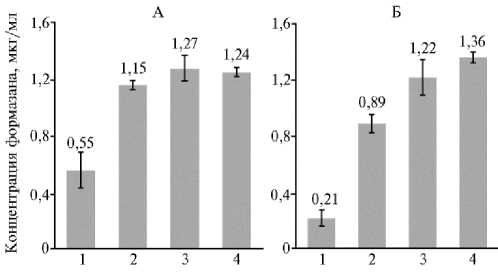
Рис. 3. Оценка жизнеспособности клеток линий SPEV-2 (А) и Hep-2 (Б) по концентрации фор-мазана при культивировании в присутствии селеновых наночастиц, конъюгированных с сили-марином (1) , исходных селеновых наночастиц (2) и чистого силима-рина (3) по сравнению с контролем (без добавления препаратов) (4). Вертикальные штрихи — доверительные интервалы для среднеарифметических при уровне значимости 95 %.
Более интенсивная ответная реакция на введение полученного нами конъюгированного препарата наблюдалась у опухолевых клеток линии Hep-2 (см. рис. 3, Б): конъюгат селена с силимарином вызывал умень- шение количества жизнеспособных клеток (концентрации формазана) на 84,6 % (исходный коллоидный раствор селена снижал этот показатель у той же линии только на 34,6 %).
Учитывая результаты этого эксперимента и описанные в литературе свойства исходных субстанций, рассмотренные нами выше, усиление цитотоксического действия селеновых наночастиц с силимарином можно объяснить синергетическим эффектом в результате конъюгирования компонентов. Предполагается, что наблюдаемое действие полученного конъюгата может быть использовано для развития подходов к созданию противораковых препаратов нового поколения. Усовершенствованный «биосинтез» селеновых наночастиц с использованием силимарина, по-видимому, представляет интерес и с точки зрения реализации принципов «зеленой» химии (27).
Таким образом, добавление силимарина в реакционную смесь при восстановлении селенистой кислоты L-цистеином приводит к образованию стабильной взвеси с органолептическими свойствами (цвет и прозрачность), характерными для коллоидных взвесей селена, при среднем (наиболее вероятном) диаметре частиц 25 нм, что примерно втрое меньше, чем в исходном, менее стабильном коллоидном растворе селена. Полученный конъюгат наночастиц селена с силимарином проявляет ярко выраженный цитотоксический эффект по отношению к линии опухолевых клеток Hep-2 с уменьшением количества жизнеспособных клеток примерно в 6,5 раза по сравнению с контролем (против примерно 2,3-кратного снижения этого показателя в линии клеток SPEV-2).
Список литературы Получение наночастиц селена с использованием силимарина и изучение их цитотоксичности по отношению к опухолевым клеткам
- Woods J.P. Palliative care for the cancer patient. In: Cancer management in small animal practice/C.J. Henry, Higginbotham M.L. (eds.). Maryland Heights, Saunders Elsevier, 2010: 183-185.
- Paoloni M.C., Khanna C. Comparative oncology today. Vet. Clin. North. Am. Small Anim. Pract., 2007, 37: 1023-1032 ( ) DOI: 10.1016/j.cvsm.2007.08.003
- Navarro-Alarcon M., Lopez-Martinez M.C. Essentiality of selenium in the human body: relationship with different diseases. Sci. Total Environ., 2000, 249: 347-371 ( ) DOI: 10.1016/S0048-9697(99)00526-4
- Rayman M.P. The importance of selenium to human health. Lancet, 2000, 356: 233-241 ( ) DOI: 10.1016/S0140-6736(00)02490-9
- Cone J.E., Del Río R.M., Davis J.N., Stadtman T.C. Chemical characterization of the selenoprotein component of clostridial glycine reductase: Identification of selenocysteine as the organoselenium moiety. PNAS USA, 1976, 73: 2659-2663.
- Wallenberg M., Olm E., Hebert C., Björnstedt M., Fernandes A.P. Selenium compounds are substrates for glutaredoxins: a novel pathway for selenium metabolism and a potential mechanism for selenium-mediated cytotoxicity. Biochem. J., 2010, 429: 85-93 ( ) DOI: 10.1042/BJ20100368
- Selenius M., Rundlof A.K., Olm E., Fernandes A.P., Björnstedt M. Selenium and the selenoprotein thioredoxin reductase in the prevention, treatment and diagnostics of cancer. Antioxid. Redox Signal., 2010, 12: 867-880 ( ) DOI: 10.1089/ars.2009.2884
- Vekariya K.K., Kaur J., Tikoo K. ER signaling imparts chemotherapeutic selectivity to selenium nanoparticles in breast cancer. Nanomedicine, 2012, 8: 1125-1132 ( ) DOI: 10.1016/j.nano.2011.12.003
- Liu W., Li X., Wong Y.S., Zheng W., Zhang Y., Cao W., Chen T. Selenium nanoparticles as a carrier of 5-fluorouracil to achieve anticancer synergism. ACS Nano, 2012, 6: 6578-6591 ( ) DOI: 10.1021/nn202452c
- Chaudhary S., Umar A., Mehta S.K. Surface functionalized selenium nanoparticles for biomedical applications. J. Biomed. Nanotechnol., 2014, 10: 3004-3042 ( ) DOI: 10.1166/jbn.2014.1985
- Yang L., Chen Q., Liu Y., Zhang J., Sun D., Zhou Y., Liu J. Se/Ru nanoparticles as inhibitors of metal-induced A aggregation in Alzheimer’s disease. J. Mater. Chem. B, 2014, 2: 1977-1987 ( ) DOI: 10.1039/C3TB21586E
- Feng Y., Su J., Zhao Z., Zheng W., Wu H., Zhanga Y., Chen T. Differential effects of amino acid surface decoration on the anti-cancer efficacy of selenium nanoparticles. Dalton Trans., 2014, 43: 1854-1861 ( ) DOI: 10.1039/c3dt52468j
- Wu H., Li X., Liu W., Chen T., Li Y., Zheng W., Man C.W.-Y., Wong M.K., Wong K.H. Surface decoration of selenium nanoparticles by mushroom polysaccharides-protein complexes to achieve enhanced cellular uptake and antiproliferative activity. J. Mater. Chem., 2012, 22: 9602-9610 ( ) DOI: 10.1039/C2JM16828F
- Prasad K.S., Selvaraj K. Biogenic synthesis of selenium nanoparticles and their effect on As(III) induced toxicity on human lymphocytes. Biol. Trace Elem. Res., 2014, 157: 275-283 ( ) DOI: 10.1007/s12011-014-9891-0
- Pi J., Jin H., Liu R.Y., Song B., Wu Q., Liu L., Jiang J., Yang F., Cai H., Cai J. Pathway of cytotoxicity induced by folic acid modified selenium nanoparticles in MCF-7 cells. Appl. Microbiol. Biotechnol., 2013, 97: 1051-1062 ( ) DOI: 10.1007/s00253-012-4359-7
- Древко Я.Б., Ситникова Т.С., Буров А.М., Древко Б.И., Щеголев С.Ю. Восстановление диацетофенонилселенида (препарат ДАФС-25) до ацетофенона с образованием микро-и наночастиц селена в присутствии культуры Saccharomyces cerevisiae. Биотехнология, 2015, 6: 65-71 ( ) DOI: 10.21519/0234-2758-2015-6-65-71
- Zhang Y., Li X., Huang Z., Zheng W., Fan C., Chen T. Enhancement of cell permeabilization apoptosis-inducing activity of selenium nanoparticles by ATP surface decoration. Nanomedicine, 2013, 9: 74-84 ( ) DOI: 10.1016/j.nano.2012.04.002
- Wattenberg L.W. An overview of chemoprevention: current status and future prospects. Proc. Soc. Exp. Biol. Med., 1997, 216: 133-141 ( ) DOI: 10.3181/00379727-216-44163
- Dragsted L.O. Natural antioxidants in chemoprevention. Arch. Toxicol., 1998, 20: 209-226 ( ) DOI: 10.1007/978-3-642-46856-8_19
- Volkov A.A., Staroverov S.A., Kozlov S.V., Kalyuzhniy I.I., Domnitsky I.J., Nikulin I.A., Derezina T.N. Study of therapeutic properties of the prototype injection of a hepatoprotective drug based on flavolignans of Silybum marianum. Biol. Med. (Aligarh), 2015, 7: 2 (http://www.biolmedonline.com/Articles/Vol7_2_2015/BM-094-15_Study-of-therapeutic-properties-of-the-prototype-injection-of-hepatoprotective-drug-based-on-flavolignans-of-Silybum-mari.pdf).
- Pradhan S.C., Girish C. Hepatoprotective herbal drug, silymarin from experimental pharmacology to clinical medicine. Indian J. Med. Res., 2006, 124: 491-504.
- Lah J.J., Cui W., Hu K.Q. Effects and mechanisms of silibinin on human hepatoma cell lines. World J. Gastroenterol., 2007, 13: 5299-5305 ( ) DOI: 10.3748/wjg.v13.i40.5299
- Cui W., Gu F., Hu K.Q. Effects and mechanisms of silibinin on human hepatocellular carcinoma xenografts in nude mice. World J. Gastroenterol., 2009, 15: 1943-1950 ( ) DOI: 10.3748/wjg.15.1943
- Mateen S., Raina K., Jain A., Agarwal C., Chan D., Agarwal R. Epigenetic modifications and p21-cyclin B1 nexus in anticancer effect of histone deacetylase inhibitors in combination with silibinin on non-small cell lung cancer cells. Epigenetics, 2012, 7: 1161-1172 ( ) DOI: 10.4161/epi.22070
- Khlebtsov N.G., Dykman L.A. Optical properties and biomedical applications of plasmonic nanoparticles. J. Quant. Spectrosc. Radiat. Transfer, 2010, 111: 1-35 ( ) DOI: 10.1016/j.jqsrt.2009.07.012
- Oez S., Platzer E., Welte K. A quantitative colorimetric method to evaluate the functional state of human polymorphonuclear leukocytes. Blut, 1990, 60: 97-102 ( ) DOI: 10.1007/BF01720515
- Iravani S. Green synthesis of metal nanoparticles using plants. Green Chem., 2011, 13: 2638-2650 ( ) DOI: 10.1039/C1GC15386B


