Получение сернокислого никеля из отработанных электролитов медной промышленности
Автор: Сидоренко А.Ю., Михайлов гГ., Животовская Г.П.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 10 (65), 2006 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156531
IDR: 147156531
Текст обзорной статьи Получение сернокислого никеля из отработанных электролитов медной промышленности
В результате химического растворения медных анодов в отделении электролиза меди, на медеплавильных заводах в электролитах накапливаются примеси ионов металла, имеющих более отрицательный электродный потенциал, чем электродный потенциал меди (фси2/си = +0,34В), это никель ф% 2+/Ni= -0,25 В, железо ф0ре2+/Ее= -0,44 В, цинк ф°гп2+/гп =~0,76 В. В состав электролита входит также и медь, которая не осадилась на катоде, за счет чего происходит обогащение электролита медью. С целью стабилизации состава электролита часть его выводят на переработку в отделение получения медного купороса CuSO4-5H2O. Преобладающая примесь в электролите в процессе электролитического рафинирования меди - никель двухвалентный. Ежемесячно, например, на Кыштымском медеэлектролитном заводе производится до 50 т сульфата никеля NiSO4'7H2O. Условием, необходимым для выделения кристаллогидратов сульфата никеля из раствора, является пересыщение и переохлаждение.
Известный способ извлечения сульфата никеля из электролитов, за счет которого достигается повышение качества никеля сернокислого и снижение потерь никеля в процессе его получения реализуется растворением чернового сульфата никеля в воде до определенной плотности раствора 1,25-1,38 г/мл. Полученный раствор нагревают до температуры 40-60 °C и обрабатывают перекисью водорода для окисления ионов Ре2+ до Fe3+, протекающего по уравнению реакции:
Н2О2 + Ре2+ + 2Н2 -» Ре3+ + 2Н2О.
После окисления раствор подают на глубокую нейтрализацию, которую проводят карбонатом никеля (NiCO3). pH полученного раствора лежит в пределах от 5 до 6. Одновременно в раствор вводят концентрированную фосфорную кислоту (Н3РО4). Фосфорная кислота вводится для связывания примесей в трудно-растворимые фосфаты соответственно уравнению реакции:
Ме2+ + NiCO3 + Н3РО4 Me РО44- + Ni2+ +
+ CO2t + Н2О:
где - Ме2+- примеси ионов (Fe2+, Zn2+, Cu2+ и др.).
Длительность процесса окисления электролита перекисью водорода варьируется от 0,5-1 ч, а нейтрализации 1-2 ч. После нейтрализации раствор фильтруют, подкисляют концентрированной серной кислотой до pH = 2,0-2,5 и подают на вакуум-кристаллизацию [1,2].
Технологическая схема производства NiSO4-7H2O на Кыштымском медеплавильном заводе (КМЭЗ) представлена на рис. 1. С целью совершенствования процесса кристаллизации сульфата никеля, были проведены эксперименты с черновыми растворами, полученными на КМЭЗе. В процессе эксперимента приготовление раствора чернового никелевого купороса проводили при температуре 23-25 °C, для чего перемешивали 70 г чернового никеля в ПО г воды в течение 30 мин. Плотность полученного раствора чернового никелевого купороса 1,27 г/см3. Масса раствора 180 г (объем раствора 180/1,27 =141,7 мл). pH полученного раствора равен 1,4.
В полученном растворе присутствуют ионы Fe+2. Для перевода ионов Fe+2 в ионы Fe+3 в раствор ввели перекись водорода в количестве 2,3 мл. Для полного окисления ионов Fe+2 в ионы Fe+3 раствор, после введения перекиси водорода, перемешивали в течение одного часа при температуре 50-55 °C.
Для осаждения цинка из раствора в него добавили 15,6 мл ортофосфорной кислоты (в расчете на 141,7 мл + 2,3 мл Н2О2 = 144 мл раствора) и нагревали до температуры 85 °C. Далее в раствор добавили конденсат Н2О (23 мл) и нагрели до 90 °C. В подогретый раствор добавили карбонат никеля массой 141,7 г (в расчете на 144 мл + 15,6 мл Н3РО4 = 159,6 мл раствора). Карбонат никеля прибавляли порциями. Раствор постоянно перемешивали и выдерживали его при температуре 90 °C в течение 1-1,5 ч. При добавлении каждой порции брали пробу и измеряли рН-раствора и только после добавления последней порции карбоната никеля получили рН=5,9. Каждый раз при измерении pH раствор охлаждали до 23-25 °C. pH 5,9 - это условия, при которых должны выделиться нерастворимые осадки гидроксидов и нерастворимых солей железа, меди и цинка.
Нерастворимые осадки и карбонат никеля, который не вступает в реакцию, отфильтровали вакуумным фильтрованием. К фильтрату (35 мл) добавили 0,1 мл концентрированной серной кислоты до достижения pH исследуемого раствора 2,02.
Без вакуум кристаллизации, при температуре 20-23 °C, в растворе через 8 суток начали расти крупные кристаллы сульфата никеля.
С целью выбора условий кристаллизации сульфата никеля (получение сульфата никеля марки «хч», получение кристаллогидратов сульфата никеля шести-, пяти-, четырехводного, получение кристаллов сульфата никеля размером 1-1,2 см) нами готовились пересыщенные растворы сульфата никеля из семиводного заводского сульфата никеля марки «ч» Приготовленные растворы обрабатывались наносекундными электромагнитными импульсами (НЭМИ) с помощью генератора импульсов
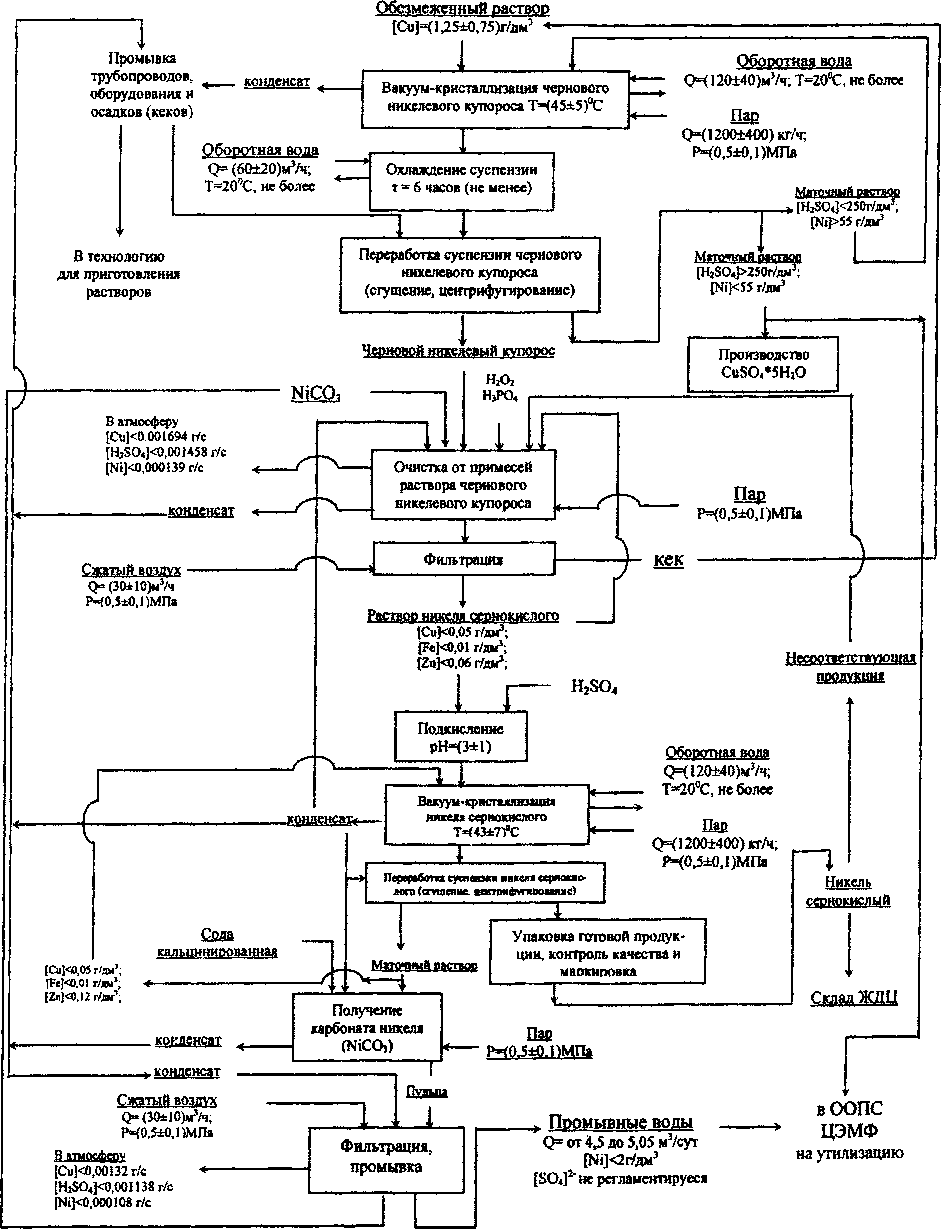
Рис.1. Технологическая схема производства никеля (II) сернокислого 7-водного
GNP-01-7-1 при выходном напряжении 7 кВ, длительности 0,5 наносекунд, с частотой 1000 Гц при токе 1 А. Кроме этого, исследовалось влияние глицерина (СН2ОН-СНОН-СН2ОН), как поверхностно-активного вещества, на скорость появления кристаллов.
Пересыщенный раствор NiSO4-7H2O готовили из расчета 85 г семиводного сульфата никеля на 100 г воды (растворимость NiSO4-7H2O составляет 76,3 г на 100 г воды при температуре 20 °C) [3]. Для полного растворения соли раствор нагревали до 50 °C при перемешивании. Полученный раствор охлаждали до температуры 18 °C. Выпавшие при этом кристаллы отделяли от маточного раствора и высушивали.
В табл. 1 предложена информация об образовании и свойствах кристаллов NiSO4-7H2O, выпавших из 2М-ного раствора его соли. Образец № 1, получен из контрольного варианта раствора соли без введения зародыша, образец № 2, получен из контрольного варианта раствора соли с введением зародыша, образцы № 3, 4, 5, 6 и 7, получены из контрольного варианта раствора соли с введением зародыша и обработанного НЭМИ в течение 10, 15, 30, 45, и 60 мин. Образец № 8, получен из контрольного варианта раствора соли с введением зародыша и при добавлении глицерина в качестве поверхностно-активного вещества.
Кристаллы сульфата никеля, как видно из табл. 1, в случае контрольного варианта (образец № 1) появились на 8-е сутки. В присутствии зародыша сульфата никеля время появления кристаллов сократилось вдвое.
Обработка растворов для процесса кристаллизации (без зародыша) с помощью НЭМИ положительно сказалось на времени появления кристаллов. Наиболее значимое влияние оказывает обработка НЭМИ растворов NiSO4-7H2O в течение первых 10 минут (образец 3, начало кристаллиза ции на 4-ые сутки), далее для образцов 4, 5, 6 и 7 увеличение времени обработки НЭМИ растворов (15, 30, 45 и 60 минут) приводит к увеличению времени появления кристаллов (от 4 до 6 суток) и стабилизации процесса кристаллизации.
Следует заметить, что размеры кристаллов полученных из облученных растворов электролита несколько меньше, чем в случае контрольного варианта (образец 1) и при добавлении в раствор для кристаллизации глицерина (образец № 8).
Добавка глицерина к раствору электролита кристаллизации NiSO4-7H2O (образец 8 табл. 1) способствует увеличению скорости кристаллизации (двое суток по сравнению с восемью сутками в контрольном варианте). Этот факт можно объяснить уменьшением межфазного натяжения на границе зародыш сульфата никеля - раствор. Показатель поверхностного натяжения глицерина (ст-103 н/м = 59,4) много меньше показателя поверхностного натяжения воды (ст-103 н/м = 72,75). В нашем случае, глицерин работает как поверхностно-активное вещество (ПАВ). Размеры кристаллов, полученных в присутствии глицерина, незначительно меняются во времени.
Следует заметить, что глицерин снимает также ползучесть кристаллов по стенкам сосуда, что может очистить внутренние поверхности стенок автоклава, в котором реализуется процесс очистки и кристаллизации NiSO4-7H2O на производстве.
На основании результатов эксперимента, изложенных выше, нами исследовалось влияние концентрации глицерина на скорость появления кристаллов и их размеры. Результаты этого эксперимента представлены в табл. 2. Поскольку наличие зародышей кристаллов NiSO4-7H2O в растворах увеличивает скорость процесса кристаллизации, как показывает эксперимент (табл. 1, образец 2), добавка глицерина осуществлялась в присутствии зародышей кристаллов NiSO4-7H2O.
Таблица 1
Влияние облучения наносекундными импульсами и действие глицерина на скорость кристаллизации NiSO4-7H2O из пересыщенных растворов
|
2М раствор электролита NiSO4-7H2O |
Время обработки пересыщенного раствора NiSO4-7H2O наносекундными электромагнитными импульсами |
|||||||
|
Контрольный вариант без зародыша |
Контрольный вариант + зародыш без НЭМИ |
10 мин обработки НЭМИ |
15 мин обработки НЭМИ |
30 мин обработки НЭМИ |
45 мин обработки НЭМИ |
60 мин обработки НЭМИ |
Добавка глицерина без обработки НЭМИ |
|
|
Номер образца |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Время появления кристаллов NiSO4-7H2O |
8-е сутки |
4-е сутки |
4-е сутки |
5-е сутки |
6-е сутки |
6-е сутки |
6-е сутки |
2-е сутки |
|
Свойства кристаллов (размеры кристаллов по длине и ширине, см) |
отдельные кристаллы, растут во времени длина 1,28 см ширина 0,55 см |
кристаллы, растут на зародышах длина 0,86 см ширина 0,45 см |
единичные кристаллы растут на дне длина 0,95 см ширина 0,48 см |
кристаллы растут на зародышах и на дне длина 0,9 см ширина 0,42 см |
кристаллы растут на зародышах ина дне длина 0,88 см ширина 0,38 см |
кристаллы растут на зародышах и на дне длина 0,87 см ширина 0,36 см |
единичные кристаллы на дне длина 0,77см ширина 0,29 см |
друза кристаллов растет во времени длина 1,12 см ширина 0,45 см |
Таблица 2
Влияние концентрации глицерина на скорость кристаллизации NiSO4-7H2O из пересыщенных растворов
|
50 мл 2М-ного раствора электролита для кристаллизации NiSO4-7H2O |
Добавка глицерина к раствору электролита кристаллизации NiSO4-7H2O |
|||||
|
Контр, вариант+ зародыш |
Контр, вариант+ зародыш + 0,1 мл глицерина |
Контр, вариант+ зародыш + 0,3 мл глицерина |
Контр, вариант+ зародыш + 0,5 мл глицерина |
Контр, вари-ант + зародыш + 0,75 мл глицерина |
Контр, вариант+ зародыш + 1,0 мл глицерина |
|
|
Номер образца |
1 |
2 |
3 |
4 |
5 |
6 |
|
Время появления кристаллов NiSO47H2O |
4-е сутки |
2-е сутки |
2-е сутки |
2-е сутки |
2-е сутки |
2-е сутки |
|
Свойства кристаллов |
Крупные кристаллы, растут во времени на зародышах |
Средней величины кристаллы, растут на зародышах во времени |
Мелкие единичные кристаллы, растут во времени на зародышах |
Мелкие кристаллы, растут во времени на зародышах |
Мелкие кристаллы, растут во времени на зародышах |
Очень мелкие кристаллы, растут во времени на зародышах |
Из табл. 2 видно, что добавка глицерина во всех случаях (образцы 2-8) способствует увеличению скорости процесса кристаллизации. Начало кристаллизации сульфата никеля не зависит от концентрации глицерина в растворе. Но влияние концентрации глицерина в пересыщенном растворе сульфата никеля проявилось на размерах кристаллов, а именно, при добавлении 0,1 мл глицерина к 50 мл раствора сульфата никеля образовались крупные кристаллы, размером в среднем 1,1-1,2 см по длине, с увеличением концентрации глицерина (табл. 2) размеры кристаллов уменьшаются. Кристаллы образца б представляют собой друзы из мелких и тонких кристаллов.
Химический анализ образцов кристаллов сульфата никеля, полученных в контрольном варианте - образец № 1, образцов кристаллов, полу ченных при обработке раствора электролита сульфата никеля с помощью НЭМИ - образец № 3 и образцов кристаллов, полученных при добавлении глицерина к раствору электролита сульфата никеля - образец № 8 (табл. 1), который проводился фотометрическим методом, показал, что концентрация ионов железа в кристаллогидратах не превышает 0,001 массовых процентов, что соответствует ОСТ 10910-40.
На рис. 2 представлено изображение поверхности образцов, полученное на растровом электронном микроскопе (при семидесятикратном увеличении), кристаллы которых образовались из пересыщенного раствора сульфата никеля семиводного при обработке его НЭМИ в течение 10 минут. На кадре 01 этого рисунка исследовалась область, максимально отвечающая большей части поверх-

Рис. 2. Поверхность образцов, полученных из облученного в течение 10 мин пересыщенного раствора электролита NiSO4-7H2O ности кристалла и именно на этой части поверхности массовая доля никеля в % равна 28,51. На более темных участках поверхности (вкраплениях) кадра 02, массовая доля никеля в % составляет 23,94; 15,53 и 21,64 соответственно. На кадре 02, в исследуемой точке рис. 2 массовая доля никеля минимальна, но как показал анализ, на этих участках присутствует углерод, сера и калий, массовая доля которых составляет 37,97; 10,47 и 0,82 % соответственно. Кислорода в этом образце в среднем 55,76 %.
На рис. 3 представлены кадры поверхности кристаллов сульфата никеля, которые выросли из растворов электролита с добавлением глицерина. Кадр 01 снят в исследуемой точке поверхности, наиболее типичной для данного образца, массовая доля никеля, в данном случае, составляет 29,77 %.
На кадре 02 рис. 3 исследовались редкие мелкие участки темного цвета. Массовая доля никеля, углерода, натрия, серы, калия и хлора на этих участках 15,065 (средняя); 60,07; 1,80; 6,29; 0,58 и 0,88 % соответственно. Массовая доля кислорода в этом образце в среднем составляет 56,84 %. Наличие углерода на поверхности образцов (рис. 2 и 3) объясняется остаточными включениями не прореагировавшего карбоната никеля.
Все исследованные образцы получены из растворов сульфата никеля семиводного NiSO4-7H2O. Подтверждением этого является проведенный нами дифракционный термогравиметрический анализ (ДТА).
Анализ дереватограммы (кривая) рис. 4, снятой в квазиизотермическом режиме, когда нагрев пробы ведется с большой скоростью до начала

Кадр 01 Кадр 02
Рис. 3. Поверхность образцов, полученных из пересыщенных растворов электролита NiSO4-7H2O с добавкой глицерина
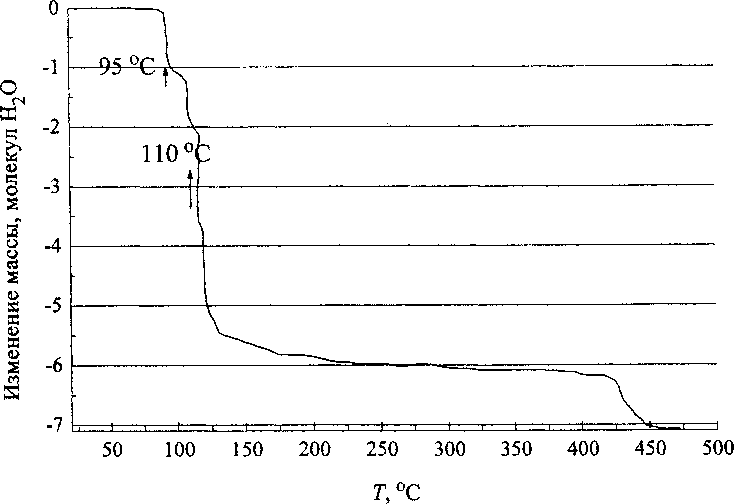
Рис. 4. Дереватограмма, снятая в квазиизотермическом режиме
изменения массы, а далее температура регулируется прибором так, чтобы изменение массы происходило с постоянной малой скоростью показывает, что процесс дегидратации кристаллогидрата сульфата никеля семиводного NiSO4-7H2O (кристаллы темно-изумрудного цвета) протекает в несколько стадий. При температуре 95 °C кристаллогидрат сульфата никеля теряет одну молекулу воды, при этом образуется кристаллогидрат сульфата никеля шестиводного MiSO4-6H2O, при температурах ПО и 120 °C уходит две молекулы воды и образуется четырехводный сульфат никеля NiSO4-4H2O и, наконец, при температуре 425 °C происходит полная дегидратация и безводный сульфат никеля представляет собой вещество светло желтого цвета [4].
Исследовательская работа относится к области цветной металлургии, а именно получению сульфата никеля из отработанных сернокислых электролитов производства рафинированной меди. Результаты работы показывают, что использование глицерина в качестве добавки к раствору элек тролита сульфата никеля увеличивает скорость процесса кристаллизации, способствует увеличению размеров кристаллов сульфата никеля, это в свою очередь положительно сказывается на слеживании продукта при транспортировке. На основании термогравиметрического анализа показано, что при температуре 425 °C можно получить безводный сульфат никеля.


