Получение терминально n-деацетилированных олигомеров хитозана с помощью рекомбинантной хитоолигосахариддеацетилазы NodB Mesorhizobium loti, продуцируемой Escherichia coli
Автор: Леппянен И.В., Долгих В.В., Артамонова Т.О., Лопатин С.А., Ходорковский М.А., Тихонович И.А., Долгих Е.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биоинженерия, биотехнологии
Статья в выпуске: 1 т.53, 2018 года.
Бесплатный доступ
Олигомеры хитина и хитозана влияют на рост и развитие растений и способны индуцировать их устойчивость к заражению фитопатогенами, что определяет интерес к получению и использованию этих соединений. Влияние олигомеров хитозана на растение непосредственно зависит от степени их деацетилирования, но при гидролизе полимера или химическом синтезе трудно получить соединения необходимой структуры. Такие задачи могут быть решены в процессе биосинтеза хитоолигосахаридов, когда используются ферменты с определенной специфичностью. Избирательная способность хитоолигосахариддеацетилазы (КФ 3.5.1.-) почвенных ризобий осуществлять монодеацетилирование хитоолигосахаридов по терминальному положению обусловливает интерес к изучению возможности использования этого фермента для получения таких соединений. В настоящей работе нами предложены подходы для синтеза монодеацетилированной хитопентаозы (тетра-N-ацетилхитопентаозы) с помощью фермента хитоолигосахариддеацетилазы бактерий Mesorhizobium loti. При гетерологичной экспрессии гена nodB, кодирующего хитоолигосахариддеацетилазу M. loti CIAM1803, в штаммах Escherichia coli XL1-Blue-MRF' и SHuffle express с помощью модифицированного вектора pOPE101mod -nodB с удаленной последовательностью pelB нам удалось получить фермент в растворимом состоянии. При этом количество растворимого фермента было выше в случае штамма SHuffle express, специально разработанного для обеспечения правильного формирования дисульфидных связей в синтезируемых белках. Изучение свойств фермента, очищенного на Ni-NTA агарозе, показало его способность деацетилировать пента-N-ацетилхитопентаозу по терминальному положению. Масс-спектрометрический анализ подтвердил использование практически всего субстрата для получения деацетилированной тетра-N-ацетилхитопентаозы. Были разработаны методы разделения и очистки деацетилированных хитоолигосахаридов с помощью ионообменной хроматографии с последующим обессоливанием. Синтез терминально N-деацетилированных олигомеров хитозана может быть необходимым этапом при получении их конъюгатов с биологически активными соединениями.
Олигомеры хитина и хитозана, хитоолигосахариддеацетилаза mesorhizobium loti, векторы pope101-215(yol) и prsetb, биосинтез, escherichia coli shuffle express и xl1-blue mrf'
Короткий адрес: https://sciup.org/142214118
IDR: 142214118 | DOI: 10.15389/agrobiology.2018.1.189rus
Текст научной статьи Получение терминально n-деацетилированных олигомеров хитозана с помощью рекомбинантной хитоолигосахариддеацетилазы NodB Mesorhizobium loti, продуцируемой Escherichia coli
Олигомеры хитина и хитозана (хитоолигосахариды) находят широкое практическое применение в медицине и агротехнологиях. В сельском хозяйстве интерес к этим соединениям связан с их способностью индуцировать неспецифическую устойчивость растений к заражению фитопатогенами благодаря активации естественного защитного потенциала (элиси-торная активность) (1, 2), а также стимулировать рост и развитие растений. Особенность хитоолигосахаридов при использовании в качестве регуляторов — нетоксичность даже в значительных количествах и легкость утилизации, что делает их экологически безопасными (3-5).
Для проявления элиситорной активности важна степень деацетилирования хитоолигосахаридов, поскольку в случае одних видов растений (арабидопсис, рис, пшеница) элиситорные свойства проявляют полностью ацетилированные олигомеры хитина, других (горох, кофе, петрушка) — частично или полностью деацетилированные олигомеры хитозана (6-9). Кро-
В работе использовано оборудование ЦКП «Аналитический центр нано- и биотехнологий ГОУ СПбГПУ» на базе ФГБОУ ВПО СПбГПУ. Исследования выполнены при финансовой поддержке РНФ (грант ¹ 16-16-10043), часть исследований по разработке методов разделения деацетилированных хитоолигоса-харидов поддержана РФФИ (грант ¹ 15-29-05858-офи-м).
ме того, деацетилирование хитоолигосахаридов по определенным положениям может позволить ковалентно присоединять к ним различные химические группировки, что значительно расширит круг таких соединений.
При химическом синтезе сложно получить соединения с необходимой степенью деацетилирования. В частности, синтезировать таким способом частично деацетилированные олигомеры хитина практически невозможно из-за одинаковой химической активности аминогрупп в сахарных остатках, что не позволяет проконтролировать прохождение реакции деацетилирования из-за жестких условий. Подобные проблемы могут быть решены при биосинтезе хитоолигосахаридов, когда используются ферменты с избирательной специфичностью и в результате образуются продукты со строго определенной структурой. В связи с этим большой интерес представляет поиск и изучение ферментов, участвующих в синтезе олигомеров хитина и их деацетилированных производных.
У бактерий Rhizobium spp. общие для всех ризобиальных видов гены nodABC (10-13) кодируют ферменты, необходимые для синтеза коровой структуры Nod-факторов — сигнальных молекул, контролирующих развитие бобово-ризобиального симбиоза. NodC — это N-ацетилглюкозаминилтранс-фераза, катализирующая синтез олигомеров хитина. Хитоолигосахаридде-ацетилаза NodB необходима для деацетилирования хитоолигосахарида по невосстанавливающему концу (терминальному N-ацетилглюкозамину) (14), что позволяет присоединять к нему жирную кислоту с помощью ацил-трансферазы NodA. Избирательная способность хитоолигосахариддеацети-лазы ризобий осуществлять монодеацетилирование по терминальному положению определяет интерес к изучению возможности использования этого фермента для синтеза in vitro деацетилированных олигомеров хитозана.
Ранее нами был разработан подход для получения олигомеров хитина, связанный с использованием фермента N-ацетилглюкозаминилтранс-феразы двух штаммов ризобиальных бактерий — Rhizobium sp. GRH2 и Mesorhizobium loti CIAM1803 (15). В представленной работе мы осуществили гетерологичную экспрессию гена nodB, кодирующего хитоолигосахаридде-ацетилазу M. loti CIAM1803, в двух штаммах Escherichia coli XL1-Blue-MRF’ и SHuffle express. При этом использовалась плазмида pOPE101-215(Yol), которая позволяет синтезированному белку за счет включения в состав лидерной последовательности pelB перемещаться в периплазматическое пространство, что обеспечивает его сохранность и правильность фолдинга (16). Такую плазмиду с успехом применили для синтеза тяжелых и легких цепей иммуноглобулина G (16). Ранее была предпринята попытка осуществить синтез NodB Sinorhizobium meliloti в бактериях E. coli BL21(DE3) с помощью вектора pET-3c, при этом рекомбинантный белок образовывал тельца включения, что потребовало рефолдинга (вероятно, поэтому активность фермента была невысока) (14). Получить активный растворимый белок NodB Rhizobium sp. GRH2 недавно удалось группе, которая осуществила его синтез в клетках BL21(DE3), трансформированных вектором pET22b(+) (17), но выход фермента оказался недостаточно высоким.
В настоящей работе с помощью вектора pOPE101-215(Yol) и его модифицированной версии pOPE101mod c удаленной последовательностью pelB , использованных для трансформации двух штаммов E. coli SHuffle express и XL1-Blue MRF’, нам удалось добиться высокого выхода растворимого белка — фермента хитоолигосахариддеацетилазы NodB Mesorhizobium loti , способного деацетилировать пента-N-ацетилхитопентаозу по терминальному положению. Для образуемых деацетилированных хитоолигосахаридов были разработаны методы избирательного выделения.
Цель работы заключалась в изучении возможности получения терминально N-деацетилированных олигомеров хитозана с помощью хитооли-госахариддеацетилазы NodB, синтезируемой при гетерологичной экспрессии специально разработанных генных конструкций.
Методика . ДНК выделяли из штамма Mesorhizobum loti CIAM 1803 (WDCM 966). Штамм E. coli DH5a использовали для стандартных процедур клонирования. Синтез белков осуществляли в мутантном штамме E. coli C41, полученном на основе BL21(DE3) (18), а также в штаммах XL1-Blue MRF’ («Stratagene», США) и SHuffle express («New England BioLabs», Великобритания). Штаммы E. coli культивировали в жидкой среде LB (19) или 2хYT («Difco», Нидерланды) на орбитальном шейкере Heidolph Unimax 2010 («Heidolph Instruments GmbH», Германия) при 30 °С или 37 °С с добавлением ампициллина (100 мкг/мл) в присутствии 0,04 мM или 0,4 мM индуктора экспрессии изопропил- β -D-тиогалактозида (ИПТГ). Штамм ри-зобий культивировали в жидкой среде TY (триптон — 5 г/л, дрожжевой экстракт — 3 г/л, CaCl2 — 0,5 г/л) при 28 °С.
При создании генетических конструкций для синтеза NodB в бактериях E. coli полноразмерный ген nodB амплифицировали на матрице ДНК штамма M. loti CIAM1803 (WDCM 966) с помощью праймеров, в которые были введены сайты рестрикции BamHI и EcoRI для клонирования в векторе pRSETb («Invitrogen», США) или NcoI и NotI для клонирования в векторе pOPE101-215(Yol) («Progen Biotechnik GmbH», Германия): nodB _F_BamHI — GG GGATCC GATGAGACGTCTCGATGACAG, nodB _R_EcoRI — GG GAATTC TCAGTGATGTTCTGGAAGCG, nodB _F_NcoI — GG CCATGG CGATGAGACGTCTCGATGACAG, nodB _R_NotI — GGG CGGCCG CGTGATGTTCTGGAAGCG.
Амплификацию проводили в термоциклере Thermal Cycler C1000 («Bio-Rad Laboratories», США) по следующему протоколу: 5 мин при 95 °С; Зо циклов — 30 с при 94 °С, 30 с при 51 °С и 30 с при 72 °С).
Для получения модифицированного вектора pOPE101mod с удаленной последовательностью pelB использовали следующие праймеры: nodB _F_NcoI — GG CCATGG CGATGAGACGTCTCGATGACAG, pOPE101mod_R_NcoI — CC CCATGG CGGTTAATTTCTCCTCTT.
Все векторы содержали His 6 последовательность, позволяющую проводить очистку рекомбинантных белков с помощью металлохелатной аффинной хроматографии.
Конструкции вводили в клетки E. coli методами электро- или химической трансформации (15, 20, 21). Плазмидную ДНК выделяли из 3 мл культуры с помощью щелочного лизиса (22).
Для синтеза белка NodB клетки E. coli С41, XL1-Blue MRF’ или SHuffle express культивировали в жидкой среде LB или 2xYT при 37 °С до плотности OD 6 00 = 0,6-0,7, затем добавляли ИПТГ до конечной концентрации 0,04 или 0,4 мМ и продолжали культивирование при 30 °С или 37 °С в течение 3 или 24 ч. После завершения синтеза клетки выдерживали на льду в течение 20 мин, затем осаждали центрифугированием при 3500 g (J2-21, «Beckman Coulter, Inc.», США) в течение 15 мин при 4 °С. Осадок клеток мягко ресуспендировали в 50 мМ Na-фосфатном буфере (pH 7,4), содержащем смесь протеазных ингибиторов («Sigma», США), 1 мМ дитиотре-итол (ДТТ) и ДНКазу (1 Е/мл). Клетки обрабатывали ультразвуком 3 раза в течение 30 с при амплитуде 10 мкм (Soniprep 150 Plus, «MSE», Великобритания), с интервалами выдерживания на льду в течение 40 с, после чего центрифугировали при 100000 g (TL-100, «Beckman Coulter, Inc.», США).
Аликвоты растворимой и нерастворимой фракций белков разделяли в 12-15 % полиакриламидном геле (ПААГ) в трис-глициновом буфере в присутствии додецилсульфата натрия (SDS) (25 мМ Трис-HCl pH 8,3; 192 мМ глицин, 0,1 % SDS) по методу U.K. Laemmli (23). Для разделения использовали систему Mini-PROTEAN 3 («Bio-Rad Laboratories», США), сила тока — 15-35 мА на гель. После завершения электрофореза гели промывали деионизованной водой и либо окрашивали в растворе Simple Blue («Invitrogen», США) по протоколу производителя, либо использовали для Вестерн-блот гибридизации. Белки переносили на нитроцеллюлозную мембрану с помощью прибора для полусухого блоттинга Mini Trans-Blot («Bio-Rad Laboratories», США). Для проверки эффективности переноса мембраны окрашивали Ponce 4R, после чего отмывали 2 раза по 10 мин в буфере TBS (50 мM Трис-HCl, pH 8,0; 150 мM NaCl), затем 2 раза по 15 мин в буфере TTBS (50 мM Трис-HCl, pH 8,0; 150 мM NaCl, 0,05 % Tween-20). Далее их инкубировали в течение 1 ч в блокирующем растворе TTBS, содержащем 1 % бычий сывороточный альбумин (БСА), затем в течение 2 ч — с антителами против His6 последовательности (анти-His), конъюгированными с пероксидазой хрена, которые разводили в буфере TTBS с 0,5 % БСА в соотношении 1:2000. После этого мембраны отмывали 2 раза по 15 мин в буфере TTBS, затем 2 раза по 10 мин в буфере TBS. Для проявления реакции использовали хемилюминесцентный субстрат Clarity Western ECL Substrate («Bio-Rad Laboratories», США). Развитие реакции анализировали на приборе G:BOX-CHEMI-XX9 («Syngene», Великобритания).
Для стандартной процедуры очистки синтезированных белков, содержащих His6 последовательность, использовали 100 мкл Ni-NTA (nickelnitrilotriacetic acid) агарозы («Thermo Fisher Scientific», США). Очистку проводили при 4 °С по протоколу, предложенному производителем, белок смывали с колонки 50 мM Na-фосфатным буфером (pH 7,4), содержащим имидазол (300 мM).
Деацетилирование пента-N-ацетилхитопентаозы in vitro с помощью полученного белка NodB проводили в течение ночи при 28 °С в 100 мкл раствора, содержащего 3-[N-морфолино]пропансульфоновую кислоту (MOPS, 20 мM, pH 7,2), 5 мкг очищенного на Ni-NTA агарозе фермента и 1 мг субстрата пента-N-ацетилхитопентаозы. Реакцию останавливали кипячением при 95 °С в течение 5 мин, центрифугировали 10 мин при 14000 g (Mikro 22R, «Hettich GmbH & Co. KG», Германия). Надосадочную жидкость высушивали в вакуумном испарителе (Concentrator Plus, «Eppen-dorf», США). Разделение и очистку полученного олигомера хитозана выполняли с помощью ионообменной хроматографии на Toyopearl-SP 650M (0,5½2 см) («Sigma-Aldrich», США); элюцию проводили 0,2 М NaCl. Для удаления соли из элюата использовали картридж Sep-Pak C18 («Waters», США).
Продукты реакции деацетилирования анализировали на ионноциклотронном масс-спектрометре Varian 902 FT/ICR MS («Agilent Technologies», США) со сверхпроводящим магнитом 9,4 Тл. Десорбцию и ионизацию пробы осуществляли с помощью третьей гармоники Nd:YAG лазера (X = 355 нм). Образцы растворяли в 2 мкл 0,1 % водного раствора трифторуксусной кислоты (ТФУ), аликвоту (0,5 мкл) смешивали на мишени с равным объемом матрицы — 2,5-дигидроксибензойной кислоты в концентрации 20 мг/мл (растворителем для матрицы служила смесь ацетонитрила и водного раствора 0,1 % ТФУ в соотношении 30 %:70 %) и сушили на воздухе. Далее образцы подвергали лазерному облучению (по 5 импульсов в серии). Молекулярную массу пробы определяли методом внешней калибровки с использованием стандартов.
Результаты. Конструирование векторов, обеспечивающих синтез белка NodB в клетках E. coli. Для гетерологичной экспрессии гена nodB M. loti CIAM1803 получили два вида конструкций — в векторе pRSETb под контролем промотора бактериофага Т7 и в векторе pOPE101-215(Yol), в котором кодирующую последовательность гена клонировали под синтетическим промотором в рамке с последовательностью pelB, необходимой для переноса синтезированного белка в периплазматическое пространство.
Синтез хитоолигосахариддеацетилазы (NodB) в штамме E. coli С41 с помощью конструкции pRSETb- nodB . Необходимым условием для синтеза белка является способность штамма E. coli стабильно сохранять экспрессионный вектор, быть устойчивым к чужеродному продукту и обеспечивать его стабильность. Такими свойствами обладают мутантные штаммы E. coli С41(DE3) и C43(DE3), полученные на основе BL21(DE3) (18). При культивировании клеток E. coli С41, трансформированных конструкцией pRSETb- nodB , в присутствии 0,4 мМ индуктора ИПТГ наблюдали синтез белка NodB с ожидаемой молекулярной массой около 25 кДа (рис. 1). Продукция NodB оказалась высокой, но при этом его основная масса накапливалась в нерастворимой фракции, полученной при 3600 g, что свидетельствовало о формировании телец включения (см. рис. 1). Варьирование температуры культивирования и концентрации индуктора не влияло на увеличение выхода белка NodB в растворимом состоянии. Сходным образом ранее при использовании клеток BL21(DE3), трансформированных вектором pET-3c, в котором ген nodB был клонирован под промотором T7, весь синтезированный белок находился в нерастворимой фракции (14). Таким образом, с векторами, обеспечивающими очень высокий уровень синтеза NodB в клетках E. coli , не удается получить его в растворимом состоянии.
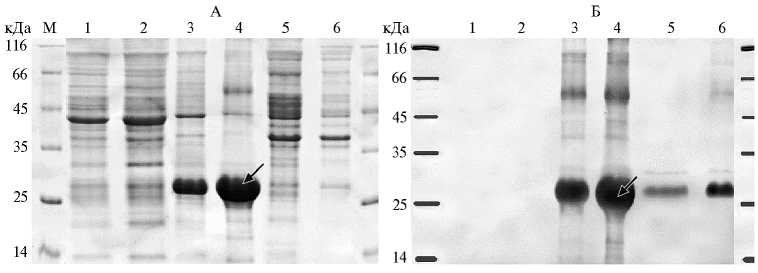
Рис. 1. Синтез хитоолигосахариддеацетилазы (NodB) Mesorhizobum loti CIAM1803 в клетках Escherichia coli C41, трансформированных вектором pRSETb- nodB , после 20 ч культивирования. А — окрашивание геля Simple Blue, Б — вестерн-блот гибридизация с анти-His антителами. Трансформация вектором pRSETb без вставки (контроль): 1 и 2 — культивирование без добавления индуктора изопропил- β -D-тиогалактозида (ИПТГ) и с 0,4 мМ ИПТГ. Трансформация вектором pRSETb- nodB : 3 и 4 — культивирование без добавления ИПТГ и с 0,4 мМ ИПТГ (нерастворимые фракции, полученные при центрифугировании при 3600 g); 5 и 6 — культивирование без добавления ИПТГ и с 0,4 мМ ИПТГ (нерастворимые фракции, полученные при центрифугировании при 14000 g). М — маркер молекулярной массы. Стрелкой отмечен синтезируемый белок.
Синтез хитоолигосахариддеацетилазы в E. coli XL1-Blue MRF’ и SHuffle express с помощью вектора pOPE101-215(Yol) . Для увеличения выхода растворимого белка NodB нами была использована конструкция в векторе pOPE101-215(Yol) («Progen Biotechnik GmbH», Германия), обеспечивающем накопление белка в периплазматическом пространстве клеток. При введении pOPE101-215(Yol)- nodB в клетки E. coli XL1-
Blue MRF’ и SHuffle express в присутствии 0,04 и 0,4 мМ ИПТГ наблюдали синтез белка с ожидаемой молекулярной массой (около 25 кДа). Об этом судили по появлению продукта, сходного по подвижности с тем, который синтезировался в клетках E. coli С41 при использовании конструкции pRSETb- nodB . У обоих штаммов экспрессия NodB была максимальной при культивировании в течение ночи, температуре 37 °С и концентрации ИПТГ 0,4 мМ (рис. 2), но в случае штамма XL1-Blue MRF’ продукция NodB оказалась существенно выше (см. рис. 2). Белок, полученный в клетках E. coli XL1-Blue MRF’, накапливался преимущественно в нерастворимой фракции, и лишь незначительное его количество присутствовало в растворимой (рис. 3). Для того чтобы исключить возможность неэффективного лизиса клеток при использовании специального буфера (16), мы применили обработку ультразвуком. Однако, вероятно, из-за особенностей структуры синтезированного белка NodB его эффективного переноса в пе-риплазматическое пространство мы не выявили. Для оценки возможного влияния pelB на уровень синтеза белка нами была также получена конструкция pOPE101mod- nodB , из которой удалили фрагмент, кодирующий эту последовательность.
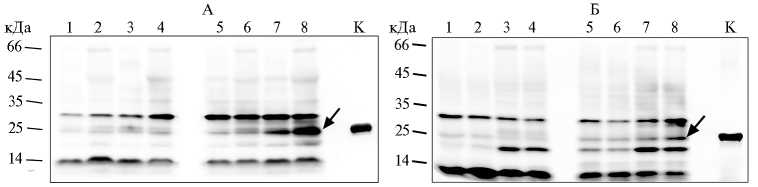
Рис. 2. Синтез хитоолигосахариддеацетилазы (NodB) Mesorhizobum loti CIAM1803 в клетках Escherichia coli XL1-Blue MRF’ (A) и SHuffle express (Б) , трансформированных вектором pOPE101-215(Yol)- nodB : 1 и 2 — культивирование при 30 °С в присутствии 0,04 мМ изопро-пил- в -D-тиогалактозида (ИПТГ) в течение 3 и 20 ч, 3 и 4 — культивирование при 30 °С с 0,4 мМ ИПТГ в течение 3 и 20 ч; 5 и 6 — культивирование при 37 °С с 0,04 мМ ИПТГ в течение 3 и 20 ч, 7 и 8 — культивирование при 37 °С с 0,4 мМ ИПТГ в течение 3 и 20 ч. К (контроль) — синтез белка NodB в клетках E. coli С41 с помощью вектора pRSETb- nodB через 20 ч при 37 °С в присутствии 0,4 мМ ИПТГ (нерастворимая фракция). Вестерн-блот гибридизация с анти-His антителами. Стрелкой отмечен синтезируемый белок.
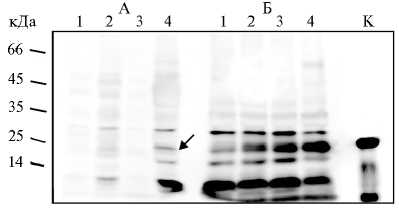
Рис. 3. Анализ содержания белка NodB Mesorhizobum loti CIAM1803 в растворимой (А) и нерастворимой (Б) фракциях клеток Escherichia coli XL1-Blue MRF’ при трансформации конструкцией pOPE101-215(Yol)-nodB: 1 и 2 — культивирование при 37 °С в присутствии 0,04 мМ изопропил-β-D-тиога-лактозида (ИПТГ) в течение 3 и 20 ч, 3 и 4 — культивирование при 37 °С с 0,4 мМ ИПТГ в течение 3 и 20 ч. К (контроль) — синтез белка NodB в клетках E. coli С41 с помощью вектора pRSETb-nodB через 20 ч при 37 оС в присутствии 0,4 мМ ИПТГ (нерастворимая фракция). Вестерн-блот гибридизация с анти-His антителами. Стрелкой отмечен синтезируемый белок.
Синтез хитоолигосахариддеацетилазы (NodB) в клетках E. coli XL1-Blue MRF’ и SHuffle express с помощью вектора pOPE101mod- nodB. При использовании вектора pOPE101mod- nodB , из которого была удалена лидерная последовательность pelB , наблюдали более высокий уровень продукции NodB в двух типах клеток E. coli XL1-Blue MRF’ и SHuffle express по сравнению с таковым в варианте трансформации исходным вектором pOPE101-215(Yol)- nodB (рис. 4, 5). При культивировании в присут-194
ствии 0,4 мМ ИПТГ и температуре 30 и 37 °С высокий уровень синтеза NodB наблюдали уже через 3 ч в клетках двух штаммов E. coli XL1-Blue MRF’ и SHuffle express (см. рис. 4, 5). При этом количество растворимого белка было
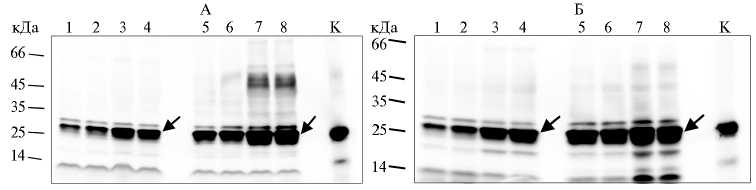
Рис. 4. Синтез хитоолигосахариддеацетилазы NodB Mesorhizobum loti CIAM1803 при трансформации Escherichia coli XL1-Blue MRF’ (А) и SHuffle express (Б) вектором pOPE101mod- nodB : 1 и 2 — культивирование при 30 °С в присутствии 0,04 мМ изопропил- в -D-тиогалактозида (ИПТГ) в течение 3 и 20 ч, 3 и 4 — культивирование при 30 °С с 0,4 мМ ИПТГ в течение 3 и 20 ч; 5 и 6 — культивирование при 37 °С с 0,04 мМ ИПТГ в течение 3 и 20 ч, 7 и 8 — культивирование при 37 °С с 0,4 мМ ИПТГ в течение 3 и 20 ч. К (контроль) — белок NodB, синтезируемый в клетках E. coli С41 с помощью вектора pRSETb- nodB через 20 ч при 37 °С в присутствии 0,4 мМ ИПТГ. Вестерн-блот гибридизация с анти-His антителами. Стрелкой отмечен синтезируемый белок.
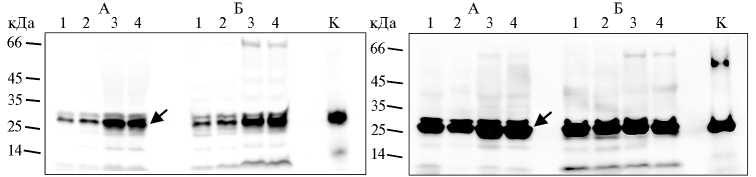
Рис. 5. Содержание белка NodB Mesorhizobum loti CIAM1803 в растворимой (А) и нерастворимой (Б) фракциях при трансформации Escherichia coli XL1-Blue MRF’ (слева) и SHuffle express (справа) конструкцией pOPE101mod- nodB ( культивирование при 30 ° С): 1 и 2 — культивирование в присутствии 0,04 мМ изопропил- β -D-тиогалактозида (ИПТГ) в течение 3 и 20 ч, 3 и 4 — культивирование с 0,4 мМ ИПТГ в течение 3 и 20 ч. К (контроль) — синтез белка NodB в клетках E. coli С41 с помощью вектора pRSETb- nodB через 20 ч в присутствии 0,4 мМ ИПТГ (нерастворимая фракция). Вестерн-блот гибридизация с анти-His антителами. Стрелкой отмечен синтезируемый белок.
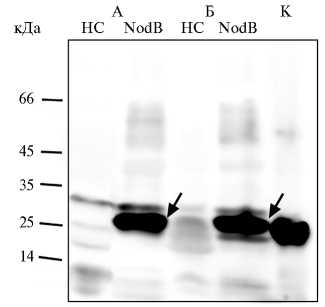
Рис. 6. Очистка рекомбинантного белка NodB Mesorhi-zobum loti CIAM1803 на Ni-NTA агарозе: А и Б — трансформация штаммов Escherichia coli XL1-Blue MRF’ и SHuffle express конструкцией pOPE101mod- nodB , K (контроль) — трансформация E. coli С41 pRSETb- nodB ; НС — белок, не связавшийся с Ni-NTA агарозой, NodB — белок, очищенный на Ni-NTA агарозе. Вестерн-блот гибридизация с анти-His антителами. Стрелкой отмечен синтезируемый белок.
выше при температуре 30 °С и использовании штамма SHuffle express (см. рис. 5), специально разработанного для обеспечения правильного формирования дисульфидных связей в белках (24). Повышение выхода рекомбинантного продукта в рас- творимом состоянии при снижении температуры культивирования, вероятно, может определяться тем, что в таких условиях в клетке усиливается синтез шаперонов (25). Таким образом, нам удалось получить хитоолигос-ахариддеацетилазу в растворимом состоянии.
Анализ продуктов реакции деацетилирования пента-
N-ацетилхитопентаозы с помощью фермента хитоолигосаха-риддеацетилазы M. loti CIAM1803. Для проверки ферментативной активности полученной хитоолигосахариддеацетилазы исследовали ее способность деацетилировать пента-N-ацетилхитопентаозу — основной субстрат этого фермента у бактерий M. loti . С этой целью провели очистку рекомбинантного белка, полученного при синтезе в клетках E. coli XL1-Blue MRF’ и Shuffle express, с помощью металлохелатной аффинной хроматографии на Ni-NTA агарозе (из 50 мл культуры получили около 200 мкг частично очищенного белка) (рис. 6). Очищенный фермент инкубировали с субстратом — пента-N-ацетилхитопентаозой. Масс-спектрометрия образцов, полученных после реакции деацетилирования, катализируемой хито-олигосахариддеацетилазой NodB (рис. 7), выявила соединение с соотношением массы к заряду (m/z) 1014,390. Ожидаемая масса деацетитилиро-ванной по одному положению хитопентаозы — 991. Однако при масс-спектрометрическом анализе к исследуемому веществу, как правило, присоединяется ион Н+ или Na+. При присоединении Na+ молекулярная масса анализируемого вещества составит 991 + 23 = 1014. Таким образом, синтезируемое вещество — это тетра-N-ацетилхитопентаоза (монодеацетилиро-ванная хитопентаоза). Проведенный анализ показал, что хитоолигосахарид-деацетилаза, полученная при синтезе в бактериях E. coli Shuffle express и XL1-Blue MRF’, обладает необходимой ферментативной активностью.
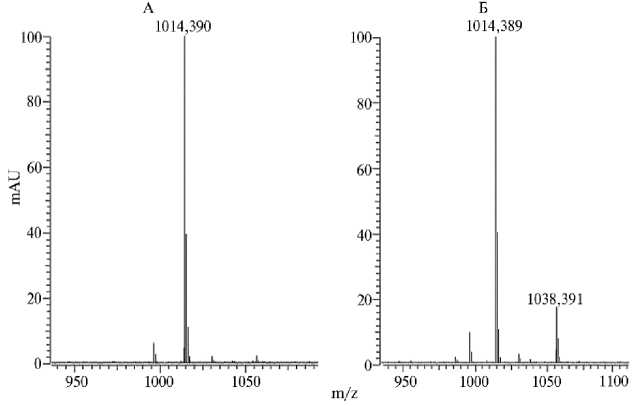
Рис. 7. Масс-спектрометрический анализ продуктов реакции деацетилирования пента-N-ацетилхитопентаозы с помощью фермента хитоолигосахариддеацетилазы Mesorhizobum loti CIAM1803, синтезированной в штаммах E. coli SHuffle Express (А) и XL1-Blue MRF’ (Б) с помощью вектора pOPE101mod- nodB (масс-спектрометр Varian 902 FT/ICR MS, «Agilent Technologies», США).
Выделение N-терминально деацетилированных хитооли-госахаридов. Мы также исследовали возможность выделения деацетилированных хитоолигосахаридов (за счет наличия в молекуле свободной аминогруппы) методом ионообменной хроматографии. При этом необходимо было решить задачу удаления водно-солевого элюента после хроматографии. Для выделения N-терминально деацетилированного хитоолигосаха-рида применили ионообменную хроматографию на Toyopearl-SP 650M; элюцию проводили 0,2 М NaCl. Для удаления соли из элюата использовали картридж Sep-Pak C18. Это связано с тем, что олигомеры как хитина, так и хитозана способны обратимо взаимодействовать в водном элюенте с обращенно-фазовыми сорбентами, а время их выхода с колонки в несколько 196
раз превышает время выхода неорганических солей (26). Раствор хитооли-госахарида после ионообменной хроматографии (не более одного объема картриджа) пропускали через сорбент, который затем промывали водой. Молекулы NaCl через гидрофобную среду проходят практически без эффекта разбавления, поэтому для полного обессоливания достаточно промыть колонку 3 объемами картриджа. После этого хитоолигосахарид элюировали водой, обессоленный раствор лиофильно высушивали и проводили анализ. Таким образом, нами были разработаны методы избирательного выделения деацетилированных хитоолигосахаридов.
В нашей работе была изучена возможность синтеза фермента хито-олигосахариддеацетилазы (NodB) бактерий M. loti в клетках E. coli в растворимом состоянии и его использования для получения терминально N-деацетилированных олигомеров хитозана. У почвенных бактерий ризобий хитоолигосахариддеацетилаза — растворимый цитоплазматический белок, который участвует в начальных этапах синтеза сигнальных молекул Nod-факторов, в частности деацетилирует получаемые на первом этапе синтеза олигомеры хитина ( n = 4-6) по невосстанавливающему концу (27). Возможность получения терминально N-деацетилированных олигомеров хитина in vitro с помощью фермента хитоолигосахариддеацетилазы представляет практический интерес, поскольку такие соединения очень сложно получить при химическом синтезе, но удобно использовать для ковалентного присоединения биологически активных веществ.
Для гетерологичной экспрессии гена nodB M. loti в бактериях E . coli были использованы несколько генетических конструкций, в том числе обеспечивающих возможность накопления синтезируемого белка в пе-риплазматическом пространстве. Однако в наших экспериментах при синтезе в клетках E. coli С41 с конструкцией pRSETb- nodB , а также в XL1-Blue MRF’ и SHuffle express с конструкцией pOPE101-215(Yol)- nodB первоначально не удалось получить существенного количества белка NodB в растворимом состоянии. Большая часть синтезируемого белка в клетках содержалась в нерастворимой фракции клеток. Наблюдаемый неэффективный вынос NodB в периплазматическое пространство, вероятно, был связан с конформационными особенностями этого белка.
Однако при удалении последовательности pelB из состава экспрес-сионного вектора нам удалось повысить продукцию растворимого белка в клетках SHuffle express и XL1-Blue MRF’. Количественный выход белка NodB после очистки на Ni-NTA агарозе при этом был достаточно высоким. Оценка активности очищенного растворимого белка NodB подтвердила его способность деацетилировать пента-N-ацетилхитопентаозу по невосстанавливающему концу. С помощью масс-спектрометрического анализа было показано, что для получения деацетилированной тетра-N-ацетил-хитопентаозы использовался практически весь субстрат. Сходная активность была выявлена для другого фермента ризобий NodB Rhizobium sp. GRH2, синтезированного в растворимом состоянии в клетках E. coli BL21(DE3) с помощью конструкции в векторе pET-22b(+) (17).
Итак, предложенный нами подход с использованием модифицированного вектора pOPE101mod- nodB впервые позволил осуществить синтез активной хитоолигосахариддеацетилазы Mesorhizobum loti в новом типе клеток Escherichia coli SHuffle express и XL1-Blue MRF’ с высоким количественным выходом. Для разделения и очистки получаемых деацетилированных хитоолигосахаридов разработаны методы, основанные на ионообменной хроматографии с последующим обессоливанием.
Список литературы Получение терминально n-деацетилированных олигомеров хитозана с помощью рекомбинантной хитоолигосахариддеацетилазы NodB Mesorhizobium loti, продуцируемой Escherichia coli
- Abu-Muriefah S.S. Effect of chitosan on common bean (Phaseolus vulgaris L.) plants grown under water stress conditions. Int. Res. J. Agric. Sci. Soil Sci., 2013, 3: 192-199.
- Chatelain P.G., Pintado M.E., Vasconcelos M.W. Evaluation of chitooligosaccharide application on mineral accumulation and plant growth in Phaseolus vulgaris. Plant Sci., 2014, 215-216: 134-140 ( ) DOI: 10.1016/j.plantsci.2013.11.009
- Khan W., Prithiviraj B., Smith D.L. Chitosan and chitin oligomers increase phenylalanine ammonia-lyase and tyrosine ammonia-lyase activities in soybean leaves. J. Plant Physiol., 2003, 160: 859-863 ( ) DOI: 10.1078/0176-1617-00905
- Aziz A., Trotel-Aziz P., Dhuicq L., Jeandet P., Couderchet M., Vernet G. Chitosan oligomers and copper sulfate induce grapevine defense reactions and resistance to gray mold and downy mildew. Disease Control and Pest Management, 2006, 96(11): 1188-1194 ( ) DOI: 10.1094/PHYTO-96-1188
- Gayoso G., Pomar F., Novo-Uzal E., Merino M., de Ilarduya O.M. The Ve-mediated resistance response of the tomato to Verticillium dahliae involves H2O2, peroxidase and lignins and drives PAL gene expression. Plant Biology, 2010, 10(232): 1471-2229 ( ) DOI: 10.1186/1471-2229-10-232
- Kaku H., Nishizawa Y., Ishii-Minami N., Akimoto-Tomiyama C., Dohmae N., Takio K., Minami E., Shibuya N. Plant cells recognize chitin fragments for defense signaling through a plasma membrane receptor. PNAS USA, 2006, 103: 11086-11091 ( ) DOI: 10.1073/pnas.0508882103
- Cabrera J.C., Messiaen J., Cambier P., Van Cutsem P. Size, acetylation and concentration of chitooligosaccharide elicitors determine the switch from defense involving PAL activation to cell death and water peroxide production in Arabidopsis cell suspensions. Physiologia Plantarum, 2006, 127: 44-56 ( ) DOI: 10.1111/j.1399-3054.2006.00677.x
- Conrath U., Domard A., Kauss H. Chitosan-elicited synthesis of callose and of coumarin derivatives in parsley cell suspension cultures. Plant Cell Rep., 1989, 8(3): 152-155 ( ) DOI: 10.1007/BF00716829
- Dzung N.A., Khanh V.T.P., Dzung T.T. Research on impact of chitosan oligomers on biophysical characteristics, growth, development and drought resistance of coffee. Carbohyd. Polym., 2011, 84: 751-755 ( ) DOI: 10.1016/j.carbpol.2010.07.066
- Spaink H., Sheeley D. M., van Brussel A.A.N., Glushka J., York W.S., Tak T., Geiger O., Kennedy E., Reinhold N., Lugtenberg B.J.J. A novel highly unsaturated fatty acid moiety of lipooligosaccharide signals determines host specificity of Rhizobium. Nature, 1991, 354: 125-130 ( ) DOI: 10.1038/354125a0
- Mergaert P., D'Haeze W., Geelen D., Promé D., Van Montagu M., Geremia R., Promé J.C., Holsters M. Biosynthesis of Azorhizobium caulinodans nod factors. J. Biol. Chem., 1995, 270(49): 29217-29223 ( ) DOI: 10.1074/jbc.270.49.29217
- Roche P., Maillet F., Plazanet C., Debelle F., Ferro M., Truchet G., Prome J.-C., Denarie J. The common nodABC genes of Rhizobium meliloti are host-range determinants. PNAS USA, 1996, 93: 15305-15310 ( ) DOI: 10.1073/pnas.93.26.15305
- Southwick A.M., Wang L.X., Long S.R., Lee Y.C. Activity of Sinorhizobium meliloti NodAB and NodH enzymes on thiochitooligosaccharides. J. Bacteriol., 2002, 184(14): 4039-4043 ( ) DOI: 10.1128/JB.184.14.4039-4043.2002
- John M., Rohrig H., Schmidt J., Wieneke U., Schell J. Rhizobium NodB protein involved in nodulation signal synthesis is a chitooligosaccharide deacetylase. PNAS USA, 1993, 90: 625-629 ( ) DOI: 10.1073/pnas.90.2.625
- Leppyanen I.V., Artamonova T.O., Lopatin S.A., Varlamov V.P., Tikhonovich I.A., Dolgikh E.A. Biosynthesis of hexa and pentameric chitooligosaccharides using N-acetyl-glucoseaminyl transferase from rhizobial bacteria. Russian Journal of Genetics: Applied Research, 2014, 4(5): 368-381 ( ) DOI: 10.1134/S2079059714050098
- Schmiedl A., Breitling F., Winter C., Queitsch I. Dübel S. Effect of unpaired cysteines on yield, solubility and activity in various recombinant antibody formats expressed in E. coli. J. Immunol. Methods, 2000, 242(1-2): 101-114 ( ) DOI: 10.1016/S0022-1759(00)00243-X
- Hamer S.N., Cord-Landwehr S., Biarnes X., Planas A., Waegeman H., Moerschbacher B.M., Kolkenbrock S. Enzymatic production of defined chitosan oligomers with a specific pattern of acetylation using a combination of chitin oligosaccharide deacetylases. Sci. Rep., 2015, 5: 8716 ( ) DOI: 10.1038/srep08716
- Miroux B., Walker J.E. Over-production of proteins in Escherichia coli: mutant hosts that allow synthesis of some membrane proteins and globular proteins at high levels. J. Mol. Biol., 1996, 260: 289-298 ( ) DOI: 10.1006/jmbi.1996.0399
- Bertani G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. J. Bacteriol., 1951, 62: 293-300.
- Inoue H., Nojima H., Okayama H. High efficiency transformation of Escherichia coli with plasmids. Gene, 1990, 96: 23-28 ( ) DOI: 10.1016/0378-1119(90)90336-P
- Dower W.J., Miller J.F., Ragsdale C.W. High efficiency transformation of E. coli by high voltage electroporation. Nucleic Acids Res., 1988, 16: 6127-6145.
- Birnboim H.C., Doly J. A rapid alkaline extraction procedure for screening recombinant plasmid DNA. Nucleic Acids Res., 1979, 7: 1513-1523.
- Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970, 227: 680-685.
- Lobstein J., Emrich C.A., Jeans C., Faulkner M., Riggs P., Berkmen M. SHuffle, a novel Escherichia coli protein expression strain capable of correctly folding disulfide bonded proteins in its cytoplasm. Microb. Cell Fact., 2012, 11: 753 ( ) DOI: 10.1186/1475-2859-11-56
- Caspeta L., Flores N., Pérez N.O., Bolívar F., Ramírez O.T. The effect of heating rate on Escherichia coli metabolism, physiological stress, transcriptional response, and production of temperature induced recombinant protein: a scale-down study. Biotechnol. Bioeng., 2009, 102(2): 468-482 ( ) DOI: 10.1002/bit.22084
- Lopatin S.A., Ilyin M.M., Pustobaev V.N., Bezchetnikova Zh.A., Varlamov V.P., Davankov V.A. Mass-spectrometric analysis of N-acetylchitooligosaccharides prepared through enzymatic hydrolysis of chitosan. Anal. Biochem., 1995, 227, 285-288 ( ) DOI: 10.1006/abio.1995.1282
- Schmidt J., Wingender R., John M., Wieneke U., Schell J. Rhizobium meliloti nodA and nodB genes are involved in generating compounds that stimulate mitosis of plant cells. PNAS USA, 1988, 85(22): 8578-8582.


