Получение водорастворимого комплекса молибдена(VI) с нитрилотриуксусной кислотой и моноэтаноламином. Молекулярная структура гидрата триаммоний[триоксо(нитрилотриацетато)молибдата] (NH4)3[MoO3L]·H2O. Использование его раствора для повышения урожайности клевера лугового
Автор: Семенов В.В., Петров Б.И., Лазарев Н.М., Разов Е.Н., Шарутин В.В., Кодочилова Н.А.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 3 т.16, 2024 года.
Бесплатный доступ
Варьированием соотношений гептамолибдата аммония (ГМА), нитрилотриуксусной кислоты и 2-аминоэтанола получен концентрированный раствор комплекса молибдена, устойчивый при длительном хранении и не выделяющий твердого осадка. В водном растворе 2-аминоэтанол замещает аммонийные группы в гептамолибдате аммония, давая смешанные аммоний-аминиевые производные (NH4)n(NH3CH2CH2OH)6-n[Mo7O24], которые являются причиной неустойчивости раствора и выпадения осадка. Аммонийные катионы в молекуле ГМА могут быть полностью замещены на катионы 2-аминийэтанола при проведении реакции в водной среде с шестикратным молярным избытком 2-аминоэтанола с получением гексааминного производного (NH3CH2CH2OH)6[Mo7O24]. В тройной системе гептамолибдат аммония - нитрилотриуксусная кислота - 2-аминоэтанол происходит образование хорошо растворимого гидрата триаммоний [триоксо(нитрилотриацетато)молибдата] (NH4)3[MoO3L]·H2O, кристаллическая структура которого изучена методом рентгеноструктурного анализа. На примере клевера лугового показано, что полученный раствор агрономически более эффективен в сравнении с раствором комплекса молибдена с (1-гидроксиэтилиден)дифосфоновой кислотой. По данным РСА, в кристалле 1 присутствуют катионы аммония, молекулы гидратной воды и анионы триоксо(нитрилотриацетато)молибдата, в котором атомы молибдена имеют координацию искаженной квадратной бипирамиды с двумя атомами кислорода O=Mo групп и двумя атомами кислорода карбоксилатных лигандов в экваториальных положениях (2,024(5), 1,710(4) и 2,316(5), 2,436(5) Å). Аксиальный угол O(2)Mo(1)N(2) составляет 147,6(2)°. Аксиальные положения занимают атомы кислорода и азота (расстояния O(2)=Mo(1) и N(2)=Mo(1) равны 1,762(5) и 2,185(4) Å соответственно). Данные РСА: (1) [C6H20MoN4O10, M = 404,20; моноклинная сингония, пр. гр. P21/с; параметры ячейки: a = 8,002(12) Å, b = 19,82(2) Å, c = 9,931(12) Å; β = 109,48(5)°, V = 1485(3) Å3, Z = 4; r(выч.) = 1,808 г/см3; m = 0,939 мм-1; F(000) = 824,0; обл. сбора по 2q: 5,98-56,98°; -10 ≤ h ≤ 10, -25 ≤ k ≤ 25, -10 ≤ l ≤ 10; всего отражений 30512; независимых отражений 2958 (Rint = 0,0567); GOOF = 1,118; R-фактор 0,0493].
Молибден, нитрилотриуксусная кислота, 2-аминоэтанол, водорастворимый комплекс, молекулярная структура
Короткий адрес: https://sciup.org/147244644
IDR: 147244644 | УДК: 546.776, | DOI: 10.14529/chem240307
Текст научной статьи Получение водорастворимого комплекса молибдена(VI) с нитрилотриуксусной кислотой и моноэтаноламином. Молекулярная структура гидрата триаммоний[триоксо(нитрилотриацетато)молибдата] (NH4)3[MoO3L]·H2O. Использование его раствора для повышения урожайности клевера лугового
Молибден относится к жизненно важным микроэлементам и необходим для питания растений. Из многих его производных наиболее доступным является гептамолибдат аммония (NH 4 ) 6 Mo 7 O 24 •4H 2 O (ГМА). Высокая растворимость в водной среде делает возможным его применение в сельскохозяйственных мероприятиях как в виде внекорневой подкормки (опрыскивание листьев растений) (П), так и в виде обработки семян (ОС). Известно [1], что на урожайность и качество продукции большое влияние оказывают не только метод внесения микроудобрений (П или ОС), но также форма самого соединения. В некоторых случаях использование координационных соединений оказывается более эффективным. Большое многообразие комплексов молибдена обеспечивается не столько его четырьмя возможными валентными состояниями [2], сколько большим числом известных комплексонов [3]. Однако для использования в сельском хозяйстве рациональным представляется синтез и тестирование на агрономическую эффективность только самых коммерчески доступных соединений. Среди комплексонов по дешевизне и доступности выделяется нитрилотриуксусная кислота (H3L, НТА), называемая также комплексоном-1. Существенное препятствие к применению координационных соединений в качестве микроудобрений составляет часто встречающаяся плохая или почти полная нерастворимость в водной среде, вызываемая их полимерным строением. Ранее мы предложили [4] использовать для ее увеличения так называемые промоторы растворимости. Среди них наиболее удобным и весьма эффективным оказался крупнотоннажный продукт – 2-аминоэтанол (моноэтаноламин, МЭА). Возрастание растворимости [5] обеспечивается не только высокой гидрофильностью присоединенного к молекуле комплекса промотора, но также уменьшением молекулярной массы координационного полимера. В [6] было показано, что соединение, получающееся в реакции ГМА с (1-гидроксиэтилиден)дифосфоновой кислотой (ОЭДФ), обладает высокой растворимостью и не требует использования промоторов для испытаний на агрономическую эффективность.
Известно достаточно много работ [7-13], посвященных получению различных соединений молибдена(VI) с НТА и другими комплексонами. Синтезы и кристаллизация комплексов производились как в Н2О, так и в среде органических растворителей. Сведений о их растворимости в водной среде не приводилось. Молибдат лития Li2MoO4 взаимодействует с НТА [7] и с последующим добавлением хлоридов щелочных металлов и LiOH дает гетеротриметаллические комплексы [Li{K(H2O)2}MoO3L]n, [Li{Rb(H2O)2}MoO3L]n, [Cs{Li(H2O)}2MoO3L]n. Реакция ГМА с НТА, нитрилотриацетатом кобальта и этилендиамином (enH4) привела к образованию кобальтмолибденового комплекса NH4(enH2)[Co(en)3][Mo2O7L]·H2O [8]. ГМА и НТА в присутствии избытка хлористоводородного гидразина (восстановителя) образуют [9] комплексы пяти- и четырехвалентного молибдена (NH4)4[Mo2O4L2]·7H2O и [Mo3O(OH)3(LH)3]·Cl·3H2O. В метаноле НТА взаимодействует с димолибдатом тетракис(н-бутил)аммония [(n-C4H9)4N]2[Mo2O7], давая [(n-C4H9)4N]2[Mo2O5{HO2CCH2N(CH2CO2)2}2]·H2O [10]. Серия соединений, в том числе производных НТА, была получена из оксида МоО3 [11-13]. Комплексы Na2[Mo2O5(HL)2]·8H2O, K2[Mo2O5(HL)2]·4H2O, (NH4)2[Mo2O5(HL)2]·4H2O, K3[Mo2O3L] синтезировали в водной фазе, в то время как производные жидких моно- и диэтаноламинов [MoO2(H2NCH2CH2O)2], [MoO2{HN(CH2CH2O)(CH2CH2OH)}2] получали нагреванием МоО3 с органическими аминами без растворителя [12]. Сделаны измерения констант устойчивости комплексов молибдена(VI) и вольф-рама(VI) с НТА в средах с различной ионной силой [14-19], определено влияние сольватации на комплексобразование [20, 21] молибдена(VI) с НТА в смешанных растворителях вода – метанол, вода – изопропиловый спирт, исследован фотолиз комплексов молибдена(VI) с НТА [22].
В настоящей работе сообщается о результатах изучения реакций ГМА с НТА и МЭА в водной среде. Цель выполненной работы состояла в нахождении такого соотношения исходных реагентов, которые обеспечивали получение концентрированного водного раствора, не выделяющего осадка при длительном хранении, и испытание его на агрономическую эффективность.
Экспериментальная часть
В работе использовали тетрагидрат гекса(аммоний)гептамолибдат (NH 4 ) 6 Mo 7 O 24 ·4H 2 O, нит-рилотриуксусную кислоту квалификации «ч», ЛАБХИМ (С.-Петербург), ТУ 10329-74; 2-аминоэтанол квалификации «ч» производства ООО «Синтез ОКА», г. Дзержинск, ТУ 2423-00278722668-2010.
Реакция тетрагидрата гекса(аммоний)гептамолибдата (NH 4 ) 6 Mo 7 O 24 •4H 2 O с нитрилотри-уксусной кислотой в молярном соотношении 1:2. Смешивали и растирали 94,80 г (7,67·10–2 моль) ГМА и 29,32 г (1,53·10–1 моль) НТА. Полученный белый мелкий порошок присыпали при перемешивании к 500 мл дистиллированной воды. Через 30 мин суспензия растворилась. Через 20 сут. из светло-синего раствора выпал белый осадок. Смесь размешали и фильтровали на воронке Бюхнера. Осадок высушили на воздухе, фильтрат упарили, остаток высушили при 110 °С. Осадок с фильтра 77,00 г (5,76·10–2 моль, 75 %), (NH 4 ) 5 H 2 Mo 7 O 24 ·H 2 L, ИК-спектр, см–1: 3482, 3199, 1629, 1593, 1563, 1328, 1298, 1227, 1116, 991, 932, 890, 854, 801, 786, 720, 702, 616, 524, 491. Найдено, %: С 5,67; Н 2,30; N 6,28; Mo 50,36. C 6 H 29 N 6 O 30 Mo 7 . Вычислено, %: С 5,40; Н 2,19; N 6,29; Mo 50,23. Растворимость 7,41 г в 100 мл Н 2 О. Остаток из фильтрата 34,50 г, ИК-спектр, см–1: 3485, 3196, 1630, 1590, 1561, 1329, 1299, 1230, 1118, 990, 930, 892, 853, 800, 784, 720, 701, 614, 521, 490.
Реакция тетрагидрата гекса(аммоний)гептамолибдата (NH 4 ) 6 Mo 7 O 24 ·4H 2 O с нитрилотри-уксусной кислотой и 2-аминоэтанолом в молярном соотношении 1:4,6:8,7. Смешивали и растирали 9,48 г (7,67·10–3 моль) ГМА и 6,48 г (3,58·10–2 моль) НТА. Полученную смесь присыпали при перемешивании к 50 мл дистиллированной воды. Через 30 мин суспензия растворилась. Через 2 дня из раствора выпал плотный белый осадок. Смесь размешивали и приливали 4,09 г (6,70·10–2 моль) 2-аминоэтанола в 6 мл Н 2 О. Осадок быстро растворился. Смесь фильтровали, получили 57 мл прозрачного синего раствора, из которого через 30 дней выпал плотный белый осадок. Смесь фильтровали, осадок сушили на воздухе и затем в сушильном шкафу при 110 °С. Получили 5,0 г (3,73·10–3 моль, 49 %) гептамолибдата тетракис (2-аминийэтанол)диаммония (NH4)2(NH3CH2CH2OH)4[Mo7O24] в виде светло-коричневого порошка. Найдено, %: С 7,60; Н 2,71; N 5,75; Mo 49,54. C 8 H 40 N 6 O 28 Mo 7 . Вычислено, %: С 7,17; Н 3,00; N 6,27; Mo 50,12. ИК-спектр, см–1: 3425, 3157, 3062, 1635, 1605, 1307, 1265, 1134, 1066, 1003, 917, 884, 720, 649, 503. Растворимость 2,50 г в 100 мл Н 2 О. Фильтрат упаривали, из вязкого раствора крупные бесцветные кристаллы отделяли фильтрованием через крупнопористый фильтр Шотта, промывали метанолом и затем ацетоном. Получили 2,3 г (5,69·10–3 моль, 11 %) гидрата триаммоний [триоксо(нитрилотриацетато)молибдата] (NH 4 ) 3 [MoO 3 ·L]·H 2 O. Найдено, %: С 18,27; Н 5,03; N 13,93; Mo 23,31. C 6 H 20 N 4 O 10 Mo. Вычислено, %: С 17,83; Н 4,99; N 13,86; Mo 23,73. ИК-спектр, см–1: 3387, 3205, 3044, 2106, 1855, 1677, 1617, 1590, 1408, 1385, 1295, 1221, 1101, 1000, 956, 935, 881, 833, 786, 729, 708, 610, 556, 535, 494. Масс-спектр, m/e: 79, 95, 135,
-
147, 161, 185, 213, 247, 255, 260, 285, 313, 326, 353, 368 (100 %), 395, 423, 452, 509, 523, 551. Растворимость >90 г в 100 мл Н 2 О.
Реакция тетрагидрата гекса(аммоний)гептамолибдата (NH 4 ) 6 Mo 7 O 24 •4H 2 O с 2-аминоэтанолом в молярном соотношении 1:6. К раствору 3,70 г (2,99·10–3 моль) ГМА в 50 мл Н 2 О прибавили 1,10 г (1.80·10–2 моль) 2-аминоэтанола в 5 мл Н 2 О. Смесь нагрели 7 ч при 70– 80 °С, прозрачный раствор упаривали, остаток высушивали при 110 °С. Получили 4,05 г (2,82·10–3 моль, 94 %) гекса(2-аминийэтанол)гептамолибдата (NH 3 CH 2 CH 2 OH) 6 [Mo 7 O 24 ] в виде вязкой синей массы, застывающей при охлаждении и легко размалывающейся до светлокоричневого порошка. Найдено, %: С 10,84; Н 2,92; N 6,07. C 12 H 42 N 6 O 30 Mo 7 . Вычислено, %: С 10,03; Н 2,95; N 5,85. ИК-спектр, см–1 : 3431, 3351, 3196, 3095, 2728, 1665, 1596, 1510, 1310, 1271, 1149, 1054, 1021, 961, 929, 884, 795, 759, 669, 613, 500. Растворимость 0,70 г в 100 мл Н 2 О.
Получение растворов для испытаний на агрономическую эффективность. Смешивали и растирали в ступке 156,6 г ГМА и 57,5 г НТА. Полученный белый порошок присыпали при перемешивании к 800 мл Н 2 О, колбу подогревали, через 1 ч приливали 35,97 г (35,2 мл) 2-аминоэтанола в 115 мл Н 2 О. Смесь фильтровали, получили 970 мл прозрачного раствора голубого цвета с плотностью 1,142 г·мл–1, содержание молибдена(VI) 87,7 г·л–1, 0,91 г-ат·л–1. Раствор комплекса молибдена с ОЭДФ (H 4 L′) MoO 2 L′ 2 ·NH 3 ·4H 2 O (1,7 л; 1,107 г·мл–1) получали из ГМА и ОЭДФ согласно [6]. Раствор ГМА получали растворением 162,5 г (1,31·10–1 моль) (NH 4 ) 6 Mo 7 O 24 ·4H 2 O в 1 л Н 2 О. Для стабилизации добавляли 250 мл раствора 19%-ного аммиака, плотность 1,085 г·мл–1, содержание молибдена(VI) 72,0 г·л–1, 0,75 г-ат·л–1.
В почвенных образцах были определены следующие показатели: обменная кислотность – потенциометрически (ГОСТ 26483-85) сумма поглощенных оснований по Каппену – Гильковицу (ГОСТ 27821-88); степень насыщенности почвы основаниями – расчетным методом; содержание гумуса по методу Тюрина в модификации Никитина (ГОСТ 26213-91); содержание подвижных соединений фосфора и калия – по Кирсанову в модификации ЦИНАО с последующим определением фосфора колориметрически на КФК-2, калия – на пламенном фотометре FLAРHO-4 (ГОСТ 26207–91).
При анализе растений использовали следующие методы: содержания азота, фосфора и калия определяли из одной навески после мокрого озоления (Н 2 О 2 и смесью Н 2 SO 4 с селеном) при последующем определении азота с помощью трилона Б, фосфора по методу Мерфи – Райли колориметрически на КФК-2, а калия – на пламенном фотометре FLAPHO-4. Сухое вещество в растениях клевера определяли в соответствии с ГОСТ 31640–2012; сырую золу – ГОСТ 13496.14–87; жир – ГОСТ 13496.15-85; клетчатку – ГОСТ 13496.2–84; протеин – расчётным методом в соответствии с ГОСТ РИСО 16634-1-2011; нитраты – ионометрическим экспресс-методом, расчет обменной энергии и кормовых единиц – по ГОСТ 27978–88. Корма зеленые.
Математическую обработку результатов исследований проводили методом дисперсионного анализа по Доспехову с использованием компьютерной программы Microsoft Office Excel.
ИК-спектры соединений в виде суспензии в вазелиновом масле между пластинами KBr регистрировали на ИК Фурье-спектрометре ФСМ 1201.
Элементный анализ выполнен на автоматическом элементном анализаторе Vario EL cube (Elementar Analysensysteme GmbH) в конфигурации CHNS, газ-носитель – гелий марки 6.0. Содержание С, Н, Mо определяли пиролитическим разложением с гравиметрическим окончанием.
Электронная микроскопия выполнена на сканирующем электронном микроскопе Tescan VEGA II. Микрорельеф исследовали при увеличениях от 500х до 50000х. Съемку проводили при ускоряющем напряжении 20 кВ и рабочем расстоянии 2–8 мм, использовали детекторы вторичных электронов (SE) и обратно рассеянных электронов (BSE).
Рентгеноструктурный анализ (РСА) кристаллов гидрата триаммо-ний[триоксо(нитрилотриацетато)молибдата] (NH4)3[MoO3·L]·H2O ( 1 ) проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор) при 293(2) K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC и OLEX2 [23‒25]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение
атомов водорода уточняли по модели наездника (Uизо(H) = 1,2Uэкв(C)). Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2331685 (1); ; . Основные кристаллографические данные и результаты уточнения структуры 1 приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения в структуре 1
|
Параметр |
1 |
|
Стехиометрическая формула |
C 6 H 20 MoN 4 O 10 |
|
М |
404,20 |
|
Сингония |
Моноклинная |
|
Пространственная группа |
P 2 1 /c |
|
a , Å |
8,002(12), |
|
b , Å |
19,82(2), |
|
C, Å |
9,931(12) |
|
α, град. |
90,00 |
|
β, град. |
109,48(5), |
|
γ, град. |
90,00 |
|
V , Å3 |
1485(3) |
|
Z |
4 |
|
ρ выч , г/см3 |
1,808 |
|
µ , мм–1 |
0,939 |
|
F (000) |
824,0 |
|
Размер кристалла, мм |
0,31 × 0,11 × 0,06 |
|
Диапазон сбора данных по 2 θ , град. |
5,98–56,98 |
|
Диапазон индексов |
–10 ≤ h ≤ 10, –25 ≤ k ≤ 25, –10 ≤ l ≤ 10 |
|
Число измеренных рефлексов |
30512 |
|
Чисто независимых рефлексов |
2958 |
|
R int |
0,0567 |
|
GOOF |
1,118 |
|
Метод уточнения |
Полноматричный МНК по F 2 |
|
Число параметров |
247 |
|
R -факторы по I > 2 σ ( I ) |
R 1 = 0,0493, wR 2 = 0,1474 |
|
R -факторы по всем рефлексам |
R 1 = 0,0592, wR 2 = 0,1543 |
|
Остаточная электронная плотность (max/min), e/A3 |
1,06/–1,10 |
Таблица 2
Длины связей и валентные углы в структуре 1
|
Связь |
d , Å |
Угол |
ω , град. |
|
Mo1–O1 |
2,024(5) |
O1‒Mo1‒O4 |
160,04(15) |
|
Mo1–O4 |
2,436(5) |
O1‒Mo1‒O5 |
98,25(19) |
|
Mo1–O5 |
1,316(5) |
O1‒Mo1‒N2 |
73,79(17) |
|
Mo1–O3 |
1,710(4) |
O5‒Mo1‒O4 |
66,13(16) |
|
Mo1–O2 |
1,762(5) |
O3‒Mo1‒O1 |
88,5(2) |
|
Mo1–N2 |
2,185(4) |
O3‒Mo1‒O4 |
103,6(2) |
|
O4–C1 |
1,098(7) |
O3‒Mo1‒O5 |
163,63(16) |
|
O6‒C1 |
1,373(8) |
O3‒Mo1‒O2 |
105,5(2) |
|
O5‒C4 |
1,318(8) |
O3‒Mo1‒N2 |
99,4(2) |
|
O7–C4 |
1,204(7) |
O2‒Mo1‒O1 |
126,6(2) |
|
O9‒C6 |
1,301(8) |
O2‒Mo1‒O4 |
65,9(2) |
|
O8‒C6 |
1,272(8) |
O2‒Mo1‒O5 |
82,5(2) |
|
N2–C2 |
1,617(8) |
O2‒Mo1‒N2 |
147,6(2) |
|
N2‒C3 |
1,446(7) |
N2‒Mo1‒O4 |
88,42(17) |
|
N2‒C5 |
1,715(8) |
C1‒O4‒Mo1 |
114,5(5) |
Обсуждение результатов
НТА представляет собой [3] трехосновную кислоту N(CH 2 COOH) 3 (H 3 L) с постепенно убывающей кислотностью: рК1 = 1,80; рК2 = 2,48; рК3 = 9,71. Низкий показатель кислотности третьей стадии обусловлен ее цвиттер-ионным строением и отвечает диссоциации протона, локализованного на атоме азота. Взаимодействие ГМА с НТА в молярном соотношении 1:2 привело к образованию растворимого соединения. В результате упаривания раствора и сушки при 110 °С образовалась твердая фаза, полностью растворимая в воде. Полученный раствор при хранении оказался неустойчив, и через 20 дней из него выпал белый осадок. Часть соединения осталась в растворе. Данные элементного анализа соответствовали комплексу (NH 4 ) 5 H 2 Mo 7 O 24 ·H 2 L. По данным ИК-спектроскопии, выпавший осадок и растворенное соединение имели идентичный химический состав. Соединение оказалось умеренно растворимым в водной фазе: 7,4 г в 100 мл воды.
Выпадение осадка не удалось предотвратить добавлением 2 моль МЭА к прозрачному раствору, полученному растворением порошкообразной смеси ГМА : НТА = 1:2. Однако 4 моль МЭА предотвратили образование осадка при длительном (6 мес.) хранении раствора. Раствор с молярным соотношением ГМА:НТА:МЭА = 1:2:4 использовали для испытаний на агрономическую эффективность. Ранее нами был получен комплекс молибдена с (1-гидроксиэтилиден)дифосфоновой кислотой H4L′, который оказался хорошо растворимым в водной среде и не требовал применения промотора для увеличения растворимости [6]. Испытание этих двух растворов на одной сельскохозяйственной культуре позволило сравнить их эффективность относительно гептамолибдата аммония в повышении урожайности.
Для выяснения причины выпадения осадков из трехкомпонентных растворов оказалась полезной реакция ГМА с НТА и МЭА, проведенная в молярном соотношении 1:4,6:8,7 и вызвавшая образование осадка. Выпавший осадок представлял собой гептамолибдат тетракис (2-аминийэтанол)диаммония (NH4)2(NH3CH2CH2OH)4[Mo7O24]. Из реакционной смеси он выделялся в виде пучков коротких (100–150 мкм) нитевидных кристаллов, толщиной 2–4 мкм (рис. 1).

200 мкм 20 мкм 2 «КМ
Рис. 1. СЭМ изображение нитевидных кристаллов гептамолибдата тетракис (2-аминийэтанол)диаммония (NH 4 ) 2 (NH 3 CH 2 CH 2 OH) 4 [Mo 7 O 24 ]
Из фильтрата были выделены кристаллы гидрата триаммоний [триок- со(нитрилотриацетато)молибдата] (NH4)3[MoO3L]·H2O (1) (рис. 2).
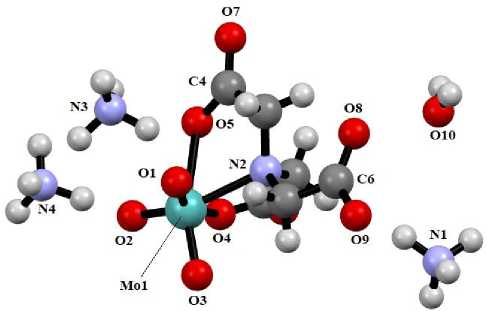
Рис. 2. Общий вид комплекса 1
По данным РСА, в кристалле 1 присутствуют катионы аммония, молекулы гидратной воды и анионы триоксо(нитрилотриацетато)молибдата, в котором атомы молибдена имеют координацию искаженной квадратной бипирамиды с двумя атомами кислорода O = Mo групп и двумя атомами кислорода карбоксилатных лигандов в экваториальных положениях (2,024(5), 1,710(4) и 2,316(5), 2,436(5) Å). Аксиальный угол O(2)Mo(1)N(2) составляет 147,6(2) ° . Аксиальные положения занимают атомы кислорода и азота (расстояния O(2) = Mo(1) и N(2) = Mo(1) равны 1,762(5) и 2,185(4) А соответственно).
Аммонийные катионы в молекуле ГМА могут быть полностью замещены на катионы 2-аминийэтанола при проведении реакции в водной среде с шестикратным молярным избытком 2-аминоэтанола. Упаривание раствора привело к удалению летучего аммиака, и в твердом остатке получалось гексааминное производное (NH 3 CH 2 CH 2 OH) 6 [Mo 7 O 24 ]. Причина неустойчивости растворов, содержащих ГМА, НТА и МЭА (выпадение осадка), заключалась в образовании плохо растворимых смешанных аммоний-аминиевых производных (NH 4 ) m (NH 3 CH 2 CH 2 OH) n [Mo 7 O 24 ]. В слабо щелочной среде при смешивании ГМА с МЭА осадок не выпадал, однако при наличии в растворе кислоты (НТА) происходило его образование. Гептамолибдат гексакис (2-аминийэтанола) (NH3CH2CH2OH)6[Mo7O24] после выделения его из раствора и сушки существенно потерял растворимость (0,75 г в 100 мл Н 2 О). Водный раствор ГМА также при хранении является неустойчивым, мутнеет и выделяет небольшое количество осадка. Для стабилизации добавляют аммиак. Определенное экспериментально соотношение ГМА:НТА:МЭА = 1:2:4 обеспечило получение стабильного при длительном хранении водного раствора и предоставило возможность использования его в агрохимических мероприятиях.
Полученные экспериментальные данные позволили предположить, что в растворе присутствовали катионы аммония NH4+, аминия [NH3CH2CH2OH]+, анионы [Mo7O24]6– и [МоО 3 L]3–. Выделение и идентификация кристаллического гидрата триаммоний [триок-со(нитрилотриацетато)молибдата] (NH4)3[MoO3·L]·H2O свидетельствовали о преобразовании шестизарядного комплексного аниона по реакции:
[Mo 7 O 24 ]6– + 7 H 3 L = 7 [MoO 3 L]3‒ + 15 H+ + 3 H 2 O.
Гидрат триаммоний [триоксо(нитрилотриацетато)молибдата] (NH 4 ) 3 [MoO 3 L]·H 2 O изострук-турен известным комплексам К 3 [MoO 3 L]·H 2 O и [Li{М(H 2 O) 2 }MoO 3 L] n (M = K, Rb, Cs) с анионом [МоО 3 L]3–, полученным из МоО 3 и НТА при добавлении КОН [11] или из Li 2 MoO 4 и НТА при добавлении KCl, RbCl, CsCl [7].
Учитывая, что использование микроэлементосодержащих препаратов является важнейшим агротехническим приемом, позволяющим улучшить биометрические параметры развития растений, в Нижегородском НИИСХ – филиале ФГБНУ ФАНЦ Северо-Востока был заложен полевой опыт для оценки влияния растворов комплексов молибдена с НТА-МЭА и ОЭДФ на показатели урожайности и питательной ценности клевера лугового. Полученные результаты отображены в таблице. Контроль (фон) предусматривал внесение в почву сложного комплексного удобрения – диаммофоски, содержащего в своем составе азот, фосфор и калий.
Таблица 1
Урожайность зеленой и сухой массы клевера лугового в зависимости от экспериментальных растворов
|
Варианты |
Высота растений, см |
Зеленая масса, т/га |
Отклонение от контроля |
Сухая масса, т/га |
Отклонение от контроля |
Масса головок клевера |
||
|
т/га |
% |
т/га |
% |
|||||
|
1. Контроль (фон) |
61,2 |
12,1 |
– |
– |
1,5 |
– |
– |
1,96 |
|
2. Фон + ГМА |
76,6 |
20,8 |
8,7 |
71,9 |
2,4 |
0,9 |
60,0 |
2,73 |
|
3. Фон + ГМА – ОЭДФ |
79,4 |
20,9 |
8,8 |
72,7 |
2,2 |
0,7 |
46,7 |
2,85 |
|
4. Фон + ГМА - НТА - МЭА |
85,2 |
21,5 |
9,4 |
77,7 |
2,5 |
1,0 |
66,6 |
2,90 |
|
НСР 05 |
1,3 |
0,1 |
||||||
Внесение молибдена в традиционной форме увеличило зеленую массу клевера на 8,7 т/га (71,9 %) относительно фона. Использование раствора комплекса ГМА с ОЭДФ практически не обеспечило преимущества, однако комплекс ГМА с НТА еще более повысил выход зеленой мас- сы: до 9,4 т/га (77,7 %). Повышение урожайности произошло прежде всего за счет увеличения высоты растений и массы головок клевера. Сухая масса растений практически не увеличилась и осталась на уровне внесения молибдена в традиционной форме.
Гептамолибдат аммония практически не увеличил содержание азота в зеленой массе клевера по отношению к контролю, в то время как комплексы ГМА с ОЭДФ и НТА привели к увеличению на 0,14 и 0,11 % соответственно. Содержание фосфора и калия незначительно уменьшилось как в случае употребления традиционной формы, так и координационных соединений молибдена.
Растворы молибдена в традиционной и хелатированной формах в целом увеличили питательную ценность надземной фитомассы клевера. Эффективность хелатных форм оказалась выше. Содержание сырой клетчатки увеличилось незначительно, сырого протеина возросло максимально с 16,06 до 16,88 %, сырого жира с 3,88 до 4,11 % относительно традиционной формы.
Сравнение двух использованных препаратов показало, что комплекс ГМА-НТА-МЭА более эффективен по сравнению с ГМА-ОЭДФ. Особенно наглядно это проявилось на показателе высоты растений. Возможная причина повышенной агрономической эффективности раствора ГМА-НТА-МЭА заключалась в благотворном действии моноэтаноламина. В работах [26-29] на примере растворов борной кислоты в органических растворителях было показано, что глицерин и мо-ноэтаноламин оказывают стимулирующее действие на урожайность и химический состав зерна озимой и яровой пшеницы, а также белой горчицы.
Выводы
Варьированием соотношений гептамолибдата аммония, нитрилотриуксусной кислоты и 2-аминоэтанола получен концентрированный раствор комплекса молибдена, устойчивый при длительном хранении и не выделяющий твердого осадка. В тройной системе гептамолибдат аммония – нитрилотриуксусная кислота – 2-аминоэтанол происходит образование хорошо растворимого гидрата триаммоний [триоксо(нитрилотриацетато)молибдата] (NH 4 ) 3 [MoO 3 L]·H 2 O, кристаллическая структура которого изучена методом рентгеноструктурного анализа. Показано, что синтезированные в работе комплексные соединения молибдена обладают повышенной агрономической эффективностью, увеличивая содержание азота в зеленой массе клевера.
Список литературы Получение водорастворимого комплекса молибдена(VI) с нитрилотриуксусной кислотой и моноэтаноламином. Молекулярная структура гидрата триаммоний[триоксо(нитрилотриацетато)молибдата] (NH4)3[MoO3L]·H2O. Использование его раствора для повышения урожайности клевера лугового
- Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия. М.: Колос, 2002. 584 с.
- Неницеску К. Общая химия. М.: Мир, 1968. С. 654.
- Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и комплексонаты металлов. М.: Химия, 1988. 544 с.
- Семенов В.В., Золотарева Н.В., Петров Б.И. Способ получения порошкообразных водорастворимых координационных соединений железа(III) и марганца(II) с оксиэтилидендифосфо-новой кислотой: Пат. 2015110362, РФ // (Б.И. 2015).
- Semenov V.V., Zolotareva N.V., Petrov B.I. et al. // Rus. J. Gen. Chem. 2015. V. 85, No 5. P. 1116. DOI: 10. 1134/S1070363215050199
- Петров Б.И., Семенов В.В., Почекутова Т.С. и др. // Коорд. химия. 2018. Т. 44, № 6. С. 354. DOI: 10.1134/S0132344X18060075
- Deb D., Duley S., Radenkovic S. et al. // Phys. Chem. Chem. Phys. 2012. V. 14, No. 44. P. 15579. DOI: 10.1039/C2CP42105D
- Leonova K.A., Klimov O.V., Kochubey D.I. et al. // Polyhedron. 2012. V. 47, No. 1. P. 65. DOI: 10.1016/j.poly.2012.08.025
- Zhou Z.H., Xu Q., Lin J. et al. // Inorg. Chem. Commun. 2007. V. 10, No. 12. P. 1461. DOI: 10.1016/j.inoche.2007.09.006
- Liu S., Ma L., McGowty D. et al. // Polyhedron. 1990. V. 3, No. 13. P. 1541. DOI: 10.1016/S0277-5387(00)86572-9
- Butcher R.J., Penfold B.R. // J. Cryst. Mol. Struct. 1976. V. 6, No. 1. P. 13. DOI: 10.1007/BF01841229
- Knobler C., Penfold B.R., Robinson W.T. et al. // J. Chem. Soc. Dalton Trans. 1980. No. 2. P. 248. DOI: 10.1039/DT9800000248
- Knobler C.B., Robinson W.T., Wilkins C.J., Wilson A.J. // Acta Cryst. 1983. C39. P. 443. DOI: 10.1107/S0108270183005053.
- Majlesi K. // Rev. Inorg. Chem. 2006. V. 26, No. 5. P. 507. DOI: 10.1515/REVIC.2006.26.5.507
- Majlesi K., Zare K. // Phys. Chem. Liquids. 2006. V. 44, No. 3. P. 257. DOI: 10.1080/00319100500509645
- Majlesi K., Zare K. // J. Mol. Liquids. 2006. V. 125, No. 1. P. 66. DOI: 10.1016/j.molliq.2005.11.018
- Majlesi K., Zare K. // Rus. J. Inorg. Chem. 2005. V. 50, No. 10. P. 1733.
- Majlesi K., Zare K., Teimouri F. // J. Chem. Engineer. Data. 2003. V. 48, No. 3. P. 680. DOI: 10.1021/je025642b
- Collin J.P., Lagrange P. // Bul. Soc. Chim. Franc. 1976. V. 9–10. Pt. 1. P. 1304.
- Gharib F., Zare K., Mohammadi B. // J. Mol. Liq. 2006. V. 124, No. 1–3. P. 63. DOI: 10.1016/j.molliq.2005.09.001
- Mohammadi B., Mohammadi J. // Chin. J. Chem. 2007. V. 25, No. 3. P. 284. DOI: 10.1002/cjoc.200790056
- Poznyak A.L., Stopolyanskaya L.V. // Rus. J. Coord. Chem. 1991. V. 17, No. 12. P. 1640.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Madison, Wisconsin, USA: Bruker AXS Inc., 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Madison, Wisconsin, USA: Bruker AXS Inc., 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726
- Кодочилова Н.А., Сюбаева А.О., Гейгер Е.Ю. и др. // Международный сельскохозяйственный журнал. 2020. № 1 (373). С. 72. DOI: 10.24411/2587-6740-2020-11017
- Кодочилова Н.А., Иваненкова А.О., Бузынина Т.С. и др. // Вестник ЮУрГУ. Серия «Химия». 2021. Т. 13, № 2. С. 49. DOI: 10.14529/chem210205
- Кодочилова Н.А., Бузынина Т.С., Семенов В.В. и др. // Агрохимический вестник. 2021. № 6. С. 78. DOI: 10.24412/1029-2551-2021-6-016
- Кодочилова Н.А., Иваненкова А.О., Бузынина Т.С. и др. // Вестник ЮУрГУ. Серия Химия. 2022. Т. 14, № 4. С. 88. DOI: 10.14529/chem220409

![Получение водорастворимого комплекса молибдена(VI) с нитрилотриуксусной кислотой и моноэтаноламином. Молекулярная структура гидрата триаммоний[триоксо(нитрилотриацетато)молибдата] (NH4)3[MoO3L]·H2O. Использование его раствора для повышения урожайности клевера лугового Получение водорастворимого комплекса молибдена(VI) с нитрилотриуксусной кислотой и моноэтаноламином. Молекулярная структура гидрата триаммоний[триоксо(нитрилотриацетато)молибдата] (NH4)3[MoO3L]·H2O. Использование его раствора для повышения урожайности клевера лугового](/file/cover/147244644/poluchenie-vodorastvorimogo-kompleksa-molibdena-vi-s-nitrilotriuksusnoj-kislotoj.png)
