Получение водорастворимых хелатных соединений железа(II) и их использование в качестве микроудобрений. Влияние промоторов растворимости на структуру урожая яровой пшеницы при некорневой подкормке
Автор: Семенов Владимир Викторович, Золотарева Наталья Вадимовна, Петров Борис Иванович, Лазарев Николай Михайлович, Сюбаева Анастасия Олеговна, Кодочилова Наталья Александровна, Гейгер Елена Юрьевна, Разов Евгений Николаевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 3 т.11, 2019 года.
Бесплатный доступ
Микрокристаллический малорастворимый гидрат (1-гидроксиэтилиден)дифосфоната железа(II) FeH2L·H2O получен взаимодействием мелкодисперсного карбонильного или восстановленного железа(0) с (1-гидроксиэтилиден)дифосфоновой кислотой H4L. При взаимодействии с органическими аминами (моноэтаноламином, трис(гидроксиметил)аминометаном, 1,8-диамино-3,6-диоксооктаном, морфолином) FeH2L·H2O переходит в водорастворимую форму, давая аморфные аминиевые производные FeH2L·H2NCH2CH2OH, FeH2L·H2NC(CH2OH)3, FeH2L·H2NCH2CH2OCH2CH2OCH2CH2NH2, FeH2L·HN(CH2CH2)2O. Растворы аминиевых соединений использовались для выяснения их влияния на структуру урожая яровой пшеницы при некорневой подкормке. Оценка эффективности некорневой подкормки хелатными соединениями железа на структуру урожая яровой пшеницы показала, что наибольшее влияние оказал морфолиниевый хелат железа FeH2L·HN(CH2CH2)2O - увеличение количества зерен в колосе до 45,1 шт. (контроль 38,8), массы зерна с растения - до 1,72 г (контроль 1,45) и массы колоса - до 2,18 г (контроль 1,90). Наиболее существенному изменению длины колоса способствовал вариант опыта с раствором моноэтаноламиниевого соединения FeH2L·H2NCH2CH2OH - увеличение на 0,57 см относительно контроля. Состав и структура гидрата (1-гидроксиэтилиден)дифосфоната железа(II) FeH2L·H2O и его аминиевых производных изучены методами ИК-спектроскопии, рентгеновского фазового анализа и сканирующей электронной микроскопии.
(1-гидроксиэтилиден)дифосфонат железа(ii), органические амины, яровая пшеница, урожайность, структура, внекорневая обработка
Короткий адрес: https://sciup.org/147233134
IDR: 147233134 | УДК: 546.722+541.49+546.185+631.81.095.337+633.11+631.816.355 | DOI: 10.14529/chem190301
Текст научной статьи Получение водорастворимых хелатных соединений железа(II) и их использование в качестве микроудобрений. Влияние промоторов растворимости на структуру урожая яровой пшеницы при некорневой подкормке
В настоящее время все большую актуальность приобретают комплексные удобрения, в состав которых входит набор жизненно необходимых микроэлементов, представленных не в традиционной солевой ионной форме, а в виде хелатного комплекса. Такие соединения являются биологически активными, способны легко транспортироваться и усваиваться растениями [1]. Высокие результаты достигаются при использовании координационных соединений – комплек-сонатов биометаллов [2–6], которые способны давать устойчивые водные растворы при различных температурных условиях окружающей среды. Они являются ценными микроудобрениями, эффективность действия которых значительно превышает действие обычных неорганических солей. Высокая растворимость комплексонатов металлов в воде представляется важным фактором для успешного использования их в сельском хозяйстве в качестве микроудобрений [7, 8].
Целью исследования являлось получение водорастворимых соединений железа(II) на основе (1-гидроксиэтилиден)дифосфоновой кислоты и оценка их влияния на элементы структуры урожая яровой пшеницы при некорневой подкормке. (1-Гидроксиэтилиден)дифосфоновая кислота (ОЭДФ) [2, 9, 10] представляет собой один из наиболее эффективных комплексонов. Этот недорогой и доступный реагент производится в Российской Федерации. С биометаллами ОЭДФ образует комплексы [11 – 17] высокой устойчивости. Она является четырехосновной кислотой, т. е. имеет четыре кислотных центра и может быть обозначена как H 4 L.
-
O CH3O
HO P C POH
HO OHOH
ОЭДФ (H4L)
Фосфорсодержащие комплексоны склонны к образованию как хорошо растворимых, так и малорастворимых комплексов металлов. Возможность использования координационных соединений в качестве составляющих микроудобрений определяется прежде всего хорошей растворимостью их в водной среде и устойчивостью крепких растворов при длительном хранении в условиях знакопеременных температур. Наиболее распространенной товарной формой комплексных и микроудобрений является водный раствор с концентрацией, близкой к насыщенной. Длительное хранение при пониженной температуре может вызывать выпадение кристаллических осадков, которые только с большим трудом переходят в водную фазу. Поэтому разработка эффективных методов получения водорастворимых соединений ОЭДФ с биометаллами представляет собой актуальную задачу. Один из способов достижения растворимости заключается в получении двойных калиевых или аммонийных солей (обработка координационного соединения KOH или NH 4 OH) [18], а также в получении аминиевых производных (обработка органическими аминами) [19 – 23]. Последние названы промоторами растворимости.
Экспериментальная часть
ИК-спектры соединений в виде суспензии в вазелиновом (область 1400 – 400 см–1) и фторированном (4000 – 1400 см–1) маслах между пластинами KBr регистрировали на ИК Фурье – спектрометре ФСМ 1201. Рентгенографические исследования выполнены на рентгеновском дифрактометре Shimadzu XRD-7000. Электронная микроскопия выполнена на сканирующем электронном микроскопе Tescan VEGA II. Микрорельеф исследовали при увеличениях от 500х до 50000х. Съемку проводили при ускоряющем напряжении 20 кВ и рабочем расстоянии 2 – 8 мм, использовали детекторы вторичных электронов (SE) и обратно рассеянных электронов (BSE). В работе использовали (1-гидроксиэтилиден)дифосфоновую кислоту H4L·H2O квалификации «ч» производства ПАО «Химпром», г. Новочебоксарск, ТУ 2439-363-05783441-2002, 2-аминоэтанол квалификации «ч» производства ООО «Синтез ОКА», г. Дзержинск, ТУ 2423-002-78722668-2010, железо карбонильное Р – 20 квалификации ОСЧ ТУ 6-09-3000-73, класс 6 – 2 производства п/я М – 5168, железо металлическое восстановленное квалификации «ч», ТУ 6-09-2227-72 производства Черкасского завода химреактивов.
Гидрат (1-гидроксиэтилиден)дифосфоната железа(II). К суспензии 4,00 г (7,2·10–2 г – ат) железа в 100 мл H2O приливали 16,04 г (7,3·10–2 моль) ОЭДФ в 100 мл воды при перемешивании и нагревании до 60 – 75 °С. Через 1,5 ч наблюдалось полное растворение железа, увеличение вязкости смеси вследствие образования большого количества белого осадка. Через 24 ч содержимое колбы размешивали механической мешалкой, фильтровали, осадок промывали дистиллированной водой, высушивали в потоке аргона и затем в вакууме при нагревании до 150 °С. Получили 12,80 г (4,61·10–2 моль, 64 %) гидрата (1-гидроксиэтилиден)дифосфоната железа(II) FeH2L·H2O ( 1 ) в виде сине-зеленой массы, легко размалывающейся до порошка. ИК-спектр, см–1:
3495 ш, 3262 ш, 2322 ш, 1640, 1300 пл, 1175 пл, 1130, 1048, 945, 820, 660, 570, 540, 457. Найдено, %: С 8,53; H 3,03; Fe 19,90; P 22,04. C 2 H 8 O 8 FeP 2 . Вычислено, %: C 8,65; H 2,90; Fe 20,10; P 22,29.
(1-Гидроксиэтилиден)дифосфонат этанол-2-аминий железо(П). К зеленой суспензии 5,22 г (2,00·10–2 моль) FeH 2 L в 100 мл дистиллированной воды при перемешивании прибавили 10 мл водного раствора 1,23 г (2,00·10–2 моль) МЭА. Смесь нагревали 1 ч при 60 – 70 °С до получения прозрачного темно-зеленого раствора, охлаждали, фильтровали, фильтрат упаривали, остаток нагревали в вакууме до 200 °С. Получили 5,07 г (1,58·10–2 моль, 79 %) (1-гидрокси-этилиден)дифосфоната этанол-2-аминий железа(II) FeH 2 L·H 2 NCH 2 CH 2 OH (FeH 2 L·МЭА) в виде темно-зеленого (почти черного) порошка. ИК спектр, см–1: 3600–2200 ш, 1620, 1519, 1271, 1093, 1003, 812, 667, 574, 476. Найдено, %: С 14,27; H 4,13; Fe 17,42; P 19,32. C 4 H 13 NO 8 FeP 2 . Вычислено, %: C 14,97; H 4,08; Fe 17,40; P 19,30.
Аналогично получали:
(1-Г идроксиэтилиден)дифосфонат трис(гидроксиметил)метанаминий железо(П) FeH 2 L·H 2 NC(CH 2 OH) 3 (FeH 2 L·ТГМА) из FeH 2 L·Н 2 О и ТГМА, выход 93 %. ИК-спектр, см–1: 3600–2300 ш, 2725 пл, 2678 пл, 1629, 1516, 1298, 1117–1060 ш, 944 пл., 818, 664, 565, 470. Найдено, %: С 19,22; H 4,03; Fe 15,04; P 16,72. C 6 H 17 NO 10 FeP 2 . Вычислено, %: C 18,91; H 4,50; Fe 14,66; P 16,26.
(1-Г идроксиэтилиден)дифосфонат 1,8-диаминий-3,6-диоксооктан железо(П) FeH 2 L·H 2 NCH 2 CH 2 OCH 2 CH 2 OCH 2 CH 2 NH 2 (FeH 2 L·ДАО) из FeH 2 L·Н 2 О и ДАО, выход 87 %. ИК-спектр, см–1: 3700–2600 ш, 1626, 1531, 1301 пл, 1355 пл, 1104, 1030, 1000, 812, 670, 586, 479. Найдено, %: С 23,87; H 5,13; Fe 13,37; P 15,08. C 6 H 17 NO 10 FeP 2 . Вычислено, %: C 23,55; H 5,43; Fe 13,69; P 15,18.
(1-Гидроксиэтилиден)дифосфонат морфолиний железо(П) FeH2L^HN(CH2CH2)2O (FeH 2 L·МФ) из FeH 2 L·Н 2 О и МФ, выход 92 %. ИК-спектр, см–1: 3600–2100 ш, 2731, 2481, 1623, 1310, 1236, 1104, 1042, 1000 пл, 953 пл, 875, 818, 667, 577. Найдено, %: С 20,90; H 4,51; Fe 16,03; P 17,83. C 6 H 15 NO s FeP 2 . Вычислено, %: C 20,77; H 4,36; Fe 16,09; P 17,85.
Получение водного раствора (1-гидроксиэтилиден)дифосфоната этанол - 2 - аминий же-леза(II). К суспензии 4,00 г (7,2·10–2 г-ат) железа в 100 мл H 2 O приливали 16,04 г (7,3·10–2 моль) ОЭДФ в 100 мл воды при перемешивании и нагревании до 60 – 75 °С. Через 24 ч образовавшийся белый осадок размешивали и добавляли 4,40 г (7,2·10–2 моль) МЭА в 50 мл воды. Смесь нагревали 1 ч при 60 – 70 °С. Получили 250 мл темно-зеленого прозрачного раствора (1-гидрокси-этилиден)дифосфоната этанол-2-аминий железа(II) с концентрацией 0,29 моль·л–1, содержание железа(II) 16,08 г· л–1.
Аналогично получали водные растворы (1-гидроксиэтилиден)дифосфоната трис(гидроксиметил)метанаминий железа(II) FeH 2 L·ТГМА, (1-гидроксиэтилиден)дифосфоната 1,8-диаминий-3,6-диоксооктан железа(II) FeH 2 L·ДАО и (1-гидроксиэтилиден)дифосфоната мор-фолиний железа(II)·FeH 2 L·МФ.
Агрохимические исследования проводились в 2017 году на базе Нижегородского НИИСХ – филиала ФГБНУ ФАНЦ Северо-Востока в рамках полевого опыта на светло-серой лесной среднесуглинистой почве на лессовидном суглинке. Почва слабокислая, с высокой степенью обеспеченности подвижным фосфором и средней – подвижным калием, с низким содержанием гумуса. Опыт заложен по схеме, представленной в табл. 1, 2 (общий размер делянки – 50 м2, повторность опыта трехкратная). Опытная культура – яровая пшеница сорта Эстер. В качестве общего фона вносили полное минеральное удобрение из расчета N 60 P 60 K 60 .
Обсуждение результатов
Комплекс железа(II) синтезировали [21] реакцией суспензии металлического железа с ОЭДФ в водной среде при эквимолярном соотношении реагентов.
Feo + H 4 L = FeH 2 L + H 2
Интенсивное перемешивание смеси при 70 – 90 °С через 1,0 – 1,5 ч приводило к выпадению обильного белого осадка труднорастворимого (1-гидроксиэтилиден)дифосфоната железа(II)
FeH2L·Н2О. Растворимость оказалась невысокой и составила только 0,14 г в 100 мл раствора. Проверка с помощью цветных реакций на катионы Fe2+ [гексацианоферрат калия] и Fe3+ [роданид аммония] показала, что длительное (до 90 дней) хранение сухого препарата при доступе воздуха не приводило к окислению. Рентгенодифракционный эксперимент показал, что FeH 2 L·Н 2 О существует в кристаллической форме. Из водного раствора кристаллы выпадали в виде плотно сро-щенных длинных нитей (рис. 1).

200 цт 2 цт
а) б)
Рис. 1. Электронно-микроскопическое изображение нитевидных кристаллов (1-гидроксиэтилиден)дифосфоната железа(II): а – участки с параллельным и беспорядочным расположением, б – плотное сращивание тонких нитей
Проведение реакции при соотношении Fe(0) : H 4 L = 1 : 2 вызвало полное растворению железа через 1 ч. Охлажденный до 25 °С раствор не претерпевал изменений, однако дальнейшее нагревание вызвало выпадение обильного творожистого осадка FeH2L. Фильтрованием и упариванием фильтрата доказано образование ОЭДФ. Таким образом, попытка увеличения растворимости посредством использования избытка кислоты не привела к успеху, происходящая реакция может быть представлена уравнениями:
Feo + 2 H 4 L = Fe(H 3 L) 2 + H 2
Fe(H 3 L) 2 = FeH 2 L + H 4 L.
Переведение (1-гидроксиэтилиден)дифосфоната железа(II) в раствор было произведено обработкой водорастворимыми органическими аминами: моноэтаноламином (МЭА), трис(гидроксиметил)аминометаном (ТГМА), 1,8-диамино-3,6-диоксооктаном (ДАО) и морфолином (МФ).
HO
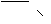
H 2 N
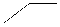
OH
OH
H 2 N

OH
C

МЭА
ТГМА
H 2 N O

NH 2
ДАО
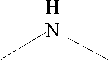
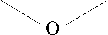
МФ
Схема 1. Водорастворимые органические амины – промоторы растворимости комплекса железа(II)
Аминиевые комплексы FeH 2 L·H 2 NCH 2 CH 2 OH, FeH 2 L·H 2 NC(CH 2 OH) 3 , FeH 2 L·H 2 NCH 2 CH 2 OCH 2 CH 2 OCH 2 CH 2 NH 2 представляют собой темно-зеленые (доходящие до черных) порошки, легко и быстро растворяющиеся в воде. Растворы устойчивы и не выделяют осадков при длительном хранении. Исходное соединение FeH2L·Н2О после сушки при 110 °С существует в кристаллической форме, в то время как выделенные аминные производные аморфи-зованы (рис. 2).
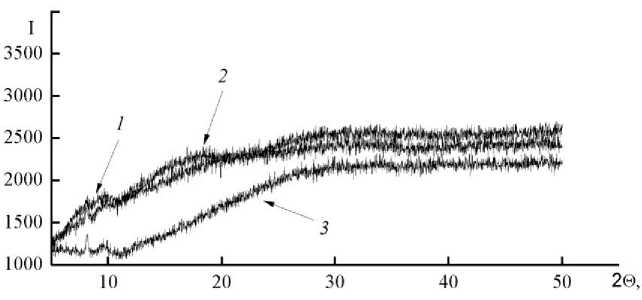
Рис. 2. Дифрактограммы аминиевых производных (1-гидроксиэтилиден)дифосфоната железа(II): 1 – FeH 2 L·H 2 NCH 2 CH 2 OH, 2 – FeH 2 L·H 2 NC(CH 2 OH) 3 , 3 – FeH 2 L·H 2 NCH 2 CH 2 OCH 2 CH 2 OCH 2 CH 2 NH 2
При сушке они ведут себя как истинно аморфные соединения. Высыхая, толстый (1–2 см) слой раствора утоньшается, концентрация растворенного соединения возрастает, вязкость увеличивается. На последнем этапе получается толстая набухшая еще эластичная пленка, края которой закручиваются вверх. Это происходит из-за сильно различающихся скоростей удаления растворителя из верхнего и нижнего (прилегающего ко дну сосуда) слоев пленки. Верхний быстро высыхающий слой сжимается, в то время как нижний еще остается набухшим и более объемистым. В результате получаются хрупкие, закрученные в спирали, легко разрушающиеся при механическом воздействии прозрачные пленки. Разломы происходят без каких-либо преимущественных направлений, как в любом стекловидном теле. Текстура поверхности стекла гладкая, не структурирована, имеет фрактально расположенные трещины. На рис. 3 показано электронномикроскопическое изображение высохшего образца координационного соединения FeH 2 L·H 2 NCH 2 CH 2 OH.

200 цт
Рис. 3. Электронно-микроскопическое изображение высохшего образца аморфного координационного соединения FeH 2 L·H 2 NCH 2 CH 2 OH
Присоединение органического амина к молекуле координационного соединения в принципе может происходить к металлоцентру или к находящейся на периферии кислотной группировке -Р(О)ОН. Второй вариант -Р(О)О-+NH 3 CH 2 - является наиболее предпочтительным из-за наличия свободных группировок -Р(О)ОН и координационной насыщенности металла.
O CH3
O Fe2+ O P C P OH + 2 H2NCH2CH2OH ►
HO OHOH
OCH
_2+ 3
O Fe2+ O P C P O H 3 NCH 2 CH 2 OH
HOCH 2 CH 2 NH 2 HO OH OH
Схема 2. Присоединение амина к комплексу железа
Для агрономических исследований готовили растворы, не выделяя аминиевые производные в сухом виде. К образовавшейся суспензии (1-гидроксиэтилиден)дифосфоната железа(II) прибавляли водный раствор органического амина и перемешивали смесь при нагревании до полного растворения твердой фазы. Полученный раствор после разбавления использовали для некорневой подкормки растений.
В опыте изучали действие хелатных соединений железа(II) с 1-гидроксиэтилиден-дифосфоновой кислотой и различными количествами промоторов растворимости. Некорневую подкормку растений проводили в фазу выход в трубку – начало колошения. Количество растворов хелатов определяли с учетом средних доз микроудобрений для полевых культур: в частности для железа – 100 г/га в расчете на действующее вещество. Для учета структуры урожая растения отбирались в фазу полной спелости зерна с 1 м2, полученные результаты подвергнуты математической обработке методом дисперсионного анализа с использованием программного обеспечения Microsoft Excel (табл. 1, 2).
Оценка структуры урожая яровой пшеницы при проведении некорневой подкормки растений хелатами железа с различными промоторами растворимости показала наличие наибольшего количества зерен в колосе в 8-м варианте опыта (хелат железа Fe(H 2 L)·МФ+3МФ) – 45,1 шт. (в 1,2 раза выше в сравнении с контролем). Достоверные прибавки по количеству зерен в колосе наблюдаются и при обработке растений хелатами железа на 2-м (Fe(H 2 L)·МЭА+МЭА) и 6-м (Fe(H2L)·МФ) вариантах опыта – 3,2 и 3,4 шт. В остальных случаях разница в анализируемом показателе между опытными и контрольным вариантами несущественна.
Таблица 1
Влияние некорневой подкормки хелатными соединениями железа на структуру урожая яровой пшеницы (зерно)
|
№ п/п |
Вариант опыта |
Количество зерен в колосе |
Масса зерна с растения |
Масса 1000 зерен |
|||
|
шт. |
+/ – к контролю |
г |
+/ – к контролю |
г |
+/ – к контролю |
||
|
1 |
Контроль |
38,8 |
– |
1,45 |
- |
37,8 |
– |
|
2 |
Fe(H 2 L)·МЭА+МЭА |
42,2 |
+3,4 |
1,61 |
+0,16 |
38,2 |
+0,4 |
|
3 |
Fe(H 2 L)·МЭА+2МЭА |
38,2 |
– 0,6 |
1,40 |
– 0,05 |
36,2 |
– 1,6 |
|
4 |
Fe(H 2 L)·ТГМА |
39,3 |
+0,5 |
1,40 |
– 0,05 |
35,5 |
– 2,3 |
|
5 |
Fe(H 2 L)·ТГМА+ТГМА |
39,8 |
+1,0 |
1,51 |
+0,06 |
37,2 |
– 0,6 |
|
6 |
Fe(H 2 L)·МФ |
42,0 |
+3,2 |
1,55 |
+0,10 |
36,7 |
– 1,1 |
|
7 |
Fe(H 2 L)·МФ+2МФ |
37,3 |
– 1,5 |
1,40 |
– 0,05 |
36,8 |
– 1,0 |
|
8 |
Fe(H 2 L)·МФ+3МФ |
45,1 |
+6,3 |
1,72 |
+0,27 |
38,0 |
+0,2 |
|
9 |
Fe(H 2 L)·ДАО |
40,7 |
+1,9 |
1,56 |
+0,11 |
37,9 |
+0,1 |
|
НСР 05 |
2,5 |
0,11 |
1,00 |
||||
Использование хелатов железа для некорневой обработки посевов яровой пшеницы привело к достоверному увеличению массы зерна на 2, 8 и 9-м вариантах опыта – до 1,56 – 1,72 г с растения. Максимальная прибавка (0,27 г) отмечается при использовании хелата железа Fe(H2L)·МФ+3МФ (8-й вариант). По остальным вариантам опыта изменения лежат в пределах ошибки.
Стоит подчеркнуть, что использование хелатов железа либо не повлияло на массу 1000 зерен яровой пшеницы (2, 5, 8, 9-й варианты), либо привело к ее существенному снижению (на 3, 4, 6, 7-м вариантах). При этом использование хелата железа Fe(H 2 L)·ТГМА (4-й вариант) наиболее существенно снизило величину данного показателя (на 2,3 г относительно контроля).
Таблица 2 Влияние некорневой подкормки хелатными соединениями железа на структуру урожая яровой пшеницы (колос, солома)
|
№ п/п |
Вариант опыта |
Длина колоса |
Масса колоса |
Масса соломы |
|||
|
см |
+/– к контролю |
г/раст. |
+/– к контролю |
г/раст. |
+/– к контролю |
||
|
1 |
Контроль |
10,76 |
– |
1,90 |
– |
1,43 |
– |
|
2 |
Fe(H 2 L)·МЭА+МЭА |
10,30 |
–0,46 |
1,80 |
–0,10 |
1,28 |
–0,15 |
|
3 |
Fe(H 2 L)·МЭА+2МЭА |
11,33 |
+0,57 |
1,79 |
–0,11 |
1,18 |
–0,25 |
|
4 |
Fe(H 2 L)·ТГМА |
10,93 |
+0,17 |
2,04 |
+0,14 |
1,31 |
–0,12 |
|
5 |
Fe(H 2 L)·ТГМА+ТГМА |
11,08 |
+0,32 |
1,91 |
+0,01 |
1,46 |
+0,03 |
|
6 |
Fe(H 2 L)·МФ |
11,06 |
+0,30 |
2,00 |
+0,10 |
1,36 |
–0,07 |
|
7 |
Fe(H 2 L)·МФ+2МФ |
10,43 |
–0,33 |
1,94 |
+0,04 |
1,45 |
+0,02 |
|
8 |
Fe(H 2 L)·МФ+3МФ |
10,65 |
–0,11 |
2,18 |
+0,28 |
1,47 |
+0,04 |
|
9 |
Fe(H 2 L)·ДАО |
10,39 |
–0,37 |
1,79 |
–0,11 |
1,26 |
–0,17 |
|
НСР 05 |
0,27 |
0,13 |
0,06 |
||||
Достоверные прибавки по длине колоса яровой пшеницы относительно контроля наблюдаются в 3, 5 и 6-м вариантах опыта. Значения показателя колеблются на уровне 11,06 – 11,33 см. Наиболее длинный колос имеют растения пшеницы на фоне использования хелата железа Fe(H2L)·МЭА+2МЭА. В остальных случаях изменения либо не выходят за пределы ошибки (4-й и 8-й варианты), либо достоверно ниже (2, 7 и 9-й варианты) в сравнении с контролем.
Оценка изменения массы колоса яровой пшеницы показала, что достоверные прибавки получены в 4-м и 8-м вариантах опыта (0,14 и 0,28 г в расчете на одно растение соответственно). Максимальная величина анализируемого показателя (2,18 г) отмечается в варианте с некорневой обработкой растений хелатом железа Fe(H 2 L)·МФ+3МФ. По остальным вариантам опыта изменения массы колоса несущественны.
Анализируя изменение массы соломы яровой пшеницы, видим, что некорневая обработка культуры хелатными формами железа привела в большинстве случаев к достоверному снижению показателя на 0,07 – 0,25 г на растение. При этом в варианте № 3 (хелат железа Fe(H2L)·МЭА+2МЭА) значение изучаемого показателя минимально и составляет 1,18 г. В остальных случаях (5, 7, 8-й варианты опыта) отмечаются прибавки по массе соломы, лежащие в пределах ошибки опыта.
Работа выполнена в рамках госзадания (Тема № 45.8 «Химия функциональных материалов», рег. № 0094 – 2016 – 0012), поддержана Российской академией наук, Программа №35 Президиума РАН «Научные основы создания новых функциональных материалов». При выполнении работы использовались приборы Аналитического центра Института металлоорганической химии РАН.
Список литературы Получение водорастворимых хелатных соединений железа(II) и их использование в качестве микроудобрений. Влияние промоторов растворимости на структуру урожая яровой пшеницы при некорневой подкормке
- Анспок, П.И. Микроудобрения / П.И. Анспок. - Л.: Агропромиздат, 1990. - 272 с.
- Дятлова, Н.М. Комплексоны и комплексонаты металлов / Н.М. Дятлова, В.Я. Темкина, К.И. Попов. - М.: Химия, 1988. - 544 с.
- Дятлова, Н.М. Теоретические основы действия комплексонов и их применение в народном хозяйстве и медицине / Н.М. Дятлова // Журнал ВХО им. Д.И. Менделеева. - 1984. - Т. 29, № 3. - С. 7-20.
- Жаворонков, Н.М. Комплексоны в решении задач Продовольственной программы СССР / Н.М. Жаворонков // Журнал ВХО им. Д.И. Менделеева. - 1984. - Т. 29, № 3. - С. 21-25.
- Кабата-Пендиас, А. Проблемы современной биохимии микроэлементов / А. Кабата-Пендиас // Рос. хим. журнал. - 2005. - Т. 49, № 3. - С. 15-19.
- Карпова, Е.А. Роль удобрений в циклах микроэлементов в агроэкосистемах / Е.А. Карпова // Рос. хим. журнал. - 2005. - Т. 49, № 3. - С. 20-25.
- Дериглазова, Г.М. Значение некорневой обработки отдельными микроэлементами и комплексными микроудобрениями посевов зерновых культур / Г.М. Дериглазова, О.А. Митрохина, Н.Н. Боева // Агрономия. - 2011. - № 5. - С. 45-47.
- Титова, Е.М. Применение водорастворимых комплексных удобрений на посевах яровой пшеницы / Е.М. Титова, М.А. Внукова // Вестник ОрелГАУ. - 2011. - № 3. - С. 50-51.
- Фосфорорганические комплексоны. М.И. Кабачник, Т.Я. Медведь, Н.М. Дятлова и др. // Успехи химии. - 1968. - Т. 37, № 7. - С. 1161-1191.
- Золотухина, М.М. Производные дифосфоновых кислот: синтез и биологическая активность / М.М. Золотухина, В.И. Крутиков, А.Н. Лаврентьев // Успехи химии. - 1993. - Т. 62, № 7. - С. 691-703.
- О комплексобразующих свойствах оксиэтилидендифосфоновой кислоты в водных растворах / М.И. Кабачник, Р.П. Ластовский, Т.Я. Медведь и др. // Доклады АН СССР. - 1967. - Т. 177, № 3. - С. 582-585.
- Исследование медь аммонийного комплекса оксиэтилидендифосфоновой кислоты. Б.И. Бихман, А.Ю. Киреева, Е.М. Уринович и др. // Журнал неорг. химии. - 1978. - Т. 23, № 6. - С. 1589-1592.
- Васильев, В.П. Комплексобразование Fe3 c оксиэтилидендифосфоновой кислотой / В.П. Васильев, Е.В. Козловский, В.В. Сердюков // Журнал неорг. химии. - 1990. - Т. 35, № 2. - С. 373-376.
- Сравнительная оценка эффективности действия водных растворов ЭДТА и ОЭДФ при растворении магнетита / И.Г. Горичев, И.В. Артамонова, Э.Е. Нифантьев и др. // Журнал неорг. химии. - 2009. - Т. 54, № 5. - С. 869-880.
- Кропачева, Т.Н. Комплексобразование железа(III) с оксиэтилидендифосфоновой кислотой / Т.Н. Кропачева, А.Н. Пагин, И.И. Корнев // Вестник Удмуртского университета. - 2012. - № 4. - С. 63-68.
- Девятов, Ф.В. Образование гомо- и гетероядерных комплексов 1-гидроксиэтилидендифосфоновой кислоты с Mn(II) и Fe(III) в водных растворах / Ф.В. Девятов, О.В. Богатырев, К.А. Игнатьева // Известия АН. Серия химическая. - 2018. - № 8. - С. 1369-1375.
- Синтез и структура разнометально-разнолигандных комплексов германия(IV) и кобальта(II) или меди(II) с 1-гидроксиэтилидендифосфоновой кислотой и 1,10-фенантролином / К.Э. Марцинко, И.И. Сейфуллина, Е.А. Чабаненко и др. // Коорд. химия. - 2018. - Т. 44, № 3. - С. 189-195.
- Золотарева, Н.В. Водорастворимые двойные калиевые и аммониевые соли железа(III) и марганца(II) с оксиэтилидендифосфоновой кислотой / Н.В. Золотарева, В.В. Семенов // Журнал общей химии. - 2014. - Т. 84, № 4. - С. 637-641.
- Аморфные водорастворимые комплексы биометаллов на основе оксиэтилидендифосфоновой кислоты, моноэтаноламина и трис(гидроксиметил)аминометана. Синтез и оценка агрономической эффективности в качестве новых микроудобрений / В.В. Семенов, Н.В. Золотарева, Б.И. Петров и др. // Журнал общей химии. - 2015. - Т. 85, № 5. - С. 822-830.
- Водорастворимые комплексы кобальта с 1-гидроксиэтилидендифосфоновой кислотой и 2-аминоэтанолом / В.В. Семенов, Н.В. Золотарева, Н.М. Лазарев и др. // Журнал общей химии. - 2017. - Т. 87, № 1. - С. 97-103.
- Получение водорастворимых соединений железа(II) на основе железа(0), (1-гидроксиэтилиден)дифосфоновой кислоты и органических аминов / В.В. Семенов, Н.В. Золотарева, Б.И. Петров и др. // Журнал общей химии. - 2018. - Т. 88, № 3. - С. 482-486.
- Термически инициированное диспропорционирование тетрагидрата бис(1-гидроксиэтилиден)дифосфоната марганца(II). Образование и свойства лепидоидной структуры из нитевидных кристаллов (1-гидроксиэтилиден)дифосфоната-2-гидроксиэтанаминий марганца(II). Агрономическая эффективность комплекса марганца(II) с (1-гидроксиэтилиден)дифосфоновой кислотой / В.В. Семенов, Н.В. Золотарева, Б.И. Петров и др. // Известия АН. Серия химическая. - 2018. - № 2. - С. 336-344.
- Диспропорционирование (1-гидроксиэтилиден)дифосфоната марганца(II) в реакции с 2-аминоэтанолом / В.В. Семенов, Н.В. Золотарева, Б.И. Петров и др. // Доклады АН. - 2017. - Т. 475, № 6. - С. 646-651.


