Потенциодинамическое исследование коррозионно-электрохимического поведения сплава AMГ0.2, легированного скандием, иттрием и лантаном в среде электролита NaCl
Автор: Норова Муаттар Турдиевна, Ганиев Изатулло Наврузович, Эшов Бахтир Бадалович, Нарзиев Бахтир Шамсиевич
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Машиностроение и машиноведение
Статья в выпуске: 1-1 т.20, 2018 года.
Бесплатный доступ
В работе потенциостатическим методом в потенциодинамическом режиме при скорости развертки потенциала 2мВ/с исследовано коррозионно-электрохимическое поведение сплавов системы АМг0.2- Sc, (Y, La) в среде электролита NaCl. Показано, что легирование скандием, иттрием и лантаном уменьшает скорость коррозии исходного сплава в 1.5-2 раза в зависимости от концентрации электролита. Снижение скорости коррозии связано с процессом пассивации сплавов.
Сплав aмг0.2, скандий, иттрий, лантан, потенциал свободной коррозии, потенциал коррозии, потенциал питтингообразования, скорость коррозии, электролит nacl
Короткий адрес: https://sciup.org/148205413
IDR: 148205413 | УДК: 669.715:620.193
Текст научной статьи Потенциодинамическое исследование коррозионно-электрохимического поведения сплава AMГ0.2, легированного скандием, иттрием и лантаном в среде электролита NaCl
Редкоземельные металлы (РЗМ) вносят определённый вклад в изменение структуры и свойств алюминиевых сплавов. Поскольку растворимость РЗМ в алюминии предельно мала, то в сплавы редко добавляют >0,5% (по массе), но уже и эти малые добавки могут существенно повысить свойства алюминиевых сплавов. Наиболее исследованной легирующей добавкой для алюминиевых сплавов является скандий [1,2]. При введении скандия измельчается литая структура – он лишь немногим уступает по своему модифицирующему действию титану, который традиционно используют в качестве модификатора при литье. Скандий образует с алюминием фазу Аl3Sc размером 10-30нм, которая вносит вклад в упрочнение. Это упрочнение может достигать 30-50% от уровня предела текучести основного материала, что особенно характерно для термически неупрочняемых сплавов системы Al-Mg. Все алюминиевые сплавы последнего поколения содержат в своем составе скандий, что обеспечивает повышение их свойств, при этом скандий не ухудшает коррозионные свойства и свариваемость материалов. Скандий и другие РЗМ эффективно позволяет
уменьшить средний размер зерна, а в сплавах некоторых систем полностью сохранить не-рекристаллизованную структуру. С этой точки зрения наиболее эффективно вводить скандий совместно с цирконием. В связи с этим представляло интерес исследования коррозионного поведения сплава АМг0.2, легированного скандием, иттрием и лантаном.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение алюминиевых сплавов, содержащих редкоземельные металлы, связано с трудностями синтеза из-за высокой химической активности вводимых в алюминий компонентов, когда температуры плавления многих двойных и тройных сплавов значительно превышают температуры плавления чистых компонентов. Эти обстоятельства вызывают необходимость применения вакуумных печей, использование инертной атмосферы (гелий или аргон), приготовление обогащенной алюминием лигатуры[3].
Для получения сплавов были использованы: алюминий марки А995 (ГОСТ 110669-74), магний – металлический гранулированный марки ХЧ (ТУ-112-40), промышленная лигатура на основе алюминия, содержащая по 2.5 мас.% скандия, иттрия – (ИтМ-1(ТУ48-4-208-72)), лантана – (Ла-ЭО(ОСТ48-295-85)). Лигатуры алюминия были получены в вакуумной печи сопротивления типа СНВЭ-1.3.1/16 ИЗ в атмосфере гелия под избыточным давлением 0.5 мПа. Шихтовка сплавов проводилась с учётом угара металлов. Взвешивание шихты производили на аналитических весах АРВ- 200 с точностью 1,0 . 10-5 кг. Легирование сплавов лигатурой осуществляли в открытых шахтных печах типа СШОЛ.
Общие потери редкоземельных металлов в 2%-ных лигатурах с алюминием составляли не более 1% от их исходного веса, а потери в лигатурах с большим содержанием РЗМ (5-10%-ные) не превышали 3%. В последующем при подготовке к сплавлению исходных лигатур вводился соответствующий избыток.
Из полученного расплава для исследования коррозионно-электрохимических свойств отливались цилиндрические образцы диаметром 8-10 мм и длиной 100-140 мм, боковая часть которых изолировалась так, что рабочей площадью служил торец электрода. Каждый образец предварительно отшлифовывали, обезжиривали спиртом и погружали в исследуемый раствор NaCl марки ЧДА (ГОСТ 4233-77) для установления бестокового потенциала коррозии.
Состав сплавов исследован методом атомноэмиссионного спектрального анализа на установке дифракционного спектрографа ДФС-452 с многоканальной оптической регистрирующий системе МОРС-9. При этом в качестве источника возбуждения использована электрическая дуга. В качестве примера на рисунке 1 приведены аналитические линии для магния и скандия, которые показывают соответствие заданных и полученных составов сплавов.
Коррозионно-электрохимические исследования проводили на потенциостате ПИ-50-1.1 и самописца ЛКД-4-002 в среде электролита NaCl марки ЧДА (ГОСТ 4233-77) при скорости развертки потенциала 2мВ/с по методике, описанные в работах [4-9]. Электродом сравнения служил хлор-серебряный, а вспомогательным-платиновый.
При электрохимических испытаниях по-тенциодинамическим методом образцы по- ляризовали в положительном направлении от потенциала, установившегося при погружении в исследуемый раствор (-Есв.корр. – потенциал свободной коррозии или стационарный), до резкого возрастания тока в результате питтин-гообразования. Затем поляризовали в обратном направлении до потенциала–1800 мВ, в результате происходило подщелачивание приэлек-тродного слоя поверхности сплава, после чего образцы поляризовали вновь в положительном направлении. На полученных таким образом по-тенциодинамических кривых определяли основные электрохимические характеристики сплавов: потенциал коррозии Екор и ток коррозии iкор, потенциалы питтингообразования Епо и репассивации Ереп. Величину Ереп определяли графически как потенциал, при котором наблюдается первый перегиб на обратном ходе анодной кривой. Расчет тока коррозии как основной электрохимической характеристики процесса коррозии проводили по катодной кривой с учетом тафе-левской константы, равной вк =0.12 В, поскольку в нейтральных средах процесс питтинговой коррозии алюминия и его сплавов контролируется катодной реакцией ионизации кислорода. Скорость коррозии определяли по формуле
К=iкор. к, где к=0.335 г.А-1.ч-1 для алюминия, iкор – ток коррозии.
Обобщённые результаты исследование сплавов систем AMг0.2-Sc,(Y,La) представлены в табл. 1-5 и на рис. 2-3.
Исследования временной зависимости потенциала свободной коррозии исходного сплава АМг0.2, и сплавов, легированных различным количеством скандия в среде 3 и 0,3%-ного раствора NaCl приведены в табл.1-2.
Рис. 1. Аналитические линии магния (а) и скандия (б) в сплаве АМг0.2
Из таблиц видно, что как для исходного сплава, так и для всех легированных сплавов независимо от состава электролита и времени характерно резкое смещение потенциала свободной коррозии в положительную область значений в начальном этапе.
При этом если у нелегированного сплава стабилизация потенциала свободной коррозии наблюдается в течение 50 минут, то у легированных сплавов это происходит в течение 30-40 минут, что свидетельствует об относительно высокой их пассивации под воздействием добавок скандия. Наибольший сдвиг потенциала наблюдается у сплава, содержащего 0.05мас.% скандия.
Потенциал свободной коррозия сплавов исследовался также в зависимости от концентрации электролита. С уменьшением концентрации хлорид-иона в 10 раз потенциал свободной коррозии растёт, что свидетельствует о снижении коррозионной активности среды.
Закономерность изменения потенциала свободной коррозии сплава АМг0.2, легированного иттрием в среде 3%-ного раствора NaCl аналогична показателям предыдущего сплава. Отличие заключается в том, что здесь наблюдается ещё больший сдвиг в область положительных потенциалов (табл.3), а также тем, что наибольший сдвиг относится к сплаву, содержащему 0.5 мас.% иттрия. Такую тенденцию можно наблюдать у данных сплавов и в среде 0.3%-ного раствора NaCl.
Из данных табл. 3 можно проследить следующую закономерность: в целом потенциал коррозии смещается в положительную область, од- нако в интервале исследованных составов имеет место иной характер, т.е. сплав, легированный скандием, иттрием и лантаном 0.05мас.% имеет минимальное значение скорости коррозии. Дальнейшее повышение концентрации РЗМ приведет к росту потенциала коррозии. Потенциалы питтингообразования и репассивации при легировании РЗМ сильно не изменяются. Все это сопровождается соответствующим изменением плотности тока и скорости коррозии.
Приведенные в табл. 3 результаты коррозионно-электрохимических испытаний указывают на то, что с увеличением концентрации хлорид-иона потенциал коррозии смещается в отрицательную область, что свидетельствует о снижении коррозионностойкости сплавов с ростом агрессивности коррозионной среды.
Учитывая питтинговый механизм коррозии алюминиево-магниевых сплавов, особое внимание было уделено определению потенциала питтингообразования сплавов с учётом влияния легирующих элементов, а также концентрации электролита. Возникновение питтинга связано с нарушением пассивного состояния на отдельных участках поверхности металлов и сплавов в результате воздействия анионов-активаторов. На этих участках происходит ускоренное разрушение оксидных плёнок, что вызывает местное активирование. Последнее может быть связано также с адсорбционным вытеснением кислорода анионами-активаторами на участках, на которых прочность связи кислорода с металлом меньше, чем с анионами.
Таблица 1. Временная зависимость потенциала (х.с.э) свободной коррозии(-Есв.кор, В) сплава АМг0.2, от содержания скандия в среде электролита 3%-ного NaCl
|
Время выдержки, мин |
Содержание скандия, мас.% |
||||
|
исх. сплав |
0,01 |
0,05 |
0,10 |
0,50 |
|
|
0.00 |
1.180 |
1.150 |
1.022 |
0.980 |
0.978 |
|
1/8 |
1.152 |
1.122 |
1.011 |
0.964 |
0.960 |
|
1/4 |
1.134 |
1.092 |
0.990 |
0.941 |
0.952 |
|
1/2 |
1.112 |
1.082 |
0.962 |
0.920 |
0.936 |
|
1 |
1.093 |
1.035 |
0.946 |
0.905 |
0.912 |
|
2 |
1.082 |
1.026 |
0.933 |
0.890 |
0.890 |
|
3 |
1.064 |
0.985 |
0.824 |
0.872 |
0.880 |
|
4 |
1.042 |
0.963 |
0.815 |
0.864 |
0.874 |
|
5 |
1.024 |
0.944 |
0.799 |
0.820 |
0.832 |
|
10 |
1.002 |
0.900 |
0.780 |
0.768 |
0.800 |
|
15 |
0.994 |
0.850 |
0.748 |
0.749 |
0.784 |
|
20 |
0.974 |
0.841 |
0.736 |
0.738 |
0.777 |
|
30 |
0.952 |
0.786 |
0.725 |
0.725 |
0.765 |
|
40 |
0.940 |
0.745 |
0.712 |
0.715 |
0.745 |
|
50 |
0.942 |
0.754 |
0.712 |
0.714 |
0.732 |
|
60 |
0.942 |
0.745 |
0.712 |
0.714 |
0.732 |
Таблица 2. Изменение потенциала свободной коррозии сплава АМг0.2, легированного скандием, от времени в среде электролита 0,3%-ного NaCl
|
Время выдержки, мин |
Содержание скандия, мас.% |
||||
|
исх. сплав |
0,01 |
0,05 |
0,10 |
0,50 |
|
|
0.00 |
1.150 |
0.999 |
0.945 |
1.082 |
1.092 |
|
1/8 |
1.112 |
0.943 |
0.921 |
1.075 |
1.065 |
|
1/4 |
1.092 |
0.888 |
0.899 |
1.045 |
1.065 |
|
1/2 |
1.076 |
0.800 |
0.846 |
1.012 |
1.022 |
|
1 |
1.052 |
0.722 |
0.812 |
0.982 |
0.999 |
|
2 |
1.041 |
0.700 |
0.800 |
0.900 |
0.962 |
|
3 |
1.033 |
0.682 |
0.780 |
0.841 |
0.942 |
|
4 |
1.026 |
0.664 |
0.765 |
0.810 |
0.932 |
|
5 |
1.003 |
0.653 |
0.740 |
0.780 |
0.860 |
|
10 |
0.985 |
0.645 |
0.712 |
0.732 |
0.822 |
|
15 |
0.982 |
0.642 |
0.710 |
0.732 |
0.820 |
|
20 |
0.953 |
0.635 |
0.680 |
0.728 |
0.780 |
|
30 |
0.934 |
0.632 |
0.660 |
0.680 |
0.720 |
|
40 |
0.903 |
0.623 |
0.652 |
0.672 |
0.700 |
|
50 |
0.894 |
0.628 |
0.610 |
0.668 |
0.690 |
|
60 |
0.885 |
0.622 |
0.610 |
0.668 |
0.680 |
Таблица 3. Коррозионно-электрохимические характеристики сплавов систем
AMг0.2, легированного скандием, иттрием и лантаном, в среде электролита NaCl
|
Cti п и |
РЗМ |
Содержание РЗМ, мас.% |
Электрохимические потенциалы (х.с.э.), В |
Скорость коррозии |
||||
|
Е св.кор |
Е кор |
-Е п.о. |
-Е рп |
i кор ., А/м2 |
К - 10 " 3 г/м2 - час |
|||
|
и rd o' |
Sc |
Исх.сплав |
0.880 |
1.140 |
0.680 |
0.750 |
0.014 |
4.69 |
|
0,01 |
0.622 |
1.072 |
0.672 |
0.744 |
0.012 |
4.02 |
||
|
0,05 |
0.610 |
1.040 |
0.660 |
0.735 |
0.008 |
2.68 |
||
|
0,10 |
0.660 |
1.000 |
0.650 |
0.730 |
0.010 |
3.35 |
||
|
0,50 |
0.680 |
0.942 |
0.642 |
0.730 |
0.011 |
3.68 |
||
|
Y |
0,01 |
0.710 |
1.004 |
0.630 |
0.742 |
0.011 |
3.68 |
|
|
0,05 |
0.705 |
0.976 |
0.610 |
0.720 |
0.0078 |
2.60 |
||
|
0,10 |
0.700 |
1.000 |
0.600 |
0.720 |
0.015 |
5.03 |
||
|
0,50 |
0.644 |
1.074 |
0.600 |
0.715 |
0.018 |
6.03 |
||
|
La |
0,01 |
0.710 |
1.090 |
0.700 |
0.750 |
0.013 |
4.36 |
|
|
0,05 |
0.707 |
1.015 |
0.680 |
0.715 |
0.010 |
3.35 |
||
|
0,10 |
0.728 |
0.986 |
0.660 |
0.700 |
0.017 |
5.69 |
||
|
0,50 |
0.730 |
0.950 |
0.660 |
0.700 |
0.022 |
7.37 |
||
|
и се Z а? to |
Sc |
Исх.сплав |
0.940 |
1.210 |
0.725 |
0.800 |
0.016 |
5.36 |
|
0,01 |
0.745 |
1.120 |
0.710 |
0.780 |
0.015 |
5.03 |
||
|
0,05 |
0.712 |
1.084 |
0.610 |
0.760 |
0.011 |
3.68 |
||
|
0,10 |
0.714 |
1.068 |
0.620 |
0.760 |
0.0147 |
4.91 |
||
|
0,50 |
0.732 |
1.022 |
0.660 |
0.750 |
0.0173 |
5.79 |
||
|
Y |
0,01 |
0.715 |
1.080 |
0.645 |
0.750 |
0.014 |
4.69 |
|
|
0,05 |
0.712 |
1.000 |
0.615 |
0.745 |
0.011 |
3.68 |
||
|
0,10 |
0.702 |
1.050 |
0.610 |
0.740 |
0.022 |
7.37 |
||
|
0,50 |
0.690 |
1.100 |
0.610 |
0.736 |
0.027 |
9.04 |
||
|
La |
0,01 |
0.622 |
1.200 |
0.540 |
0.700 |
0.012 |
4.02 |
|
|
0,05 |
0.612 |
1.070 |
0.520 |
0.680 |
0.0076 |
2.53 |
||
|
0,10 |
0.618 |
1.000 |
0.510 |
0.630 |
0.015 |
5.25 |
||
|
0,50 |
0.618 |
0.985 |
0.510 |
0.610 |
0.020 |
6.70 |
||
Нарушение пассивного состояния на отдельных участках приводит к увеличению скорости коррозии и возникновению питтинга. Часто центром точечной коррозии является граница металл-неметаллического включения. В этих местах из-за низких защитных свойств пассивных пленок облегчается адсорбция анионов-ак-тиваторов.
При анодной поляризации возрастает адсорбция анионов-активаторов, и при достижении некоторого потенциала, который называется потенциалом питтингообразования (Еп.о), происходит местное нарушение пассивности -пробой пленки, и наступает точечная коррозия. Величина потенциала питтингообразования является показателем склонности металлов к точечной коррозии: чем меньше (отрицательнее)
потенциал питтингообразования, тем выше склонность сплава к точечной коррозии.
Что касается сплава AMг0.2, легированного РЗМ, то результаты, приведённые в табл. 4, и на рис. 2 показывают, что с увеличением концентрации РЗМ до 0.05 мас% питтингоустойчивость сплавов увеличивается. В этом плане более перспективными являются сплавы, легированные скандием и иттрием.
На рис. 2 представлены анодные ветви по-тенциодинамических кривых сплава
AMг0.2, содержащего различное количество скандия в среде электролита 0.3%-ного NaCl. Представлен повторный ход анодной поляризационной кривой (после катодной поляризации поверхности образца), что позволяет исключить влияние оксидной плёнки. Из рисунка видно, что
Таблица 4. Изменение потенциала (х.с.э.) питтингообразования (-ЕП.О.,В) сплава AMг0.2, легированного редкоземельными металлами, в среде 3%-ного NaCl
|
Легирующий элемент |
Содержание РЗМ, мас.% |
||||
|
исх. сплав |
0.01 |
0.05 |
0.10 |
0.50 |
|
|
Sc |
0.725 |
0.710 |
0.610 |
0.620 |
0.660 |
|
Y |
0.725 |
0.645 |
0.615 |
0.610 |
0.610 |
|
La |
0.725 |
0.700 |
0.680 |
0.660 |
0.660 |
Таблица 5. Влияние РЗМ на скорость коррозии сплава AMг0.2 в среде 0,3%-ного NaCl
|
Легирующий элемент |
Содержание РЗМ, мас.% |
||||
|
Исх. сплав |
0.01 |
0.05 |
0.10 |
0.50 |
|
|
Sc |
4,69 |
4,02 |
2,68 |
3,35 |
3,68 |
|
Y |
4,69 |
3,68 |
2.60 |
5,03 |
6,03 |
|
La |
4,69 |
4,02 |
2,53 |
5,25 |
6,70 |
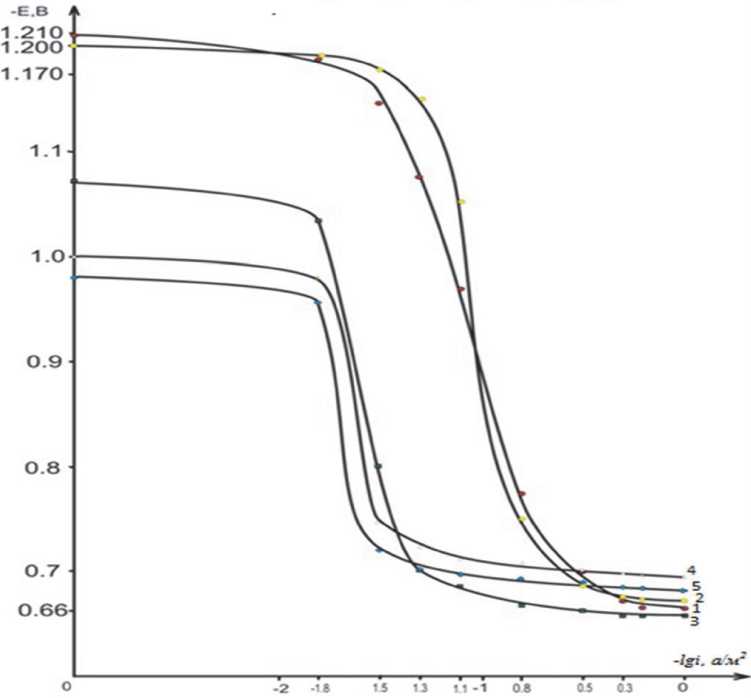
Рис. 2. Потенциодинамические (2мВ/с) анодные поляризационные кривые сплава AMг0.2 (1), содержащего скандий, мас.%: 0.01(2), 0.05(3), 0.1(4), 0.5(5)
в среде электролита 0,3%-ного NaCl. E- потенциал (B), i-плотность тока, (А/м2)
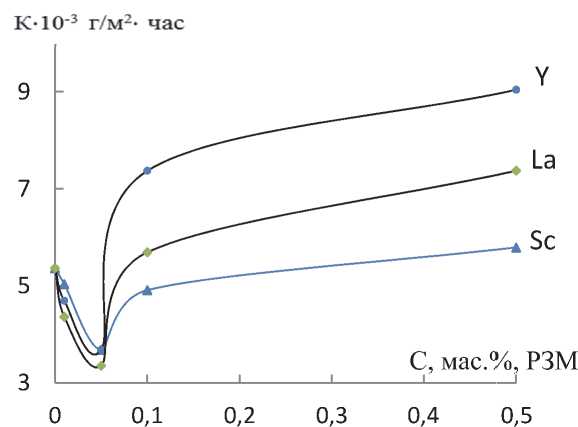
Рис. 3. Зависимость скорости коррозии сплава AMг0.2 от содержании мас.%: Sc (1), Y (2), La (3) в среде электролита 3%-ного NaCl
присутствие скандия несколько изменяет ход анодной кривой в сторону меньших значений токов и в положительную область значений потенциалов, при этом потенциал питтингообразо-вания так же повышается с увеличением концентрации легирующего компонента до 0.5%.
Результаты исследования скорости коррозии сплава AMг0.2, легированного РЗМ, от концентрации последнего в среде 3% и 03%-ного NaCl представлены на рис. 3.и в табл.5. Рассчитанная из катодных ветвей потенциодинамиче-ских кривых скорость коррозии показывает, что добавки РЗМ до 0.05 мас.% уменьшают скорость коррозии исходного сплава в 1.5-2 раза. Приведенные данные показывают, что с увеличением концентрации РЗМ до 0.05 мас.% наблюдается плавное снижение скорости коррозии, а дальнейшее повышение концентрации легирующего компонента несколько увеличивает скорость коррозии. Как видно из рис.3 РЗМ по характеру влияния на скорость коррозии сплава AMг0.2 располагаются следующим образом: Sc, La, Y.
Как видно, добавки скандия до 0.05 мас.% во всех исследованных средах повышают коррозионную стойкость сплавов, дальнейшее увеличение концентрации легирующего компонента до 0.5 мас.% несколько увеличивает скорость коррозии сплавов, но по абсолютной величине меньше (3.68 г/м2.час в среде 0.3% NaCl), чем для исходного сплава (4.69 г/м2.час).
Повышение коррозионной стойкости сплавов, содержащих до 0.05 мас.% РЗМ объясняется, на наш взгляд, их растворимостью в сплаве и образованием защитной плёнки на поверхности образцов, отличающихся отсутствием дефектов и устойчивостью к хлорид-иону.
Список литературы Потенциодинамическое исследование коррозионно-электрохимического поведения сплава AMГ0.2, легированного скандием, иттрием и лантаном в среде электролита NaCl
- Напалков В.И., Махов С.В. Легирование и модифицирование алюминия и магния. М.: МИСИС, 2002, 374 с.
- Фридляндер И.Н. Алюминиевые деформируемые конструкционные сплавы. М.: Металлургия, 1979.208с.
- Шарло Г. Методы аналитической химии. Количественный анализ неорганических соединений. Ч.П.-М.: Химия, 1969. С.952-955
- Норова М.Т., Ганиев И.Н., Назаров Х.М.//ЖПХ,2002, Т.75,вып.4,с.567-569.
- Раджабалиев С.С., Ганиев И.Н., Амонов И.Т., Норова М.Т.//Известия СПбГТИ(ТУ). 2016. № 35(61). С. 22-26.
- Махсудова М.С., Норова М.Т., Нарзиев Б.Ш. Коррозия алюминиево-магниевых сплавов, легированных щелочноземельными и редкоземельными металлами. Германия, LAP LAMBERT Academic Publishing. 2012,168 с.
- Махсудова М.С., Норова М.Т., Ганиев И.Н.//Доклады АН РТ. Душанбе. 2007. Т.50. № 6. С.621-626.
- Вазиров Н.Ш., Норова М.Т., Ганиев И.Н., Махсудова М.С.//Известия АН РТ. Отд.ф-з.-мат.,хим., геол. и тех. наук. 2013. № 3(152). С.91-98.


