Потенциометрические измерения трансмембранного потенциала клеток с использованием проникающих ионов
Автор: Варехов Алексей Григорьевич
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение для биофизики и биохимиии
Статья в выпуске: 1 т.25, 2015 года.
Бесплатный доступ
В статье обсуждаются методические ограничения, возникающие при потенциометрических измерениях трансмембранного потенциала клеток с использованием проникающих (липофильных) ионов. Произведен анализ экспериментальных результатов измерений трансмембранного потенциала бактериальных клеток B.subtilis при действии грамицидина А, полученных с использованием ТФФ +-селективного мембранного электрода. Анализ основан на предположении о почти обратимой адсорбции индикаторных катионов на клеточной поверхности. Показано, что результатом таких измерений является не трансмембранный, а значительно больший по величине дипольный потенциал мембраны. Предлагается способ оценки изменений мембранного потенциала с использованием для расчета необратимо связанной части проникающих ионов, иммобилизованных в мембранных каналах при действии грамицидина. Вычислены поверхностная плотность адсорбированного заряда, концентрация мест связывания индикаторных катионов и параметры двойного электрического слоя.
Потенциометрические измерения, грамицидин, тфф +-селективный электрод, дипольный потенциал, трансмембранный потенциал
Короткий адрес: https://sciup.org/14264962
IDR: 14264962 | УДК: 576.3.08
Текст научной статьи Потенциометрические измерения трансмембранного потенциала клеток с использованием проникающих ионов
Косвенные методы измерения трансмембранного потенциала с использованием проникающих (липофильных) ионов стали активно использоваться при исследовании энергетического сопряжения на митохондриальных мембранах [1]. При использовании таких ионов, в частности катионов тетрафенилфосфония ТФФ+ (TPP+), несущих делокализованный положительный заряд, были получены многочисленные важные научные результаты. В самое последнее время исследована [2] специфическая функция ТФФ+ как ингибитора выхода ионов Ca2 + из митохондрий клеток сердечной мышцы, что способствует энергоснабжению.
Эти измерения стали актуальными и для бактериальных клеток как с точки зрения исследования мембранной энергетики, так и для оценки жизнеспособности клеточных популяций. Исследования с использованием проникающих ионов способствовали также развитию детальных представлений о строении периферической области клеток и органелл. Эта область представляет собой, как правило, морфологически сложную слоистую концентрическую структуру с непрерывным электрическим потенциальным профилем, включая локальные скачки потенциала на границах отдельных слоев. Электрический потенциальный профиль в целом отражает как пассивные (абиогенные) свойства клеточной периферии, так и процессы, связанные с энергетическим метаболизмом.
Косвенные методы измерения основаны на использовании химических агентов, действие которых сводится к энергизации или деэнергизации клеток и органелл. Это прежде всего активация или ингибирование сопряженных процессов дыхания (переноса электронов) и фосфорилирования или разобщение обоих этих процессов. Такими агентами являются некоторые липофильные фенолы (например, 2,4-динитрофенол, разобщающее действие которого известно очень давно), а также некоторые антибиотики, стимулирующие или подавляющие дыхание и фосфорилирование.
В этой работе использовался шунтирующий мембрану для катионов H+, K+, Na+ и (селективно) ТФФ+ ионофорный антибиотик (порообразующий токсин) грамицидин, угнетающий энергизацию клеток (фосфорилирование), не подавляя или умеренно подавляя (при накоплении в клетке K+) при этом дыхание. Спиральный пептид грамицидин А, продуцируемый бактерией Bacillus brevis, состоит из 15 аминокислот и встраивается в мембранный бислой таким образом, что две его спирали, соприкасающиеся своими концами, образуют сквозной трансмембранный ионный канал. При этом диаметр (просвет) канала равен 4 Å, а длина, равная 2 × 30 = 60 Å, должна (для максимальной проницаемости) близко соответствовать толщине мембраны. Селективность (проницаемость) такого канала, определяемая радиусом витков спирали, для однозарядных ионов представлена рядом H+ > > NH4+ > Cs+ > Rb+ > K+ > Na+ > Li+, т. е. наиболее выражена для протонов [3]. При этом ионный радиус протона H+ (0.38 Å) примерно в 4 раза меньше ионного радиуса ближайшего к протону по проницаемости катиона аммония NH4+ (1.46 Å) и примерно в 10 раз меньше ионного радиуса катиона ТФФ+ (около 4 Å) . Таким образом, можно предполагать однорядовый механизм диффузионного продвижения катионов ТФФ+ вдоль мембранного канала, образованного грамицидином.
ПОСТАНОВКА ЗАДАЧИ
Проблема измерения мембранного потенциала косвенными методами (главным образом потенциометрическим и флуоресцентным) связана с тем, что распределение связанных с клеткой зондирующих (индикаторных) ионов в направлении от поверхности клетки внутрь, как правило, неизвестно. Первоначально при использовании ТФФ+ предполагалось [4–7], что весь измеренный потенциометрически, т. е. с использованием ТФФ+-селективного электрода, связанный клетками пул катионов благодаря липофильности оказывается в цитоплазматическом матриксе. Однако предположение о том, что липофильность сама по себе может обеспечить пассивную диффузию зондирующих ионов в клетку, физически не обоснована. Оставались непонятными все физические процессы, происходящие на поверхности и в периферическом слое, граничащем с мембраной. Использование формулы Нернста позволяло сразу вычислить разность потенциалов, однако было недостаточным для того, чтобы считать ее трансмембранной. Усложнения формулы Нернста [4, 5] позволяли уточнить результат, однако это требовало многих дополнительных данных, например точного знания объема внутриклеточной воды [4].
В вычислениях мембранного потенциала светочувствительных клеток Rhodopseudomonas sphe-roides пул поглощенного ТФФ+ разделялся на свободную и связанную части с разными концентрациями [8]. В расчетное соотношение для мембранного потенциала, полученное с использованием закона действующих масс, входили такие параметры, как доля инкубационного объема, занятого клетками, а также и обе концентрации. В другой статье той же группы исследователей [9] на том же биологическом материале утверждалось, что 47 % мест связывания ТФФ+ находится на внутренней стороне цитоплазматической мембраны, а 53 % — на внешней стороне. Таким образом, предполагалось, что весь связанный материал находился на мембране, но не в цитоплазме. Отметим, что с принципиальной точки зрения уравнение Нернста отражает только постоянство электрохимического потенциала при наличии в электролите концентрационного градиента ионов определенного вида или разности потенциалов между двумя водными отсеками, разделенными проницаемой для этих ионов перегородкой, но ничего не говорит о характере связывания. Кроме того, если одна из концентраций неограниченно убывает, равновесная разность электрических потенциалов неограниченно возрастает.
Несколько позже более частым способом измерения мембранного потенциала стало применение флуоресцентных техник, например, с использованием положительно заряженных карбоцианинов (дипропилтиодикарбоцианин DiSC 3 (5) и другие) [10]. Однако и в этом случае увеличение или уменьшение уровня флуоресценции отражает только свойства микроокружения (полярность и вязкость) хромофора красителя в области связывания и соответственно квантовый выход флуоресценции, но не связаны с локализацией мест связывания красителя и механизмами связывания.
МЕТОДИКА И РЕЗУЛЬТАТЫ
В этой работе использовался достаточно стабильный потенциометрический мембранный электрод, селективный по отношению к катионам ТФФ+, разработанный на кафедре биохимии и биофизики Вильнюсского университета [11].
Электрод представляет собой структурную матрицу на основе материала стекловолокнистых фильтров марки Whatman GF/F, пропитанную раствором ионообменного комплекса тетрафенил-фосфоний—тетрафенилборат (ТФФ+-ТФБ–) в тетрагидрофуране. Эта плоская структура с обеих сторон покрывалась слоем поливинилхлорида, для чего последний также растворялся в тетрагидрофуране с небольшой добавкой диоктилфталата. Электрод выполнялся в виде стеклянной трубочки, запаянной с одного конца упомянутой выше стекловолокнистой матрицей, и заполнялся изнутри 10–2 М раствором ТФФ в воде. Для электрического контакта служил стандартный хлорсеребряный электрод сравнения, сочленяемый после его предварительной разборки с трубочкой измерительного электрода. Другим электрическим контактом служил еще один хлорсеребряный электрод сравнения, помещаемый в инкубационную среду. Измерительная цепь замыкалась через электролитический ключ. Селективность электрода по отношению к ближайшему аналогу ТФФ+ трифе-нилметилфосфонию (ТФМФ+) составляла 3·10–2.
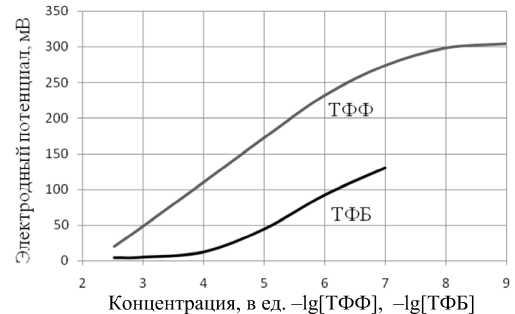
Рис. 1. Зависимость электродного потенциала от концентрации ТФФ и ТФБ в инкубационной среде.
Концентрация во внутреннем объеме электрода 10–2 М
Клетки B.subtilis
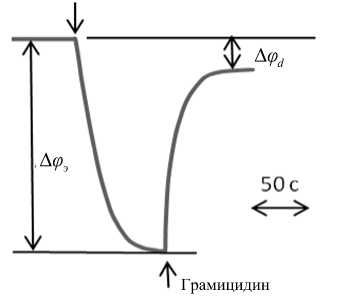
Рис. 2. Изменение электродного потенциала при связывании (сорбции) индикаторных катионов ТФФ+ клетками B.subtilis и потере (десорбции) при действии грамицидина.
Концентрация ТФФ+ в инкубационной среде (физиологический раствор) — 10–5 М; концентрация клеток (по сухому весу) — 0.56 мг·мл–1; концентрация грамицидина — 5.85 мкМ
По отношению ко всем остальным компонентам включая NaCl, Трис-HCl, MgSO 4 , глюкозу, АТФ и многие другие — не более 3·10–5 [4].
На рис. 1 представлены концентрационные характеристики электрода по отношению к ТФФ+ и ТФБ-, откуда следует, что метрологические свойства катион-селективного электрода с точки зрения диапазона измерений и линейности существенно лучше, чем анион-селективного. Из рис. 1 также следует, что в диапазоне концентраций от 10–6 М до значения 10–3 М или несколько большего значения ТФФ+-селективный электрод является нернстовским с угловым коэффициентом прямой, равным 59.1 мВ на декаду. Изменения электродного потенциала в диапазоне значений pH7.0 ± 0.5 составляли не более 2 мВ.
Рис. 2 показывает характер потенциометрического эксперимента, необходимого для расчетов трансмембранного потенциала. Добавление в инкубационную среду (физиологический раствор) интактных клеток B.subtilis приводит к связыванию (сорбции) индикаторных катионов. Изменение потенциала измерительного электрода после добавления клеток составляло Афэ = 1мВ . Последующее добавление грамицидина в концентрации 4–6 мкМ соответствует десорбции связанных катионов. Оба процесса сорбции и десорбции почти обратимы с точностью до небольшого по величине потенциала Афа , обозначаемого [4] как доннанов-ский и связанного с невозможностью выхода во внешнюю среду части сорбированных катионов, иммобилизованных в углеводородном ядре мем- браны и на ее внутренней стороне. Добавление грамицидина инициирует процесс образования мембранных каналов (пор), который ведет к де-энергизации мембраны и к инактивации клеток. Порообразование порождает, во-первых, конкурентное (по отношению к катионам ТФФ+) связывание протонов в поверхностном слое и соответственно выход во внешнюю среду индикаторных катионов, а, во-вторых, относительно медленное частичное поглощение их мембраной.
Процедура расчета трансмембранного потенциала сводилась [4] к следующим действиям. Добавление интактных клеток Bacillus subtilis позволяло измерить электродный потенциал А фэ и далее определить концентрацию Cэout индикаторных катионов после окончания (около 100 c) процесса связывания их с клетками в среде с исходной концентрацией Cэin на основании формулы Нернста:
RT Cin
А ф = ln —— э nF Cэout где RT/nF = kT/e = 25.7мВ (T = 298K).
Для расчета использовалась та часть изменения концентрации ТФФ+ в суспензии клеток Bacillus subtilis, которая связана с действием на клетки грамицидина. Эта часть, соответствующая изменению электродного потенциала, равного Афэ - Афd , в конкретном случае составляла 2.49 нМ в расчете на 1 мл суспензии. Первона- чально предполагалось, как уже было отмечено ранее, что действие грамицидина приводит к проникновению катионов ТФФ+ в цитоплазму клеток. Далее вычислялся общий объем цитоплазматического матрикса в расчете на 1 мл суспензии при известной концентрации клеток. Таким образом определялись величина сухого веса клеток (0.56 мг в расчете на 1 мл суспензии) и соответствующий объем внутриклеточной воды (2 мкл на 1 мл суспензии). Это давало значение эквивалентной концентрации ТФФ+ в клетке, равное в данном случае С™ = 2.49/(0.56 • 2) = 2.22мМ. Трансмембранный потенциал определялся из соотношения in
А Ф К = - К ln - к г, (1) м φ out
Cкл в котором kφ = kT / e = 25.7мВ ; Cкoлut = 5.85мкМ — концентрация ТФФ+ в инкубационной среде. Вычисления дают значение АфМ =-152.6мВ. Знак (минус) соответствует цитоплазматическому матриксу. Это значение находится в согласии с большой совокупностью экспериментальных данных измерений трансмембранного потенциала для сопрягающих мембран различной природы.
Существуют некоторые противоречия относительно корректности такой процедуры расчета. Поскольку детали распределения связанных катионов неизвестны, достоверным, по-видимому, можно считать только утверждение, что особенности связывания и количество связанных клетками катионов каким-то образом зависят от трансмембранной разности потенциалов и, следовательно, от уровня энергетического метаболизма. Таким образом, вычисленное значение А ф М определяет не трансмембранный потенциал, а суммарную разность потенциалов между цитоплазмой и водным окружением клетки, т. е. алгебраическую сумму всех компонентов трансмембранного потенциального профиля.
Рассмотрим далее потенциометрический ответ электрода, исходя из предположения об адсорбции ТФФ+ на клеточной поверхности. Косвенно об этом свидетельствует почти обратимый (с точностью до доннановского потенциала цитоплазмы) характер ответов при последовательном добавлении клеток и грамицидина, показанный на рис. 2. Обсуждаемый ниже подход основан на следующих положениях.
-
1. Физиологически активная часть бактериальной клетки с дыхательным типом энергетики, т. е. плазматическая мембрана, несущая трансмембранную разность потенциалов, поляризует периферическую область клетки, граничащую с ее водным окружением. Эта поляризация определяет
-
2. Индикаторные катионы ТФФ+, несущие делокализованный электрический заряд, благодаря чему ослабляется кулоновское взаимодействие катиона с полимерной решеткой периферии, образуют на поверхности плотный двойной электрический слой вместе с анионными группами клеточной периферии, но не проникают в цитоплазматический матрикс.
-
3. Грамицидин образует в плазматической мембране каналы; присутствие сорбированных катионов ТФФ+ делает внешнюю поверхность плазматической мембраны липофильной, что, как известно [3], необходимо для образования трансмембранных каналов.
-
4. Образование мембранных каналов, проницаемых для протонов, приводит к шунтированию трансмембранной разности потенциалов и частичной или полной деполяризации поверхности клетки.
-
5. Деполяризация поверхности приводит, во-первых, к деструкции двойного электрического слоя и выходу сорбированных катионов во внешний водный объем, а, во-вторых, к однорядовому диффузионному продвижению части этих катионов в каналах (порах) к внутренней поверхности мембраны.
-
6. Накопление в порах положительного пространственного заряда устанавливает равновесное распределение катионов по длине поры, т. е. равенство химического и электрического потенциалов этих катионов.
совместно с пассивными (абиогенными) свойствами периферии величину отрицательных поверхностного и электрокинетического потенциалов.
Пусть концентрация проникающих ионов С (r) убывает при удалении от наружной границы сферической клетки радиуса r = a внутрь. При этом удовлетворяется условие сохранения числа частиц (ионов), записываемое в форме a -8 4 ч
J С ( r ) 4 nr 2d r = C™ 3 п ( a - 8 ) 3, (2)
a где δ — толщина клеточной периферии; Cкinл — значение концентрации из (1). Выполнение условия сохранения в данном контексте сводится к тому, что все поглощенные ионы размещаются в объеме клеточной периферии (клеточная стенка плюс мембрана для бактериальных клеток). Пусть теперь для простоты концентрация выражается экспоненциальной формой
C ( r) = CmexP [—a ( a — r)] , где α — параметр, показывающий скорость убывания концентрации, Cm — граничная концентрация при r = a . Таким образом, вся перифериче- ская область клетки предполагается однородной средой, не имеющей внутренних границ раздела. Это предположение оказывается тем более верным, чем меньше толщина адсорбированного слоя. После интегрирования в левой части (2) при условиях a - § = а и exp(-a§)^1 получаем уравнение
C m
^ a 2 2 a 2
--+ —T + —T 2 3
^ a a a
= C a- = - Cina3, m кл ,
α 3
или
Cm in Cкл
1 αa .
Определим далее ход электрического потен-
циала в поверхностном слое клетки, соответствующий принятой экспоненциальной концентрационной зависимости. Рассмотрим элементарный участок d r , расположенный внутри периферического слоя толщины δ . Из уравнения (1) при условии r < a элементарное приращение потенциала выражается следующим образом:
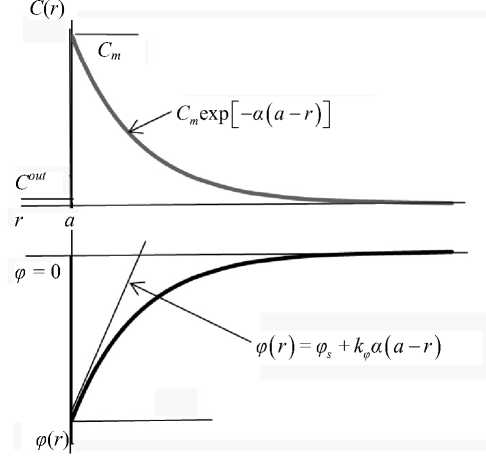
Рис. 3. Зависимость концентрации индикаторных катионов ТФФ+ и генерируемого ими потенциала при удалении внутрь от внешней границы клетки
d φ = kφ ln
C ( r ) - d C C ( r )
d C
— — к ---- фс (r )
- kv
d C ( r ) / d r
C (r)
d r
(здесь d C> 0).
Это же соотношение следует непосредственно из определения химического потенциала:
RT d ф=nF d Pn C (r)]=кф
5 C ( r ) / 5 r C ( r )
d r
(здесь d C< 0).
При экспоненциальном законе убывания концентрации интегрирование выражения (4)
Ф ( r ) r
J d ф= - к ф J φ s a
aC m exp [- a ( a - r ) ] C m exP [- a ( a - r ) ]
d r
приводит к линейной зависимости вида
Ф ( r ) = Ф s +k ф a ( a - r ) .
Концентрационная зависимость C ( r ) и ход потенциала ф ( r ) в периферическом слое клетки, а также и линейная зависимость (5) иллюстрируются рис. 3.
Из этой зависимости, в частности, следует, что в общем случае потенциал может неограниченно
возрастать, что не соответствует физическому смыслу. Такое неограниченное возрастание потенциала имеет место в силу ограничения, содержащегося в исходном уравнении (1), т. е. неограниченного возрастания потенциала в случае, если одна из концентраций ( Cкinл ) неограниченно убывает. Это обстоятельство уже отмечалось выше. Поскольку одновременно удовлетворяется уравнение Пуассона
V 2 ф = — р ( r ) = - ^eC ( r ) ( e = 1.6^10 |9Кл), (6) ε 0 ε 0
которое дает при экспоненциально убывающей концентрации экспоненциально убывающий потенциал, мы будем считать, что асимптотическое поведение потенциала определяется именно уравнением (6). Интегрирование (6) в сферических координатах при условиях
V2Ф = |4 и C (r) = CmexP [-a (a - r)] dr приводит к соотношению
ф ( r ) = ---2 C m exP [- a ( a - r ) ] + C 1 r + C 2 •
ε 0 α
При выполнении условия a - r » l , т. е. в пределах клеточной периферии C 1 = C 2 = 0; другое
граничное условие, т. е. равенство φ = φs при r = a дает в результате уравнение
- εe φs = Cm .
ε 0 α 2
Таким образом, если известна величина поверхностного потенциала φs , то система уравнений
Cm = 1 αa ,
Cin 3 , кл
- εe
φs= 2 Cm
ε 0 α
определяет оба параметра концентрационной зависимости α и Cm . Отметим, что именно поверхностный потенциал и поверхностный заряд определяют проводимость мембранных каналов, в том числе каналов, образованных грамицидином А [12].
Необходимые параметры концентрационной зависимости α и Cm получаются при совместном решении уравнений (7) и (3). Для этого необходимо задаться значением φs . Для оценочных расчетов можно воспользоваться значением электроки-нетического потенциала (ζ-потенциала) для границы раздела "жирная кислота—вода", равного ζ = - 120мВ [13]. Имеются основания считать [14], что граница раздела "вода—неполярный растворитель" может рассматриваться как модель границы раздела "вода—липидная мембрана" с диэлектрической проницаемостью в граничном слое, равной 2–3.
С другой стороны, можно использовать вычисленное выше значение трансмембранного потенциала Δ φмкл = - 152.6мВ и считать его равным поверхностному потенциалу клетки φs . Значение относительной диэлектрической проницаемости ε оценим, исходя из величины удельной емкости бислоя 0.7 ÷ 1.0мкФ ⋅ см - 2 [ 12 ] . Используя значения ε = 5, ε 0 = 8.85 ⋅ 10 - 12Ф ⋅ м - 1 , совместное решение (3) и (7) дает значения l = 1/ α ≅ 0.038 Å и Cm = 1.95 ⋅ 102 M (в молях на литр). Нетрудно подсчитать, что один адсорбированный катион занимает площадь, равную примерно 17 × 17 Å. Если принять среднюю площадь в расчете на одну молекулу липида равной 52 Å2, как это принято в модельных расчетах [15], то, следовательно, в поверхностной решетке один сорбирующийся катион располагается в окружении 5–6 полярных (карбоксильных) фрагментов липидов.
Вычисленная малая величина l представляет собой на самом деле результат усреднения по поверхности двойного электрического слоя, если считать, как это принято в адсорбционной модели Штерна, что максимальная реальная толщина слоя в месте контакта определяется размерами катионов ТФФ+ (4 Å). При этом эквивалентная толщина слоя, вычисленная как длина ребра кубического объема 17 × 17 × 0.038 Å, составляет 2.2 Å. Очевидно, что при столь малых значениях l весь процесс представляет собой однослойную (лэнг-мюровскую) адсорбцию с дополнениями модели Штерна. Таким образом, можно предположить, что связывание индикаторных катионов происходит в тонком (2–3 Å) поверхностном слое (слой Штерна), связанном с мембраной малоподвижной воды. Для такой воды характерен крайне низкий коэффициент самодиффузии (10 - 7см2 ⋅ с - 1 по сравнению со значением 10–5 см2·с–1 для свободной воды [15]), что и способствует стабилизации двойного слоя.
Отмеченную выше специфическую функцию ТФФ+ как блокатора кальциевого обмена
Са2+/ 2Na+ [2], препятствующего выходу кальция из митохондрий, по-видимому, можно рассматривать как дополнительное свидетельство в пользу сорбционного механизма связывания.
Величина концентрации Cm , соответствующая тому же количеству поглощенного материала, что и вычисленное исходя из значения внутриклеточной концентрации Cкinл , стала несоизмеримо больше. Соответственно отношение обеих концентраций определяется теперь отношением объема цитоплазмы и объема плотного тонкого адсорбированного слоя индикаторных катионов.
Если теперь вернуться к (1) и подставить вместо Cкinл = 2.22мМ значение Cm = 1.95 ⋅ 102 M , получим Δ φмкл = φs = - 445.2мВ . Затем из (7) совместно с (3) снова находим l = 0.1104 Å, Cm = 67M, φs = - 417.8мВ и так далее. Конец итераций (пять шагов) соответствует с высокой точностью значениям Cm = 71.6 M, l = 0.104 Å,
φs = -419.2мВ . При этом эквивалентная толщина адсорбированного слоя, вычисленная тем же способом, как и выше, составит 3.1 Å. Это значение достаточно близко к размеру сорбирующихся ионов. Если считать, возвращаясь к действию грамицидина (рис. 2), что часть сорбированных катионов, определяемая изменением электродного потенциала Δφd , поглощается мембраной и располагается в порах и на ее внутренней поверхности, то можно определить изменение трансмембранного потенциала, определяющего деполяризующее мембрану воздействие грамицидина.
Для наглядности представим изменение электродного потенциала в виде суммы А ф э = ( А ф э -A ф d ) + A фd , где первое слагаемое, измеряемое непосредственно, и второе принципиально неизмеримое слагаемое определяют доли исходной концентрации Cэout катионов, возвращающихся благодаря десорбции в инкубационную среду и поглощенных мембраной. Обозначим эти доли соответственно, как 1 - x и x , так что С э“‘ = ( 1 — x ) C u +хС э“‘ , где первое и второе слагаемые в правой части равенства представляют собой концентрации, установившиеся после окончания переходного процесса. Для рассматриваемого конкретного случая (рис. 2) А ф э - А фd = = 0.88мВ = кф ln [ C f / C03ut ( 1 - x ) ] = кф ln [ 1 / ( 1 - x ) ] , откуда следует значение x = 0.0337 . Деполяризующая мембрану разность потенциалов определяется соответственно выражением А ф деп =
= к ф ln [ xC? / ( 1 - x ) C u ] = к ф ln [ x / ( 1 - x ) ] = = –86.24 мВ. Знак (минус) соответствует внутренней поверхности мембраны. При этом предполагается, что вдоль мембранного канала сохраняется постоянство электрохимического потенциала поглощенных катионов.
Вычислим теперь поверхностную плотность адсорбированного заряда. Для конечного значения концентрации Cm = 71.6M в адсорбированном слое индикаторных катионов ТФФ+ получим значение площади в расчете на один катион, равное примерно 15 × 15Å. Следовательно, поверхностная плотность адсорбированного электрического заряда равна a = 0.07 Кл • м - 2. Максимальная плотность отрицательного поверхностного заряда для бислоя на основе фосфатидилсерина (PS), определяющая число центров связывания для одновалентных ионов, оценивается [16] величиной a max = 0.23Кл • м - 2. Таким образом, в рассматриваемом расчетном примере только около одной трети центров связывания на поверхности бислоя заняты адсорбированными ионами.
ЗАКЛЮЧЕНИЕ И ВЫВОДЫ
Полученное расчетным путем значение поверхностного потенциала соответствует, по всей вероятности, дипольному потенциалу. Происхождение дипольного потенциала связано с ориентацией дипольных моментов полярных групп липидов и гидроксилов ассоциированных с ними моле- кул воды. Дипольный потенциал возрастает от внешней границы клетки в направлении неполярного углеводородного ядра мембраны. Экспериментально измерены [17] значения дипольного потенциала для границы "мономолекулярная пленка фосфатидилхолин—вода", равного 400 мВ, и потенциала для границы липидного бислоя в воде, равного 280 мВ. Таким образом, именно дипольный потенциал определяет высоту 400 мВ потенциального барьера, препятствующего проникновению катионов ТФФ+ в мембрану. Это значение достаточно близко соответствует оценке примерно 360 мВ, найденной Френкелем для поверхностного потенциала микронных водных капель. Для расчета этого потенциала использовалось соотношение φs = ndδpr /ε0 (nd,δ, pr — соответственно объемная концентрация диполей, толщина двойного слоя и проекция дипольного момента на радиальное направление сферической частицы) [18]. Общая оценка дипольного потенциала лежит еще выше, т. е. в пределах от 400 до 700 мВ [17].
Дипольный потенциал не может быть измерен непосредственно, но его изменения при адсорбции индикаторных катионов определяются измеримыми электрокинетическим и поверхностным потенциалами, зависящими, в свою очередь, от величины трансмембранного потенциала.
Таким образом, основные выводы статьи сводятся к следующим положениям:
-
1) измеряемый с помощью ТФФ+-селективного электрода потенциал соответствует, по всей вероятности, значению периферического дипольного потенциала;
-
2) предположение об адсорбционном характере связывания индикаторных катионов с мембраной позволяет вычислить сначала долю поглощенных катионов, определяющую изменение мембранного потенциала клеток, а затем и само изменение мембранного потенциала при действии деэнерги-зующих агентов, в частности, порообразующего токсина грамицидина А.
Список литературы Потенциометрические измерения трансмембранного потенциала клеток с использованием проникающих ионов
- Liberman E.A., Topali V.P., Tsofina L.M. et al. Mechanism of coupling of oxidative phosphorylation and the membrane potential of mitochondria//Nature. 1969. Vol. 222. P. 1076-1078.
- Тренделева Т.А., Рогов А.Г., Черепанов Д.А. и др. Взаимодействие тетрафенилфосфония и додецилтрифенилфосфония с липидными мембранами и митохондриями//Биохимия. 2012. Т. 77, № 9. C. 1230-1239.
- Корыта И. Ионы. Электроды. Мембраны. М.: Изд. Мир, 1983. 227 с.
- Гринюс Л.Л., Даугелавичюс Р.Ю., Алькимавичюс Г.А. Исследование мембранного потенциала клеток Bacillus subtilis и Escherichia Coli методом проникающих ионов//Биохимия. 1980. Т. 45, № 9. С. 1609-1618.
- Rottenberg H. Membrane potential and surface potential in mitochondria: Uptake and binding of lipophilic cations.//J. of Membrane Biol. 1984. Vol. 81, No. 2. P. 127-138.
- Muratsugu M., Kamo N., Kobatake Y., Kimura K. Determination of membrane potential of Escherichia coli with use of an electrode sensitive to tetraphenyl phosphonium//J. of Electroanalyt. Chem. and Interfacial Electrochem. 1979. Vol. 104. P. 477-491.
- Kamo N., Muratsugu M., Hongoh R., Kobatake Y. Membrane potential of mitochondria measured with electrode sensitive to tetraphenyl phosphonium and relationship between proton electrochemical potential and phosphorylation potential in steady state//J. of Membrane Biol. 1979. Vol. 49. P. 105-121.
- Lolkema J.S., Hellingwerf K.J., Konings W.H. The effect of «probe binding» on the quantitative determination of the proton-motive force in bacteria//Biochimica et Biophysica Acta. 1982. Vol. 681. P. 85-94.
- Lolkema J.S., Abbing A., Hellingwerf K.J., Konings W.H. The transmembrane electrical potential in Rhodopseudomonas sphaeroides determined from the distribution of tetraphenylphosphonium after correction for its binding to cell components//FEBS J. 1983. Vol. 130, No. 2. P. 287-292.
- Breeuwer P., Abee T. Assesment of the membrane potential, intracellular pH and respiration of bacteria employing fluorescence techniques//Molecular Microbial Ecology Manual, Second Edition. 2004. P. 1563-1580.
- Гринюс Л.Л., Даугелавичюс Р.Ю., Пташекас М.Р. Ионселективный мембранный электрод. АC СССР, № 1136611, 1984.
- Остроумова О.С., Ефимова С.С., Малев В.В., Щагина Л.В. Ионные каналы в модельных липидных мембранах. СПб.: Институт цитологии РАН, 2012. 32 с.
- Weiss L. The cell periphery//Intern. Rev. Cytology. 1970. Vol. 26. P. 63.
- Рубин А.Б. Биофизика (в 2 томах). Т. 1. Теоретическая биофизика. М., 1999. 81 с.
- Зленко Д.В., Красильников П.М. Молекулярное моделирование липидных бислойных мембран//Компьютерные исследования и моделирование. 2009. Т. 1, № 4. C. 423-436.
- Ермаков Ю.А. Биоэлектрохимия бислойных липидных мембран//Российский химический журнал. 2005. Т. 49, № 5. C. 114-120.
- Brockman H. Dipole potential of lipid membranes//Chemistry and Physics of Lipids. 1994. Vol. 73, No. 1-2. P. 57-79.
- Френкель Я.И. Теория явлений атмосферного электричества. М.-Л.: ГИТТЛ, 1949. 155 с.


