Потенциометрическое определение фтора в зубных пастах
Автор: Матвейко Николай Петрович, Протасов Семен Корнеевич
Журнал: Вестник Витебского государственного технологического университета @vestnik-vstu
Рубрика: Химическая технология и экология
Статья в выпуске: 2 (21), 2011 года.
Бесплатный доступ
Определено содержание фторид-ионов в восьми наименованиях зубных паст потенциометрическим методом с использованием фторидного индикаторного электрода типа ЭF-VI.
Фтор, зубная паста, содержание фтора, методы определения, фторид-ионы, определение фторид-ионов, потенциометрическое определение, потенциометрический метод, индикаторные электроды, фторидные индикаторные электроды
Короткий адрес: https://sciup.org/142184717
IDR: 142184717
Текст научной статьи Потенциометрическое определение фтора в зубных пастах
Фтор относится к микроэлементам и присутствует в костных и зубных тканях человека преимущественно в виде неорганических соединений. При недостатке фтора у человека развивается кариес, поэтому в профилактических целях фтор вводят в состав зубных паст. Однако высокие концентрации фтора опасны ввиду способности ионов фтора ингибировать ряд ферментативных реакций, а также связывать биологически активные элементы (например, фосфор, кальций, магний и др.) [1, 2]. Поэтому содержание фторидов в зубных пастах нормируется и обязательно контролируется [3, 4]. Для определения фторид–ионов используют спектрофотометрию, ионную хроматографию и капиллярный электрофорез [5, 6]. Однако наиболее широкое применение получил метод прямой потенциометрии (ионометрии) с использованием фторидселективного индикаторного электрода [3, 7, 8]. Метод прост, не требует дорогостоящих приборов и реактивов, имеет высокую чувствительность и селективность, является экспрессным и легко может быть автоматизирован.
Цель работы – определить содержание фтора (фторид–ионов) в зубных пастах прямой потенциометрией с использованием фторидселективного индикаторного электрода.
Исследования проводили при температуре 25 0С с помощью иономера марки И– 130.2М, фторидного индикаторного электрода типа ЭF–VI, имеющего диапазон линейности электродной функции в интервале концентраций ионов фтора от 3·10 –6 до 10–1 моль/дм3, хлорсеребряного электрода сравнения марки ЭВЛ–1М3.1. Растворы готовили на дистиллированной воде из реактивов марки «ЧДА». В качестве фонового электролита использовали буферный раствор с рН 5,0 – 5,5, содержащий ацетат натрия, хлорид натрия, цитрат натрия, трилон Б и уксусную кислоту. Значение рН раствора проверяли с помощью рН–метра (рН 150М) и, при необходимости, доводили до требуемой величины (5,0–5,5) раствором гидроксида натрия или уксусной кислотой. Стандартный раствор фторида натрия концентрацией 0,1 моль/л готовили из высушенного до постоянной массы при 105 0С фторида натрия. Из стандартного раствора (0,1 моль/л NaF) последовательным разбавлением готовили градуировочные растворы фторида натрия концентрацией (моль/дм3): 1⋅10–5; 1⋅10–4; 1⋅10–3; 1⋅10–2 5⋅10–2.
Фторидный электрод ЭF–VI после длительного хранения в сухом виде выдерживали в 0,001М растворе NaF в течение суток, тщательно промывали дистиллированной водой и хранили в 0,0001М растворе NaF.
Для исследований отобраны образцы восьми наиболее широко применяемых зубных паст разного состава и различных производителей, названия и основные сведения о которых приведены в таблице 1.
Для установления градуировочной зависимости измеряли потенциал фторидного электрода в каждом градуировочном растворе (моль/дм3: 1 ⋅ 10–5; 1 ⋅ 10–4; 1 ⋅ 10–3; 1 ⋅ 10–2 5 ⋅ 10–2), начиная с раствора, имеющего наименьшую концентрацию. Для этого в стакан вместимостью 50 см3 помещали 10 см3 градуировочного раствора, 10 см3 буферного раствора для устранения влияния алюминия и железа. Раствор тщательно перемешивали, погружали фторидный и хлорсеребряный электроды, после стабилизации потенциала (примерно через 3 минуты) измеряли его значение. Затем электроды тщательно промывали (обычно 3 раза) дистиллированной водой. Аналогичным способом измеряли потенциалы фторидного электрода во всех градуировочных растворах. Относительная погрешность единичного измерения не превышала 1 %. Результаты представлены в таблице 2.
По усредненным результатам трех измерений потенциала индикаторного электрода в стандартных растворах фторида натрия строили зависимость Е ср от (– lg C F ), которая представлена на рисунке. В программе Micrоsoft Excel по методу наименьших квадратов выполнена аппроксимация экспериментально полученных точек с подбором аппроксимирующей зависимости линейного вида и указанием достоверности полученной аппроксимации ( R2 ).
Таблица 1 – Названия и основные сведения о зубных пастах
|
№ образца |
Название зубной пасты / страна-производитель |
Основные ингредиенты |
Показания |
|
1 |
2 |
3 |
4 |
|
1 |
32 жемчужины / Республика Беларусь |
Глицерофосфат кальция, лауралсульфат натрия, фторид натрия, оксид титана (IV), оксид кремния (IV) |
Профессиональная защита от кариеса, защита от пародонтоза |
|
2 |
Splat Ультракомплекс / Россия |
Лаурилсульфат натрия, гидроксиапатит, нитрат калия, гидрокарбонат натрия, оксид титана (IV), гидратированный оксид кремния (IV), цитрат цинка |
Комплексный уход и отбеливание чувствительной эмали |
Окончание таблицы 1
|
1 |
2 |
3 |
4 |
|
3 |
Aquafresh 3 Mild & Minty / Великобрита ния |
Лаурилсульфат натрия, фторид натрия, оксид титана (IV), гидратированный оксид кремния (IV), гидроксид натрия, глицерин, экстракт лимона |
Тройная защита, укрепление эмали, защита от действия кислот |
|
4 |
Lacalut fluor / Германия |
Лаурилсульфат натрия, фторид натрия, оксид титана (IV), гидратированный оксид кремния (IV), оксид кремния (IV), экстракт лимона |
Реминерализует и укрепляет эмаль, защита от кариеса, замедляет процесс потемнения зубов при курении, употреблении чая, кофе |
|
5 |
Blend-a-med 7 комплекс + отбеливание / Германия |
Лаурилсульфат натрия, фторид натрия, гидратированный оксид кремния (IV), пирофосфат калия, дигидропирофосфат натрия, триклозан, экстракт лимона |
Защита от кариеса, профилактика пародонтоза |
|
6 |
New Betadent Blue Granules / Италия |
Лаурилсульфат натрия, фторид натрия, оксид титана (IV), гидратированный оксид кремния (IV), бензоат натрия, глицерин, экстракт мяты |
Профилактика кариеса, бережное отбеливание |
|
7 |
Colgate Total / Китай |
Лаурилсульфат натрия, фторид натрия, гидратированный оксид кремния (IV), гидроксид натрия, триклозан, экстракт лимона |
Защита от кариеса, профилактика пародонтоза |
|
8 |
Colgate Доктор Заяц / Китай |
Лаурилсульфат натрия, фторид натрия, гидратированный оксид кремния (IV), пирофосфат натрия, вкусовая добавка «Клубника» |
Предотвращает кариес, для детей старше 2 лет |
Таблица 2 – Значения потенциалов фторидного электрода в градуировочных растворах
|
№ градуировочного раствора |
Концентрация фторид–ионов в градуировочном растворе, моль/ дм3 |
Значения потенциалов по отношению к хлорсеребряному электроду, Е (мВ) |
Среднее значение потенциала, Е ср (мВ) |
||
|
Е 1 |
Е 2 |
Е 3 |
|||
|
1 |
1 ⋅ 10–5 |
267 |
268 |
266 |
267 |
|
2 |
1 ⋅ 10–4 |
234 |
233 |
235 |
234 |
|
3 |
1 ⋅ 10–3 |
181 |
179 |
180 |
180 |
|
4 |
1 ⋅ 10–2 |
129 |
133 |
131 |
131 |
|
5 |
5 ⋅ 10–2 |
110 |
112 |
114 |
112 |
|
6 |
Буферный раствор |
275 |
274 |
273 |
274 |
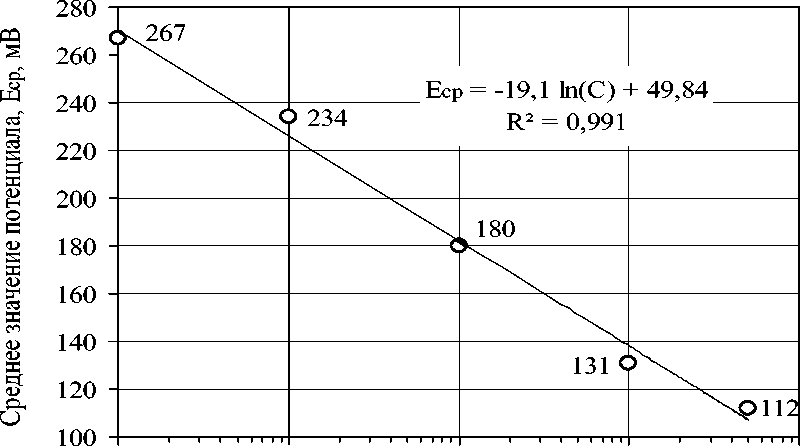
0,00001 0,0001 0,001 0,01 0,1
С, моль/л
Рисунок – Градуировочная зависимость для фтора
Из данных рисунка видно, что градуировочная зависимость для фтора с достоверностью полученной аппроксимации R2 = 99,1 % выражается уравнением:
Е ср = –19,1 ln(С) + 49,84 или Е ср = – 43,9 lg(С) + 49,84 , (1)
где Е ср – среднее значение потенциала фторидного электрода, мВ;
С – концентрация фторид–иона в растворе, моль/дм3.
С целью расчета основных аналитических характеристик методики потенциометрического определения фтора использовали метод «введено-найдено». Для этого проводили по четыре параллельных измерения значения потенциала фторидселективного индикаторного электрода в каждом модельном (стандартном) растворе NaF (моль/дм3): 1) 4·10–5; 2) 2·10–4; 3) 4·10–3; 4) 2·10–2 («введено»). По значениям потенциала, используя градуировочную зависимость (рисунок, уравнение 1), рассчитали содержание фтора в модельных растворах («найдено»). Результаты обработали методом математической статистики [9]. Полученные значения представлены в таблице 3.
Из таблицы 3 видно, что относительная погрешность определения фтора с применением фтордселективного индикаторного электрода типа ЭF–VI для более низких концентраций фторид-иона (4·10–5 и 2·10–4 моль/дм3) выше (2,75 и 1,98 % соответственно), чем для более высоких концентраций. При этом для концентрации фтор-иона в растворе 4·10–3 моль/дм3 она составляет 1,50 %, а для концентрации фторид-иона в растворе 2·10–2 моль/дм3 – 1,01 %. Относительное стандартное отклонение также уменьшается с увеличением концентрации фторид-иона в растворе: с 2,9 % для 4·10–5 моль/дм3 до 0,9 % для концентрации 2·10–2 моль/дм3.
Для проведения испытаний на содержание фторидов приблизительно 0,5 г зубной пасты взвешивали, результат записывали до третьего десятичного знака, помещали в колбу, приливали 25 см3 дистиллированной воды и 25 см3 0,5 моль/ дм3 раствора серной кислоты. Колбу соединяли с обратным холодильником и нагревали на кипящей водяной бане в течение 1 ч. Охлаждали до комнатной температуры, содержимое колбы переносили в мерную колбу вместимостью 100 см3, доводили раствор до метки дистиллированной водой, тщательно перемешивали. Значения потенциалов фторидного электрода измеряли для каждого образца зубной пасты три раза в растворе, содержащем 10 см3 приготовленного раствора и 10 см3 буферного раствора (см. выше).
Таблица 3 – Результаты исследований модельных растворов NaF и основные аналитические характеристики
|
«Введено» фтора моль/дм3 ( µ ) |
«Найдено» фтора моль/дм3 ( Х i ) |
Среднее арифметическое значение измеренной концентрации фтора ( Х ср ), моль/дм3 |
Относи тельное стандартное отклонение ( s r ), % |
Интервальное значение с доверительной вероятностью 95 % µ изм = Хс р ± ∆х , моль/дм3 |
Относительная погрешность δ = (Х ср – Х i ) ⋅ 100/Х ср , % |
|
4·10–5 |
4,09·10–5 3,89·10–5 4,10·10–5 3,90·10–5 |
4,00·10–5 |
2,9 |
(4,00 ± 0,18)·10–5 |
2,25 2,75 2,50 2.50 |
|
2·10–4 |
2,06·10–4 2,05·10–4 1,98·10–4 1,98·10–4 |
2,02·10–4 |
2,2 |
(2,02 ± 0,07)·10–4 |
1,98 1,49 1,98 1,98 |
|
4·10–3 |
4,06·10–3 3,95·10–3 4,05·10–3 3,94·10–3 |
4,00·10–3 |
1,6 |
(4,00 ± 0,10)·10–3 |
1,50 1,25 1,25 1,50 |
|
2·10–2 |
1,98·10–2 2,00·10–2 2,01·10–2 1,97·10–2 |
1,99·10–2 |
0,9 |
(1,99 ± 0,03)·10–2 |
0,50 0,50 1,01 1,01 |
После измерения потенциалов фторидного электрода в исследуемом растворе, используя среднее арифметическое значение трех результатов, по уравнению (1) (или по градуировочной зависимости рисунка) рассчитывали концентрацию фторида в рабочем растворе. По значению концентрации фторида в рабочем растворе вычисляли массовую долю фторида в зубной пасте (% в пересчете на фтор) по формуле
Х з = [(С ф ⋅ 19 ⋅ 100) / (m ⋅ 1000)] ⋅ 100,
где С ф – молярная концентрация фторида в рабочем растворе, рассчитанная по уравнению (1), моль/дм3;
19 – молярная масса фтора, г/моль;
100 – вместимость мерной колбы, см3;
m – масса навески зубной пасты, г.
Зная массовую долю фторида, рассчитали содержание фторида в зубной пасте М (мг/кг) М = Х з ⋅ 104 .
Все полученные результаты представлены в таблице 4.
Анализ данных, приведенных в таблице 4, и их сопоставление с данными таблицы 1 показывает, что содержание фторида (в пересчете на фтор, мг/кг) для всех изученных образцов зубной пасты соответствует информации, представленной на упаковке. При этом величина показателя «масса фторида в пересчете на фтор (мг/кг)» не превышает требований СанПиН 10–64 Республики Беларусь. Гигиенические требования к производству, качеству и безопасности средств гигиены полости рта – 1500 мг/кг [4].
Таким образом, определение фтора в зубных пастах после их обработки раствором серной кислоты потенциометрическим методом с применением фторидселективного индикаторного электрода типа ЭF–VI возможно (видно из таблицы 3) с относительной погрешностью, не превышающей 2,75 % и относительным стандартным отклонением менее 2,9 % в интервале концентраций 4 ⋅ 10–5 – 2 ⋅ 10–2 моль/дм3.
Таблица 4 – Результаты измерения массовой доли фторида в зубных пастах
|
№ п/п |
Название зубной пасты/страна-производитель |
Среднее значение Е , мВ |
Масса навески, m , г |
Концентрации фторида в растворе, С ф , моль/л |
Массовая доля фторида (в пересчете на фтор), Х з , % |
Содержание фторида (в пересчете на фтор), М , мг/кг |
|
1 |
32 жемчужины/ Республика Беларусь |
201,3 |
0,502 |
0,9846 |
0,135 |
1350 |
|
2 |
Splat Ультракомплекс/ Россия |
274,3 |
0,498 |
0 |
0 |
0 |
|
3 |
Aquafresh 3 Mild & Minty/ Великобритания |
199,9 |
0,499 |
1,5346 |
0,144 |
1440 |
|
4 |
Lacalut fluor/ Германия |
199,5 |
0,503 |
0,8206 |
0,147 |
1470 |
|
5 |
Blend-a-med 7 комплекс + отбеливание/ Германия |
200,0 |
0,501 |
0,8605 |
0,143 |
1430 |
|
6 |
New Betadent Blue Granules/ Италия |
209,2 |
0,499 |
1,1928 |
0,089 |
890 |
|
7 |
Colgate Total/ Китай |
199,8 |
0,503 |
0,9004 |
0,145 |
1450 |
|
8 |
Colgate Доктор Заяц / Китай |
220,5 |
0,502 |
0,9616 |
0,049 |
490 |
Список литературы Потенциометрическое определение фтора в зубных пастах
- Большая советская энциклопедия/гл. ред. А. М. Прохоров. -Москва: Сов. энцикл., 1978. С. 113.
- Уход за зубами и полостью рта. [Электронный ресурс]. -2011. -Режим доступа: http://www.neways.na.by/uhod_za_zubami.htm. -Дата доступа 12.01.2011.
- ГОСТ 7983-99. Пасты зубные. Общие технические условия. -Введ. 01.01.2001. -Москва: Межгосударственный совет по стандартизации, метрологии и сертификации, 2000. -36 с.
- СанПиН 10 64 РБ 98. Гигиенические требования к производству, качеству и безопасности средств гигиены полости рта. -Введ. 29.04.1998. -Минск, 1999. -23 с.
- ПНД Ф 14.1;2.179-02. Количественный химический анализ вод. Методика выполнения измерений массовой концентрации фторид-ионов в природных и сточных водах. -Введ. 06.08.2002. -М. 2002. -10 с.
- ГОСТ Р 52181-2003. Вода питьевая. Определение содержания анионов методами ионной хроматографии и капиллярного электрофореза. -Введ. 01.06.2004. Москва: ИПК Издательство стандартов, 2004. -14 с.
- Казак, А. С. Твердотельный рН-электрод для анализа фторсодержащих водных растворов/А. С. Казак, С. А. Радионова, М. А. Трофимов, А. А. Пендин//Журн. аналит. химии. -1996. -Т. 51, № 9. -С 970-976.
- Карелин, В. А. Потенциометрическое определение фторид-ионов в обессоленных водах энергетических установок/В. А. Карелин, Е. Н. Микуцкая//Известия томского политехнического университета. -2005. -Т. 308, № 4. -С.85-91.
- Дерффель, К. Статистика в аналитической химии/К. Дерффель. -Москва: Мир, 1994. -146 с.


