Потенциометрическое определение меди в пищевых продуктах
Автор: Матвейко Николай Петрович, Протасов Семен Корнеевич
Журнал: Вестник Витебского государственного технологического университета @vestnik-vstu
Рубрика: Химическая технология и экология
Статья в выпуске: 1 (20), 2011 года.
Бесплатный доступ
Предложена методика потенциометрического определения ионов меди в пищевой продукции на фоне 0,05 М KNO 3 + 0,02 М NaF.
Определение меди, медь в пищевых продуктах, тяжелые металлы, медь, потенциометрическое определение, потенциометрия, ионометрия, ионы меди, содержание меди, определение ионов меди, фоновые электролиты, ионометрическое определение, пищевые продукты
Короткий адрес: https://sciup.org/142184688
IDR: 142184688
Текст научной статьи Потенциометрическое определение меди в пищевых продуктах
Из всего многообразия загрязнителей природной среды по степени опасности для человека и распространенности в объектах окружающей среды первое место принадлежит тяжелым металлам [1,2].
Одним из тяжелых металлов является медь, которая относится к микроэлементам. Она необходима организму человека для их нормального функционирования и протекания физиологических (биохимических) процессов – кроветворения, пигментации волос, воспроизводительной функции и др. Однако избыточное поступление меди вызывает токсические эффекты у людей и животных, связанные с серьезными нарушениями в обмене веществ. Так, хронический избыток меди в организме человека ведет к остановке роста, гемолизу и низкому содержанию гемоглобина, а также к нарушению тканей в печени, почках, мозге [3].
В этой связи необходимо контролировать содержание меди в объектах окружающей среды, воде, биологических средах и продуктах питания.
Для определения содержания меди чаще всего используют достаточно чувствительные и надежные атомно-абсорбционные методы. Однако такие методы требуют применения дорогостоящих и для многих лабораторий мало доступных спектрометров [4].
Перспективным методом определения меди в водных растворах является прямая потенциометрия (ионометрия) [5–7]. Метод прост, не требует дорогостоящих приборов и реактивов, имеет низкую относительную погрешность, является экспрессным и легко может быть автоматизирован [8].
Цель работы – разработка методики ионометрического определения меди в пищевых продуктах.
Все исследования проводили при постоянной температуре 25 0С с использованием иономера лабораторного марки И–130.2М, медьселективного индикаторного электрода марки ЭМК–Cu–01, имеющего (согласно паспортным данным) диапазон линейности электродной функции в интервале концентраций ионов меди от 10–5 до 10–1 моль/дм3, хлорсеребряного электрода сравнения марки ЭВЛ–1М3.1. Растворы готовили на дистиллированной воде из реактивов марки «ЧДА».
Для определения меди ионометрическим методом чаще всего используют фоновые электролиты, содержащие сульфат натрия, нитрат калия или ацетатный буферный раствор [5–8], поэтому в качестве фоновых электролитов исследованы растворы Na 2 SO 4 , KNO 3 и буферный раствор состава 0,05 моль/дм3 СН 3 СООН + 0,05 моль/дм3 СН 3 СООNa . При этом фоновый электролит определяли, используя два важнейших критерия – наибольший диапазон линейности и максимальную крутизну электродной функции. Зависимости потенциала индикаторного электрода (E) от логарифма концентрации меди в растворе (– lgCCu ) строили по усредненным результатам трех измерений потенциала индикаторного электрода в стандартных растворах сульфата меди концентрацией (моль/дм3): 8·10–6; 2·10–5; 2·10–4; 2·10–3; 2·10–2; 1·10–1. Относительная погрешность единичного измерения не превышала 1 %.
С целью апробации методики определяли медь в изюме и пшеничной муке. Подготовку проб к анализу проводили способом сухой минерализации в соответствии с ГОСТ 26929–94 [9], согласно которому пробы массой 25 г помещали в кварцевый тигель и обугливали на электрической плитке. После прекращения выделения дыма выполняли минерализацию проб в электрической печи, постепенно повышая температуру от 250 0С до 500 0С (на 50 0С в течение каждых 30 минут). Минерализацию продолжали при этой температуре до получения золы серого цвета. Затем пробы охлаждали до комнатной температуры, смачивали водным раствором азотной кислоты, выпаривали на водяной бане и сушили при температуре не выше 140 0С в течение 30 минут. После этого пробы помещали в охлажденную электрическую печь, нагревали постепенно до температуры 300 0С и выдерживали при этой температуре 30 минут. Цикл подготовки проб повторяли до тех пор, пока не образовалась зола белого (для муки) или слегка розоватого (для изюма) цвета, не содержащая обугленных частиц. После охлаждения золу изюма растворяли в 30 см3, а золу муки – в 10 см3 фонового электролита и проводили по три параллельных измерения потенциала индикаторного электрода. По средним арифметическим значениям потенциалов, используя градуировочную зависимость между E и –lgCCu, определяли концентрацию меди в растворе, а затем рассчитывали содержание меди в изюме и пшеничной муке.
Исследования показали, что крутизна электродных функций для всех составов фоновых электролитов практически одинакова (линейные участки кривых параллельны). Однако наибольший диапазон линейности электродной функции наблюдается для фонового электролита, содержащего 0,05 моль/дм3 КNO 3 , и составляет 10–5 – 10–2 моль/дм3 меди. Этот электролит использован в дальнейших исследованиях.
Согласно литературным данным, ионометрическому определению меди практически не мешают ионы других металлов, за исключением ионов железа (III) [8]. Для устранения мешающего влияния ионов Fe+3 в анализируемые растворы добавляют фторид натрия, который связывает железо в прочный комплекс [6,7].
В этой связи выполнены исследования по влиянию ионов Fe+3 и фторида натрия на величину потенциала медьселективного индикаторного электрода марки ЭМК–Cu–01. Основные результаты представлены в таблице 1.
Таблица 1 – Значения потенциала индикаторного электрода марки ЭМК–Cu–01 в зависимости от состава раствора электролита
|
Концентрация СuSO 4 в растворе, моль/дм3 |
Значение потенциала Е , мВ |
||
|
Раствор СuSO 4 |
Раствор СuSO 4 + 0,001 моль/дм3 Fe 2 (SO 4 ) 3 |
СuSO 4 + 0,001 моль/дм3 Fe 2 (SO 4 ) 3 +0,02 моль/дм3 NaF |
|
|
1·10-4 |
0,1837 |
0,2113 |
0,1829 |
|
8·10-4 |
0,2093 |
0,2152 |
0,2086 |
|
5·10-3 |
0,2252 |
0,2273 |
0,2246 |
|
1·10-2 |
0,2392 |
0,2420 |
0,2388 |
Видно, что в присутствии ионов Fe +3 потенциал медьселективного индикаторного электрода марки ЭМК–Cu–01 больше, чем это наблюдается для растворов СuSO 4 , не содержащих железо. При добавлении в раствор 0,02 моль/дм3 NaF мешающее влияние ионов Fe+3 практически полностью устраняется, и значения потенциала индикаторного электрода во всех исследованных растворах становятся близкими к значениям в отсутствии ионов Fe+3 .
Таким образом, для ионометрического определения меди с применением индикаторного электрода марки ЭМК–Cu–01 оптимальным является фоновый электролит, содержащий 0,05 моль/дм3 КNO 3 + 0,02 моль/дм3 NaF .
Таблица 2 – Значения потенциалов индикаторного электрода марки ЭМК–Cu–01 в стандартных растворах
|
Концентрация меди в растворе ( С Cu ), моль/дм3 |
–lgC Cu |
Е , В |
|||
|
Е 1 |
Е 2 |
Е 3 |
Е ср |
||
|
1·10–5 |
5,00 |
0,1570 |
0,1564 |
0,1568 |
0,1567 |
|
5·10–5 |
4,30 |
0,1750 |
0,1748 |
0,1751 |
0,1750 |
|
1·10–4 |
4,00 |
0,1843 |
0,1837 |
0,1835 |
0,1838 |
|
5·10–4 |
3,30 |
0,2025 |
0,2030 |
0,2027 |
0,2027 |
|
1·10–3 |
3,00 |
0,2131 |
0,2127 |
0,2129 |
0,2129 |
|
5·10–3 |
2,30 |
0,2310 |
0,2305 |
0,2311 |
0,2309 |
|
1·10–2 |
2,00 |
0,2400 |
0,2403 |
0,2397 |
0,2400 |
Для определения меди по значениям измеренных потенциалов в модельных (стандартных) растворах и растворах, полученных после подготовки проб изюма и пшеничной муки, градуировочную зависимость устанавливали с помощью пяти стандартных растворов на фоновом электролите 0,05 М KNO 3 + 0,02 М NaF , содержащих СuSO 4 (моль/дм3): 1·10–5; 5·10–5; 1·10–4; 5·10–4; 1·10–3; 5·10–3; 1·10–2. В таблице 2 представлены значения потенциала индикаторного электрода марки ЭМК–Cu–01, измеренные в этих стандартных растворах.
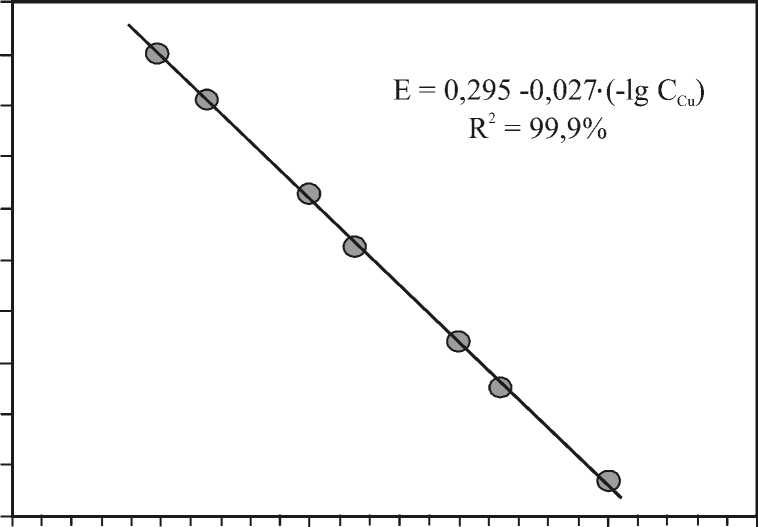
По усредненным значениям потенциала индикаторного электрода Е ср в стандартных растворах с различным содержанием меди построена зависимость Е от ( –lgC Cu ), которая представлена на рисунке.
0,25
0,24
0,23
0,22
0,21
0,20
0,19
0,18
0,17
0,16
0,15
-lg C Сu
Рисунок – Градуировочная зависимость для меди
В программе Micrisoft Excel по методу наименьших квадратов выполнена аппроксимация экспериментально полученных точек с подбором аппроксимирующей зависимости линейного вида и указанием достоверности полученной аппроксимации ( R2 ). Из данных рисунка видно, что градуировочная зависимость для меди с достоверностью полученной аппроксимации R2 = 99,9 % выражается уравнением:
Е = 0,295 – 0,027 ⋅ (–lgCCu).
Для расчета основных аналитических характеристик методики ионометрического определения меди использовали метод «введено-найдено». С этой целью проводили по четыре параллельных измерения значения потенциала индикаторного электрода в каждом модельном (стандартном) растворе СuSO4 (моль/дм3): 1) 6·10–5; 2) 3·10–4; 3) 8·10–4; 4) 6·10–3 («введено»). По значениям потенциала, используя градуировочную зависимость (рисунок, уравнение 1), рассчитали содержание меди в модельных растворах («найдено»). Результаты обработаны методом математической статистики [10]. Они представлены в таблице 3.
Из таблицы 3 видно, что относительная погрешность определения меди для более низких концентраций (6·10–5 и 3·10–4 моль/дм3) выше (3,75 и 3,63 % соответственно), чем для более высоких концентраций. Например, для концентрации меди в растворе 8·10–4 моль/дм3 она составляет 1,00 %, а для концентрации 6·10–3 моль/дм3 – 1,01 %. Относительное стандартное отклонение также больше для низких концентраций (например, для 6·10–5 моль/дм3 оно составляет 7,0 %). По мере увеличения концентрации меди в растворе относительное стандартное отклонение уменьшается, и для концентрации меди в растворе 6·10–3 моль/дм3 оно составляет 0,9 %.
Таблица 3 – Результаты исследований модельных растворов СuSO 4 и основные аналитические характеристики
|
«Введено» меди моль/дм3 ( µ ) |
«Найдено» меди моль/дм3 ( Х i ) |
Среднее арифметическое значение измеренной концентрации меди ( Х ср ) , моль/дм3 |
Относительное стандартное отклонение ( s r ) , % |
Интервальное значение с доверительной вероятностью 95% µ изм = Хс р ± ∆х , моль/дм3 |
Относительная погрешность δ = (Х ср – Х i ) ⋅ 100/Х ср , % |
|
6,16·10–5 |
3,75 |
||||
|
6,43·10–5 |
(6,40 ± 0,67)·10–5 |
0,47 |
|||
|
6·10–5 |
6,48·10–5 |
6,40·10–5 |
7,0 |
1,25 |
|
|
6,52·10–5 |
1,88 |
||||
|
2,92·10–4 |
3,63 |
||||
|
3,07·10–4 |
(3,03 ± 0,12)·10–4 |
1,32 |
|||
|
3·10–4 |
3,05·10–4 |
3,03·10–4 |
2,5 |
0,66 |
|
|
3,08·10–4 |
1,65 |
||||
|
8,09·10–4 |
1,00 |
||||
|
7,94·10–4 |
(8,02 ± 0,12)·10–4 |
0,75 |
|||
|
8·10–4 |
8,08·10–4 |
8,01·10–4 |
1,0 |
0,87 |
|
|
7,93·10–4 |
1,00 |
||||
|
5,94·10–3 |
0,33 |
||||
|
6,02·10–3 |
(5,96 ± 0,08)·10–3 |
1,01 |
|||
|
6·10–3 |
5,93·10–3 |
5,96·10–3 |
0,9 |
0,50 |
|
|
5,95·10–3 |
0,16 |
В ходе анализа изюма и пшеничной муки измеренные значения потенциала индикаторного электрода в растворе, полученном после подготовки проб, оказались равными (В): для пробы изюма 0,1678; 0,1673; 0,1675 (среднее арифметическое значение потенциала 0,1675 В); для пробы муки 0,1734; 0,1732; 0,1724 (среднее арифметическое значение потенциала 0,1730 В). По градуировочной зависимости (рисунок, уравнение 1) такие значения потенциала соответствуют концентрации меди в растворе 1,925·10–5 и 3,029·10–5 моль/дм3 соответственно для проб изюма и муки. Зная массу пробы и объем раствора, легко рассчитать, что содержание меди в изюме составляет 1,45, а в пшеничной муке – 0,77 мг/кг. Такое содержание меди не превышает ПДК этого металла, которое по нормативным документам составляет 5 мг/кг для изюма и 15 мг/кг для пшеничной муки [11].
По результатам исследований можно сделать следующие выводы:
-
1. Определение ионов меди в пищевой продукции можно проводить потенциометрическим методом с применением ионселективного индикаторного
-
2. Разработанная методика позволяет определять медь в водных растворах электролитов с относительной погрешностью, не превышающей 3,75 % и относительным стандартным отклонением менее 7,0 %.
электрода марки ЭМК–Cu–01 на фоне 0,05 М KNO 3 + 0,02 М NaF в интервале концентраций от 1∙10–5 до 1∙10–2 моль/дм3.
Список литературы Потенциометрическое определение меди в пищевых продуктах
- Тиво, П. Ф. Тяжелые металлы и экология/П. Ф. Тиво, И. Г. Быцко. -Минск: Юником, 1996. -185 с.
- Трахтенберг, И. М. Тяжелые металлы во внешней среде/И. М. Трахтенберг, В. С. Колесников, В. П. Луковенко. -Минск: Наука и техника, 1994. -120 с.
- Рейли, К. Металлические загрязнители пищевых продуктов/К. Рейли. -Москва: Агропромиздат, 1985. -184 с.
- Сырье и продукты пищевые. Атомно-абсорбционный метод определения токсичных элементов: Гост 30178. -введ. 01.07.1998. -Москва: Издательство стандартов, 1998. -16 с.
- Шпигун, Л. К. Проточно-инжекционный анализ. Потенциометрическое определение меди (II) в водах/Л. К. Шпигун, О. В. Базанова, Н. М. Кузьмин//ЖАХ. -1988. Т. 43. -№ 12. -С. 2200-2205.
- Овчинников, А. А. Потенциометрический метод определения критического содержания меди в полимерных композитах/А. А. Овчинников, А. А. Хорошилов, К. Н. Булгакова, Н. Д. Володин//ЖАХ. -1999. Т. 54. -№ 7. -С. 725-727.
- Гуськова, В. П. Ионометрическое определение меди в молоке и молочных продуктах/В. П. Гуськова, И. В. Крупина, Л. С. Сизова//ЖАХ. -1988. Т. 43. -№ 11. -С. 2036-2038.
- Демина, Л. А. Ионометрия в неорганическом анализе/Л. А. Демина, Н. Б. Краснова, Б. С. Юрищева, М. С. Чупахин. -Москва: Химия,1991. -192 с.
- ГОСТ 26929-94. Сырье и продукты пищевые. Подготовка проб. Минерализация для определения токсичных элементов. -Введ. 01.01.1996. -Минск: Межгосударственный совет по стандартизации, метрологии и сертификации, 1996. -12 с.
- Дерффель, К. Статистика в аналитической химии/К. Дерффель. -Москва: Мир, 1994. -146 с.
- СанПиН 11 63 РБ 98. Гигиенические требования к качеству и безопасности продовольственного сырья и пищевых продуктов. -Введ. 29.04.1998. -Минск: 1999. -218 с.


