Поверхность растворимости углерода, кислорода и хрома в жидкой меди
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна, Самойлова Ольга Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 2 т.17, 2017 года.
Бесплатный доступ
Выполнено термодинамическое моделирование фазовых равновесий в металлическом расплаве для систем Cu-C-O и Cu-Cr-C-O в интервале температур 1100-1300 °С. Термодинамический анализ процессов взаимодействия в исследуемых системах был проведен с использованием методики построения поверхности растворимости компонентов в металле. Диаграмма такого вида позволяет связать составы металлического расплава с видом продуктов взаимодействия, включающих не только твердые частицы оксидов, но и компоненты оксидного расплава, а также газообразные продукты взаимодействия. В ходе моделирования были уточнены температурные зависимости констант равновесия реакций, протекающих в медном расплаве исследуемых систем. Также были оценены параметры взаимодействия первого порядка (по Вагнеру) элементов в жидкой меди. Результаты моделирования представлены в виде графиков, на которых отражены составы металлического расплава (в зависимости от температуры), который находится в равновесии с тем или иным продуктом взаимодействия. По результатам проведенного моделирования определено, что образование частиц оксида меди в присутствии углерода и хрома, растворенных в жидкой меди, термодинамически маловероятно. При использовании графита в качестве элемента-раскислителя необходимо учитывать малую растворимость углерода в медном расплаве.
Система cu-c-o, система cu-cr-c-o, термодинамическое моделирование, поверхность растворимости компонентов в металле, хромовые бронзы
Короткий адрес: https://sciup.org/147157088
IDR: 147157088 | УДК: 669.35 | DOI: 10.14529/met170201
Текст научной статьи Поверхность растворимости углерода, кислорода и хрома в жидкой меди
Бронзы системы Cu–Cr отличаются высокими механическими свойствами, высокой электропроводностью и теплопроводностью, повышенной температурой рекристаллизации. Эти сплавы применяют для изготовления электродов электросварочных аппаратов, а также для изготовления различных деталей, работающих при повышенных температурах. В основном хромовые бронзы содержат порядка 0,4–1,0 мас. % хрома [1–4]. При производстве таких бронз графит используют не только как составную часть сплавов для раскисления, но и как покров, который помещают на зеркало металла для предотвращения окисления металлического расплава [5].
В литературе имеются сведения по термодинамике процессов взаимодействия в системе Cu–Cr–O, согласно которым хром взаимодействует с растворенным в медном расплаве кислородом с образованием частиц оксида хрома Cr2O3 [5, 6]. Для системы Cu–C–O большинство литературных данных посвяще- но описанию раскисления медного расплава монооксидом углерода CO [7–9]. Только в работах [6, 10] представлены некоторые сведения о термодинамических и диффузионных аспектах процессов взаимодействия растворенных в медном расплаве углерода и кислорода. Следует отметить, что для системы Cu– Cr–C–O в литературе нет данных, описывающих взаимодействие компонентов в жидкой меди.
Целью данной работы является термодинамическое моделирование процессов взаимодействия в системах Cu–C–O и Cu–Cr–C–O в условиях существования металлического расплава на основе меди.
Термодинамический анализ в данной работе выполнялся с использованием методики построения поверхности растворимости компонентов в металле (ПРКМ) [11, 12], которая позволяет связать количественные изменения в составе металлического расплава с изменениями в составе продуктов взаимодействия, которые могут быть представлены как твердыми частицами, так и компонентами оксидного расплава, а также газом.
На начальной стадии моделирования рассматривались бинарные диаграммы состояния (Cu–C, Cu–O и Cu–Cr), составляющие исследуемые системы, для определения пределов растворимости компонентов в жидкой меди в интересующем интервале температур (в данной работе этот интервал составляет 1100– 1300 °С).
Согласно литературным данным [13, 14] углерод обладает ограниченной растворимостью как в твердой, так и в жидкой меди. Растворимость углерода в жидкой меди в интересующем нас интервале температур 1100– 1300 °С крайне мала и составляет для температуры 1100 °С величину порядка 10–5 мас. %, а для температуры 1300 °С не превышает 10–4 мас. %.
Данные по диаграмме состояния системы Cu–O обобщены в работе [15], согласно этим сведениям для температуры 1100 °С растворимость кислорода в медном расплаве состав- ляет 0,64 мас. %; для 1200 °С – порядка 1,66 мас. %; для 1300 °С – порядка 3,10 мас. %.
Согласно фазовой диаграмме Cu–Cr [16], хром обладает ограниченной растворимостью в металлическом расплаве на основе меди: для температуры 1100 °С растворимость хрома в жидкой меди составляет порядка 2 мас. %; для температуры 1200 °С – порядка 4 мас. %; для температуры 1300 °С – не более 7 мас. %.
При моделировании системы Cu–Cr–C–O также учитывалась возможность образования соединения CuCrO 2 [17–19].
Для расчета координат ПРКМ исследуемых систем необходимы сведения о константах равновесия реакций, протекающих в металлическом расплаве (табл. 1), а также данные по параметрам взаимодействия первого порядка по Вагнеру (табл. 2).
Следует отметить, что для сильных раскислителей возможна не только температурная, но и концентрационная зависимость для параметра взаимодействия первого порядка (по Вагнеру) элемента-раскислителя с кислородом в жидкой меди [12, 22], что учитывалось для
Таблица 1
Константы равновесия процессов взаимодействия медного расплава и сопряжённых фаз (lg K = -AIT + B) [6]
|
Уравнение реакции* |
A |
B |
|
(Cu 2 O) = 2 [Cu]+ [O] |
3141 |
2,251 |
|
(Cr 2 O 3 ) = 2 [Cr]+ 3 [O] |
45 292 |
13,123 |
|
|Cu 2 O| = 2 [Cu] + [O] |
6500 |
4,468 |
|
|Cr 2 O 3 | = 2 [Cr] + 3 [O] |
50 760 |
15,248 |
|
|CuCrO 2 | = [Cu] + [Cr] + 2 [O] |
30 631 |
9,638 |
|
{CO} = [C] + [O] |
13 170 |
–1,930 |
|
{CO 2 } = [C] + 2 [O] |
23 660 |
1,858 |
* В квадратных скобках приведены компоненты металлического расплава, в круглых – оксидного расплава, в прямых скобках указаны чистые твердые вещества, в фигурных – газ.
Параметры взаимодействия первого порядка в медном расплаве e i j [6, 20, 21]
Таблица 2
Активности компонентов оксидного шлакового расплава Cu 2 O–Cr 2 O 3 , который может находиться в равновесии с металлическим расплавом системы Cu–Cr–C–O, рассчитывались по теории субрегулярных ионных растворов [11]. Энергетические параметры теории оказались равными (Дж/моль): Q 1112 = –61 304; Q 1122 = –51 688; Q 1222 = –22 300.
Результаты моделирования поверхности растворимости компонентов в металле системы Cu–C–O приведены на рис. 1. Описать ПРКМ можно следующим образом. В области I представлены составы металлического расплава, в равновесии с которым находится чистый твердый оксид меди; в области II – оксидный расплав, представленный оксидом меди (Cu 2 O); в области III – газ, представленный смесью {CO, CO 2 }, с общим давлением P общ = 1 атм. Линия a–b соответствует равновесию «металлический расплав – чистый твердый оксид меди – газ»; линия b–c – «металлический расплав – оксидный расплав – газ»; линия b–d – «металлический расплав – чистый твердый оксид меди – оксидный рас-
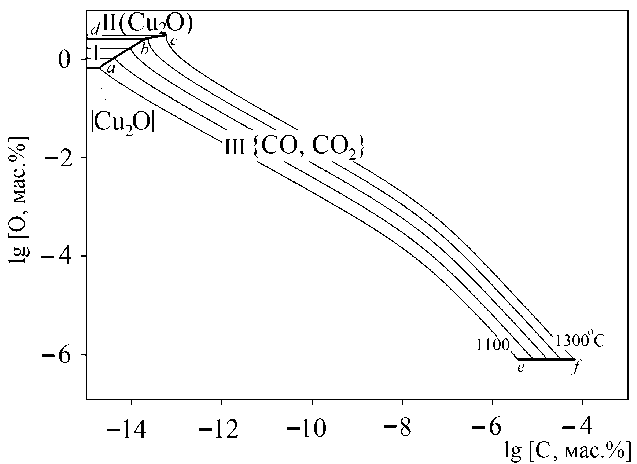
а)
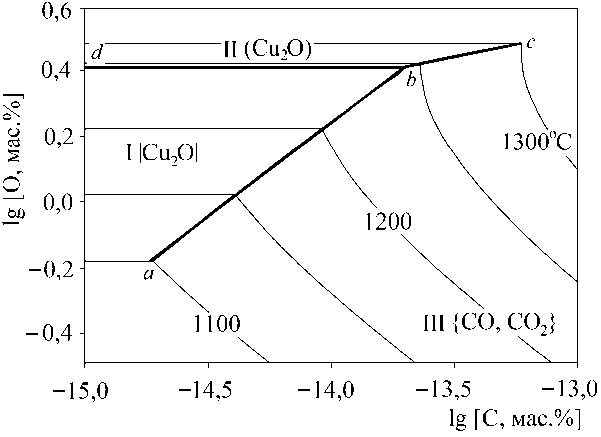
б)
Рис. 1. ПРКМ системы Cu–C–O: а – общий вид; б – увеличенный фрагмент с высокой концентрацией кислорода в металлическом расплаве
плав»; линия e–f ограничивает предельную растворимость углерода в жидкой меди при разных температурах.
Следует отметить, что линия b–d фактически соответствует процессу плавления оксида меди и реализуется при температуре 1242 °С, соответствующей литературным данным [23] о температуре плавления Cu 2 O.
Результаты моделирования поверхности растворимости компонентов в металле системы Cu–Cr–C–O приведены на рис. 2–4. Помимо известных областей I–III на ПРКМ добавились: область IV, определяющая составы металлического расплава, равновесного с чистым твердым соединением CuCrO 2 , и область V – с чистым твердым оксидом хрома Cr 2 O 3 . Также следует отметить, что в области II представлен оксидный расплав переменного состава (Cu 2 O,
Cr 2 O 3 ). На рис. 2–4 линия g–h соответствует равновесию «металлический расплав – чистое твердое соединение CuCrO 2 – чистый твердый Cr 2 O 3 »; линия g–i – «металлический расплав – чистый твердый Cr 2 O 3 – газ». На рис. 2 линия j–k определяет составы «металлический расплав – чистый твердый оксид меди – чистое твердое соединение CuCrO 2 »; линия j–l – «металлический расплав – чистый твердый оксид меди – газ». На рис. 3 линия o–k определяет составы «металлический расплав – оксидный расплав – чистый твердый оксид меди»; линия o–l – «металлический расплав – чистый твердый оксид меди – газ». На рис. 3, 4 линия m–n определяет составы «металлический расплав – оксидный расплав – чистое твердое соединение CuCrO 2 »; линия o–m – «металлический расплав – оксидный расплав – газ».
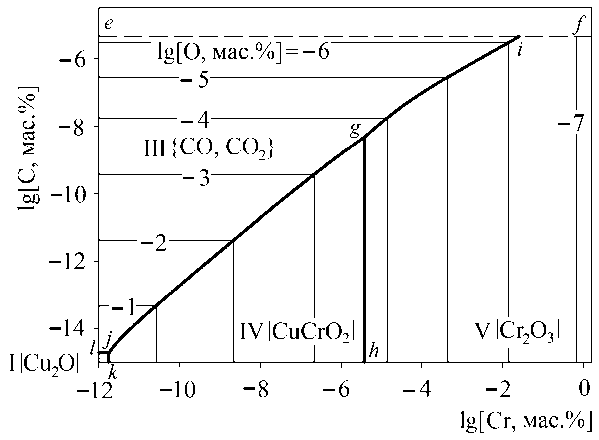
Рис. 2. ПРКМ системы Cu–Cr–C–O для температуры 1100 °С
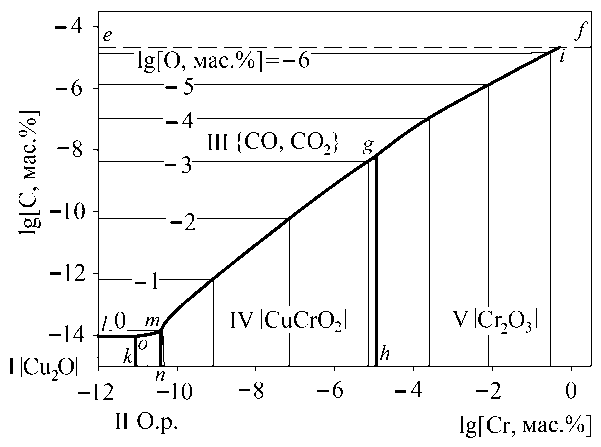
Рис. 3. ПРКМ системы Cu–Cr–C–O для температуры 1200 °С
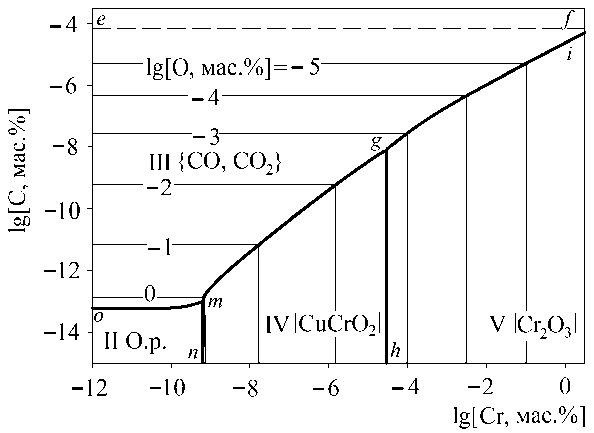
Рис. 4. ПРКМ системы Cu–Cr–C–O для температуры 1300 °С
Согласно рис. 2–4 углерод является в медном расплаве сильным раскислителем. При одних и тех же концентрациях углерода и хрома в медном расплаве (например, 10–6 мас. %) основным продуктом взаимодействия в системе Cu–Cr–C–O будет являться газ {CO, CO 2 }. Однако вследствие малой растворимости углерода в медном расплаве его раскислитель-ная способность ограничена пределом его растворимости. Для температуры 1100 °С при концентрациях хрома, соответствующих составу хромовых бронз (0,4–1,0 мас. % Cr), основным продуктом взаимодействия будет являться оксид хрома Cr 2 O 3 . И лишь только для температуры 1300 °С (с увеличением растворимости углерода в жидкой меди с ростом температуры) для интересующих концентраций хрома в металлическом расплаве системы Cu–Cr–C–O основным продуктом взаимодействия будет газ {CO, CO 2 }.
Выводы
Проведено термодинамическое моделирование процессов взаимодействия в системах Cu–C–O и Cu–Cr–C–O в условиях существования металлического расплава на основе меди для интервала температур 1100–1300 °С. Результаты моделирования представлены в виде диаграмм поверхности растворимости компонентов в металле. Установлено, что углерод является сильным раскислителем в медном расплаве, однако его раскислительная способность ограничена пределом его растворимости в жидкой меди. В системе Cu–Cr–C–O в интервале концентраций хрома в меди, соответствующих хромовым бронзам (0,4–1,0 мас. %), при температуре 1100 °С в качестве неметаллических включений образуются частицы Cr2O3. При более высоких температурах (1300 °С) раскислителем медно-хромового сплава является углерод.
Работа осуществлена при финансовой поддержке РФФИ, грант № 16-08-00133 а.
Список литературы Поверхность растворимости углерода, кислорода и хрома в жидкой меди
- Осинцев, О.Е. Медь и медные сплавы. Отечественные и зарубежные марки: справ./О.Е. Осинцев, В.Н. Федоров. -М.: Машиностроение, 2004. -336 с.
- On the use of alloying elements for Cu interconnect applications/K. Barmak, C. Cabral Jr., K.P. Rodbell, J.M.E. Harper//Journal of Vacuum Science & Technology B. -2006. -Vol. 24, no. 6. -P. 2485-2498 DOI: 10.1116/1.2357744
- Watanabe, Ch. Mechanical properties of Cu-Cr system alloys with and without Zr and Ag/Ch. Watanabe, R. Monzen, K. Tazaki//Journal of Materials Science. -2008. -Vol. 43, no. 3. -P. 813-819 DOI: 10.1007/s10853-007-2159-8
- Nanostructured Cu-Cr alloy with high strength and electrical conductivity/R.K. Islamgaliev, K.M. Nesterov, J. Bourgon et al.//Journal of Applied Physics. -2014. -Vol. 115. -P. 194301-194301-4 DOI: 10.1063/1.4874655
- Производство отливок из сплавов цветных металлов: учеб. для вузов/А.В. Курдюмов, М.В. Пикунов, В.М. Чурсин, Е.Л. Бибиков. -М.: Металлургия, 1986. -416 с.
- Куликов, И.С. Раскисление металлов/И.С. Куликов. -М.: Металлургия, 1975. -504 с.
- Sano, K. Physico-chemical investigation on copper smelting (2nd report). Thermodynamical consideration for the experimental results of the equilibrium between liquid copper and CO-CO2 gas mixtures/K. Sano, H. Sakao//Journal of the Japan Institute of Metals. -1955. -Vol. 19. -P. 435-438.
- Nanda, Ch.R. The kinetics of deoxidation of copper and copper alloys by carbon monoxide/Ch.R. Nanda, G.H. Geiger//Metallurgical Transactions. -1971. -Vol. 2, no. 4. -P. 1101-1106 DOI: 10.1007/BF02664242
- Andreini, R.J. Copper deoxidation kinetics utilizing carbon monoxide/R.J. Andreini, J.S. Foster, R.B. Phillips//Metallurgical Transactions B. -1977. -Vol. 8, no. 4. -P. 633-638 DOI: 10.1007/BF02669341
- Жуков, В.П. Математическое моделирование кинетики раскисления жидкой черновой меди углеродом/В.П. Жуков//Известия вузов. Цветная металлургия. -2016. -№ 4. -С. 13-16 DOI: 10.17073/0021-3438-2016-4-13-16
- Михайлов, Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. Дом МИСиС, 2009. -520 с.
- Михайлов, Г.Г. Фазовые равновесия в многокомпонентных системах с жидкими цветными металлами/Г.Г. Михайлов, Е.А. Трофимов, А.Ю. Сидоренко. -М.: Издат. Дом МИСиС, 2014. -158 с.
- Oden, L.L. Cu-C and Al-Cu-C phase diagrams and thermodynamic properties of C in the alloys from 1550 °С to 2300 °С/L.L. Oden, N.A. Gokcen//Metallurgical Transactions B. -1992. -Vol. 23, no. 4. -P. 453-458 DOI: 10.1007/BF02649664
- Okamoto, H. Supplemental literature review of binary phase diagrams: Ag-Cl, Br-Pb, Br-Zn, C-Cu, Ce-Zr, Cl-Zn, Fe-Lu, Fe-Tm, Ga-V, Nd-Ti, Nd-Zr, and Si-Ta/H. Okamoto//Journal of Phase Equilibria and Diffusion. -2016. -Vol. 37, no. 2. -P. 246-257 DOI: 10.1007/s11669-015-0433-z
- Thermodynamic description of the Cu-O system/M.T. Clavaguera-Mora, J.L. Touron, J. Rodríguez-Viejo, N. Clavaguera//Journal of Alloys and Compounds. -2004. -Vol. 377. -P. 8-16 DOI: 10.1016/j.jallcom.2004.01.031
- Chakrabarti, D.J. The Cr-Cu (chromium-copper) system/D.J. Chakrabarti, D.E. Laughlin//Bulletin of Alloy Phase Diagrams. -1984. -Vol. 5, no. 1. -P. 59-68.
- Gadalla, A.M.M. The system CuO-Cu2O-Cr2O3 and its bearing on the performance of basic refractories in copper-melting furnaces/A.M.M. Gadalla, J. White//Transactions of the British Ceramic Society. -1964. -Vol. 63, no. 10. -P. 535-552.
- Vlach, K.C. A thermodynamic study of the Cu-Cr-O system by the EMF method/K.C. Vlach, Y.-Z. You, Y.A. Chang//Thermochimica Acta. -1986. -Vol. 103, no. 2. -P. 361-370 DOI: 10.1016/0040-6031(86)85173-5
- Revisiting the properties of delafossite CuCrO2: a single crystal study/M. Poienar, V. Hardy, B. Kundys et al.//Journal of Solid State Chemistry. -2012. -Vol. 185. -P. 56-61. DOI: 10.1016/j.jssc.2011.10.047
- Линчевский, Б.В. Термодинамика и кинетика взаимодействия газов с жидкими металлами/Б.В. Линчевский. -М.: Металлургия, 1986. -222 с.
- Standard Gibbs free energy of formation of MnO-saturated MnO•Cr2O3 solid solution at 1873 K/M. Tanahashi, N. Furuta, T. Taniguchi et al.//ISIJ International. -2003. -Vol. 43, no. 1. -P. 7-13 DOI: 10.2355/isijinternational.43.7
- Взаимодействие лития с кислородом в жидкой меди/О.В. Самойлова, Г.Г. Михайлов, Л.А. Макровец, Е.А. Трофимов//Расплавы. -2017. -№ 1. -С. 83-92.
- Химическая энциклопедия: в 5 т./под ред. И.Л. Кнунянца. -М.: Сов. энцикл. -1990. -Т. 2. -671 с.


