Повторяющиеся измерения физиологического рН имплантируемыми оптическими датчиками в мышцах взрослого Danio rerio: предварительные результаты
Автор: Борвинская Е.В., Гурков А.Н., Щапова Е.П., Бадуев Б.К., Белоусова И.А., Меглинский И.В., Тимофеев М.А.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.12, 2016 года.
Бесплатный доступ
Инкапсулированные оптические датчики являются перспективным инструментом для измерения физиологических параметров внутри живых организмов. В настоящем исследовании мы проверили возможность применения инкапсулированных флуоресцентных сенсоров для измерения рН в мышцах взрослого Danio rerio. Сразу после инъекции датчики обнаруживают слабокислотный рН, а через 3 часа рН становится значительно более щелочным. Эти колебания, вероятно, связаны с повреждением клеток во время инъекции и дальнейшим восстановлением раны. Через 20 часов рН промежуточной жидкости составлял 7,65, что находится между ранее измеренными значениями и близко к рН крови, известным другим рыбам.
Короткий адрес: https://sciup.org/14324006
IDR: 14324006
Текст научной статьи Повторяющиеся измерения физиологического рН имплантируемыми оптическими датчиками в мышцах взрослого Danio rerio: предварительные результаты
Измерение физиологических параметров живого организма с помощью имплантируемых оптических сенсоров является перспективным направлением развития современной медицинской и экологической физиологии. Одной из многообещающих технологий для измерения химических и физических параметров водных сред являются разнообразные молекулярные сенсоры, чей спектр флуоресценции чувствителен к определённым параметрам среды (Johnson & Spence, 2010). Сами по себе данные сенсоры удобны для измерения физико-химических условий внутри живых клеток, однако малоприменимы на сравнительно крупных многоклеточных организмах из-за растворения во всём объёме внутренних сред. Кроме того, флуоресцентные сенсоры и комбинации различных сенсоров могут быть токсичны для организма. По этой причине, перспективным способом их применения является инкапсуляция в полупроницаемые оболочки (Gurkov et al. , 2016). Флуоресцентные сенсоры, заключённые в полупроницаемые микрокапсулы, остаются чувствительны к физиологическим параметрам организма, но в то же время локализованы в определённой области и не оказывают прямого токсического эффекта на живой организм.
Рыбы являются не только важным компонентом большинства водных экосистем, но и объектами аквакультуры и промысла. Разработка методики определения физиологического статуса представителей различных видов рыб с помощью имплантируемых оптических сенсоров представляет интерес как для фундаментальной экофизиологии, так и для таких прикладных областей как экологический мониторинг водоёмов и разведение рыб в аквакультуре. Целью данной работы было изучение возможности динамического мониторинга pH in vivo с использованием инкпсулированных флуоресцентных сенсоров в мышцах рыб Danio rerio — широко используемого лабораторного модельного объекта.
MATERIALS AND METHODS
Подготовка инкапсулированных pH-сенсоров
Чувствительные к pH инкапсулированные сенсоры на основе флуоресцентного красителя SNARF-1 подготавливали методом наслоения противоположно заряженных полимеров (Gurkov et al. , 2016; Kreft et al. , 2007). Вначале получали пористые ядра карбоната кальция, смешивая 1 М раствор Na 2 CO 3 и 1 М раствор CaCl 2 с раствором 2,5 мг/мл SNARF-1, ковалентно сшитого с декстраном (SNARF-1-D; D-3304, Invitrogen), в соотношении 1 : 1 : 3. Через 7 с перемешивания полученные ядра карбоната кальция, содержащие SNARF-1-D, троекратно отмывали в деионизированной воде.
Затем на ядра наносили слои положительно заряженного полимера полиаллиламин гидрохлорида (ПАГ; Aldrich, 2832315) и отрицательно заряженного полистиролсульфоната натрия (ПСН; Aldrich, 243051). Для этого ядра помещали в раствор соответствующего полимера с концентрацией 4 мг/мл (содержащий также 1 М NaCl) на 7 мин с ультразвуковыми импульсами в течение 1 мин для снижения агрегации ядер. Ядра трижды отмывали от раствора оставшегося полимера, после чего наслаивали второй полимер, и повторяли процедуру несколько раз. Для повышения биосовместимости сенсоров покрывали их дополнительным слоем cополимера поли-L-лизина и полиэтиленгликоля (ПЛЛ-ПЭГ; SZ34-67, SuSoS), экспонируя в растворе данного полимера с концентрацией 2 мг/мл в течение 10 часов (Sadovoy et al. , 2012). Наконец, ядра растворяли в 0,1 М растворе ЭДТА c pH 7.1, после чего получали полые микрокапсулы, соответствующие формуле SNARF-1-D/(ПАГ/ПСН) 5 / (ПЛЛ-ПЭГ). Поскольку SNARF-1 ковалентно связан с декстраном, он не может покинуть полость микрокапсулы.
Размер и концентрацию инкапсулированных сенсоров определяли под флуоресцентными микроскопом в камере Горяева. Средний размер полученных микрокапсул составлял 8,2±1,6 мкм.
Содержание рыб и инъекции инкапсулированных сенсоров
В качестве объекта данного исследования были выбраны взрослые особи Danio rerio, масса тела рыб составляла 0,32±0,08 г. Рыб содержали в 4-литровых пластиковых ёмкостях с водопроводной водой, предварительной очищенной коммерческим фильтром «Аквафор Топаз». Плотность посадки рыб составляла 1,25 шт/л, температура воды 20 °С, концентрация кислорода 7,5-8,2 мг/мл. Подмену 25 % воды осуществляли 1 раз в 2 дня. Кормление коммерческим кормом TetraWater Mini Mix (Tetra, Германия) проводили 1 раз в день.
Для обеззараживания наружных покровов, перед инъекцией рыб помещали в раствор метиленового синего (0,18 г/л) на 1 минуту. Затем рыб на 1 минуту переносили в эмульсию гвоздичного масла в воде (0,1 мкл/мл) для анестезии. Для инъекций инкапсулированных сенсоров использовали микроинъектор IM-9B (Narishige, Япония) с иглой диаметром 0,3 мм. Раствор микрокапсул объемом 0,8 мкл вводили внутримышечно на глубину около 0,5-1 мм в хвостовую часть спины. Концентрация вводимых сенсоров составляла порядка 104 микрокапсул на рыбу. Сразу после инъекции снимали спектральный сигнал от введённых флуоресцентных сенсоров. После измерения рыб возвращали в аквариум с постоянной аэрацией для восстановления. Для повторной регистрации флуоресцентного сигнала от инкапсулированных сенсров из мышц, рыб подвергали повторной анестезии по описанной схеме.
Калибровка инкапсулированных сенсоров и измерение pH in vivo
Икапсулированные сенсоры как в растворах, так и in vivo визуализировали в красном канале с помощью флуоресцентного микроскопа Микмед-2 (ЛОМО, Россия), спектральный сигнал получали с использованием спектрометра QE Pro (OceanOptics, USA), сопряжённого с микроскопом.
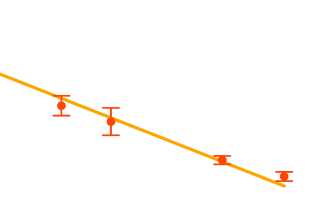
Для калибровки инкапсулированных pH-сенсоров их растворяли в наборе буферов в диапазоне pH 6,37,9 и помещали под микроскоп. Спектр флуоресценции инкапсулированного SNARF-1 регистрировали непосредственно после включения освещения для минимизации фоторазложения красителя. Для каждого спектра рассчитывали соотношение интенсивности флуоресценции между длинами волн 605 и 640 нм, после чего полученную зависимость между pH и I605/I640 аппроксимировали линейной регрессией (Рис. 1).
Измерение pH in vivo проводили аналогично, используя полученную калибровочную линию (Рис. 1) для определения pH по соотношению I 605 /I 640 . pH был измерен в шести биологических повторах непосредственно после инъекции сенсоров, а также через 3 и 20 ч. после инъекций. Статистическую значимость отличий между значениями pH в разные временные точки определяли с помощью критерия Манна-Уитни с поправкой Бонферрони в пакете R (R Core Team, 2015).
RESULTS AND DISCUSSION
Непосредственно после инъекции инкапсулированных флуоресцентных сенсоров в мышцы D. rerio pH в месте инъекции находился в диапазоне 7,24-7,52 с медианой 7,38 (Рис. 2). Через три часа после инъекции сенсоров наблюдали статистически значимое (p = 0,024) повышение pH до 7,80-7,87. К концу наблюдения (через 20 ч.) в мышцах произошло статистически значимое (p = 0,048) закисление тканевой жидкости по сравнению со вторым измерением: зафиксированный pH оказался в диапазоне 7,40-7,67 с медианой 7,65. Несмотря на то, что статистически значимых отличий между показаниями сенсоров сразу после инъекции и через 20 ч. после инъекции не обнаружено (p = 0,191), медианный pH через 20 ч. оказался выше, чем непосредственно после инъекции (7,65 и 7,38 соответственно).
одновременно с временным нарушением кровообращения (Woo et al., 2004). Повышение pH тканевой жидкости через 3 ч. после инъекции может быть связано с процессами заживления, важным высокой активности различных протеаз, оптимально функционирующих при высоких значениях рН (Schneider et al., 2007). К 20 ч. наблюдения основная часть процессов заживления, вероятно, завершается, и pH возвращается к физиологической элементом
которых является деградация
норме.
разрушенных клеточных компонентов за счёт
1.0
pH =-2.791*(1б05/1б40) + 8.637
0.8 -
R2 = 0.996
о
ID
-- 0.6
m о
<0
0.4
0.2
pH
-
Figure 1. Калибровочная линия использованных pH-чувствительных инкапсулированных сенсоров (представлены средние ± стандартные отклонения).
8.2
8.0
7.8
7.6
7.4
7.2
0 ч. после инъекции
3 ч. после инъекции
20 ч. после инъекции
-
Figure 2. Мониторинг pH in vivo с помощью инкапсулированных сенсоров в мышцах D. rerio сразу после инъекции, через 3 ч. и 20 ч. после инъекции. Отсутствуют статистически значимые отличия между выборками, имеющими в подписи одну букву при p < 0,05.
Полученные данные формируют основу для разработки комплексной методики долговременного мониторинга физиологических показателей в мышечной ткани взрослых рыб, которая может быть использована не только на D. rerio , но и на других видах.
ACKNOWLEDGEMENTS
Работа проведена при финансовой поддержке гранта РНФ (№ 15-14-10008).
Список литературы Повторяющиеся измерения физиологического рН имплантируемыми оптическими датчиками в мышцах взрослого Danio rerio: предварительные результаты
- Evans D.H. and Claiborne J.B. (1997) The Physiology of Fishes (ed. 2). CRC Press, USA
- Gurkov A., Shchapova E., Bedulina D., Baduev B., Borvinskaya E., Meglinski I. and Timofeyev M. (2016) Remote in vivo Stress Assessment of Aquatic Animals with Microencapsulated Biomarkers for Environmental Monitoring. Sci. Rep., DOI: 10.1038/srep36427
- Johnson I. and Spence M.T.Z. (2010) The Molecular Probes Handbook: A Guide to Fluorescent Probes and Labeling Technologies (ed. 11). Life Technologies, NY, USA
- Kreft O., Javier A.M., Sukhorukov G.B. and Parak W.J. (2007) Polymer Microcapsules as Mobile Local pH-Sensors. J. Mater. Chem., 17(42), 4471
- R Core Team (2015) R: A Language and Environment for Statistical Computing
- Sadovoy A., Teh C., Korzh V., Escobar M. and Meglinski I. (2012) Microencapsulated Bio-Markers for Assessment of Stress Conditions in Aquatic Organisms in vivo. Laser Phys. Lett., 9(7), 542
- Schneider L.A., Korber A., Grabbe S. and Dissemond J. (2007) Influence of pH on Wound-Healing: A New Perspective for Wound-Therapy? Arch. Dermatol. Res., 298(9), 413-420
- Woo Y.C., Park S.S., Subieta A.R. and Brennan T.J. (2004) Changes in Tissue pH and Temperature after Incision Indicate Acidosis May Contribute to Postoperative Pain. Anesthesiology, 101(2), 468-475


