Повторное облучение интракраниальных опухолей активным сканирующим пучком протонов
Автор: Гулидов И.А., Гордон К.Б., Гоголин Д.В., Мардынский Ю.С., Лепилина О.Г., Неледов Д.В., Галкин В.Н., Каприн А.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 5 т.16, 2017 года.
Бесплатный доступ
Современные технические достижения лучевой терапии в частности, протонная терапия активным сканирующим пучком и визуальным сопровождением лечения, способствуют возрождению интереса к повторным курсам облучения опухолей центральной нервной системы. Традиционно данная опция лечения при рецидивах интракраниальных новообразований хотя и является эффективной, но специалисты достаточно редко ее используют ввиду опасения тяжелых постлучевых неврологических осложнений. Есть лишь отдельные статьи с небольшим числом наблюдений, посвященные данной теме. Описание клинического случая. Приводим собственные наблюдения - 3 клинических случая повторного облучения интракраниальных опухолей с использованием активного сканирующего пучка протонов. В первом случае представлен опыт лечения больной глиомой высокой степени злокачественности, облученной повторно пучком протонов через 1,5 года после предшествующего конвенционального облучения. Была достигнута значительная регрессия опухоли, подтвержденная данными ПЭТ-КТ, в течение 18 мес. Во втором случае описано повторное протонное облучение пациентки с рецидивирующей эстезионейробластомой основания черепа, наблюдаемой нами в течение полутора лет без признаков рецидива и поздней токсичности. Третий случай является уникальным, так как пациентке с рецидивирующей гемангиоперицитомой орбиты был проведен четвертый курс облучения на одну зону. У больной также достигнута значительная регрессия без признаков осложнений облучения в течение 12 мес. Заключение. Использование современных технических достижений протонной терапии позволяет проводить повторное облучение опухолей центральной нервной системы в эффективных суммарных очаговых дозах, с возможностью значительно снизить лучевую нагрузку на окружающие нормальные структуры. Выполнение ПЭТ-КТ для оконтуривания мишени позволяет уточнить локализацию и объем метаболически активной ткани опухоли. Следование принципу ALARA позволяет минимизировать токсичность лечения.
Протонная терапия, интракраниальные опухоли, пэт-кт
Короткий адрес: https://sciup.org/140254144
IDR: 140254144 | DOI: 10.21294/1814-4861-2017-16-5-63-70
Текст научной статьи Повторное облучение интракраниальных опухолей активным сканирующим пучком протонов
Одной из наиболее сложных проблем современной лучевой терапии является проведение повторного облучения интракраниальных опухолей. Радиотерапевты крайне осторожно подходят к данному вопросу, чаще всего предпочитая отказывать в лечении этой категории пациентов. В первую очередь это связано с высокими ожидаемыми рисками развития ранних и поздних постлучевых осложнений, преимущественно радионекроза, а также очагового неврологического дефицита [1].
К сожалению, большинство таких больных – это пациенты с глиомами высокой степени злокачественности, и на момент развития рецидива опухоли у них, как правило, являются нерезекта-бельными, а системная терапия уже не проводится ввиду развития гематологической токсичности III–IV степени после первичных курсов химиотерапии или развития резистентности опухоли к ней [1]. Именно поэтому локальное неинвазивное лечение, которым является лучевая терапия, пред-
ставляется крайне интересным и перспективным методом воздействия в этой ситуации. Повторная радиотерапия является весьма эффективным способом лечения, особенно при опухолях глиального происхождения (уровень доказательности 2B) [2]. По данным литературы, выживаемость пациентов с глиомами высокой степени злокачественности после проведения повторного облучения может достигать в среднем 12–13 мес, и даже до 20–24 мес при радиохирургическом лечении очагов небольшого объема (до 10 см3) [3-5].
Лечение же рецидивов опухолей большого объема представляется весьма затруднительным. Показано, что относительно безопасная кумулятивная доза за два курса лечения может составлять до 100 Гр, или 40–50 Гр при проведении повторного курса [6]. Однако риски радионекроза при этом остаются достаточно высокими. Одним из наиболее сложных вопросов в этой связи является также срок проведения повторной радиотерапии. В случае небольших рецидивов это время практически не лимитировано. Но при облучении опухолей большого объема (более 50 см3) риски токсичности резко возрастают. Принято считать, что за 1 год после стандартного фотонного облучения в дозе 60 Гр восстанавливается около 50 % толерантности нервной ткани [7]. Вследствие этого минимальным сроком для повторного облучения считают не менее 6–8 мес [8]. Мы в своей клинической практике используем более консервативный подход и минимальным сроком для проведения протонной терапии считаем 1 год с момента предшествующего облучения.
Отдельного внимания заслуживает вопрос оценки состояния местных тканей в области предшествующего облучения. Для диагностики традиционно используют магнитно-резонансную томографию с контрастным усилением. Однако в последнее время все больше внимания уделяется достижениям молекулярной диагностики, таким методам как мр-спектроскопия, диффузионные и перфузионные изображения. Наибольшей достоверностью в дифференциальной диагностике рецидивов и продолженного роста интракраниальных опухолей обладает позитронно-эмиссионная томография с аминокислотами (метионин и тирозин). Этот метод позволяет с наибольшей точностью произвести оценку локального статуса, выявить истинную распространенность опухоли и область наибольшего интереса (BTV-биологический объем опухоли). Именно поэтому перед повторным курсом облучения мы рекомендуем всем пациентам с глиальными опухолями выполнить ПЭТ исследование.
Современное развитие техники для проведения лучевой терапии позволило возродить интерес к повторным курсам облучения как в целом, так и интракраниальных опухолей в частности. Наибольший интерес представляет в этой связи протонная терапия. Известно, что при облучении протонами риск токсичности резко снижается за счет уменьшения объема паразитной дозы, приходящейся на окружающие мишень (опухоль) ткани. Согласно имеющимся литературным данным, риск развития радионекроза не превышает 7–10 % [9], поэтому логичным представляется использование протонного пучка именно в подобных ситуациях.
При дозиметрическом планировании протонной терапии для расчета нагрузок на критические структуры нами используется принцип ALARA, то есть максимально достижимая в конкретной клинической ситуации минимизация облучения органов риска [10]. Данный принцип был выбран исходя из крайней неопределенности реальной толерантности структур головного мозга после первичного курса стандартной фотонной лучевой терапии. В контексте вышесказанного приводим клинические наблюдения случаев повторного облучения интракраниальных опухолей с использованием активного сканирующего пучка протонов и визуального контроля облучения.
Клиническое наблюдение 1
Пациентка Г., 1964 г.р., находилась на лечении в клинике МРНЦ им. Цыба в январе–феврале 2016 г. с диагнозом: Глиома (WHO grade 3–4) левой височнотеменной области. Лучевая терапия в январе 2014 г., СОД 55,0 Гр. Рецидив в 2015 г. Химиотерапия. Гематологическая токсичность IV ст.
С учетом диффузного характера опухоли (рис. 1), наличия осложнений химиотерапии пациентке было проведено повторное лучевое лечение: протонная терапия, в конвенциональном режиме, РОД 2 Гр-экв., СОД 50 Гр-экв., к мишени объемом (Vptv) 88 см3 (рис. 2).
Для планирования лечения данной пациентки была выполнена ПЭТ-КТ с метионином, которая выявила диффузный продолженный рост глиальной опухоли левой височно-теменной области, размерами 70×46×64 мм с индексом накопления 3,39 (рис. 3). Данные ПЭТ были совмещены со стандартной МРТ, и по результатам ко-регистрации обоих исследований выполнено оконтуривание мишени.
В январе–марте 2016 г. больной был проведен курс протонной терапии, в режиме традиционного фракционирования. С учетом того, что это была одна из наших первых пациенток, был выбран консервативный вариант режима лечения и суммарной дозы. На фоне проведения протонной терапии каких-либо непосредственных реакций не наблюдалось, после облучения в месте входа полей отмечена эритема I–II ст. Также было проведено 6 циклов адъювантной таргетной терапии (бева-цизумаб). В течение 18 мес после облучения была зарегистрирована постепенная значительная регрессия опухоли – на 80–85 % от первоначального объема (рис. 4). При контрольной МРТ через 1,5 года после лечения (рис. 5) выявлено прогрессирование опухоли в правое полушарие, в области
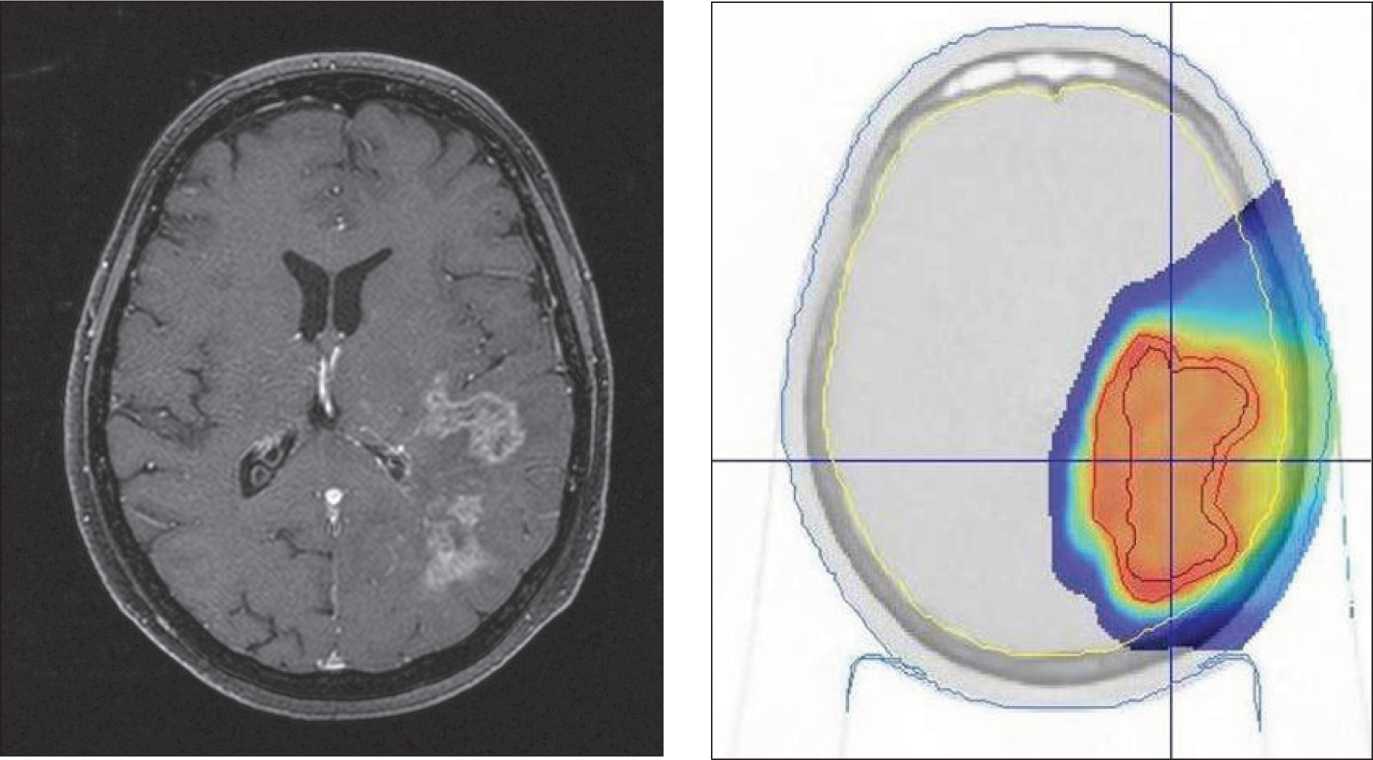
Рис. 2. Пациентка Г. Дозное распределение при облучении активным сканирующим пучком протонов, 2 Гр-экв, 25 фракций. Отмечается резкий спад дозы с максимума 100 % до 10–20 %
Рис. 1. Пациентка Г. МРТ головного мозга с контрастом перед протонной терапией. Инфильтративная глиома левой теменно-височно-затылочной области высокой степени злокачественности, размерами 7,5×4,3×4,7 см
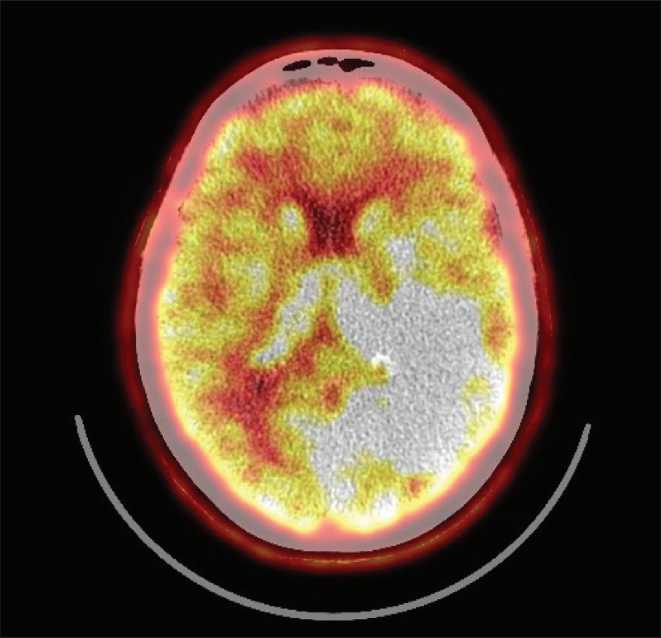
Рис. 3. Пациентка Г. ПЭТ-КТ с С11-метионином перед протонной терапией. Диффузный продолженный рост глиомы с признаками анаплазии, ИН=3,39, размерами 70×46×64 мм
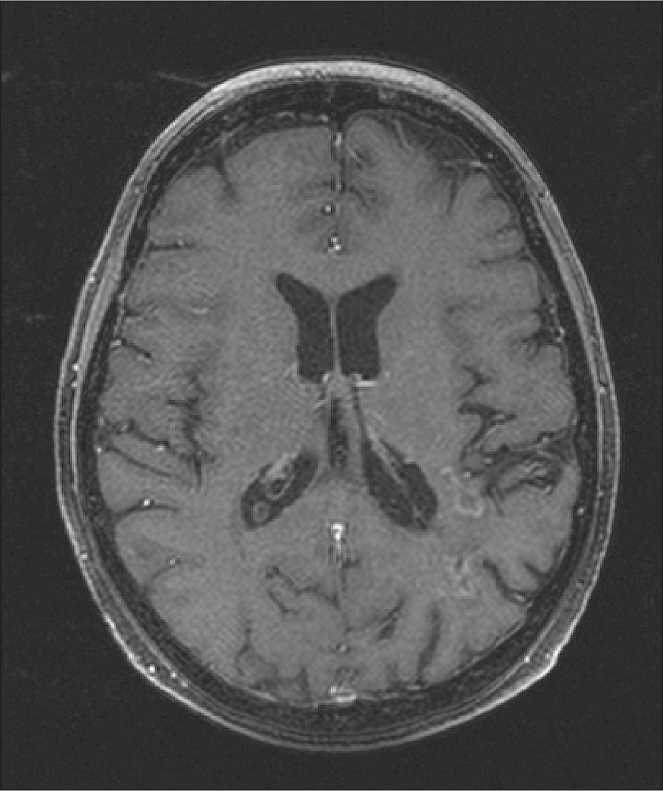
Рис. 4. Пациентка Г. МРТ головного мозга с контрастом через 18 мес после протонной терапии. Уменьшение размеров опухоли более 80 % (частичный ответ)
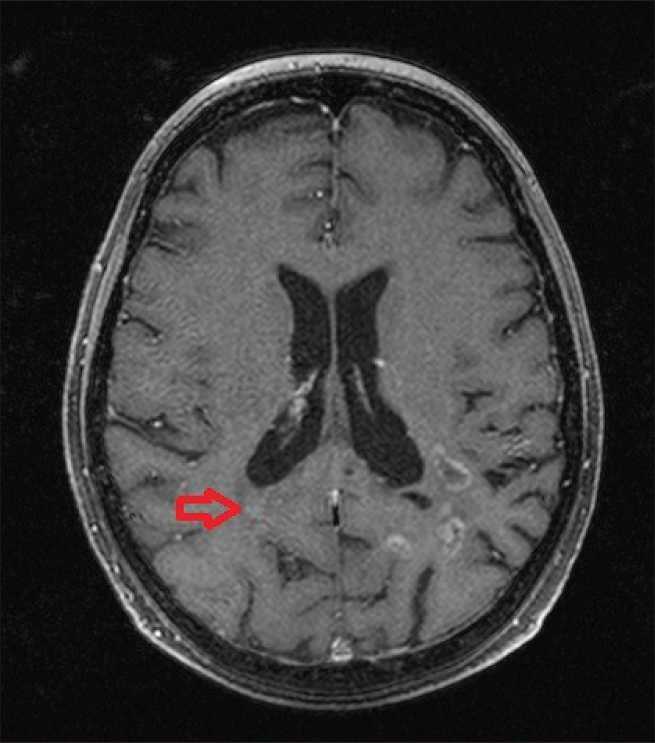
Рис. 5. Пациентка Г. МРТ головного мозга с контрастом через 18 мес после протонной терапии. Прогрессирование опухоли в области медиальной стенки треугольника правого бокового желудочка, размерами до 9 мм (указано стрелкой)
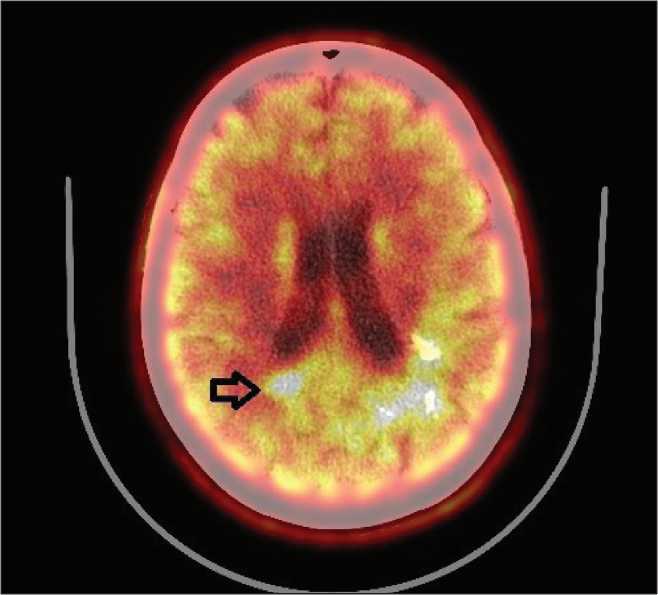
Рис. 6. Пациентка Г. ПЭТ-КТ с С11-метионином через 18 мес после протонной терапии. Прогрессирование глиомы в области медиальной стенки треугольника правого бокового желудочка, до 9 мм, ИН=1,7 (указано стрелкой)
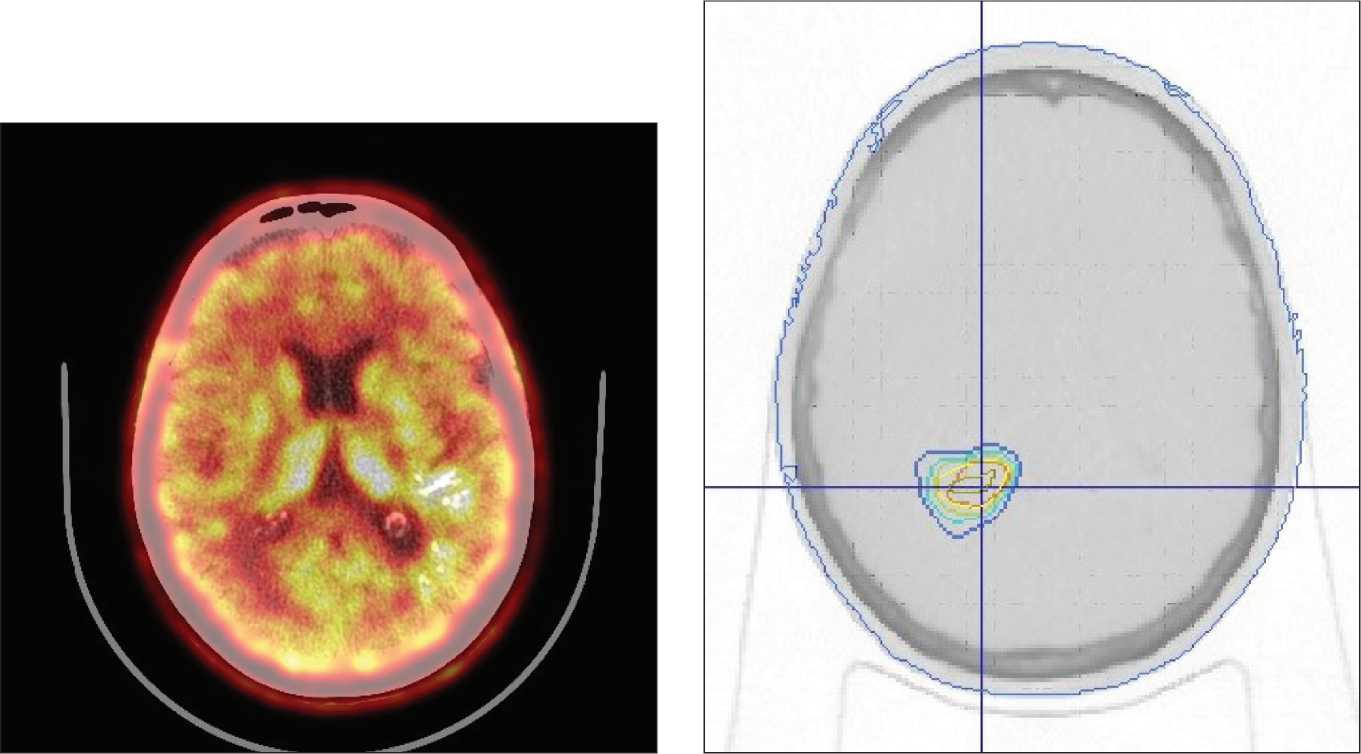
Рис. 7. Пациентка Г. ПЭТ-КТ с С11-метионином через 18 мес после протонной терапии. Уменьшение размеров метаболически активной ткани опухоли до 45×30×24 мм, ИН=1,6
Рис. 8. Пациентка Г. Дозное распределение при облучении активным сканирующим пучком протонов в режиме гипофракционирования, 5 Гр-экв, 7 фракций
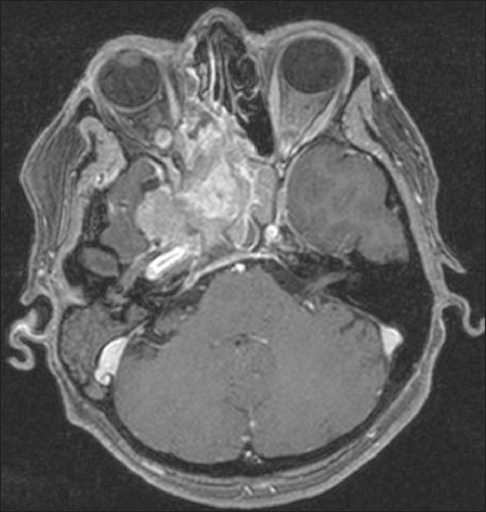
Рис. 9. Пациентка Б., МРТ головного мозга с контрастом перед протонной терапией. Инфильтративная эстезионейробластома основания черепа, размерами 5,7×4,7×4,9 см
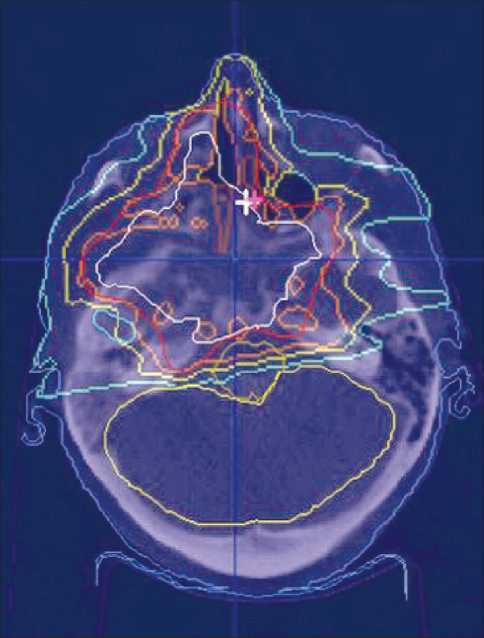
Рис. 10. Пациентка Б. Дозное распределение при облучении активным сканирующим пучком протонов, 2 Гр-экв, 25 фракций. Отмечается высокая избирательность в отношении облучения органов риска (зрительные структуры, гипофиз, орган слуха)
медиальной стенки треугольника правого бокового желудочка, размерами до 9 мм, подтвержденное данными ПЭТ-КТ с ИН=1,7 (рис. 6). При этом индекс накопления в области предшествующего облучения снизился до 1,6, а также уменьшился размер метаболически активной ткани опухоли (до 45×30×24 мм) (рис. 7). С учетом размеров области продолженного роста (Vptv=28 см3) и ее локализации в июне 2017 года был проведен третий курс облучения, также на протонном ускорителе, но в режиме гипофракционирования, РОД 5 Гр-экв., 7 сеансов (рис. 8). Кроме того, возобновлен прием бевацизумаба. В настоящий момент пациентка находится под динамическим наблюдением. Поздних лучевых осложнений не отмечено.
Клиническое наблюдение 2
Больная Б., 1967 г.р., находилась на лечении в клинике МРНЦ им. Цыба в феврале–марте 2016 г. с диагнозом: Эстезионейробластома придаточных пазух носа с интракраниальным распространением (рис. 9). Комплексное лечение в 1999–2000 гг.: операция и химиолучевая терапия СОД 60 Гр. Рецидив в 2014 г.: хирургическое лечение. Рецидив в 2015 г.
С учетом отказа в хирургическом лечении по поводу очередного рецидива опухоли (Vptv=214 см3) пациентке был проведен курс протонной терапии, в конвенциональном режиме (РОД 2 Гр), до СОД 50 Гр-экв. (рис. 10). После облучения в течение 12 мес была достигнута частичная регрессия опухоли, ее структурные изменения в виде фиброзного замещения (рис. 11). Рецидивная опухоль локализовалась в области передней черепной ямки, с переходом в
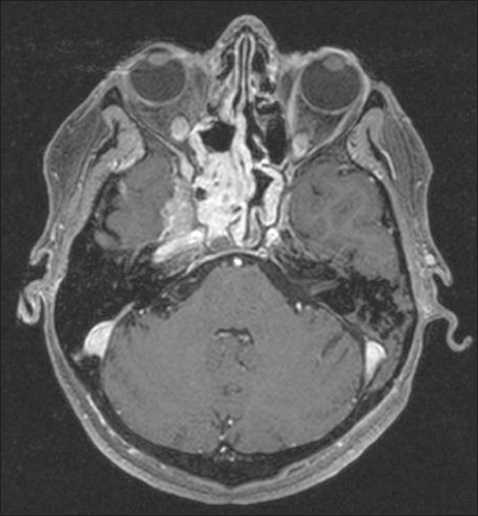
Рис. 11. Пациентка Б. МРТ головного мозга с контрастом, 12 мес после протонной терапии. Уменьшение объема опухоли до 50 %, структурные изменения в виде фиброза
среднюю. Дополнительную сложность при планировании создавало примыкание новообразования к критическим структурам: зрительным нервам, хиазме, слуховому нерву. Пациентка наблюдается в течение 1 года без признаков рецидива и поздних лучевых повреждений.
Клиническое наблюдение 3
Больная С., 1972 г.р., находилась на лечении в клинике МРНЦ им. Цыба в мае 2016 г. с диагнозом: Гемангиоперицитома краниоорбитальной области слева. Комбинированное лечение в 2000–2001 гг.: операция + лучевая терапия СОД 60 Гр. Рецидив в 2009 г.: стереотаксическая лучевая терапия 3 Фр × 8 Гр. Продолженный рост в 2013 г.: стереотаксическая лучевая терапия 5 Фр × 6 Гр. Продолженный рост в 2016 г.
Пациентка имела длительный анамнез рецидивирующей опухоли в области левой орбиты (рис. 12). Трижды была проведена радиотерапия, в том числе и в режиме гипофракционирования. Как было указано выше, даже вторые курсы облучения опухолей в области головного мозга являются практически единичными случаями. В этой связи данный случай является уникальным, так как в мировой литературе нам не удалось найти описание подобных клинических ситуаций.
При принятии решения о проведении четвертого курса облучения было принято во внимание удовлетворительное состояние местных тканей, отсутствие каких-либо признаков радионекроза, а также тот факт, что левый зрительный нерв был ранее уже поврежден, и зрение слева было утрачено. Несмотря на малый объем рецидивной
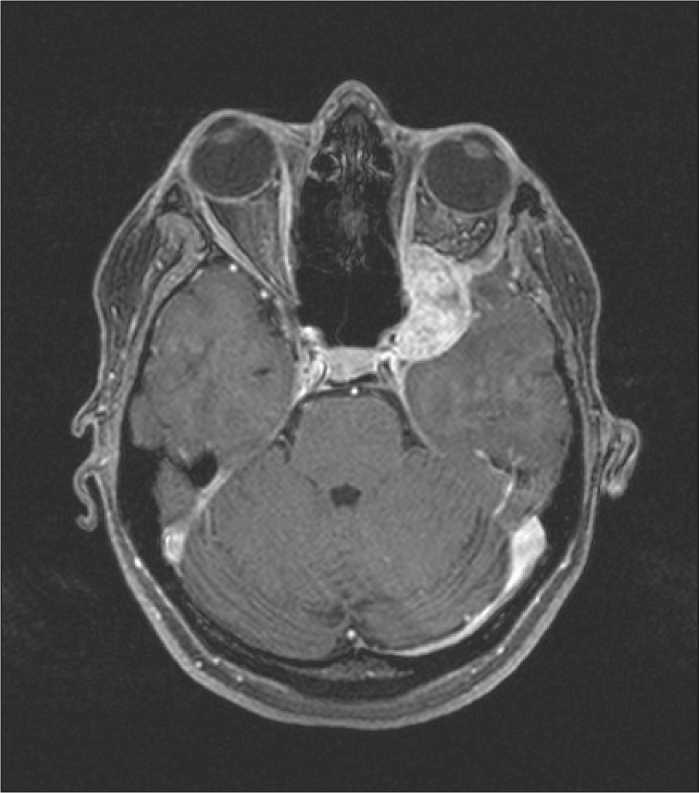
12. Пациентка C. МРТ головного мозга с контрастом перед протонной терапией. Солидное образование в области левой орбиты, размерами 2,5×2,0×2,7 см
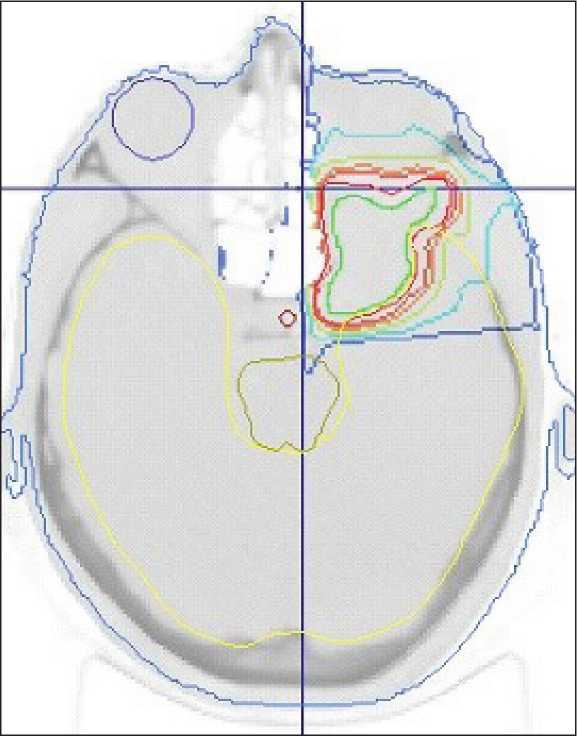
Рис. 13. Пациентка C. Дозное распределение при облучении активным сканирующим пучком протонов, 2 Гр-экв, 30 фракций. Отмечается высокая прецизионность и резкий спад дозы
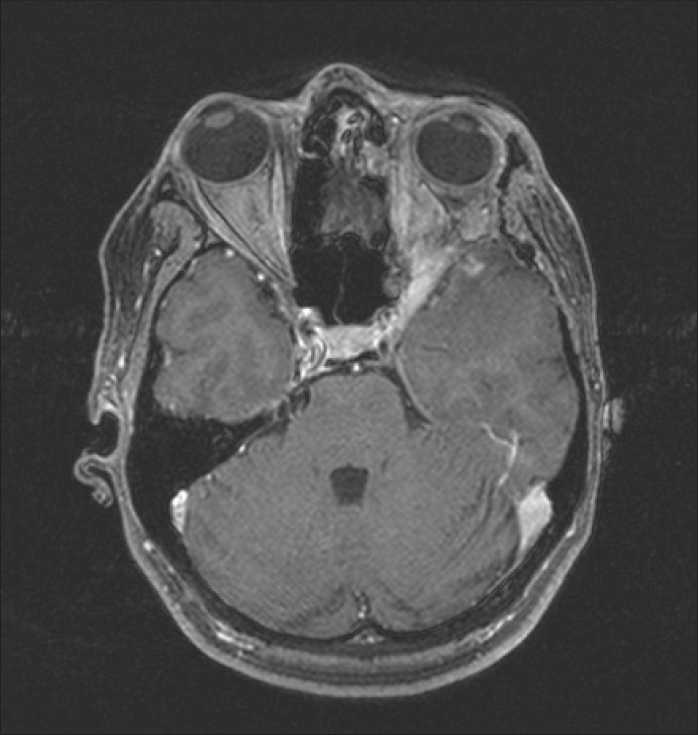
Рис. 14. Пациентка С. МРТ головного мозга с контрастом, 12 мес после протонной терапии. Уменьшение объема опухоли до 70 %
опухоли (Vptv=19 см3), учитывая предшествующие курсы лучевой терапии, было принято решение провести курс облучения в наименее токсичном режиме, по 2 Гр-экв., но до суммарной дозы в 60 Гр-экв. (рис. 13). На настоящий момент пациентка наблюдается в течение 12 мес. Достигнута значительная регрессия опухоли (рис. 14). Признаков постлучевых изменений не выявлено.
Современная протонная терапия с использованием активного сканирующего пучка, визуальным контролем положения мишени, фиксирующих приспособлений позволяет проводить эффективное и безопасное облучение локальных рецидивов интракраниальных опухолей, несмотря на топографоанатомические и радиобиологические сложности в данной области, при умеренном воздействии на окружающие структуры и минимальных рисках токсичности. Однако остается дискутабельным ряд вопросов, таких как критерии отбора пациентов,
Список литературы Повторное облучение интракраниальных опухолей активным сканирующим пучком протонов
- Langedijk J.A. Re-irradiation: new frontiers. Sprienger, 2011. 85-93
- NCCN Clinical practice guidelines in oncology. Central nervous system. Version 1.2016. National Comprehensive Cancer Network. 2016. 16
- Fogh S.E., Andrews D.W., Glass J., Curran W., Glass C., Champ C., Evans J.J., Hyslop T., Pequignot E., Downes B., Comber E., Maltenfort M., Dicker A.P., Werner-Wasik M. Hypofractionated stereotactic radiation therapy: an effective therapy for recurrent high-grade gliomas. J Clin Oncol. 2010 Jun 20; 28 (18): 3048-53. DOI: 10.1200/JCO.2009.25.6941
- Kong D.S., Lee J.I., Park K., Kim J.H., Lim D.H., Nam D.H. Efficacy of stereotactic radiosurgery as a salvage treatment for recurrent malignant gliomas. Cancer. 2008 May 1; 112 (9): 2046-51. 10.1002/ cncr.23402 DOI: 10.1002/cncr.23402
- Kohshi K., Yamamoto H., Nakahara A., Katoh T., Takagi M. Fractionated stereotactic radiotherapy using gamma unit after hyperbaric oxygenation on recurrent high-grade gliomas. J Neurooncol. 2007 May; 82 (3): 297-303


