Повышение адаптивного потенциала посевов сахарной свеклы микробными биопрепаратами в условиях биотических и абиотических стрессов
Автор: Пусенкова Л.И., Ильясова Е.Ю., Максимов И.В., Ласточкина О.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Микробные биопрепараты в защите и оздоровлении растений
Статья в выпуске: 1 т.50, 2015 года.
Бесплатный доступ
Заболевания, вызванные патогенными микромицетами, и воздействие гербицидов приводят к снижению продуктивности и качества корнеплодов у сахарной свеклы. К перспективным экологически безопасным агентам, применяемым для защиты растений от биотических и абиотических стрессов, относятся биопрепараты на основе Bacillus Cohn. Поиск таких биорегуляторов для целенаправленного и эффективного использования на сахарной свекле, основанный на выявлении механизмов их действия, остается актуальным. В представляемой работе изучено влияние бациллярных биопрепаратов фитоспорина-М, альбита и витаплана на структуру комплекса патогенных микромицетов в ризосфере сахарной свеклы Beta vulgaris L. (гибрид КВС), ферментативную активность в почве и листьях, накопление сахарозы в корнеплодах и их продуктивность на фоне патогенного и гербицидного прессинга. Оценку проводили с использованием классических микробиологических и физиолого-биохимических методов. Обнаружено, что обработка фитоспорином-М, альбитом и витапланом снижала обилие и частоту встречаемости патогенных видов в ризосфере и приводила к активизации полезной микрофлоры, о чем могут свидетельствовать данные об увеличении активности оксидоредуктаз и гидролаз в ризосфере корнеплодов. Так, в почве контрольных участков обнаружили 8 видов патогенных микромицетов, из которых доминирующими оказались Alternaria tenuis, Aspergillus niger и Penicillium glabrum (два последних - сильные токсинообразователи). После 1-кратной обработки фитоспорином-М патогенные грибы в ризосфере корнеплодов были представлены только видом Penicillium glabrum, альбитом - P. ci-trinum, витапланом - Alternaria tenuis, Aspergillus niger, Fusarium oxysporum, F. solani и Penicillium solitum, на участках, обработанных фитоспорином-М и альбитом, отсутствовали возбудители корнееда. После 2-кратной обработки обилие видов было в 1,5-3,0 раза меньше, а их частота - в 2,0-4,0 раза ниже, чем в контроле. Активность каталазы, отражающей интенсивность микробиологических процессов в почве, в проведенном эксперименте после 1-й обработки фитоспорином-М и альбитом превысила контроль соответственно в 1,4 и 3,7 раза, после 2-й - в 1,4 и 1,2 раза. В то же время в листьях наблюдалось снижение активности гидролаз и повышение активности их ингибиторов, что служит показателем индуцирования у растений защитных реакций против патогенов, причем максимальные значения регистрировались при обработках фитоспорином-М и альбитом. О протекторном действии биопрепаратов на растения свидетельствовали также данные об активации пероксидазы в листьях (до 0,175-0,250 ОЕ 490/г сырой массы). Следует отметить, что фитоспорин-М поддерживал сравнительно высокую активность этого фермента и после повторного внесения, что указывает на длительное действие биопрепарата на антиоксидантную систему в период вегетации. Результирующим показателем положительного влияния биопрепаратов в условиях патогенного и гербицидного прессинга послужили данные об увеличении продуктивности и сахаристости корнеплодов у обработанных растений, причем максимальный эффект был достигнут при 2-кратном применении фитоспорина-М.
Биопрепараты на основе bacillus cohn, оксидоредуктазы, гидролазы, пероксидаза, сахароза, патогенная микробиота, гербицидный прессинг, устойчивость, продуктивность
Короткий адрес: https://sciup.org/142133562
IDR: 142133562 | УДК: 635.112:631.559.2:632:579.64 | DOI: 10.15389/agrobiology.2015.1.115rus
Текст научной статьи Повышение адаптивного потенциала посевов сахарной свеклы микробными биопрепаратами в условиях биотических и абиотических стрессов
Работа поддержана грантом РФФИ 10-04-97025-р_поволжье_а.
и листьев (некротические пятнистости), возбудители которых впоследствии могут вызвать кагатные гнили (5, 6), а также повсеместное использование гербицидов в период вегетации растений (2). В связи с этим актуальным остается подбор различных экологически безопасных биорегуляторов, благотворно влияющих на фитосанитарное состояние посевов сахарной свеклы и повышающих степень гомеостатичности и толерантности растительной клетки в условиях стрессовых воздействий (2, 3).
По сравнению с химическими пестицидами микробные биопрепараты, используемые для оздоровления и защиты растений от неблагоприятных факторов окружающей среды, имеют ряд преимуществ, связанных с их экологической безопасностью и системным иммуномодулирующим действием (7-11). Помимо низкой токсичности, биопрепараты на основе живых бактериальных культур обладают полифункциональным эффектом, широким спектром действия в отношении различных растений и патогенов и имеют низкую стоимость (12, 13). По данным литературы, ассоциативные микроорганизмы выполняют комплекс функций, полезных для растения-хозяина: стимулируют рост и развитие растений (синтез гормонов, витаминов), способствуют биоконтролю патогенов (синтез антибиотиков, индукция системной устойчивости), а также повышают интенсивность ассимиляции корнями питательных веществ, содержащих азот, фосфор и калий (14-19). Взаимодействие с микробным сообществом ризосферы положительно влияет на растение, повышая его устойчивость к биотическим (15, 16, 20, 21) и абиотическим факторам внешней среды (22-26). В частности, известно, что биопрепараты на основе эндофитных бактерий Bacillus Cohn способствуют повышению адаптивного потенциала растений пшеницы при абиотических стрессах (22, 25, 27) и благотворно влияют на иммунитет растений (12, 20, 28, 29). Обработка растений биологическими препаратами штаммов симбиотических и эндофитных микроорганизмов с комплексом свойств, способствующих повышению микробного разнообразия ризосферы, служит перспективным способом повышения урожайности сельскохозяйственных культур (9, 13, 30, 31). Однако, несмотря на многочисленные работы, последовательность реакций устойчивости растений к стрессам, которую индуцируют бациллярные биопрепараты, до конца не выяснена и требует дальнейшего изучения. Кроме того, ограничены сведения и об их влиянии на растения сахарной свеклы в условиях различных стрессовых факторов, в частности патогенного и гербицидного прессинга, что затрудняет более эффективное использование уже существующих микробных биопрепаратов с целью целенаправленного управления устойчивостью растений.
Цель работы заключалась в оценке влияния биопрепаратов на основе Bacillus Cohn и их метаболитов на структуру комплекса патогенных микромицетов в ризосфере растений, ферментативную активность в почве и листьях, а также динамику накопления сахарозы в корнеплодах сахарной свеклы и их продуктивность в условиях воздействия патогенной микрофлоры почвы и гербицидов.
Методика. Полевые опыты проводили в 2010-2011 годах на посевах сахарной свеклы Beta vulgaris L. гибрида КВС (ООО «Сингента», Россия) в условиях Предуральской степной зоны Республики Башкортостан (ООО «Чишмы агроинвест»). Характеристика почвы опытного поля: выщелоченный чернозем, рН — 5,4, Hg — 5,64 мг-экв/100 г почвы, содержание гумуса 8,72 %, фосфора и калия — соответственно 24,8 и 30 мг/100 г почвы. Технология возделывания сахарной свеклы была одинаковой во всех вариан- тах опыта и соответствовала общепринятой для региона. Для защиты посевов от сорняков применяли 3-кратную обработку комплексом гербицидов лонтрел-300 (0,3 л/га; «Август», Россия), бетанал 22 (1,5 л/га; «Bayer CropScience», Россия), фюзилад форте (1 л/га; ООО «Сингента», Россия). Опыты закладывали в соответствии с методическими указаниями (32). Использовали биопрепараты фитоспорин-М (норма расхода 1 л/га, действующий агент — эндофитный штамм Bacillus subtilis 26Д; НВП «БашИн-ком», Россия), витаплан (40 г/га, смесь штаммов Bacillus subtilis; ЗАО «Агробиотехнология», Россия), альбит (40 мл/га; поли-р-гидроксимасляная кислота, продуцируемая почвенными бактериями Bacillus megaterium и Pseudomonas aureofaciens; ООО НПФ «Альбит», Россия). Препараты вносили в баковых смесях с гербицидами 2-кратно (в фазу 2-3 пар и 4-6 пар настоящих листьев, соответственно 1-я и 2-я обработка). В каждом варианте опыта площадь производственных участков — 0,5 га, повторность 3-кратная, площадь учетных делянок — 25 м2, повторность 4-кратная. Оценки проводили в фазы 2-3 и 6-8 пар настоящих листьев.
Выделение и количественный учет микроорганизмов на опытных участках выполняли согласно методике посева почвенной суспензии на плотные агаризованные среды (33). Виды микромицетов идентифицировали по определителям (34, 35). Видовые названия грибов уточняли по пополняемым опубликованным спискам в базе данных «Index fungorum» .
На 4-е и 10-е сут после начала эксперимента часть листьев опытных растений сахарной свеклы фиксировали в жидком азоте для последующих биохимических исследований. В условиях лаборатории образцы растирали в фарфоровых ступках в 0,05 М Na-фосфатном буфере (ФБ, рН 6,2) в соотношении 1:5 (масса/объем) и после экстракции белков в течение 60 мин при 4 ° С центрифугировали 10 мин при 15 000 g.
Активность пероксидазы в аликвотах определяли микрометодом. В лунки плоскодонных планшетов для иммуноанализа добавляли по 0,075 мл предварительно разбавленного в 0,01 М ФБ (соотношение объемов ферментного образца и ФБ 1:50) и 0,025 мл раствора о-фенилендиамина в концентрации 0,5 мг/мл. После внесения 0,025 мл 0,016 % Н2О2 развитие окраски останавливали через 2 мин добавлением 0,05 мл 4 н. H2SO4. Планшет сканировали при X = 490 нм на спектрофотометре IFA-Reader (Польша) (14). Активность гидролаз определяли в растительных экстрактах, полученных при гомогенизации материала в забуференном растворе (0,05 М Трис-HCl, рН 8,0, и 0,05 М NaCl) в течение 12 ч в соотношении 1:30 (масса навески, г/объем экстрагента, мл) при 4 °С. Активность протеаз учитывали с использованием желатиновых пластинок согласно рекомендациям (36). На поверхности желатиновой пластинки формировали слой агарозного геля, вырезали в нем лунки диаметром 5 мм, оплавляли их края и вносили по 50 мкл белкового экстракта. После окончания инкубации агарозный гель снимали и пластинку промывали проточной водой для удаления гидролизованных участков, которые после этого хорошо проявлялись на темном фоне в виде круглых светлых участков. По диаметру круга оценивали размер гидролизованного участка и пересчитывали активность по кривой стандартных растворов трипсина, предварительно раститрованных на той же пластинке. Нижний предел определения активности коммерческого препарата трипсина составил 0,5-1,0 мкг. Активность каталазы, дегидрогеназы, полифенолоксидазы, пероксидазы, протеазы и уреазы в почве из прилегающей к ризосфере зоны измеряли в экстрактах по методике, предложенной Ф.Х. Хазиевым (37), содержание сахарозы в корнеплодах сахарной свеклы — при помощи поляриметра (П161-М, Россия) методом холодного водного дигерирования (38).
Статистическую обработку полученных результатов проводили методом дисперсионного анализа (39). При математической обработке экспериментальных данных использовали программы Microsoft Excel. На гистограммах показаны средние значения и их стандартные отклонения.
Резуёътаты . Получение высоких урожаев сельскохозяйственных культур в значительной степени зависит как от агрохимического состояния почвы, так и от наличия в ней соответствующей микрофлоры (30). Так, под влиянием микробного сообщества в ризосфере растения повышается его устойчивость к биотическим (15) и к абиотическим стресс-факторам (8, 24), но при значительном количестве патогенных и условно патогенных видов микроорганизмов проявляется негативный эффект, связанный с развитием различных заболеваний, ведущих к снижению продуктивности и качества корнеплодов, а также к уменьшению сроков их хранения.
В последние годы отмечается значительное снижение продуктивности сахарной свеклы от заболеваний корневой системы (гнили) и листьев (некротические пятнистости), возбудители которых впоследствии могут вызвать кагатные гнили (4, 6). Работы по снижению потерь от болезней, в частности от корневых гнилей, при использовании биопрепаратов на основе микроорганизмов ведутся в настоящее время очень активно (2, 3, 6, 40), причем особое внимание уделяется изучению микробиологических процессов, протекающих в почве и в ризосфере растений. Интерес к ризосфере как зоне максимального сосредоточения и функциональной активности почвенных микроорганизмов при этом возрастает (30, 41, 42). Проведенное нами исследование влияния микробных биопрепаратов фи-тоспорина-М, витаплана и альбита на комплекс микромицетов в ризосфере сахарной свеклы показало, что в фазу 2-3 пар настоящих листьев из указанной почвенной зоны удавалось выделить до 38 видов микроскопических грибов, из которых 28 штаммов были идентифицированы как представители трех родов Aspergillus , Penicillium и Fusarium (соответственно 5, 20 и 3 штамма). Значительно менее представленными оказались роды Alternaria , Rhizopus и Trichoderma (табл. 1).
1. Изменение состава патогенной микобиоты в ризосфере корнеплодов сахарной свеклы Beta vulgaris L. (гибрид) КВС после обработки биопрепаратами на фоне применения гербицидов (ООО «Чишмы агроинвест», Республика Башкортостан, 2010-2011 годы)
|
Вид |
Обилие видов, ед/частота, % |
|||
|
контроль |
I фитоспорин-М |
альбит |
витаплан |
|
|
1-кратная обработка, фаза |
2-3 настоящих листьев |
|||
|
Alternaria tenuis Nees1 |
12,1/40 |
- |
- |
5,3/20 |
|
Aspergillus niger Tiegh.1 |
9,1/40 |
- |
- |
5,3/20 |
|
Aspergillus parvulus G. Sm.2 |
3,0/20 |
— |
- |
- |
|
Fusarium oxysporum var. Orthoceras Appel & Wollenw.2 |
6,1/40 |
- |
- |
5,3/20 |
|
Fusarium solani Appel2 |
- |
- |
- |
2,6/20 |
|
Fusarium solani var. agrillaceum 2 |
6,1/40 |
- |
- |
- |
|
Penicillium aurantiogriseum Dierckx1 |
15,2/80 |
- |
- |
- |
|
Penicillium glabrum Wehmer2 |
9,1/40 |
3,1/20 |
- |
- |
|
Penicillium citrinum Thom2 |
- |
- |
8,1/40 |
- |
|
Penicillium solitum var. crustosum Thom1 |
- |
- |
- |
2,6/20 |
|
Rhizopus microsporus Tiegh.2 |
6,1/20 |
- |
- |
- |
|
2 - кратная обработка, фаза |
6-8 настоящих листьев |
|||
|
Alternaria tenuis (Fr.) Keissl.1 |
7,0/40 |
5,9/20 |
- |
- |
|
Aspergillus flavus Link2 |
3,5/20 |
- |
- |
- |
|
Aspergillus niger Tiegh1 |
10,5/80 |
3,0/20 |
2,6/20 |
2,8/20 |
|
Fusarium oxysporum Schltdl.2 |
3,5/40 |
- |
- |
- |
|
Fusarium solani var. agrillaceum C. Booth2 |
7,0/60 |
5,9/20 |
- |
- |
Ïðîäîëæåíèå òàáëèöû 1
Penicillium aurantiogriseum Direckx.1 14,0/80 — 5,1/40 5,6/20
Penicillium. glabrum Wehmer2 19,3/100 — — —
Penicillium. solitum var. crustosum Thom1 — 3,0/20 — —
Примечание. Прочерки означают, что вид не обнаружен; 1 — возбудитель корнееда сахарной свеклы по классификации А.В. Корниенко (28), 2 — возбудитель кагатной гнили.
Как видно из представленных данных (см. табл. 1), в почве контрольных участков, не подвергавшихся воздействию биопрепаратов, обнаружили 8 видов патогенных микромицетов, из которых, согласно классификации А.В. Корниенко (5), 3 ( Penicillium aurantiogriseum , Alternaria tenuis , Aspergillus niger ) — возбудители корнееда сахарной свеклы, 5 ( Penicillium glabrum , Fusarium solani var. agrillaceum , F . oxysporum , Aspergillus parvulus , Rhizopus microsporus ) — возбудители болезней корневой системы (кагатная гниль). При этом доминирующими видами были Alternaria tenuis , Aspergillus niger и Penicillium glabrum . Отметим, что два последних — сильные ток-синообразователи: продуцируемые ими вещества могут приводить к ослаблению и последующей гибели растений и вызывать снижение качества корнеплодов (43).
Обработки растений сахарной свеклы биопрепаратами фитоспори-ном-М, альбитом и витапланом способствовали изменению видового состава микроскопических грибов в ризосфере сахарной свеклы. Так, после 1-кратной обработки растений фитоспорином-М видовой состав патогенных грибов в ризосфере корнеплодов был представлен всего одним видом — Penicillium glabrum, альбитом — P . citrinum, витапланом — 5 видами ( Alternaria tenuis , Aspergillus niger , Fusarium oxysporum , F . solani и Penicillium solitum ) (см. табл. 1). Важно также, что на участках, обработанных фитоспорином-М и альбитом, было выявлено отсутствие возбудителей корнееда.
Видовой состав микобиоты в ризосфере контрольных растений сахарной свеклы в фазу 6-8 листьев практически не изменился, за исключением появления вида Aspergillus flavus Link, вызывающего кагатную гниль (см. табл. 1). В то же время в образцах почвы после 2-кратной обработки посевов биопрепаратами альбит и витаплан выявлялись всего два возбудителя корнееда — Aspergillus niger и Penicillium aurantiogriseum , причем они встречались с частотой, которая оказалась в 4 раза меньше по сравнению с контролем. При обработке фитоспорином-М обнаружили трех возбудителей корнееда и одного — кагатной гнили. В этом варианте опыта обилие видов было в 1,5-3,0 раза меньше, а их частота — в 2,0-4,0 раза меньше, чем в контроле. Таким образом, обработки растений биопрепаратами снижали обилие видов и частоту встречаемости патогенных микромицетов в ризосфере сахарной свеклы.
Активация полезной микробиоты почвы под влиянием биопрепаратов, несомненно, приводит к изменениям биохимического состояния почвы, в частности ее ферментативной активности, что в значительной степени может отражаться на продуктивности растений (19). Ранее нами показано, что обработки растений сахарной свеклы биопрепаратами альбит и фитоспорин-М положительно влияли на активность оксидоредуктаз и гидролаз в ризосфере сахарной свеклы (42). Активность каталазы, отражающей интенсивность микробиологических процессов в почве, в проведенном эксперименте после 1-й обработки фитоспорином-М и альбитом превысила контроль соответственно в 1,4 и 3,7 раза, после 2-й — в 1,4 и 1,2 раза.
Обработки растений фитоспорином-М и витапланом стимулирова- ли развитие агрономически полезной микробиоты под посевами сахарной свеклы: увеличилось общее количество микроорганизмов, усваивающих органические формы азота, возросла численность микроорганизмов, разрушающих сложные полимерные соединения, а также азотфиксирующих бактерий (42). Полученные результаты согласуются с данными литературы о механизмах индукции продуктивных качеств растений под влиянием микроорганизмов (30, 44).
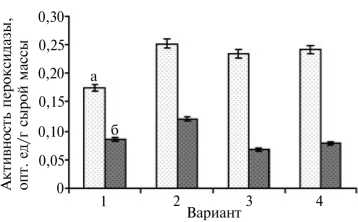
Динамика активности пероксидазы в листьях сахарной свеклы Beta vulgaris L. (гибрид КВС) при обработке растений биопрепаратами на фоне применения гербицидов: а — 1-я обработка, б — 2-я обработка (ООО «Чишмы агроинвест», Республика Башкортостан, 2010-2011 годы).
Известно, что в ответ на вредные воздействия в растениях развивается окислительный стресс, в нейтрализации которого важную роль играет пероксидаза (14, 16). Во всех вариантах обработка растений биопрепаратами достоверно активировала пероксидазу в листьях (рис.). Ранее подобное повышение активности пероксидазы под влиянием биопрепаратов мы отмечали у растений пшеницы и картофеля (12, 14). После повторного внесения биопрепаратов во всех образцах наблюдалось уменьшение активности пероксидазы, за исключением варианта с фитоспорином-М, где этот пока затель оставался повышенным по сравнению с контролем, что, вероятно, свидетельствует о длительном действии препарата на антиоксидантную систему растения.
У растений в формировании защитных механизмов против патогенов значительную роль играют гидролитические ферменты (протеазы, амилазы, пектиназы) и их ингибиторы. Ранее на модельных опытах с клубнями картофеля нами было показано, что продолжительная активация синтеза ингибиторов протеаз способствовала защите клубней картофеля, обработанных фитоспорином-М, от проникновения и развития патогенных микроорганизмов (36).
Обработка растений сахарной свеклы биопрепаратами снижала активность гидролаз в листьях (табл. 2) и, напротив, повышала активность их ингибиторов, что свидетельствует об индуцировании у растений защитных реакций против патогенов, при этом максимальные показатели регистрировали при обработках биопрепаратами фитоспорин-М и альбит.
2. Динамика активности гидролитических ферментов (ИЕ/г сырой массы) в листьях сахарной свеклы Beta vulgaris L. (гибрид КВС) при обработке биопрепаратами на фоне применения гербицидов ( X ± х , ООО «Чишмы агроинвест», Республика Башкортостан, 2010-2011 годы)
|
Вариант |
4-е сут после обработки |
10-е сут после обработки |
||||
|
протеаза |
| амилаза |
| пектиназа |
протеза |
| амилаза | |
пектиназа |
|
|
1-кратная обработка |
гербицидам |
и и биопрепаратами |
||||
|
Контроль |
6,43±0,23 |
7,12±0,14 |
4,46±0,12 |
6,67±0,10 |
8,22±0,11 |
5,76±0,24 |
|
Фитоспорин-М |
3,12±0,13 |
2,57±0,23 |
2,76±0,12 |
2,77±0,12 |
3,68±0,13 |
4,11±0,15 |
|
Альбит |
2,89±0,13 |
3,03±0,21 |
3,33±0,23 |
3,67±0,24 |
3,88±0,22 |
3,58±0,12 |
|
Витаплан |
3,67±0,14 |
3,43±0,12 |
3,86±0,21 |
3,21±0,11 |
3,76±0,10 |
3,34±0,21 |
|
2-кратная обработка |
гербицидам |
и и биопрепаратами |
||||
|
Контроль |
5,78±0,22 |
6,65±0,23 |
4,03±0,31 |
6,77±0,12 |
8,72±0,11 |
5,76±0,25 |
|
Фитоспорин-М |
3,23±0,10 |
3,21±0,12 |
3,03±0,32 |
2,77±0,19 |
3,68±0,22 |
3,21±0,17 |
|
Альбит |
3,43±0,09 |
2,67±0,14 |
2,78±0,22 |
3,57±0,12 |
3,58±0,24 |
3,58±0,21 |
|
Витаплан |
2,48±0,13 |
3,26±0,12 |
3,24±0,12 |
3,21±0,12 |
3,76±0,13 |
3,34±0,12 |
Результирующим показателем физиолого-биохимических и микро- биологических процессов в растениях за весь период вегетации служат показатели продуктивности и качества корнеплодов сахарной свеклы. Так, применение исследуемых биопрепаратов привело к увеличению урожайности корнеплодов на 1,6-5,0 т/га по сравнению с контролем и способствовало более интенсивному накоплению в них сахаристых веществ. В то время как к моменту уборки в контроле содержание сахарозы составляло 16,2 %, по вариантам опыта оно варьировало в пределах 17,0-18,8 %, причем максимальные показатели были получены при 2-кратной обработке посевов фитоспорином-М.
Итак, полученные данные свидетельствуют в пользу того, что биопрепараты на основе Bacillus Cohn и их метаболитов способствуют повышению урожайности и качества корнеплодов сахарной свеклы посредством корректировки состава микрофлоры в прикорневой зоне, в частности благодаря сокращению численности и видового разнообразия патогенных микромицетов, что, в свою очередь, снижает вероятность инфицирования растений возбудителями заболеваний корневой системы и листьев. Кроме того, важный вклад в формирование продуктивности и рост устойчивости растений к действию неблагоприятных факторов окружающей среды (в частности, к патогенному и гербицидному прессингу), вероятно, вносит усиление ферментативной активности как в ризосфере, так и в листьях сахарной свеклы, обусловленное влиянием биопрепаратов. В целом по результатам исследования можно заключить, что применение биопрепаратов фитоспорина-М, альбита и витаплана способствует снижению заболеваемости растений, повышению продуктивности и качества корнеплодов сахарной свеклы в условиях воздействия патогенных микромицетов и гербицидного прессинга. При этом положительный эффект наиболее выражен при применении фитоспорина-М, что позволяет рекомендовать его в технологиях интенсивного возделывания сахарной свеклы.
Список литературы Повышение адаптивного потенциала посевов сахарной свеклы микробными биопрепаратами в условиях биотических и абиотических стрессов
- Pathak A.D., Kapur R., Solomon S., Kumar R., Srivastava S., Singh P.R. Sugar beet: a historical percpective in Indian context. Sugar tech., 2014, 16(2): 125-132.
- Алехин В.Т., Рябчинская Т.А., Харченко Г.Л., Бобрешкова И.Ю., Саранцева Н.А. Разработка тактики применения фитоактиваторов на свекловичных полях. Сахарная свекла, 2010, 2: 16-22.
- Bargabus R.L., Zidack N.R., Sherwood J.W., Jacobsen B.J. Screening for the identification of potential biological control agents that induce systemic acquired resistance in sugar beet. Biol. Control, 2004, 30: 342-350.
- Collins D.P., Jacobsen B.J. Optimizing a Bacillus subtilis isolate for biological control of sugar beet cercospora leaf spot. Biol. Control, 2003, 26(2): 153-161.
- Корниенко А.В. Новая классификация патогенов сахарной свеклы. Агро XXI, 2006, 1-3: 25-29.
- Селиванова Г.А., Стогниенко О.И. Корневые гнили сахарной свеклы. Защита растений, 2010, 6: 16-17.
- Fravel D.R. Commercialization and implementation of biocontrol. Ann. Rev. Phytopathol., 2005, 43: 337-359.
- Цавкелова Е.А., Климова С.Ю., Чердынцева Т.А., Нетрусов А.И. Микроорганизмы -продуценты стимуляторов роста растений и их практическое применение. Прикладная биохимия и микробиология, 2006, 42(2): 133-143.
- Монастырский О.А., Першакова Т.В. Современные проблемы и решения создания биопрепаратов для защиты сельскохозяйственных культур от возбудителей болезней. Агро XXI, 2009, 7-9: 3-5.
- Perez-Garcia A., Romero D., de Vicente A. Plant protection and growth stimulation by microorganisms: biotechnological applications of Bacilli in agriculture. Curr. Opin. Biotechnol., 2011, 22: 187-193.
- Baysal O., Tor M. Smart biologics for crop protection in agricultural systems. Turk. J. Agric. For., 2014, 38: 723-731.
- Максимов И.В., Пусенкова Л.И., Абизгильдина Р.Р. Поствегетационное сохранение защитного потенциала в клубнях картофеля против патогенов биопрепаратами на основе эндофитной бактерии Bacillus subtilis 26. Агрохимия, 2011, 6: 43-48.
- Kaymak H.C. Potential of PGPR in agricultural innovations. Plant growth and health promoting bacteria. Microbiology Monograph, 2011, 18: 45-79.
- Максимов И.В., Абизгильдина Р.Р., Юсупова З.Р., Хайруллин Р.М. Влияние бактерий B. subtilis на содержание пероксида водорода и активность пероксидазы в растениях яровой пшеницы. Агрохимия, 2010, 1: 55-60.
- Whipps J.M. Microbial interactions and biocontrol in the rhizosphere. J. Exp. Bot., 2001, 52: 487-511.
- Шакирова Ф.М., Сахабутдинова А.Р. Сигнальная регуляция устойчивости растений к патогенам. Успехи современной биологии, 2003, 123(6): 563-572.
- Дахмуш А.С., Кожемяков А.П. Использование ассоциативных ризобактерий в улучшении плодородия почв и питания растений. Агрохимия, 2007, 1: 57-61.
- Кацы Е.И. Молекулярная генетика ассоциативного взаимодействия бактерий и растений. М., 2007.
- Мелентьев А.И. Аэробные спорообразующие бактерии Bacillus Cohn в агроэкосистемах. М., 2007.
- Кузьмина Л.Ю., Пахомова Т.Б., Максимов И.В. Эффективность бактерий Bacillus Cohn в защите пшеницы от гриба Septoria nodorum Berk. Агрохимия, 2012, 10: 39-45.
- Compant S., Duffy B., Clement C., Barka E.A. Use of plant growth promoting bacteria for biocontrol of plant diseases: principles, mechanisms of actions, and future prospects. Appl. Environ. Microbiol., 2005, 94: 4951-4959.
- Bochow H., El-Sayed S., Junge H., Stavropoulou A., Schmiedeknecht G. Use of Bacillus subtilis as biocontrol agent. IV. Salt-stress tolerance induction by Bacillus subtilis FZB24 seed treatment in tropical vegetable field crops, and its mode of action. J. Plant Dis. Protect., 2001, 108(1): 21-30.
- Архипова Т.Н., Мелентьев А.И., Веселов С.Ю., Кудоярова Г.Р. Влияние цитокининпродуцирующих микроорганизмов на устойчивость растений салата к токсическому действию кадмия. Агрохимия, 2004, 3: 69-73.
- Yang J., Klopper J.W., Ryu C.-M. Rhizosphere bacteria help plants tolerate abiotic stress. Trends Plant Sci., 2009, 14(1): 1-8.
- Хайруллин Р.М., Недорезков В.Д., Мубинов И.Г., Захарова Р.Ш. Повышение устойчивости пшеницы к абиотическим стрессам эндофитным штаммом Bacillus subtilis. Вестник Оренбургского государственного университета, 2007, 2: 129-134.
- Соколова М.Г., Акимова Г.П., Сотникова И.В., Нечаева Л.В. Эффективность внесения бактериальных препаратов под овощные культуры. Сибирский вестник сельскохозяйственной науки, 2009, 1: 25-29.
- Мубинов И.Г. Реакции пшеницы на действие клеток эндофитного штамма 26Д Bacillus subtilis -основы биофунгицида Фитоспорин. Канд. дис. Уфа, 2007.
- Jacobsen B.J., Zidack N.K., Larson B.J. The role of Bacillus-based biological control agents in integrated pest management systems: plant diseases. Phytopathology, 2004, 94: 1272-1275.
- Castillo H.F.D., Reyes C.F., Moralles G.G., Herrera R.R., Aguilar C. Biological control of root pathogens by plant-growth promoting Bacillus spp. Agricultural and Biological Sciences. Ch. 4. Weed and pest control -conventional and new challenges. Open access, 2013 ( ) DOI: 10.5772/54229
- Крафт А.В. Влияние эффективных микроорганизмов на микробное сообщество чернозема выщелоченного и продуктивность сахарной свеклы. Канд. дис. Рамонь, 2004.
- Kumar A., Prakash A., Johri B.N. Bacillus as PGPR in crop ecosystem. In: Bacteria in agrobiology: crop ecosystems/D.K. Maheshwari (ed.). Berlin, Springer, 2011: 37-59.
- Методические указания по регистрационным испытаниям фунгицидов в сельском хозяйстве. СПб, 2009.
- Мифтахова А.М., Киреева Н.А., Бакаева М.Д. Экология почвенных микромицетов. Уфа, 2005.
- Билай В.И. Фузарии. Киев, 1977.
- Билай В.И., Коваль Э.З. Аспергиллы. Киев, 1988.
- Ибрагимов Р.И. Белковые ингибиторы протеолитических ферментов и их роль в формировании гомеостатических реакций у растений. Автореф. докт. дис. Уфа, 1999.
- Хазиев Ф.Х. Методы почвенной энзимологии. М., 2005.
- Методика определения химического состава и показателей качества сахарной свеклы. Курск, 2001.
- Доспехов Б.А. Методика полевого опыта. М., 1979.
- Злотников А.К. Разработка и комплексная характеристика полифункционального препарата Альбит для защиты растений от болезней и стрессов. Автореф. докт. дис. Воронеж, 2012.
- Широких А.А., Мерзаев О.В., Широких И.Г. Методические подходы к изучению микроорганизмов прикорневой зоны растений. Сельскохозяйственная биология, 2007, 1: 43-55.
- Пусенкова Л.И., Ильясова Е.Ю., Киреева Н.А. Влияние биопрепаратов на биологическую активность почвы и продуктивность сахарной свеклы. Агрохимия, 2012, 10: 20-26.
- Берестецкий О.А. Фитотоксины почвенных микроорганизмов и их экологическая роль. В сб.: Фитотоксические свойства почвенных микроорганизмов. Л., 1978: 7-30.
- Завалин А.А. Биопрепараты, удобрения и урожай. М., 2005.


