Повышение активности ферментов пуринового обмена как один из факторов патогенеза злокачественных новообразований прямой кишки
Автор: Зуйков С.А., Полунин Г.Е.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.22, 2023 года.
Бесплатный доступ
Цель исследования - изучить изменения активностей ферментов распада пуриновых нуклеозидов -аденозиндезаминазы (АДА) и ксантиноксидазы (КО) у больных раком прямой кишки (РПК). Материал и методы. Исследование изучаемых показателей проводили в плазме крови и гомогенатах тканей: опухолевой ткани и нетрансформированной слизистой оболочке прямой кишки у 70 больных РПК I-IV стадии. Гистологической формой РПК являлась аденокарцинома. Показателем метаболизма пуриновых нуклеозидов послужило определение активностей ферментов АДА и КО. Методом исследования ферментативных активностей была спектрофотометрия. Результаты. У больных РПК в плазме крови установлено статистически значимое повышение активностей ферментов катаболизма пуринов АДА и КО по сравнению со здоровыми людьми. Также установлено достоверное повышение активностей АДА и КО в ткани опухоли относительно нетрансформированной ткани. Выявлены взаимосвязи между активностями ферментов катаболизма пуринов в плазме крови и в тканях. Обнаружено повышение катаболизма пуринов в зависимости от стадии РПК. Выводы. Установленное повышение активностей АДА и КО свидетельствует об усилении катаболизма пуринов не только при злокачественной трансформации, но и при опухолевой прогрессии, что, в свою очередь, носит системный характер.
Аденозиндезаминаза, ксантиноксидаза, пуриновый обмен, рак прямой кишки, плазма крови, гомогенат тканей
Короткий адрес: https://sciup.org/140297848
IDR: 140297848 | УДК: 616.351-006.6-088.9-092 | DOI: 10.21294/1814-4861-2023-22-1-95-100
Текст научной статьи Повышение активности ферментов пуринового обмена как один из факторов патогенеза злокачественных новообразований прямой кишки
Число больных со злокачественными новообразованиями (ЗНО) увеличивается во всем мире. Заболеваемость ЗНО выше в развитых странах, в РФ данный показатель за 10 лет вырос почти на 23 %, что связано не только с ростом заболеваемости, но и с большей доступностью диагностики [1]. По данным ВОЗ, заболеваемость раком прямой кишки (РПК) составляет 1,93 млн случаев, причем РПК находится на втором месте в списке ЗНО с наиболее распространенными причинами смерти от онкологических заболеваний, составляя 935 000 случаев [2]. В 2020 г. в РФ РПК был выявлен у 25–30 тыс. пациентов, при этом треть случаев РПК определяется посмертно [3]. Одной из основных причин летальности этих больных является поздняя диагностика из-за страха обратиться за медицинской помощью, что в последние годы также обусловлено опасением заразиться COVID-19 при обращении в медицинское учреждение. В связи с распространением COVID-19 онкологическим службам приходилось работать в сложных условиях, были ограничены возможности скрининга, приостановлена диспансеризация определенных групп взрослого населения, увеличена нагрузка на систему оказания онкологической помощи, что привело к снижению выявляемости всех ЗНО [4].
Долгосрочное снижение смертности при РПК обусловлено как очевидным прогрессом в диагностике, так и совершенствованием технологий лечения. Однако биология ЗНО различна и не предсказуема. С одной стороны, назначая противоопухолевые препараты, мы изменяем природу заболевания, «выключая» агрессивный потенциал опухоли, с другой – в ответ на системную терапию опухоль активирует различные механизмы защиты, включая мутации, которые вначале необходимо обнаружить, а затем разработать к ним новые таргетные препараты [5].
Патогенез изменений слизистой оболочки прямой кишки, который может привести к развитию рака, является сложным и многофакторным процессом. Для больных РПК характерной патофизиологической чертой является отсутствие нормального снабжения тканей кислородом, что вызывает гипоксические явления различной выраженности, с последующим нарушением утилизации кислорода и усиленной генерацией свободных радикалов (СР), а также ряд метаболических нарушений в нуклеотидном, углеводном и энергетическом обменах, тесно связанных между собой [6].
Одна из основных задач фундаментальных и клинических исследований сводится к изучению биологии канцерогенеза и выявлению новых маркеров для ранней диагностики ЗНО. Известно, что изменения состояния ключевых ферментов катаболизма пуриновых нуклеозидов – аденозин-дезаминазы (АДА, КФ 3.5.4.4) и ксантиноксидазы (КО, КФ 1.17.3.2) ‒ являются характерной чертой быстрорастущих тканей [7, 8], при этом в ходе КО реакции происходит генерация супероксид-анион радикала (O2 - ), способствующая окислительной модификации липидов, белков и нуклеиновых кислот, в то же время мочевая кислота как продукт данной реакции является сильнейшим антиоксидантом [9]. Данный двойственный эффект может играть важную роль в патогенезе опухолевого роста при РПК. Аденозин – субстрат АДА, вызывает фрагментацию ядра и конденсацию хроматина, таким образом участвуя в апоптозе, а также является мощнейшим регулятором оксигенации тканей [10]. Соответственно, изменения пуринового обмена могут быть обусловлены репарационными процессами, а также быть ключевым этапом в развитии онкологической патологии, стимулируемой действием СР.
Цель исследования ‒ изучить изменения активностей ферментов распада пуриновых нуклеозидов АДА и КО у больных РПК.
Материал и методы
Оценку показателей проводили в плазме крови и гомогенатах тканей: опухолевой ткани и нетранс-формированной слизистой оболочке прямой кишки (СОПК), под которой понимали ткань края резекции, отдаленную от опухоли (min 30 мм от опухолевого инфильтрата) и не имеющую гистологических и морфологических признаков злокачественной трансформации. Обследовано 70 больных РПК I–IV стадии. Гистологической формой РПК являлась аденокарцинома. Возраст больных – от 40 до 80 лет, из них 48 мужчин и 22 женщины. Материал для исследования был взят после операции. Для изучения метаболизма пуринов в зависимости от тяжести процесса больные были разделены на 2 группы с различной стадией РПК. Первую группу составили 26 пациентов с неметастатическим РПК (I–II стадия), вторую группу – 44 больных РПК с наличием метастазов (III–IV стадия). При статистическом анализе нами не обнаружено достоверных отличий по гендерному признаку ни для одного из изученных показателей. Группу контроля составили 80 здоровых добровольцев (52 мужчи- ны и 28 женщин) того же возраста, не имеющих ЗНО и тяжелой патологии желудочно-кишечного тракта. О состоянии их здоровья судили по данным анамнеза, медицинского осмотра и медицинской документации.
Изучена активность ферментов распада пуриновых нуклеозидов АДА, который является признанным фактором роста и компонентом системы СР окисления, и КО – общеизвестного генератора СР в клетке. Активность АДА определяли по изменению оптической плотности реакционной смеси при длине волны 265 нм, обусловленному накоплением инозина при гидролитическом распаде аденозина, и выражали в нмоль/(мин×мг) [11]. Определение активности КО (в мкмоль/(мин×мг)) основано на способности фермента генерировать O2 - , о содержании которого судили по скорости восстановления нитросинего тетразолия в фор-мазан [12]. Определение общего белка проводили в соответствии с методикой, описанной Лоури [13]. Определение всех исследуемых показателей проводилось спектрофотометрически и регистрировалось на спектрофотометре Specord200 (Германия).
Статистическая обработка данных проводилась с помощью программы «Statistica 10.0» Statsoft, USA. Перед оценкой значимости различий исследуемых показателей в зависимости от возраста провели проверку распределения исследуемых групп на нормальность, с использованием критерия Шапиро–Уилка. Оценка значимости различий показателей пуринового обмена в плазме крови и гомогенатах тканей больных РПК в зависимости от стадии проводилась непарным критерием Стьюдента. Корреляционный анализ на выявление взаимосвязи между ферментами пуринового обмена в плазме крови и тканях больных проводился с помощью корреляции Пирсона. Результаты статистического анализа представлены в виде среднего значения и стандартного отклонения (М ± σ).
Все исследования проводились у больных, предварительно детально ознакомленных с задачами исследования, программой лечебно-диагностических мероприятий и давших свое письменное, информированное согласие на отборы проб, которые осуществлялись под непосредственным контролем лечащих врачей. Исследование соответствует этическим принципам клинических испытаний и положениям Хельсинкской декларации Всемирной медицинской ассоциации, не нарушает интересы пациента и не вредит его здоровью (Комиссия по биоэтике ГОО ВПО «Донецкого национального медицинского университета им. М. Горького»).
Результаты и обсуждение
У больных РПК по сравнению со здоровыми добровольцами в плазме крови установлено значимое повышение активностей ферментов пуринового обмена. Активность АДА составила 6,03 ± 1,7 vs
2,45 ± 0,54 нмоль/мин×мг, активность КО ‒ 0,91 ± ± 0,34 vs 0,34 ± 0,14 мкмоль/мин×мг соответственно (р˂0,001). При сравнительном анализе изменения активностей АДА и КО у больных РПК между опухолевыми и нетрансформированными тканями СОПК выявлено значимое повышение активностей ферментов пуринового обмена в опухолевой ткани относительно ткани СОПК – активность АДА равнялась 22,6 ± 4,19 vs 12,8 ± 1,92 нмоль/мин×мг, активность КО – 6,90 ± 1,30 vs 3,76 ± 0,56 мкмоль/ мин×мг соответственно (р˂0,001).
Известно, что изменения содержания некоторых метаболитов в плазме крови отражают их метаболизм в тканях [14]. Следовательно, можно предположить, что изменение активностей этих ферментов в плазме крови отражает их тканевой метаболизм. Для подтверждения этого предположения мы провели статистический анализ на выявление корреляционной зависимости между активностями ферментов пуринового обмена в опухолевой ткани и плазме крови, в ткани опухоли и нетрансформированной СОПК. Нами установлена тесная взаимосвязь между ферментами в ткани опухоли и плазме крови: для АДА (r=0,88, р˂0,001) и КО (r=0,73, р˂0,001) (рис. 1), а также между ферментативными активностями в ткани опухоли и нетрансформированной СОПК: у АДА (r=0,84, р˂0,001), для КО (r=0,67, р˂0,001) (рис. 2).
Исходя из полученных результатов, можно предположить, что плазма крови выступает своеобразным «зеркалом» метаболизма пуринов в тканях в условиях патологии, а обнаруженные взаимосвязи между нетрансформированной и опухолевой тканью позволяют судить о системности опухолевого процесса. Повышение активностей ферментов пуринового обмена в плазме крови может выступать не только как показатель деструкции клеточных мембран опухолевой ткани (тем более что в опухоли АДА и КО повышены по сравнению с нетрансформированными тканями), что согласуется с известными данными о повышении проницаемости мембран злокачественных клеток и выходе тканевых белков методом пиноци-тоза, но и свидетельствует о системности процесса злокачественной трансформации.
Сравнив изменения активностей ферментов пуринового обмена (АДА и КО) в плазме крови у больных РПК с различной стадией заболевания и у здоровых людей, установили, что у больных РПК I–II стадии по сравнению со здоровыми людьми активность АДА составила 4,18 ± 0,39 vs 2,45 ± 0,54 нмоль/мин×мг, активность КО – 0,61 ± 0,09 vs 0,34 ± 0,14 мкмоль/мин×мг соответственно (р˂0,001). У больных РПК III–IV стадии активность АДА составила 7,13 ± 1,13 vs 2,45 ± ± 0,54 нмоль/мин×мг, КО – 1,09 ± 0,31 vs 0,34 ± ± 0,14 мкмоль/мин×мг соответственно (р˂0,001). Следовательно, у больных РПК без метастазов по сравнению со здоровыми людьми активность фер-
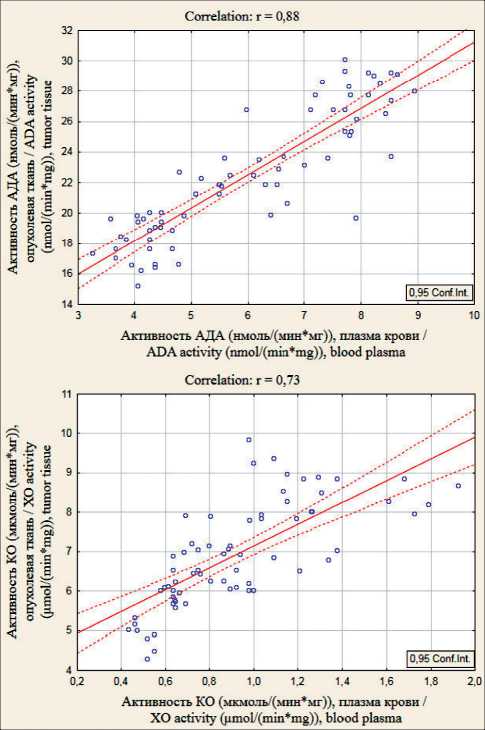
Рис. 1. Взаимозависимость активностей ферментов пуринового обмена в ткани опухоли и плазме крови у больных РПК, значение коэффициента корреляции статистически достоверно при р˂0,001
Fig. 1. Relationship between the activities of purine metabolism enzymes in tumor tissue and blood plasma of patients with RC; the value of the correlation coefficient is statistically significant at р˂0.001
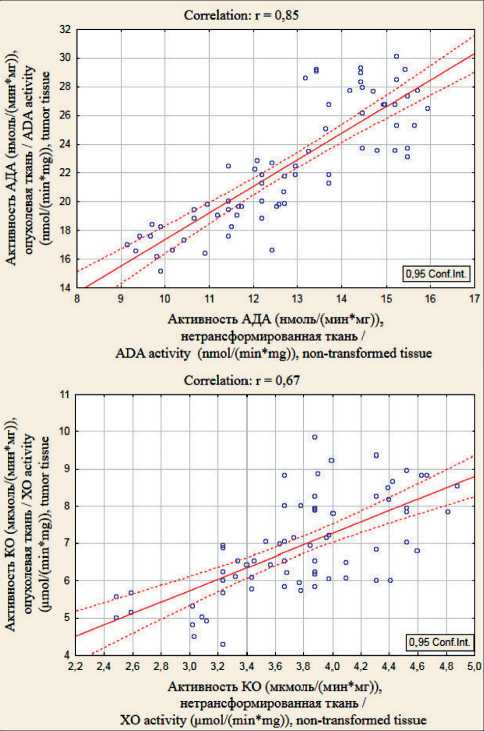
Рис. 2. Взаимозависимость активностей ферментов пуринового обмена в ткани опухоли и нетрансформированной ткани у больных РПК, значение коэффициента корреляции статистически достоверно при р˂0,001
Fig. 2. Relationship between the activities of purine metabolism enzymes in the tumor and normal tissues in patients with RC, the value of the correlation coefficient is statistically significant at р˂0.001
ментов пуринового обмена в плазме крови выше в 1,7 раза для АДА и 1,8 раза для КО, у больных с наличием метастазов АДА выше в 2,9 раза, КО – в 3,2 раза.
Затем у больных РПК мы сравнили изменения активностей ферментов в зависимости от тяжести патологического процесса в плазме крови и гомогенатах опухолевых тканей, установив статистически значимое повышение активностей ключевых ферментов распада пуринов во всех исследуемых образцах. Так, активность АДА в плазме крови больных РПК III–IV стадии была на 41,4 % (р˂0,001) выше, чем в группе с I‒II стадией, активность КО выше на 44,3 % (р˂0,001) соответственно.
В опухолевых тканях активность АДА у больных РПК III–IV стадии была на 27,7 % (р˂0,001) выше по сравнению с больными РПК I–II стадии, тогда как активность КО у пациентов с III–IV стадией была выше на 25 % (р˂0,05), чем в группе больных РПК I–II стадии (рис. 3).
Известно, что в опухолевых клетках происходит интенсификация гликолитического окисления глюкозы и усиливается скорость метаболизма нуклеотидов с последующим накоплением аденозина. При этом аденозин является регуляторной молекулой и в зависимости от факторов, стимулирующих повышение его в клетке, по-разному может оказывать свои биологические эффекты, одним из которых является стимуляция ангиогенеза для роста опухоли. Однако аденозин еще и выступает стимулятором экспрессии апоптогенных белков и ферментативных антиоксидантов, что, в свою очередь, будет препятствовать росту опухоли и ее метастазированию [15–17]. Следовательно, в опухоли работает тонкий механизм регуляции уровня аденозина за счет стимуляции активности ферментов катаболизма этой молекулы (АДА и КО), что способствует увеличению уровня O2 - , который в условиях канцерогенеза запускает процессы, направленные на поддержание жизнедеятельности

Рис. 3. Изменение активностей АДА и КО в ткани опухоли и плазме крови у больных РПК в зависимости от стадии (М ± σ) Fig. 3. Changes in the activities of ADA and XO in tumor tissue and blood in RC patients depending on the stage (M ± σ)
клетки, способствуя стимуляции экспрессии АДА и КО, тем самым замыкая порочный круг опухолевой прогрессии.
Полученные результаты показывают, что активности ферментов катаболизма пуриновых нуклеозидов АДА и КО в тканях и в плазме крови зависят от тяжести онкологического процесса и выражены у больных с метастатическим РПК. Следовательно, повышение активностей этих ферментов в плазме может служить фактором плохого прогноза при РПК.
Заключение
Установленное нами повышение активностей ферментов пуринового обмена происходит не только при злокачественной трансформации, но и при опухолевой прогрессии, что носит системный характер. При этом изменение активностей АДА и КО в плазме крови отражает метаболизм пуринов в тканях, что свидетельствует о возможной оценке состояния активности внутритканевых ферментов по показателям изменения их активности в плазме крови и прогностической роли последних при РПК. Следовательно, изменение активности данных ферментов, возможно, выступает как неспецифический маркер онкологических заболеваний желудочно-кишечного тракта и является показателем распространенности РПК. Дальнейшее изучение этой проблемы необходимо для совершенствования методов диагностики с учетом сведений о биологических особенностях РПК.
Список литературы Повышение активности ферментов пуринового обмена как один из факторов патогенеза злокачественных новообразований прямой кишки
- Kaprin A.D., Starinskii V.V., Shakhzadova A.O. Zlokachestvennye novoobrazovaniya v Rossii v 2019 godu (zabolevaemost' i smertnost'). M., 2020. 252 s.
- Rak. Vsemirnaya organizatsiya zdravookhraneniya URL: https://www.who.int/ru/news-room/fact-sheets/detail/cancer. [cited 2022 Apr 1].
- Dubovichenko D.M., Val'kov M.Yu., Merabishvili V.M., Karpunov A.A., Shcherbakov A.M., Val'kova L.E., Pankrat'eva A.Yu. Epidemiologicheskaya otsenka vyzhivaemosti pri rake pryamoi kishki: obzor literatury i sobstvennoe issledovanie. Voprosy onkologii. 2020; 66(1): 36-41. https://doi.org/10.37469/0507-3758-2020-66-1-36-41.
- Kaprin A.D., Gameeva E.V., Polyakov A.A., Kornietskaya A.L., Rubtsova N.A., Fedenko A.A. Vliyanie pandemii COVID-19 na onkologicheskuyu praktiku. Sibirskii onkologicheskii zhurnal. 2020; 19(3): 5-22. https://doi.org/10.21294/1814-4861-2020-19-3-5-22.
- Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020; 70(1): 7-30. https://doi.org/10.3322/caac.21590.
- Camici M., Garcia-Gil M., Pesi R., Allegrini S., Tozzi M.G. PurineMetabolising Enzymes and Apoptosis in Cancer. Cancers (Basel). 2019; 11(9): 1354. https://doi.org/10.3390/cancers11091354.
- Battelli M.G., Polito L., Bortolotti M., Bolognesi A. Xanthine oxidoreductase in cancer: more than a differentiation marker. Cancer Med. 2016; 5(3): 546-57. https://doi.org/10.1002/cam4.601.
- Wang L., Londono L.M., Cowell J., Saatci O., Aras M., Ersan P.G., Serra S., Pei H., Clift R., Zhao Q., Phan K.B., Huang L., LaBarre M.J., Li X., Shepard H.M., Deaglio S., Linden J., Thanos C.D., Sahin O., Cekic C. Targeting Adenosine with Adenosine Deaminase 2 to Inhibit Growth of Solid Tumors. Cancer Res. 2021; 81(12): 3319-32. https://doi.org/10.1158/00085472.CAN-21-0340.
- Liu D., Yun Y., Yang D., Hu X., Dong X., Zhang N., Zhang L., Yin H., Duan W. What Is the Biological Function of Uric Acid? An Antioxidant for Neural Protection or a Biomarker for Cell Death. Disease Markers. 2019; 31: 1-9. https://doi.org/10.1155/2019/4081962.
- Allard B., Allard D., Buisseret L., Stagg J. The adenosine pathway in immuno-oncology. Nat Rev Clin Oncol. 2020; 17(10): 611-29. https://doi.org/10.1038/s41571-020-0382-2. Epub 2020 Jun 8. Erratum in: Nat Rev Clin Oncol. 2020.
- Tritsch G.L. Validity of the continuous spectrophotometric assay of Kalckar for adenosine deaminase activity. Anal Biochem. 1983; 129(1): 207-9. https://doi.org/10.1016/0003-2697(83)90070-2.
- Karpishchenko A.I., Alipov A.N., Alekseev V.V. Meditsinskie laboratornye tekhnologii: rukovodstvo po klinicheskoi laboratornoi diagnostike. M., 2013.
- Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with the Folin phenol reagent. J Biol Chem. 1951; 193(1): 265-75.
- Kuo T., Kim-Muller J.Y., McGraw T.E., Accili D. Altered Plasma Profile of Antioxidant Proteins as an Early Correlate of Pancreatic β Cell Dysfunction. J Biol Chem. 2016; 291(18): 9648-56. https://doi.org/10.1074/jbc.M115.702183.
- Eisenstein A., Chitalia S.V., Ravid K. Bone Marrow and Adipose Tissue Adenosine Receptors Effect on Osteogenesis and Adipogenesis. Int J Mol Sci. 2020; 21(20): 7470. https://doi.org/10.3390/ijms21207470.
- Zhou R., Zhang S., Gu X., Ge Y., Zhong D., Zhou Y., Tang L., Liu X.L., Chen J.F. Adenosine A2A receptor antagonists act at the hyperoxic phase to confer protection against retinopathy. Molecular Medicine. 2018; 24(41): 1-13. https://doi.org/10.1186/s10020-018-0038-1.
- Vigano S., Alatzoglou D., Irving M., Ménétrier-Caux C., Caux C., Romero P., Coukos G. Targeting Adenosine in Cancer Immunotherapy to Enhance T-Cell Function. Front. Immunol. 2019; 10: 925. https://doi.org/10.3389/fimmu.2019.00925.


