Повышение антигенной активности инактивированной вакцины против инфекционного бронхита кур из вариантного изолята
Автор: Дубовой А.С., Самусева Г.Н.
Журнал: Теория и практика современной науки @modern-j
Рубрика: Основной раздел
Статья в выпуске: 1 (19), 2017 года.
Бесплатный доступ
Цель работы - изучение антигенных свойств инактивированной эмульгированной вакцины против инфекционного бронхита кур (ИБК) из вариантного изолята, в водную фракцию которой добавлена гидроокись алюминия (ГОА), как дополнительного адъюванта. Проведенное сравнительное изучение антигенных свойств вакцины против ИБК инактивированной эмульгированной, изготовленной на базе масляного адъюванта (МА), и аналогичной, но содержащей ГОА в составе водной фракции, показало увеличение иммунного ответа, индуцируемое МА и ГОА при их сочетанном применении.
Инфекционный бронхит, изолят, вариантный штамм, инактивированная вакцина, гидроокись алюминия
Короткий адрес: https://sciup.org/140270022
IDR: 140270022
Текст научной статьи Повышение антигенной активности инактивированной вакцины против инфекционного бронхита кур из вариантного изолята
Инфекционный бронхит кур (ИБК) - высококонтагиозная болезнь, проявляющаяся поражением респираторного тракта, а также мочеполовой системы птиц [2,8]. Экономический ущерб, причиняемый ИБК, складывается из убытков от гибели и вынужденной выбраковки птицы, длительного снижения яйценоскости у кур, снижения качества инкубационных и пищевых яиц, затрат на препараты, а также за счет снижения качества мясной продукции. Возбудитель ИБК - РНК-содержащий вирус, принадлежащий к семейству Coronaviridae. К вирусу ИБК восприимчивы куры всех возрастных групп. В настоящее время заболевание широко распространено практически во всех странах с развитым птицеводством [8,11].
Вирусу ИБК свойственна высокая генетическая изменчивость в результате накопления точечных мутаций, инсерций и делеций и рекомбинации [10,12]. Возникающие вариантные штаммы вируса ИБК зачастую становятся причиной поражения птицепоголовья, вакцинированного классическими вакцинными штаммами, принадлежащими к серотипу Массачусетс, которые обеспечивают лишь частичную защиту от заражения вариантными вирусами ИБК [1,9,12] Исследования показали, что во многих странах циркулируют различные вариантные штаммы вируса ИБК [11]. Вакцинация птиц одним серотипом не гарантирует полной защиты от гетерологичных штаммов вируса ИБК, однако было показано, что использование вакцин из комбинаций классического и вариантного штаммов дает возможность обеспечить высокую защиту [6,13,18]. Многие исследователи считают наиболее эффективным применение комбинации вакцинных штаммов, относящихся к генотипам Массачусетс и
793В. Для профилактики ИБК в России и за рубежом получили распространение живые и инактивированные вакцины.
При изготовлении инактивированных вакцин широко применяются адъюванты, позволяющие значительно повышать иммуногенную и антигенную активность препаратов, а также увеличивать продолжительность иммунного ответа. Адъюванты - вещества различного происхождения и различной химической природы, оказывающие неспецифическое стимулирующее действие на иммунный ответ при совместном их применении со специфическими антигенами. Известно большое количество веществ, имеющих различный химический состав и происхождение, которые способны оказывать адъювантное действие [5, 16]. Механизм адъювантного действия во многом еще остается невыясненным. В настоящее время установлено, что адъюванты взаимодействуют с наиболее важными антигенпрезентирующими клетками (макрофагами, клетками Лангерганса, дендритными клетками) и эффекторными клетками (плазматическими клетками, естественными киллерами), Т-хелперами и клетками воспаления (полиморфно-ядерными базофилами, эозинофилами) [10, 15, 16, 17]. Анализ литературных данных показывает, что в настоящее время интенсивно проводятся исследования, направленные на разработку новых и улучшение существующих адъювантных систем.
Цель данной работы - изучение антигенных свойств инактивированной вакцины против инфекционного бронхита кур (ИБК) из вариантного изолята, изготовленной на основе комбинации масляного адъюванта (МА) и гидроокиси алюминия (ГОА).
В работе были использованы СПФ-эмбрионы кур 9 суточного срока инкубации, выделенный ранее нами изолят вариантного вируса ИБК, по анализу последовательности фрагмента гена S1 имеющий 98% гомологии со щтаммами и изолятами серотипа 793/В. Эмбрионы заражали инокуляцией вирусного материала в аллантоисную полость объемом 0,2 см3. Инкубацию инфицированных эмбрионов проводили при 37°C и относительной влажности
60-70% в течение 72 часов. Биологическую активность собранного вируссодержащего материала определяли титрованием на развивающихся СПФ-эмбрионах кур. Титр вируса рассчитывали методом Кербера в модификации Ашмарина. Титр вирусного материала составил 107,45 ЭИД 50/см 3.
Инактивацию вируссодержащего материала проводили теотропином (1,8,3,6-диэндометилен-1,3,6,8-тетраазациклодекан) - конечная концентрация препарата 0,15%, время инкубации 36 часов, температура инкубации (37,0±0,5)0С. Контроль полноты инактивации осуществляли методом трех последовательных пассажей на развивающихся эмбрионах кур. Из полученного инактивированного материала изготовили два образца инактивированной эмульгированной вакцины, которые отличались между собой тем, что в водную фракцию первой вакцины добавили ГОА в конечной концентрации 0,2%, а в водную фракцию второй – объем стерильного физиологического раствора, равный объему ГОА первого образца (референс-препарат). При изготовлении образцов инактивированных вакцин эмульсию получали методом гомогенизации водного и масляного компонентов в соотношении 30:70 с помощью гомогенизатора Ultraturrax T-25. В качестве масляной фазы использовали адъювант АБ-4М отечественного производства.
Антигенную активность оценивали по титрам поствакцинальных антител к вирусу ИБК в ИФА в соответствии с инструкцией по применению набора. Для этого цыплята в количестве 60 голов были разделены на 3 группы по 20 голов в каждой. Цыплят каждой группы иммунизировали соответствующим образцом инактивированной вакцины. Дополнительно 10 голов цыплят оставили в качестве чистого контроля. Через 28 дней после вакцинации от всех цыплят брали кровь, получали сыворотки и исследовали их в ИФА на наличие антител к вирусу ИБК.
Вакцину считали антигенно активной, если титры поствакцинальных антител в ИФА к вирусу ИБК не менее, чем в 2 раза превышали минимальный положительный титр, указанный в инструкции набора BioChek (1:834) при отрицательном иммунном фоне (уровень титров антител к вирусу ИБК у цыплят контрольной группы) или не менее, чем в 2 раза превышали уровень иммунного фона. Результаты исследований образцов вакцин на антигенную
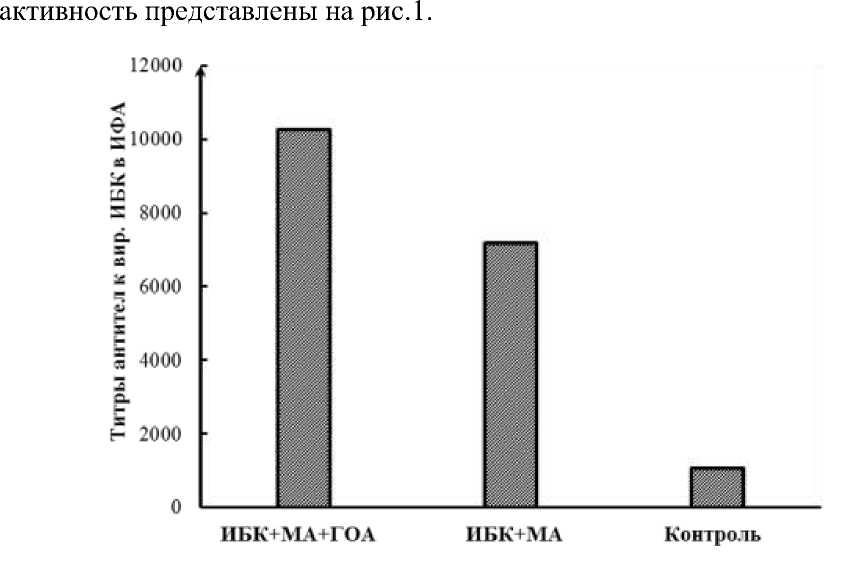
Рис. 1 Антигенная активность двух образцов инактивированной вакцины против ИБК: 1 - содержит в своем составе антиген вируса ИБК, ГОА и масляный адъювант (ИБК+МА+ГОА); 2 - содержит в своем составе антиген вируса ИБК и масляный адъювант (ИБК+МА)
Как видно из представленных данных, уровень иммунного ответа, оцениваемый по титрам антител к вирусу ИБК в ИФА, у препарата, содержащего в своем составе ГОА, выше, чем у референс-препарата -стандартной инактивированной эмульгированной вакцины против ИБК.
Таким образом, проведенные предварительные исследования показывают, что введение в водную фазу ГОА может увеличивать антигенную активность инактивированной вакцины.
Список литературы Повышение антигенной активности инактивированной вакцины против инфекционного бронхита кур из вариантного изолята
- Бочков, Ю.А. Диагностика инфекционного бронхита кур / Ю. А. Бочков, А. В. Борисов, С.В. Фролов и др. // Ветеринария. - 2003. - №4. - С. 21-24.
- Вирусные болезни животных / В.Н. Сюрин, А.Я. Самуйленко, Б.В. Соловьев и др. - М.: ВНИТИБП, 1998. - 928 с.
- Овчинникова, Е.В. Генетическая характеристика полевых изолятов вируса инфекционного бронхита кур, выявленных в России в 2004-2005 гг. / Е.В. Овчинникова, Г.В. Батченко, О.А. Чупина и др. // Тр. Федерального центра охраны здоровья животных. - Владимир, 2006. - Т. 4. - С. 362-369.
- Фролов, С.В. Обоснование использования российских вариантных штаммов инфекционного бронхита кур для изготовления инактивированной вакцины / С.В. Фролов, Ю.А. Бочков, Г.В. Батченко и др.// Тр. Федерального центра охраны здоровья животных. - Владимир, 2005. - Т. 1. - С. 343-357
- Aguilar J. C. Vaccine adjuvants revisited / J.C. Aguilar, E. G. Rodrıguez // Vaccine. - 2007. - № 25.- Р. 3752-3762
- Alvarado, I. R. Evaluation of the protection conferred by commercial vaccines against the California 99 isolate of infectious bronchitis virus / I. R. Alvarado, P. Villegas, J. El-Attrache et al. // Avian Diseases. - 2003. -Vol. 47, No. 4. -Р. 1298-1304
- Bochkov, Y.A. Molecular epizootiology of avian infectious bronchitis in Russia / Y.A. Bochkov, G.V. Batchenko, L.O. Shcherbakova et al. // Avian Pathology. - 2006.-Vol. 3 5. - P. 379-393.
- Calnek, B.W. Infectious bronchitis / B.W. Calnek, H.J. Barnes, C.W. Beard et al. // Diseases of Poultry,Tenth Edn. Iowa State University Press Ames, Iowa, USA -1997. - P. 510-526.
- Cavanagh, D., Naqi S. Infectious bronchitis // Diseases of Poultry. - 11th ed. - Ames, Iowa, 2003. -P. 101-119.
- Cox J.C., Coulter A.R. Adjuvants ˗ a classification and review of their modes of action // Vaccine. -1997. - Vol.15. - №3. - P. 248-256
- de Wit, J. J. Infectious bronchitis virus variants: a review of the history, current situation and control measures./ J. J. de Wit, J. K. A. Cook, H. M. J. F. Van Der Heijden //Avian Pathology. - 2011. -Vol. 40, No. 3. - Р. 223-235.
- Ignjatovic, J. Isolation of a variant infectious bronchitis virus in Australia that further illustrates diversity among emerging strain / J. Ignjatovic, G. Gould, S. Sapats et al. // Arc. Virol. - 2006. -Vol. 151, -Р. 1567-1585.
- Martin M. P. Evaluation of the effectiveness of two infectious bronchitis virus vaccine programs for preventing disease caused by a California IBV field isolate./ M. P. Martin, P. S. Wakenell, P. Woolcock et al. // Avian Diseases. - 2007. -Vol. 51, No. 2. - Р. 584-589.
- Ovchlnnikova, E. Molecular characterization of infectious bronchitis virus isolates from Russia and neighbouring countries: identification of intertypic recombination in the SI gene / E. Ovchlnnikova, Y. Bochkov, L. Shcherbakova, Z. Nikonova et al. // Avian Pathology. - 2011. - Vol. 40, No. 5. - P. 507-514.
- Petrovsky N. Vaccine adjuvants: current state and future trends / N. Petrovsky, J. C. Aguilar // Immunology and Cell Biology. - 2004. Vol. 82. - № 5. -Р. 488-496.
- Rajput Z.I. Adjuvant effects of saponins on animal immune responses / Z. I. Rajput, Song-hua Hu, Chen-wen Xiao et al. // Zhejiang Univ Sci B. - 2007. - Vol. 8. - № 3. - P. 153-161
- Shakya A.K. Polymers as immunological adjuvants: An update on recent developments / A. K. Shakya, K. S. Nandakumar // J. BioSci. Biotech. - 2012. - Vol.1 - № 3. - P. 199-210
- Terregino, C. Pathogenicity of a QX strain of infectious bronchitis virus in specific pathogen free and commercial broiler chickens, and evaluation of protection induced by a vaccination programme based on the Ma5 and 4/91 serotypes. / C. Terregino, A. Toffan, M. Serena Beato et al. //Avian Pathology. - 2008. - Vol. 37, No.5 - Р. 487-493.


