Повышение эффективности анализа изображений МРТ головного мозга с использованием отбора признаков
Автор: Коневский Владислав Валерьевич, Благов Александр Владимирович, Гайдель Андрей Викторович, Капишников Александр Викторович, Куприянов Александр Викторович, Суровцев Евгений Николаевич, Асатрян Давид Гегамович
Журнал: Компьютерная оптика @computer-optics
Рубрика: Обработка изображений, распознавание образов
Статья в выпуске: 4 т.46, 2022 года.
Бесплатный доступ
В данной статье рассматривается возможность повышения качества анализа изображений МРТ головного мозга в различных режимах сканирования путем использования алгоритмов жадного отбора признаков. Всего было рассмотрено пять последовательностей МРТ. Формирование текстурных признаков производилось с использованием програм-много комплекса MaZda. С использованием алгоритма рекурсивного отбора признаков удалось повысить точность определения типа опухоли с 69 % до 100 %. С помощью комбинированного алгоритма отбора признаков удалось повысить точность определения необходимости лечения пациента с 60 % до 78 % и с 81 % до 88 % в случае использования дополнительного класса, содержащего в себе данные пациентов, у которых точный результат лечения не известен. Использование текстурных признаков в совокупности с признаком, отвечающим за тип менингиомы, позволило однозначно определить необходимость лечения пациента.
Текстурный анализ, компьютерная оптика, обработка изображений, жадные алгоритмы, диагностика мрт, менингиома
Короткий адрес: https://sciup.org/140295015
IDR: 140295015 | DOI: 10.18287/2412-6179-CO-1040
Текст научной статьи Повышение эффективности анализа изображений МРТ головного мозга с использованием отбора признаков
Работа посвящена повышению качества диагностики первичных внемозговых объемных образований (ПВОО) при МРТ головного мозга и определению персонифицированных критериев отбора пациентов для радиохирургического лечения путем использования методов отбора информационных признаков.
ПВОО являются наиболее распространенными внутричерепными опухолями у взрослых [1, 2] и представлены широким спектром гистологических вариантов с различной степенью злокачественности [1]. Радиологический диагноз ПВОО должен быть установлен с помощью магнитно-резонансной томографии (МРТ) [4–7].
Подход к лечению ПВОО включает три варианта: динамическое наблюдение, нейрохирургическое вмешательство и стереотаксическую лучевую терапию (SRS) [4, 5]. SRS является полностью неинвазив- ным способом лечения и направлена на достижение контроля за ростом образования (остановку его роста) [8]. Однако в отдельных случаях после SRS наблюдается увеличение размеров опухоли, что может негативно сказываться на состоянии больного [9, 10]. Такая неопределенность лечебного эффекта SRS приводит к недостаточному ее внедрению в клиническую практику в то время, как более распространённое хирургическое вмешательство может привести к развитию осложнений и снизить качество жизни пациента [11].
В последние годы сформировалось новое направление в высокотехнологическом анализе медицинских изображений, получившее наименование «радиомика». Концепция радиомики базируется на извлечении большого массива разнообразных признаков путем углубленного компьютерного анализа изображений и применения их в системах поддержки принятия клинических решений [12, 13]. Использование количественных данных медицинских изображе- ний в качестве биомаркеров имеет значительный клинический потенциал как на этапе планирования лечения, так и на этапе оценки его эффективности.
Таким образом, совершенствование диагностических и прогностических возможностей МРТ у пациентов с ПВОО на основе извлечения цифровых признаков с помощью современных информационных технологий является актуальной проблемой лучевой диагностики. Средства автоматизированной диагностики смогли бы ускорить и удешевить обследование пациентов.
В данной работе для формирования признаков используется программа MaZda, позволяющая получить 298 текстурных характеристик изображения. Выбор признаков выполняется с использованием жадных алгоритмов: рекурсивного отбора, прямого выбора, обратного исключения, а также комбинации прямого выбора и обратного исключения. Эти алгоритмы позволяют выбрать наиболее информативные признаки для дальнейшей классификации объектов на заданное количество классов.
Описание набора данных
Изображения магнитно-резонансной томографии головного мозга были получены при обследовании пациентов в клиниках Самарского государственного медицинского университета. Набор данных состоял из 650 цифровых изображений, на каждом из которых медицинским специалистом была вручную выделена область интереса, представляющая собой участок патологических изменений. Изображения были получены для пяти последовательностей (режимов сканирования) МРТ:
– C (Т1 ВИ после в /в контрастирования): 150 изображений,
– D (DWI измерение броуновского движения молекул): 80 изображений,
– F (FLAIR): 133 изображения,
– T1 ВИ: 142 изображения,
– T2 ВИ: 145 изображений.
На рис. 1 представлен пример исходного изображения. Невооружённым глазом можно увидеть новообразование.
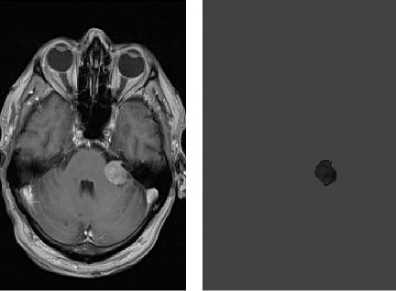
Рис. 1. МРТ головного мозга в аксиальной проекции, режим сканирования C с маской для новообразования
МРТ были предоставлены для 70 пациентов с описанной историей болезни. Возраст пациентов варьировался от 19 до 76 лет, средний возраст составил 56 лет. Из них 10 человек были мужчинами и 60 женщинами.
Определением предполагаемого гистологического типа ПВОО по типичной МРТ семиотике и выделением зоны интереса занимался эксперт. Были возможны следующие типы ПВОО: атипичная (злокачественная) менингиома, типичная (доброкачественная) менингиома и невринома.
После прохождения МРТ части пациентов было выполнено SRS. Набор данных содержал в себе информацию как для пациентов, подвергшихся SRS, так и для пациентов, не прошедших данное лечение, но проходивших контрольные исследования для динамического наблюдения за опухолью. Все пациенты после SRS проходили контрольное МРТ-исследование для наблюдения за результатом выполненного лечения. По результатам лечения были результаты: прогрессирование, частичный ответ, незначительный ответ, стабилизация, а также были пациенты, для которых результаты лечения определить не удалось. Результат лечения SRS оценивался согласно критериям RANO [14].
Выбор необходимости лечения осуществлялся по следующему алгоритму. Использовалось три класса: лечение требуется, лечение не требуется, недостаточно данных для принятия решения. Если без лечения наблюдается стабилизация – лечение не требуется. Если без лечения наблюдается прогрессирование – лечение требуется. Если с лечением наблюдается стабилизация – лечение требуется. Если с лечением наблюдается прогрессирование – лечение не требуется. Частичный или незначительный ответ считался так же, как стабилизация.
Текстурный анализ
Для количественного описания областей интереса были вычислены текстурные признаки. Текстурные признаки вычислялись с помощью программного пакета MaZda. MaZda – это программный инструмент для анализа изображений. Его эффективность была доказана участниками различных проектов, которые использовали это программное обеспечение для различных задач, где был необходим текстурный анализ, [15]. Признаки, вычисляющиеся с помощью MaZda, включают в себя:
– гистограммные характеристики (среднее, дисперсия, коэффициент асимметрии, коэффициент эксцесса и др.);
– градиентные характеристики (те же среднее, дисперсия, коэффициент асимметрии, коэффициент эксцесса и др., но для градиента изображения);
– признаки, основанные на длинах серий (второй угловой момент, контраст, корреляция и др.);
– признаки, основанные на матрице взаимной встречаемости (признаки Харалика);
– признаки, основанные на модели авторегрессии (коэффициенты в этой модели);
– признаки, основанные на вейвлет-преобразовании (энергетические характеристики изображения на разных масштабах различных вейвлет-преобразований).
Таким образом, при проведении текстурного анализа было получено 298 признаков.
Задача отбора признаков
Отбор признаков необходим для повышения результатов классификации. В общем виде проблема отбора признаков заключается в том, что требуется выбрать некоторое подмножество из имеющегося множества примитивных признаков, которое позволяет оптимизировать некоторый критерий качества признакового пространства.
Допустим, имеется множество распознаваемых объектов Ω, разбитое на L классов Ωj д^} L:0. (1)
Каждый объект распознавания me Q представляет собой вектор из M вещественных чисел (признаков).
Для решения задачи классификации необходимо построить оператор Ф ( x ) :О ^ [ 0; L - 1 ] n Z , который по вектору признаков x предсказывает его класс. Если имеется конечная обучающая выборка U cQ , конечная контрольная выборка U с О и идеальный оператор Ф( x ): Q^ [0; L -1] n Z, который ставит в соответствие объекту распознавания его класс, то вероятность ошибки предсказания можно оценить как
£:
|{ x e U |Ф ( x ) ^ Ф ( x )}|
U
где | A | – это количество элементов в конечном множестве A .
Тогда под точностью классификации можно понимать долю верно классифицированных объектов из заданной выборки, то есть
J : 1 -е .
Решить задачу отбора признаков – значит найти подмножество признаков Q с [1; M ] n Z , которое будет обеспечивать максимальное значение точности классификации J , вычисленной по обучающей выборке с помощью кросс-валидации. Нужно отметить, что при использовании такого критерия качества признакового пространства отбор признаков привязан к конкретному классификатору, решающему конечную задачу классификации.
Для решения задачи классификации мы использовали Random Forest Model. Это наиболее универсальный классификатор, хорошо подходящий для решения подобных задач [16].
Методы отбора признаков
Метод прямого отбора признаков [17]. Начинаем с пустого набора признаков Q(0) = 0, на шаге i ищем ошибку (2) для набора признаков с добавленным признаком j и добавляем признак j, для которого эта ошибка минимальна:
Q ( i ): Q ( i - 1 ) ^ 1 argmin е [ Q ( , -- 1 ) ^ { j } ]k (4)
I j e [ 1; m ] n Z I
Алгоритм завершает работу по достижению необходимого количества признаков.
Метод обратного отбора признаков [18]. Начинаем с набора, состоящего из всех признаков Q (0) = Q = [1; K ] n Z , на шаге i ищем ошибку (2) для набора признаков с удаленным признаком j и удаляем из набора признак j , для которого ошибка минимальна:
Q ( i ) : Q ( i - 1 ) \ I argmin е[ Q ( i - 1 ) \ { j } ] [ • (5)
I j e [ 1; m ] n Z I
Алгоритм завершает работу по достижении необходимого количества признаков.
Следуя идее, предложенной в [19], можно синтезировать комбинированный алгоритм отбора признаков, включающий в себя шаги прямого и обратного отбора. Начинаем с набора, состоящего из всех признаков Q (0) = Q = [1; K ] n Z . На шаге i ищем ошибку е i - для набора признаков с удаленным признаком j (4), после чего удаляем признак, для которого ошибка минимальна. Далее сразу на этом же шаге рассматриваем все наборы признаков (5) с добавленными признаками ( j ) и вычисляем для них значение ошибки е i + . Если е i + < е i - , то соответствующий признак j , для которого ошибка е i + минимальна, добавляется в набор.
Алгоритм останавливается, когда достигается необходимое количество признаков либо когда достигается ограничение на количество итераций.
Рекурсивное удаление признаков [20] – это развитие алгоритма обратного отбора признаков. Начинаем с набора, состоящего из всех признаков
Q (0) = Q = [1; K ] n Z , на шаге i ищем, перебираем все подмножества F i текущего набора признаков Q i небольшой мощности, не превышающей h . Предсказательная модель обучается на наборе признаков F i , после чего из набора признаков Q i удаляется подмножество признаков F j , для которого ошибка (2) максимальная.
Алгоритм завершает работу по достижении необходимого количества признаков.
Результаты вычислительных экспериментов
Было проведено четыре исследования.
В ходе вычислительных экспериментов, чтобы избежать переобучения, набор данных разделялся на обучающую и контрольную выборку в отношении 80/20. Для разбиения использовалась функция train_test_split библиотеки sklearn с параметрами test_size = 0,20 и random_state = 27.
Первое исследование заключалось в определении типа новообразования по его изображению.
Средняя точность (3) при полном наборе признаков составила 71 %, с использованием алгоритмов отбора признаков составила 97%. Сводная диаграмма представлена на рис. 2. Лучшие результаты по алгоритмам представлены в табл. 1, количество признаков, позволяющее получить лучшие результаты, представлено в табл. 2.
Можно заметить, что лучшую точность показали методы прямого отбора признаков и метод рекурсивного удаления. В режимах сканирования С и D удалось достичь 100-процентного результата распознавания.
Il ll II ll ll
-
■ Полный набор признаков Наилучший результат после отобора признаков
Рис. 2. Результаты на определение типа менингиомы
Табл. 1. Результаты на определение типа менингиомы, лучшие показатели с использованием алгоритмов
|
C |
D |
F |
T1 |
T2 |
|
|
Метод прямого отбора признаков |
1 |
0,69 |
0,96 |
0,83 |
0,9 |
|
Метод обратного отбора признаков |
0,8 |
0,5 |
0,78 |
0,65 |
0,72 |
|
Комбинированный алгоритм отбора признаков |
0,87 |
0,38 |
0,86 |
0,62 |
0,69 |
|
Рекурсивное удаление признаков |
0,97 |
1 |
0,96 |
0,97 |
0,97 |
Табл. 2. Результаты на определение типа менингиомы, количество признаков, при котором достигнуты лучшие показатели
|
C |
D |
F |
T1 |
T2 |
|
|
Метод прямого отбора признаков |
10 |
210 |
10 |
240 |
10 |
|
Метод обратного отбора признаков |
10 |
270 |
40 |
240 |
250 |
|
Комбинированный алгоритм отбора признаков |
198 |
218 |
208 |
218 |
48 |
|
Рекурсивное удаление признаков |
10 |
10 |
10 |
10 |
10 |
|
Второе исследование заключалось в определении необходимости лечения в случае использования двух |
|||||
классов.
Средняя точность при полном наборе признаков составила 52%, а с использованием алгоритмов отбора признаков составила 69 %. Сводная диаграмма представлена на рис. 3. Лучшие результаты по алгоритмам представлены в табл. 3, количество признаков, позволяющее получить лучшие результаты, представлено в табл. 4.
Можно заметить, что лучшую точность показал метод прямого отбора признаков для режима сканирования F при 100 признаках.
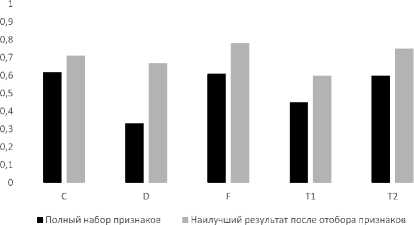
Рис. 3. Результаты определения необходимости лечения для 2 классов
Табл. 3. Результаты определения необходимости лечения для 2 классов, лучшие показатели с использованием алгоритмов
|
C |
D |
F |
T1 |
T2 |
|
|
Метод прямого отбора признаков |
0,67 |
0,67 |
0,78 |
0,60 |
0,7 |
|
Метод обратного отбора признаков |
0,71 |
0,67 |
0,67 |
0,60 |
0,7 |
|
Комбинированный алгоритм отбора признаков |
0,67 |
0,67 |
0,67 |
0,60 |
0,7 |
|
Рекурсивное удаление признаков |
0,71 |
0,67 |
0,67 |
0,60 |
0,75 |
Табл. 4. Результаты определения необходимости лечения для 2 классов, количество признаков, при котором достигнуты лучшие показатели
|
C |
D |
F |
T1 |
T2 |
|
|
Метод прямого отбора признаков |
30 |
80 |
100 |
10 |
180 |
|
Метод обратного отбора признаков |
160 |
150 |
30 |
30 |
50 |
|
Комбинированный алгоритм отбора признаков |
47 |
27 |
7 |
247 |
157 |
|
Рекурсивное удаление признаков |
80 |
150 |
10 |
10 |
190 |
Третье исследование заключалось в определении необходимости лечения в случае использования 3 классов. Добавились пациенты, для которых результаты лечения не определены.
Средняя точность при полном наборе признаков составила 55 %, с использованием алгоритмов отбора признаков составила 60%. Сводная диаграмма представлена на рис. 4. Лучшие результаты по алгоритмам представлены в табл. 5, количество признаков, позволяющих получить лучшие результаты, представлено в табл. 6.
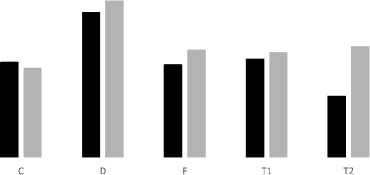
■ Полный набор признаков Наилучший результат после отобора признаков
Рис. 4. Результаты определения необходимости лечения для 3 классов
Можно заметить, что все алгоритмы показали лучшие результаты для режима сканирования D, од- нако комбинированный алгоритм достиг результата всего при 127 признаках.
Четвертое исследование заключалось в определении необходимости лечения в случае использования 2 классов, но с добавлением признака, который отвечает за тип менингиомы.
Табл. 5. Результаты определения необходимости лечения для 3 классов, лучшие показатели с использованием алгоритмов
|
C |
D |
F |
T1 |
T2 |
|
|
Метод прямого отбора признаков |
0,5 |
0,875 |
0,48 |
0,586 |
0,448 |
|
Метод обратного отбора признаков |
0,5 |
0,875 |
0,556 |
0,586 |
0,414 |
|
Комбинированный алгоритм отбора признаков |
0,5 |
0,875 |
0,556 |
0,586 |
0,517 |
|
Рекурсивное удаление признаков |
0,47 |
0,875 |
0,593 |
0,48 |
0,62 |
Табл. 6. Результаты определения необходимости лечения для 3 классов, количество признаков, при котором достигнуты лучшие показатели
Можно заметить, что алгоритм прямого отбора признаков и алгоритм рекурсивного отбора признаков позволили выбирать набор признаков, который может однозначно определить их необходимость.
Добавление признака, который отвечает за тип менингиомы, позволил значительно улучшить результат, что отчетливо видно в сравнении табл. 3 и 7.
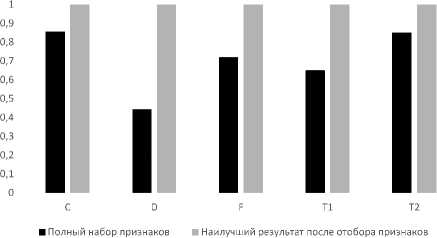
Рис. 5. Результаты определения необходимости лечения для 2 классов с использования признака, который отвечает за тип менингиомы
Табл. 7. Результаты определения необходимости лечения с использованием признака, который отвечает за тип менингиомы, лучшие показатели с использованием алгоритмов
|
C |
D |
F |
T1 |
T2 |
|
|
Метод прямого отбора признаков |
1 |
1 |
1 |
1 |
1 |
|
Метод обратного отбора признаков |
1 |
0,78 |
0,83 |
0,85 |
0,95 |
|
Комбинированный алгоритм отбора признаков |
0,95 |
0,67 |
0,94 |
0,55 |
0,95 |
|
Рекурсивное удаление признаков |
1 |
1 |
1 |
1 |
1 |
Табл. 8. Результаты определения необходимости лечения с использованием признака, который отвечает за тип менингиомы, количество признаков, при котором достигнуты лучшие показатели
|
C |
D |
F |
T1 |
T2 |
|
|
Метод прямого отбора признаков |
10 |
10 |
10 |
10 |
10 |
|
Метод обратного отбора признаков |
190 |
40 |
40 |
60 |
90 |
|
Комбинированный алгоритм отбора признаков |
88 |
68 |
268 |
228 |
38 |
|
Рекурсивное удаление признаков |
10 |
10 |
10 |
10 |
10 |
Заключение
В данной работе были рассмотрены способы повышения эффективности анализа изображений МРТ головного мозга.
С использованием алгоритмов жадного отбора признаков удалось приблизить результаты определения типа новообразования к 97 %. Для режима сканирования DWI тип новообразования был правильно определён для всех изображений контрольной выборки без исключения.
В исследованиях необходимости лечения наблюдается яркий пик для режима сканирования DWI, точность правильной классификации для него составила 88 %. Однако при исключении из набора данных пациентов, для которых нет явных данных результатов лечения, результат упал до 70 %. Это может быть связано с небольшим объемом выборки.
Лучший результат для двух классов (требуется лечение / лечение не требуется) показал режим сканирования F, с использованием жадных алгоритмов отбора признаков удалось правильно классифицировать 78 % изображений.
Использование текстурных признаков в совокупности с признаком, отвечающим за тип менингиомы, позволило однозначно определить необходимость лечения пациента.
Лучшие результаты при этом достигаются с использованием алгоритма прямого отбора признаков и алгоритма рекурсивного удаления.
Список литературы Повышение эффективности анализа изображений МРТ головного мозга с использованием отбора признаков
- Ostrom QT, Patil N, Cioffi G, Waite K, Kruchko C, Barn-holtz-Sloan JS. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the united states in 2013-2017. Neuro Oncol 2020; 22(Suppl 2): iv1-iv96. doi: 10.1093/neuonc/noaa200.
- Kholin AV. Magnetic resonance imaging for diseases and injuries of the central nervous system [In Russian]. Moscow: "MEDpress-inform" Publisher; 2017.
- Louis DN, Perry A, Reifenberger G, von Deimling A, Figa-rella-Branger D, Cavenee WK, Ohgaki H, Wiestler OD, Kleihues P, Ellison DW. The 2016 world health organization classification of tumors of the central nervous system: A summary. Acta Neuropathol 2016; 131(6): 803820. doi: 10.1007/s00401-016-1545-1.
- Goldbrunner R, Minniti G, Preusser M, et al. EANO guidelines for the diagnosis and treatment of meningiomas. Lancet Oncol 2016; 17(9): e383-e391. DOI: 10.1016/S1470-2045(16)30321-7.
- Goldbrunner R, Weller M Regis J, et al. EANO guideline on the diagnosis and treatment of vestibular schwannoma. Neuro Oncol 2020; 22(1): 31-45. doi: 10.1093/neuonc/noz153.
- Shabani S, Kaushal M, Kaufman B, et al. Intracranial ex-traskeletal mesenchymal chondrosarcoma: Case report and review of the literature of reported cases in adults and children. World Neurosurg 2019; 129: 302-310. doi: 10.1016/j.wneu.2019.05.221.
- Strasilla C, Sychra V. Bildgebende Diagnostik des Vestibu-larisschwannoms. HNO 2017; 65(5): 373-380. doi: 10.1007/s00106-016-0227-6.
- Kim KH, Kang SJ, Choi JW, et al. Clinical and radiological outcomes of proactive Gamma Knife surgery for asympto-maticmeningiomas compared with the natural course without intervention. J Neurosurg 2018; 130(5): 1740-1749. doi: 10.3171/2017.12.JNS171943.
- Nasi D, Zunarelli E, Puzzolante A, Moriconi E, Pavesi G. Early life-threating enlargement of a vestibular schwannoma after gamma knife radiosurgery. Acta Neurochir (Wien) 2020; 162(8): 1977-1982. doi: 10.1007/s00701-020-04434-2.
- Kim JH, Jung HH, Chang JH, Chang JW, Park YG, Chang WS. Predictive factors of unfavorable events after gamma knife radiosurgery for vestibular schwannoma. World Neurosurg 2017; 107: 175-184. doi: 10.1016/j.wneu.2017.07.139.
- Speckter H, Bido J, Hernandez G, Rivera D, Suazo L, Valenzuela S, Miches I, Oviedo J, Gonzalez C, Stoeter P. Pretreatment texture analysis of routine MR images and shape analysis of the diffusion tensor for prediction of volumetric response after radiosurgery for meningioma. J Neurosurg 2018; 129(Suppl 1): 31-37. doi: 10.3171/2018.7.GKS181327.
- Lambin P, Leijenaar RTH, Deist TM, et al. Radiomics: the bridge between medical imaging and personalized medicine. Nat Rev Clin Oncol 2017; 14(12): 749-762. doi: 10.1038/nrclinonc.2017.141.
- Agafonova YuD, Gaidel AV, Zelter PM, Kapishnikov AV. Efficiency of machine learning algorithms and convolutional neural network for detecting of pathological changes in MR images of the brain. Computer Optics 2020; 44(2): 266-273. DOI: 10.18287/2412-6179-C0-671.
- Wen PY, Chang SM, Van den Bent MJ, Vogelbaum MA, Macdonald DR, Lee EQ. Response assessment in neuro-oncology clinical trials. J Clin Oncol 2017; 35(21): 24392449. doi: 10.1200/JCO.2017.72.7511.
- Szczypinski PM, Strzelecki M, Materka A. MaZda - a software for texture analysis. Int Symposium on Information Technology Convergence 2007: 245-249. DOI: 10.1109/ISITC.2007.15.
- Fernández-Delgado M, Cernadas E, Barro S, Amorim D. Do we need hundreds of classifiers to solve real world classification problems? J Mach Learn Res 2014; 15(1): 3133-3181. DOI: 10.5555/2627435.2697065.
- Guyon I, Weston J, Barnhill S, Vapnik V. Gene selection for cancer classification using support vector machines. Mach Learn 2002; 46(1-3): 389-422. DOI: 10.1023/A:1012487302797.
- Couvreur C, Bresler Y. On the optimality of the back-ward greedy algorithm for the subset selection problem. SIAM J Matrix Anal Appl 2000; 21(3): 797-808. DOI: 10.1137/S0895479898332928.
- Goncharova EF, Gaidel AV. Greedy algorithms of feature selection for multiclass image classification. CEUR Workshop Proceedings 2018; 2210: 38-46.
- Marcano-Cedeño A, Quintanilla-Domínguez J, Cortina-Januchs MG, Andina D. Feature selection using sequential forward selection and classification applying artificial metaplasticity neural network. IECON 2010 - 36th Annual Conf on IEEE Industrial Electronics 2010: 2845-2850. DOI: 10.1109/IECON.2010.5675075.


