Повышение эффективности диагностики и лечения рака легких с помощью сочетания глубокого обучения, радиомики и геномного анализа
Автор: Павлов В.А., Шариати Ф., Баранов М.А., Серебренников Н.А.
Журнал: Компьютерная оптика @computer-optics
Рубрика: Численные методы и анализ данных
Статья в выпуске: 4 т.49, 2025 года.
Бесплатный доступ
Рак легких с его высоким уровнем смертности представляет собой серьезную проблему в онкологии, в основном из-за бессимптомного характера ранних стадий, что затрудняет своевременную диагностику. В данной статье рассматривается интегрированный подход с использованием глубокого обучения и признаков радиомики для улучшения обнаружения и прогнозирования генетических мутаций в узловых образованиях легких, тем самым продвигая границы персонализированной медицины в контексте рака легких. В работе используются сверточные нейронные сети и трансформеры, что позволяет анализировать изображения компьютерной томографии для сегментации легочных узелков и прогнозирования значимых генетических мутаций, в частности EGFR и KRAS. Наш интегрированный подход, в частности сочетание YOLOv7 с DeepLabv3 и признаками текстур, показал высокие результаты, достигнув Accuracy 98,5% и Precision 96% в задачах сегментации, а также высоких показателей Accuracy 97,8% и 98% для прогнозирования мутаций EGFR и KRAS соответственно с помощью сочетания глубокого обучения и радиомики.
Рак лёгких, радиомика, нейронные сети, мутация генов, анализ текстуры
Короткий адрес: https://sciup.org/140310511
IDR: 140310511 | DOI: 10.18287/2412-6179-CO-1533
Текст научной статьи Повышение эффективности диагностики и лечения рака легких с помощью сочетания глубокого обучения, радиомики и геномного анализа
Рак легких остается одной из главных проблем в здравоохранении, занимая второе место в мировой статистике после рака молочной железы. В 2020 г. рак легких стал причиной 1,8 млн случаев смерти (18 %) во всем мире [1].
Такой высокий уровень смертности объясняется прежде всего тем, что рак легких часто диагностируется на поздних стадиях, когда методы лечения менее эффективны. Раннее выявление рака легкого значительно улучшает показатели выживаемости, позволяя своевременно проводить более эффективные лечебные мероприятия. Однако рак легких на ранних стадиях обычно протекает без симптомов, что затрудняет его раннюю диагностику. Это подчеркивает необходимость в эффективных и надежных методах скрининга, таких как низкодозная компьютерная томография (НДКТ), которая показала свою эффективность в выявлении ранней стадии рака легкого в группах высокого риска.
Алгоритмы глубокого обучения, в частности свёрточные нейронные сети (СНС), широко используются для анализа изображений [2], демонстрируя высокие результаты при обнаружении сложных паттернов в медицинской визуализации [3]. Применение этих алгоритмов для выявления рака легких привело к созданию систем компьютерной диагностики (СКД), способных с высокой точностью идентифицировать легочные узелки, тем самым решая одну из важнейших задач скрининга рака легких [4, 5].
В работе [6] была предложена полностью автоматизированная система для выявления и классификации рака легких с использованием глубоких СНС и LSTM. Эта система продемонстрировала точность более 98,8%. В работе [7] для обнаружения изображений легких и узлов использовалась система на базе глубокого обучения. Эти исследования подчеркивают значительные успехи, достигнутые в области выявления рака легких благодаря интеграции глубокого обучения в системы компьютерной диагностики.
Радиомика – новый инструмент персонализированной медицины, который играет важную роль в преобразовании данных медицинской визуализации в количественные, высокопроизводительные признаки [8]. Последние исследования были посвящены нормализации и проверке алгоритмов радиомики для демонстрации их эффективности и надежности в клинических условиях [9]. Как и в работах [10, 11], текстурные признаки показали высокий потенциал при раннем обнаружении диабетической ретинопатии. Эти исследования подчеркивают важность использования анализа текстур при оценке структурных изменений в сетчатке, которые предшествуют клиническим проявлениям заболевания. Аналогично в нашем исследовании текстурные признаки, извлеченные из КТ-изображений, демонстрируют значительный потенциал для улучшения точности диагностики и раннего выявления немелкоклеточного рака легкого. Применение методов обработки КТ, таких как анализ текстурных и радиомических признаков, позволяет не только обнаруживать опухоли на ранних стадиях, но и оценивать их агрессивность, что крайне важно для выбора стратегии лечения.
Интеграция клинических параметров с признаками радиомики показала эффективность в различении различных патологических подтипов рака легкого, таких как аденокарцинома и плоскоклеточная карцинома [12].
Обнаружение генных мутаций имеет ключевое значение в контексте лечения рака, поскольку играет решающую роль в понимании молекулярных механизмов, определяющих развитие и прогрессирование рака [13, 14]. В настоящее время остается недостаточно изученной корреляция признаков визуализации с генетическими мутациями, такими как EGFR (Epidermal growth factor receptor) и KRAS (Kirsten RAt Sarcoma Virus) , которые имеют ключевое значение для разработки стратегий лечения рака.
Цель данной работы заключается в интеграции глубокого обучения и признаков радиомики для обнаружения, определения характеристик и прогнозирования генетических мутаций в легочных узелках.
Материалы и методы
В работе на начальном этапе выполняется предварительная обработка данных и формирование трёхканального изображения для задачи сегментации на основе двух текстурных признаков и основного КТ-изображения. На следующем этапе выполняется извлечение радиомических и глубоких признаков для классификации типа мутации легочного узла.
Предобработка набора данных ‒ в данном исследовании использован набор данных [15, 16], который объединяет различные формы диагностических и прогностических данных, включая компьютерную томографию (КТ), позитронно-эмиссионную томографию (ПЭТ) / КТ-изображения, семантические аннотации опухолей на КТ-изображениях 211 пациентов. Кроме того, количественные показатели, полученные на снимках ПЭТ / КТ, сочетаются с подробным данными о мутациях генов и секвенировании РНК, полученной из опухолевой ткани. Этот набор данных дополнен соответствующими клиническими данными, такими как результаты выживания, что создает основу для изучения корреляции между геномными признаками и медицинской визуализацией. В работе используется два типа текстурных признаков: Haralick и Law (градиент).
Создание трехканального изображения . Признаки, полученные из матрицы распределения совпадений интенсивности ( gray-level co-occurrence matrix, GLCM ) [17]. Для каждого пикселя на КТ-изображении вычисляется GLCM , затем фиксируется частота совпадений интенсивностей на определенном расстоянии и в определенной ориентации. GLCM C для изображения I с N различными уровнями серого представляет собой N × N матрицу С , где каждый элемент C i,j представляет собой частоту совпадающих интенсивностей пикселей i и j . Она определяется как:
J 1, if I ( x, y ) = i and I ( x + Л х, y + Д y ) = j , C i ' j = к otherwise.
GLCM нормируется на Cnorm :
Ci norm
C i , j
£ ci’j
Затем вычисляются Haralick признаки, включая контрастность, энергию, однородность и энтропию. Контрастный признак, который используется в данной работе, определяется следующим образом:
Contrast = £ C norm • | i - J | 2 .
Признаки текстуры Law сосредоточены на информации о текстуре на основе градиента, что имеет решающее значение для выделения тонких изменений на КТ-изображениях [18]. Для получения подробной карты краев и текстурных градиентов в работе применяются градиентные фильтры. Градиент G ( x , y ) в пикселе ( x , y ) представляет собой векторное поле, определяемое как:
—*
G ( x , y )
( Gx (x, У) ] I Gy(x, У ) J где Gx и Gy ‒ горизонтальный и вертикальный градиенты, полученные в результате свертки изображения I с градиентными фильтрами Fx и Fy:
G x = I * Fx и Gy = I * Fy .
Величина градиента рассчитывается следующим образом:
| G(x, y) |= д/Gx(x, y)2 + Gy(x, y)2 , а направление градиента 0(x, y) определяется, как:
0 ( x , y ) = arctan | y ( , y ) I G x ( x , y )
.
На основе текстурных признаков Haralick, Law и КТ-изображения формируется трёхканальное изоб- ражение (рис. 1), которое повышает интерпретируемость входных данных, что особенно полезно при выявлении тонких сосудистых аномалий и патологий.
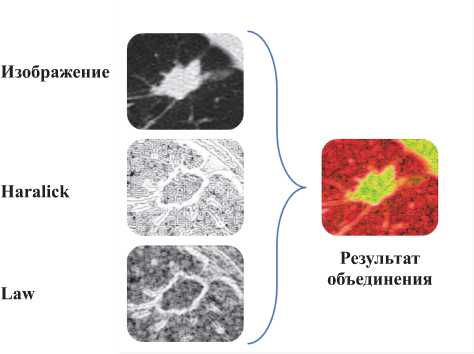
Рис. 1. Пример объединения признаков и КТ-изображения
Анализ узелков в легких. Рассмотрим процесс радиомического анализа, которой включает в себя всестороннее изучение количественных признаков, извлеченных из медицинских изображений, в особенности тех, которые относятся к легочным узелкам, выявленным с помощью сегментации. Этот этап является ключевым в методологии данной работы, поскольку он использует высокоразмерные данные, содержащиеся в КТ-изображениях, для дальнейшего уточнения обнаружения легочных узелков. Извлечение признаков радиомики ‒ это многогранный подход, который включает в себя количественную оценку различных аспектов узлов, в том числе текстурных признаков, признаков формы, интенсивности. На рис. 2 представлен процесс комбинирования радиомических и глубоких свёрточных признаков (ResNet18). Применение глубокого обучения в сочетании с радиомическим анализом обеспечивает более детальное изучение структурных и функциональных аспектов узелков, что значительно усиливает возможности ранней диагностики и персонализированной оценки риска прогрессирования заболевания.
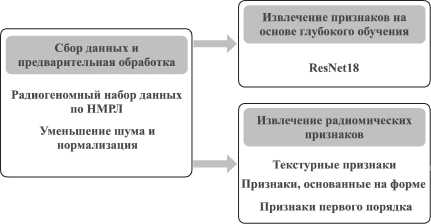

Обнаружение мутаций с использованием алгоритмов классификации
KRAS
EGFR
Рис. 2. Комбинация радиомических и глубоких свёрточных признаков
Признаки текстуры. Текстура легочного узелка на КТ-изображениях содержит важную информацию о его неоднородности, которая может свидетельствовать о природе и потенциальной злокачественности [17, 19, 24]. Для систематической количественной оценки этих текстурных паттернов в данной работе используется два основных статистических метода: GLCM и матрица длины интервала между уровнями серого ( Gray Level Run Length Matrix, GLRLM ).
GLCM: GLCM ‒ это метод извлечения статистических текстурных признаков второго порядка. Он оценивает, как часто пары пикселей с определенными значениями и в определенном пространственном соотношении встречаются на изображении, создает GLCM , а затем извлекает статистические показатели из этой матрицы. Для заданного перемещения d = ( d x , d y ) и изображения I элемент GLCM C i,j определяется как количество раз, когда пиксель с интенсивностью i встречается рядом с пикселем с интенсивностью j , математически представляемое как:
NM 1
Cj =Е i , j £ я ( о
if I (x, y) = i and I (x + dx, y + dy ) = j , otherwise, где N и M ‒ размеры изображения. На основе GLCM можно рассчитать различные текстурные признаки, такие как:
-
• контраст: измеряет локальные изменения в
GLCM .
Contrast = £ ( i - j') 2 C i , j ;
i , j
-
• энергия: определяет однородность текстуры.
Energy = £ Cj ;
i , j
-
• гомогенность: оценивает близость распреде
ления элементов в GLCM к диагонали GLCM.
C i , j
Homogeneity = / --------
Г Т 1 + ( i - j ) 2
.
GLRLM: GLRLM оценивает длину непрерывных интервалов пикселей с определенным уровнем серого в определенном направлении. Длина определяется как набор последовательных, коллинеарных пикселей, имеющих одинаковое значение уровня серого. Для изображения I матрица длины интервала Ri,j представляет собой количество интервалов с пиксе- лями с уровнем серого i и длиной пробега j, что позволяет извлекать такие признаки, как:
-
• акцент на короткие интервалы ( Short Run Emphasis, SRE ): подчеркивает распределение коротких интервалов на изображении.
SRE — Z R j ;
i , j j
-
• акцент на длинные интервалы ( Long Run Emphasis, LRE ) : уделяет особое внимание распределению длинных интервалов .
LRE - Z j 2 R j
Интеграция признаков GLCM и GLRLM позволяет получить полное представление о текстуре легочных узелков, облегчая разграничение между доброкачественными и злокачественными образованиями за счет анализа неоднородности текстуры.
Признаки формы. Анализ формы играет ключевую роль в рентгенологической оценке легочных узелков, обеспечивая геометрический взгляд на морфологические признаки, которые имеют решающее значение для диагностики рака легкого [25, 26]. Следующие уравнения и методики описывают извлечение признаков формы:
-
• площадь (A) и объем (V): площадь и объем -это признаки формы, которые количественно определяют размер узелка в двух и трех измерениях соответственно. Для двухмерного среза изображения площадь рассчитывается путем суммирования пикселей в пределах границы узла. В трехмерном изображении объем вычисляется путем суммирования количества вокселей на всех срезах, содержащих узелок, и умножения на размер вокселя.
A - Z 1, V - Z voxel volume; pixels in nodule voxels in nodule
-
• периметр (P): периметр измеряется путем обведения границы узла и суммирования расстояний между соседними пикселями. В цифровом изображении это можно приближенно оценить с помощью таких методов, как цепные коды, или путем прямого подсчета пикселей на границе.
P — Z distance to next pixel;
boundary pixels
-
• сферичность (у): сферичность - это показатель того, насколько форма узелка похожа на сферу, при этом значение 1 означает идеальную сферу. Она рассчитывается на основе объема и площади поверхности ( SA ) конкреции:
n 13(6 V )23
SA ;
-
• компактность ( C ): компактность оценивает, насколько компактна форма конкреции по отношению к кругу (в 2D) или сфере (в 3D). Она обратно пропорциональна площади поверхности при заданном объеме, при этом более низкие значения указывают на более компактную форму.
C — -V-
SA 32
.
Эти признаки формы, извлекаемые из КТ-изображений, предоставляют информацию о морфологических аспектах легочных узелков. Анализируя эти геометрические признаки, клиницисты и радиологи могут сделать вывод об агрессивности, характере роста и потенциальной злокачественности узелков, что способствует раннему вмешательству и адаптированным стратегиям лечения.
Признаки интенсивности. Анализ признаков интенсивности является неотъемлемой частью понимания рентгенографических признаков легочных узелков [27, 28]. Эти признаки, полученные из распределения значений пикселей (на 2D-изображениях) или вокселей (на 3D-изображениях), дают количественную оценку внутренней структуры узелка. К основным метрикам относятся:
-
• среднее значение интенсивности,
-
• стандартное отклонение,
-
• коэффициент асимметрии,
-
• коэффициент эксцесса.
Извлечение этих признаков интенсивности из КТ-изображений позволяет провести комплексный анализ узловых образований легких, помогая дифференцировать доброкачественные и злокачественные новообразования на основе их внутреннего состава и признаков плотности.
Обнаружение и сегментация узелков в лёгких. Анализ литературы показал [20, 21], что для обнаружения узелков в легких наиболее предпочтительной архитектурой является YOLOv7 (You only look once) [20]. Для сегментация легочных узелков были выбраны две нейросетевые архитектуры: DeepLabv3 (Deep Labelling) [22] и U-Net [23].
Результаты
Результаты сегментации узелков в лёгких. В табл. 1 представлена информация об обучающей выборке. Разрешение изображений – 512×512.
Табл. 1. Распределение данных в обучающей выборке
|
Обучающая выборка |
Тестовая выборка |
|
|
Кол-во КТ |
2556 |
639 |
Обучение нейросетевых подходов выполнялось на графическом ускорителе Nvidia RTX 2080 TI. Параметры обучения представлены в табл. 2.
В табл. 3 представлены результаты сравнения производительности моделей глубокого обучения и их различные комбинации. Результаты были получены на графическом ускорителе Nvidia RTX 2080 TI.
Табл. 2. Параметры обучения нейросетевых моделей
|
Параметр |
Значение |
|||
|
YOLOv7 обнаружение |
YOLOv8 m сегментация |
U-Net |
DeepLabv3 (ResNet18) |
|
|
Кол-во эпох |
100 |
100 |
100 |
100 |
|
Размер пакета |
16 |
16 |
8 |
8 |
|
Скорость обучения |
10-3 |
10-3 |
10-4 |
10-4 |
|
Метод обучения |
Adam |
Adam |
Adam |
Adam |
Табл. 3. Сравнение производительности моделей
|
Модель |
Accuracy, % |
F1-score, % |
Precision, % |
|
U-Net |
93,4 |
75,9 |
84,3 |
|
DeepLabv3 |
94,7 |
79,4 |
85,7 |
|
YOLOv7+ U-Net |
97,5 |
87,4 |
92,3 |
|
YOLOv7+DeepLabv3 |
98,0 |
91,0 |
94,7 |
|
YOLOv7+DeepLabv3 (вход: объединение текстурных признаков и КТ (рис. 1)) |
98,5 |
93,5 |
96,0 |
|
YOLOv8 |
96,3 |
81,4 |
90,3 |
Комбинация YOLOv7 с DeepLabv3 , дополненная текстурными признаками (трёхканальное изображение), продемонстрировала высокую производительность, достигнув Accuracy 98,5 %, F1-score 93,5 % и Precision 96%.
На рис. 3 представлены результаты обнаружения и сегментации предложенным методом ( YOLOv7 + DeepLabv3 +текстурные признаки) двух КТ-изображений. Эти примеры иллюстрируют эффективность примененных нейросетевых моделей, подчеркивая точность, с которой каждая модель выделяет легочные узелки из окружающей легочной ткани.
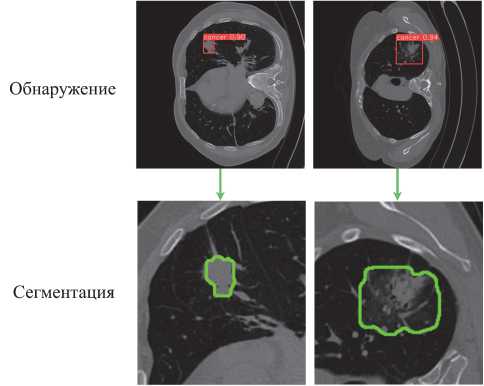
Рис. 3. Визуальные результаты обнаружения узелков (верхние рисунки) в легких и сегментация (нижние рисунки) для двух КТ-изображений с использованием текстурных признаков, YOLOv7 и DeepLabV3
На рис. 4 представлено сравнение предложенного метода (зеленая линия), YOLOv8 (красная линия) и аннотации врача (синяя линия). Интеграция YOLOv7 + DeepLabv3 с текстурными признаками демонстрирует заметное улучшение точности и специфичности сегментации, о чем свидетельствует уменьшение числа ложноположительных результатов и более четкое определение границ узлов.
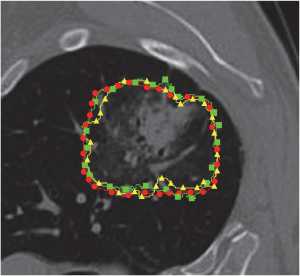
■Предложенный метод
#YOLOv8
Рис. 4. Визуальное сравнение предложенного метода (зеленая линия), YOLOv8 (красная линия) и аннотации врача (желтая линия)
Для предсказания и выявления генных мутаций EGFR и KRAS , ассоциированных с раком легких, с помощью анализа КТ-изображений были использованы две модели глубокого обучения: Vision Transformer ( ViT ) [29] и ResNet18 [30]. Эти модели были выбраны благодаря их эффективности в задачах классификации изображений, предлагая новый подход к предсказанию генных мутаций в контексте рака легких.
Набор данных для этого анализа был разделен на обучающий и тестовый. Распределение классов Mutant и Wildtype для мутаций EGFR и KRAS представлено в табл. 4 и 5. Для обеспечения стабильности и надежности результатов обучение и тестирование моделей проводилось на пяти независимых разбиениях исходных данных, что позволило оценить средние значения и СКО ключевых метрик: Accuracy, Precision, Recall, F1-score и площади под кривой ROC (AUC).
Табл. 4. Распределение данных о мутациях EGFR
|
Класс |
Обучающая выборка |
Тестовая выборка |
|
Mutant |
370 |
159 |
|
Wildtype |
1495 |
641 |
Табл. 5. Распределение данных о мутациях KRAS
|
Класс |
Обучающая выборка |
Тестовая выборка |
|
Mutant |
407 |
175 |
|
Wildtype |
1486 |
637 |
Обучение и тестирование моделей было выполнено на графическом ускорителе Nvidia RTX 2080 TI. Результаты тестирования выявили различия в эффективности классификации мутаций EGFR и KRAS между алгоритмами ViT, ResNet18 и ResNet18 с добавлением радиомических признаков.
Для мутаций EGFR (табл. 6), ResNet18 с радиоми-ческими признаками показал высокие результаты с Accuracy 0,978±0,008, Precision 0,972±0,007, Recall 0,955±0,016, F1-score 0,96±0,01 и AUC 0,956±0,015. Это сравнивалось с базовой моделью ResNet18 , показавшей также высокие результаты, но немного ниже по всем параметрам, и моделью ViT , которая показала более низкие результаты в этой задаче.
Аналогичные тенденции наблюдались и для мутаций KRAS (табл. 7), где модель ResNet18 с радио-мическими признаками также продемонстрировала высокую производительность с Accuracy 0,98 ± 0,001, Precision 0,98 ± 0,003, Recall 0,97 ± 0,003, F1-score 0,97 ± 0,004 и AUC 0,97 ± 0,003. Базовая модель ResNet18 показала сопоставимые, но чуть ниже результаты, в то время как ViT оказался менее эффективен по сравнению с двумя другими методами.
Табл. 6. Показатели эффективности предсказания мутаций EGFR
|
Метод |
Accuracy |
Precision |
Recall |
F1-score |
AUC |
|
ViT |
0,96±0,008 |
0,95±0,017 |
0,92±0,017 |
0,93±0,012 |
0,92±0,018 |
|
ResNet18 |
0,97±0.007 |
0,98±0.015 |
0,93±0.018 |
0,95±0.011 |
0,93±0,007 |
|
ResNet18+признаки радиомики |
0,978±0,008 |
0,97±0,007 |
0,955±0,016 |
0,96±0,010 |
0,956±0,015 |
Табл. 7. Показатели эффективности предсказания мутаций KRAS
|
Метод |
Accuracy |
Precision |
Recall |
F1-score |
AUC |
|
ViT |
0,95 ±0,016 |
0,931 ±0,033 |
0.936 ±0,011 |
0,931 ±0,019 |
0,936 ± 0,011 |
|
ResNet18 |
0,98 ±0,007 |
0,97 ±0,007 |
0,96 ±0,007 |
0,97 ±0,007 |
0,96 ±0,008 |
|
ResNet18+признаки радиомики |
0,98±0,001 |
0,98±0,003 |
0,97±0,003 |
0,97±0,004 |
0,97±0,003 |
Эти результаты подчеркивают значительный вклад архитектур глубокого обучения, особенно когда они дополнены радиомическими признаками, в точную идентификацию генетических мутаций на КТ-изображениях легких. Использование различных разбиений данных для обучения и тестирования помогает подтвердить надежность и универсальность предложенных методов, что является ключевым аспектом в развитии персонализированной медицины в лечении рака легких.
Обсуждения
Представленный метод, сочетающий глубокое обучение и радиомические признаки для классификации мутаций рака легких, продемонстрировал высокий средний показатель Accuracy при классификации EGFR и KRAS , который составил 98%. Это значительно выше по сравнению с результатами, полученными в [31], где Accuracy составило 89% с использованием МРТ, и в [32], где авторы достигли значения Accuracy 77% с применением КТ . Наш метод не только достигает высо -ких значений Accuracy , но и обеспечивает высокие средние значения Precision (97,5%), Recall (96%), F1-score (96,5%) и AUC (96%), что критически важно для ранней диагностики рака.
Для понимания процесса принятия решений моделями глубокого обучения в работе был использован метод Grad-CAM [33], который позволил выявить специфические особенности изображения, которые модель считает значимыми при формировании прогноза.
Тепловые карты, созданные Grad-CAM после классификации изображений с помощью ResNet18, ярко выделяют края легочных узелков красным цветом, указывая на то, что эти области имеют большое влияния на процесс принятия решения моделью (рис. 5). Это позволяет предположить наличие закономерности в том, как модель различает различные генные мутации (EGFR и KRAS) в легочных узелках.
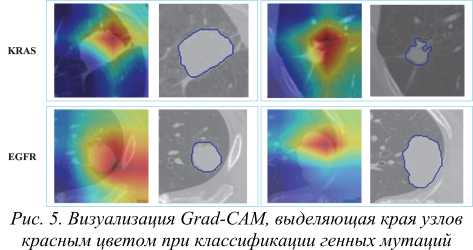
Выводы, сделанные на основе тепловых карт Grad-CAM , особенно акцент модели на краях легочных узелков, позволяют выдвинуть гипотезу, которая заслуживает более детального изучения. Выделенные края, идентифицированные моделью ResNet18 , могут не только очерчивать границы узлов, но и указывать на наличие сосудистых структур . Это наблюдение позволяет предположить, что сосуды на краях узлов могут играть важную роль в процессе классификации модели.
Потенциальная корреляция между сосудами, подсвеченными по краям, и генными мутациями может предложить новое измерение в диагностической оценке рака легкого. Можно предположить, что определенные сосудистые особенности, заметные на краях легочных узелков, свидетельствуют о специфических генетических изменениях, предоставляя тем самым неинвазивный метод определения биологии опухоли.
Заключение
В данной статье представлен подход для ранней диагностики и определения характеристик рака легкого с помощью интеграции глубокого обучения и радиомики. В работе используются методы глубокого обучения, такие как свёрточные нейронные сети и трансформеры, для анализа КТ-изображений с целью точного обнаружения и сегментации легочных узелков и предсказания генетических мутаций, таких как EGFR и KRAS . Включение признаков радиомики значительно улучшает диагностический процесс, обеспечивая более глубокое понимание характеристик опухоли.
Полученные результаты демонстрируют способность нашего комплексного подхода не только точно сегментировать легочные узелки, но и предсказывать генетические мутации с высокими значениями Accuracy , Precision и Recall . В частности, комбинация YOLOv7 с DeepLabv3 и текстурных признаков достигла высоких показателей.
Данное исследование вносит вклад в развивающуюся область персонализированной медицины в онкологии, предлагая перспективный путь для подбора лечения для отдельных пациентов на основе специфических характеристик их опухолей. Способствуя раннему выявлению и предоставляя подробные сведения о генетических основах рака легких, наш подход может значительно улучшить результаты лечения пациентов.
Будущие направления исследований включают изучение корреляции между особенностями визуализации и более широким спектром генетических мутаций, а также распространение нашей методологии на другие типы рака. Изучение микроокружения опухоли и ее сосудистых особенностей в связи со специфическими мутациями может еще больше углубить наше понимание биологии рака, что приведет к открытию новых биомаркеров и терапевтических мишеней.
Исследование выполнено за счет гранта Российского научного фонда № 24-25-00204,


